一种具有连续三个手性中心的手性双烯丙基取代化合物及其制备方法与应用
1.本发明属于化学医药领域,具体涉及一种具有连续三个手性中心的手性双烯丙基取代化合物及其制备方法与应用。
背景技术:
2.手性烯丙基结构单元因其具有烯基等极易转化修饰的官能团和烯丙位较为稳定的手性位点使其成为被广泛合成与研究的热门结构单元。而具有连续多个手性中心化合物的合成,因其更多的分子内立体干扰和较大的空间位阻效应,使其合成非常困难。具有连续多个手性中心化合物的立体多样性合成是现代医药合成领域非常渴求的方法,但是由于立体选择性控制非常困难导致目前鲜有报道。因此高效、普适、容易操作的立体多样性合成具有多个连续手性中心化合物的合成方法一直是合成化学中的热点研究领域,但目前鲜有高效催化不对称合成的报道。
技术实现要素:
3.本发明目的之一在于提供一种具有连续三个手性中心的手性双烯丙基取代化合物。
4.本发明目的之二在于提供一种具有连续三个手性中心的手性双烯丙基取代化合物的制备方法,本发明方法合成简单、成本低、产率高,所得反应目标化合物非对映选择性好,并能实现立体多样性合成。
5.本发明目的之三在于提供一种具有连续三个手性中心的手性双烯丙基取代化合物的应用。
6.本发明实现目的之一采用以下技术方案:
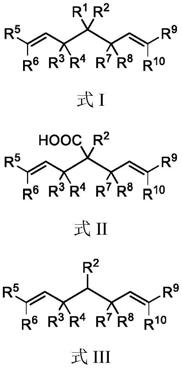
7.一种具有连续三个手性中心的手性双烯丙基取代化合物,其结构如下式i、ii或iii所示,
8.[0009][0010]
上述结构式中,
[0011]
r1、r2独立的为
‑
h、
‑
cf3、氰基、酯基、硝基、羰基、取代的酰胺基、磺酰基、取代的磺酰胺基、亚磺酰基、取代的亚磺酰胺基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的茂金属基,且r1、r2不相同;所述取代芳基、取代杂芳基、取代茂金属基的取代基为卤素、硝基、酚羟基、取代的磺酰胺、取代的硅基、烷基、烷氧基、氧羰基、氮羰基、
‑
cf3、
‑
cn或取代的氨基,所述羰基包括烷基取代酰基、取代或未取代的芳甲酰基、取代或未取代的杂芳甲酰基、取代或未取代的茂金属甲酰基。
[0012]
r3、r4和r7、r8独立地为
‑
h、烷基、卤代烷基、c2~c
20
链烯基、取代或未取代的芳基、c5~c
25
芳基取代的烷基、c5~c
25
芳基取代的烯基、
‑
ocor
11
、
‑
(c0~c8烷基)
‑
or
12
、
‑
(c0~c8烷基)
‑
sr
13
、或
‑
(c1~c8烷基)
‑
nr
14
r
15
、取代或不取代的5~20元不饱和杂环基;所述取代芳基的取代基为卤素、c1~c
20
烷基、c1~c
20
烷氧基、c1~c
20
羰基、
‑
ocor
16
、
‑
cf3、
‑
cn或取代的氨基;所述取代氨基的取代基为c1~c
20
烷基、c4~c
24
芳基或c2~c
20
链烯基;所述取代或不取代的5~20元不饱和杂环基含有1~5个杂原子,所述的杂原子为n、o或s;所述取代的5~20元不饱和杂环基的取代基为对甲苯磺酰基、c1~c
20
烷基、c1~c
20
烷氧基、c4~c
24
芳基、c5~c
25
芳基取代的c1~c
20
烷基、卤素或c2~c
20
链烯基。
[0013]
或,r3和r4、r7和r8组合成环,所述的环为c4~c
24
饱和或不饱和的环烷基、5~20元饱和或不饱和的杂环基;所述的杂环基含有1~3个杂原子,所述的杂原子为n、o或s。
[0014]
r5、r6和r9、r
10
独立地为
‑
h、c1~c
20
烷基、c1~c
20
卤代烷基、c2~c
20
链烯基、c4~c
24
芳基、c5~c
25
芳基取代的c1~c
20
烷基、
‑
ocor
17
、
‑
(c0~c8烷基)
‑
or
18
、
‑
(c0~c8烷基)
‑
sr
19
、或
‑
(c0~c8烷基)
‑
nr
20
r
21
,且r5、r6至少有一个为
‑
h,r9、r
10
至少有一个为
‑
h。
[0015]
且r3~r6的组合与r7~r
10
的组合不相同。
[0016]
r
11
~r
21
独立地为c1~c8烷基、c5~c
14
芳基取代的c1~c8烷基或c4~c
15
芳基。
[0017]
本发明实现目的之二采用以下技术方案:
[0018]
上述具有连续三个手性中心的手性双烯丙基取代化合物的制备方法,当所述的手性双烯丙基取代化合物为结构如式i所示的化合物时,其制备方法主要包括以下步骤:
[0019]
以铱络合物
‑
1作为催化剂,底物
‑
1与底物
‑
2进行催化反应,得到中间体
‑
i;中间体
‑
i在铱络合物
‑
2作为催化剂的条件下与底物
‑
3进行催化反应得到结构如式i所示的具有连续三个手性中心的手性双烯丙基取代化合物。
[0020]
反应式如下:
[0021][0022]
其中,底物
‑
2、底物3结构式中的lg为oco2r
22
、op(o)2or
23
、卤素、
‑
or
24
、氧磺酰基;所述的r
22
、r
23
、r
24
独立地为c1~c8烷基、c5~c
14
芳基取代的c1~c8烷基或c4~c
15
芳基。
[0023]
底物
‑
1、底物
‑
2、中间体
‑
i、底物
‑
3结构式中的r1‑
r
10
基团与式i、ii、iii中的r1‑
r
10
基团相同。
[0024]
进一步地,结构如式i所示的具有连续三个手性中心的手性双烯丙基取代化合物的制备方法,包括以下步骤:
[0025]
(1)在惰性气体保护下,在溶剂中加入底物
‑
1、底物
‑
2、铱络合物
‑
1和0.01~10当量的碱,在
‑
20~110℃反应0.1~96小时得到中间体
‑
1;优选的反应温度为
‑
10~20℃;
[0026]
其中,所述底物
‑
1的浓度范围为0.001~3.0m,所述底物
‑
1与底物
‑
2的摩尔比为1~10:1;所述铱络合物的用量为底物
‑
1的0.0001~10mol%。
[0027]
(2)在惰性气体保护下,在溶剂中加入中间体
‑
i、底物
‑
3、铱络合物
‑
2和0.01~10当量的碱,在
‑
20~110℃反应0.1~96小时得到结构如式i所示的化合物;优选的反应温度为0~30℃;
[0028]
其中,所述中间体
‑
i的浓度范围为0.001~3.0m,所述中间体
‑
i与底物
‑
3的摩尔比为1:1~20;所述铱络合物的用量为中间体
‑
i的0.0001~10mol%。
[0029]
进一步地,所述的碱为醇的碱金属盐、胺的碱金属盐、碱金属碳酸盐、碱金属氢氧化物或有机碱中的任意一种。
[0030]
所述醇的碱金属盐为叔丁醇钾、叔丁醇钠、异丙醇钾、异丙醇钠等。
[0031]
所述胺的碱金属盐为二异丙基胺基锂、双三甲基硅基胺基锂、双三甲基硅基胺基钠、双三甲基硅基胺基钾等。
[0032]
所述碱金属碳酸盐为碳酸钾、碳酸钠、碳酸铯等。
[0033]
所述碱金属氢氧化物为氢氧化钾、氢氧化钠等。
[0034]
所述有机碱为三乙胺、四甲基乙二胺、1,5
‑
二氮杂二环[4.3.0]壬
‑5‑
烯、1,8
‑
二氮杂二环十一碳
‑7‑
烯、1,4
‑
二氮杂二环[2.2.2]辛烷、吡啶、4
‑
二甲氨基吡啶、n
‑
甲基吗啉、三乙烯二胺、四甲基胍、2
‑
叔丁基
‑
1,1,3,3
‑
四甲基胍。
[0035]
优选的,所述的碱为有机碱或碱金属碳酸盐。
[0036]
再进一步地,所述溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、乙酸乙酯、乙酸异丁酯、乙酸异丙酯、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、三氯甲烷、1,2
‑
二氯乙烷、二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、甲苯和二氧六环中的至少一种。
[0037]
更进一步地,所述铱络合物
‑
1和铱络合物
‑
2独立地采用包括如下步骤的方法制
备:
[0038]
30~70℃下,将金属铱盐和手性配体l以1:2摩尔比溶于有机溶剂中,加入有机碱经反应得到;优选的反应温度为40~60℃。
[0039]
其中,
[0040]
所述金属铱盐为[ir(cod)cl]2、[ir(dbcot)cl]2、[ir(cod)ome]2中的任一种。
[0041]
所述手性配体l的结构式为如下任一种:
[0042][0043][0044]
所述有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、乙酸乙酯、乙酸异丁酯、乙酸异丙酯、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢
呋喃、四氢呋喃、乙腈、二氯甲烷、二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、甲苯和二氧六环中的至少一种。
[0045]
所述有机碱为三乙胺、四甲基乙二胺、1,5
‑
二氮杂二环[4.3.0]壬
‑5‑
烯、1,8
‑
二氮杂二环十一碳
‑7‑
烯、1,4
‑
二氮杂二环[2.2.2]辛烷、吡啶、4
‑
二甲氨基吡啶、n
‑
甲基吗啉、三乙烯二胺、四甲基胍、2
‑
叔丁基
‑
1,1,3,3
‑
四甲基胍。
[0046]
再进一步地,在步骤(1)和步骤(2)反应中使用不同构型的手性铱络合物以及底物
‑
2和底物
‑
3的组合可以实现一个具有连续三个手性中心的手性烯丙基取代化合物的立体多样性合成,可以合成全部8个立体异构体中的6个。
[0047]
当所述的手性双烯丙基取代化合物为结构如式ii所示的化合物时,其制备方法主要包括以下步骤:
[0048]
将结构如式i所示的具有连续三个手性中心的手性双烯丙基取代化合物在酸中进行水解,得到结构如式ii所示的具有连续三个手性中心的手性双烯丙基取代化合物。
[0049]
反应式如下:
[0050][0051]
其中,结构如式i所示化合物中的r1为酯基,r2‑
r
10
基团同上。
[0052]
更进一步地,所述的手性双烯丙基取代化合物为结构如式ii所示的化合物时,其制备方法包括以下步骤:结构如式i所示化合物在有机溶剂溶解的条件下,加入酸水解,水解温度为20~100℃,水解时间为0.5~48小时,所述酸为浓盐酸、甲磺酸、三氟乙酸、三氟甲磺酸、对甲苯磺酸、乙酸、硫酸、甲酸、磷酸中的任意一种,结构如式i所示化合物的浓度为0.001~3.0m,所述酸的用量为结构如式i所示化合物物质量的1~100当量,所述的有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、三氯甲烷、1,2
‑
二氯乙烷、二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、甲苯和二氧六环中的至少一种。
[0053]
优选的酸为三氟乙酸、盐酸、硫酸甲磺酸。
[0054]
优选的有机溶剂为甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、三氯甲烷、1,2
‑
二氯乙烷、二甲亚砜、甲苯和二氧六环。
[0055]
当所述的手性双烯丙基取代化合物为结构如式iii所示的化合物时,其制备方法主要包括以下步骤:
[0056]
在有机溶剂中加入结构如式i所示的具有连续三个手性中心的手性双烯丙基取代化合物和水,在碱金属盐的存在下通过加热或者微波反应,得到结构如式iii所示的具有连续三个手性中心的手性双烯丙基取代化合物。
[0057]
反应式如下:
[0058]
[0059]
其中,结构如式i所示化合物中的r1为酯基,r2‑
r
10
基团同上。
[0060]
再进一步地,所述的手性双烯丙基取代化合物为结构如式iii所示的化合物时,其制备方法包括以下步骤:在惰性气体保护下,在有机溶剂中加入结构如式i所示的化合物、水和碱金属盐,在50~180℃反应0.1~24小时。
[0061]
其中,结构如式i所示的化合物的浓度范围为0.001~3.0m,所述水与结构如式i所示的化合物的摩尔比为1:1~100;所述有机溶剂为乙酸乙酯、乙酸异丁酯、乙酸异丙酯、甲醇、乙醇、异丙醇、叔丁醇、仲丁醇、正己烷、环己烷、正庚烷、丙酮、丁酮、乙醚、甲基叔丁基醚、甲基环戊基醚、甲基四氢呋喃、四氢呋喃、乙腈、二氯甲烷、三氯甲烷、1,2
‑
二氯乙烷、二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、甲苯和二氧六环中的至少一种;所述碱金属盐为卤化锂、卤化钠、卤化钾、硫酸锂、硫酸钠、硫酸钾、氰化钾、氰化钠和氰化锂中的一种。
[0062]
优选的有机溶剂为二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺。
[0063]
优选的反应温度为130~160℃。
[0064]
本发明实现目的之三采用以下技术方案:
[0065]
本发明还提供了上述具有连续三个手性中心的手性双烯丙基取代化合物在制备手性非天然氨基酸及其衍生物中的应用。
[0066]
本发明还提供了上述具有连续三个手性中心的手性双烯丙基取代化合物在制备抗抑郁类药物、抗肿瘤类药物或天然产物中的应用;优选的,上述抗抑郁类药物、抗肿瘤类药物或天然产物具有手性氨基酸结构单元。
[0067]
本发明还提供了上述具有连续三个手性中心的手性双烯丙基取代化合物在制备具有手性氨基酸结构单元、手性烷基羧酸和羧酸酯结构单元和手性胺结构单元的化合物中的应用。
[0068]
本发明创造性地利用碳负离子高立体选择性地参与两次铱催化烯丙基化反应得到具有独特的双烯丙基结构的具有连续三个手性中心的手性双烯丙基取代化合物。本发明具有以下有益效果:
[0069]
(1)本发明方法合成简单、成本低、产率较高,所得反应目标化合物非对映选择性好;
[0070]
(2)本发明方法采用铱络合物作为催化剂,在反应中表现出催化反应速度快和催化剂用量低的优点;
[0071]
(3)本发明提供的方法制备的化合物里有多个重要的官能团,可以轻易转化成其他有用基团,能作为原料合成大量的有效化合物,比如用于合成含手性胺结构的化合物,而很多具有重要生物活性的化合物都具有手性胺结构单元;
[0072]
(4)本发明提供的方法能够容忍非常多类型的底物,包括药物化学中重要的杂环类底物;
[0073]
(5)本发明的方法可实现具有三个连续手性中心化合物的立体多样性合成;
[0074]
(6)本发明的提供的方法可以制备手性非天然氨基酸及其衍生物;
[0075]
(7)本发明的方法得到的化合物可以用于制备具有手性氨基酸结构单元的抗抑郁类药物、抗肿瘤类药物或天然产物。
具体实施方式
[0076]
为了更好的理解本发明,下面结合实施例对本发明做进一步的说明。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
[0077]
下列实施例中采用的手性配体(s,s,s)
‑
l1的结构式为下列实施例中采用的配体(r,r,r)
‑
l1的结构式为
[0078]
【实施例1】
[0079]
(1)的制备
[0080]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0081]
(2)的制备
[0082]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙
基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率94%,熔点88
‑
90℃,[α]
25d
=126.46(c 1.05,ch2cl2);核磁测定非对映选择性1:0.12:0.02:0,1h nmr(400mhz,chloroform
‑
d)δ7.82
–
7.76(m,4h),7.57(dd,j=8.6,1.9hz,1h),7.49
–
7.38(m,4h),7.25
–
7.21(m,2h),6.62(ddd,j=17.0,10.0,9.8hz,1h),6.30(ddd,j=16.9,10.2,9.4hz,1h),5.35(dd,j=10.2,1.5hz,1h),5.244(dd,j=10.0,1.6hz,1h),5.35(dd,j=17.0,1.6hz,1h),5.17(dd,j=16.9,2.0hz,1h),4.08(d,j=9.4hz,1h),3.84(d,j=9.8hz,1h),0.86(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.3,137.4,135.9,134.3,133.8,133.2,132.7,131.6,130.8,128.2,128.1,127.9,127.4,126.6,126.2,126.1,122.0,120.2,120.1,118.3,84.3,58.4,54.7,53.5,27.1.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0083]
【实施例2】
[0084]
(1)的制备
[0085]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0086]
(2)的制备
[0087]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反
应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率98%,熔点88
‑
90℃,[α]
25d
=31.96(c 1.12,ch2cl2);核磁测定非对映选择性1:0.04:0.04:0,1h nmr(400mhz,chloroform
‑
d)δ7.78(ddd,j=8.8,4.3,2.4hz,4h),7.51(dd,j=8.6,1.8hz,1h),7.46
–
7.40(m,4h),7.30
–
7.26(m,2h),6.46(dddd,j=16.9,10.2,8.8hz,1h),6.37(dddd,j=16.9,10.2,8.8hz,1h),5.30(dd,j=10.2,1.6hz,1h),5.29(dd,j=10.2,1.7hz,1h),5.18(dd,j=16.9,2.3hz,1h),5.17(dd,j=16.9,2.2hz,1h),4.05(d,j=8.8hz,1h),3.92(d,j=8.8hz,1h),0.79(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.1,138.1,136.2,135.9,135.7,133.1,132.7,131.4,130.9,128.2,128.0,127.9,127.5,126.8 126.2,126.1,121.7,120.1,120.0,118.4,84.1,58.3,56.2,55.5,26.9.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0088]
【实施例3】
[0089]
(1)的制备
[0090]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0091]
(2)的制备
[0092]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率99%,熔点88
‑
90℃,
[α]
25d
=
‑
20.39(c 1.27,ch2cl2);核磁测定非对映选择性1:0.03:0.02:0,1h nmr(400mhz,chloroform
‑
d)δ7.78(ddd,j=8.8,3.6,2.4hz,4h),7.51(dd,j=8.6,1.9hz,1h),7.46
–
7.40(m,4h),7.29
–
7.26(m,2h),6.46(ddd,j=16.9,10.0,8.8hz,1h),6.36(ddd,j=16.8,10.0,8.9hz,1h),5.30(dd,j=10.0,1.6hz,1h),5.29(dd,j=10.0,1.6hz,h),5.18(dd,j=16.8,2.0hz,1h),5.17(dd,j=16.9,2.0hz,h),4.05(d,j=8.8hz,1h),3.92(d,j=8.9hz,1h),0.79(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.1,138.1,136.2,135.9,135.7,133.1,132.7,131.4,130.9,128.2,128.0,127.9,127.5,126.8,126.2,126.1,121.7,120.1,120.0,118.4,84.1,58.3,56.2,55.5,26.9.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0093]
【实施例4】
[0094]
(1)的制备
[0095]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0096]
(2)的制备
[0097]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率95%,熔点84
‑
86℃,[α]
25d
=
‑
159.26(c 1.36,ch2cl2);核磁测定非对映选择性1:0.12:0.02:0,1h nmr(400mhz,
chloroform
‑
d)δ7.82
–
7.76(m,4h),7.57(dd,j=8.6,1.9hz,1h),7.47
–
7.43(m,4h),7.25
–
7.21(m,2h),6.62(ddd,j=17.0,10.0.9.8hz,1h),6.30(ddd,j=16.9,10.2,9.4hz,1h),5.35(dd,j=10.2,1.5hz,1h),5.244(dd,j=10.0,1.5hz,1h),5.240(dd,j=17.0,1.5hz,1h),5.18(dd,j=16.9,2.1hz,1h),4.08(d,j=9.4hz,1h),3.84(d,j=9.8hz,1h),0.86(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.3,137.4,135.9,134.3,133.8,133.2,132.7,131.6,130.8,128.2,128.1,127.9,127.4,126.6,126.2,126.1,122.0,120.2,120.1,118.3,84.3,58.4,54.7,53.5,27.1.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0098]
【实施例5】
[0099]
(1)的制备
[0100]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol对溴苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率68%,1h nmr(400mhz,chloroform
‑
d)δ7.53
–
7.45(m,4h),7.24
–
7.14(m,4h),6.17
–
5.99(m,2h),5.35
–
5.20(m,4h),4.02
–
3.94(m,2h),3.75(d,j=7.2hz,1h),3.67(d,j=6.9hz,1h),1.39(s,9h),1.39(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.4,137.6,136.8,135.7,134.4,132.0,131.9,129.9,129.5,122.0,121.8,119.5,118.4,115.5,84.51,84.47,49.1,48.8,44.8,44.4,27.7,27.6.;hrms(esi+)计算值c
16
h
18
brnnao
2+
([m+na]
+
):358.0413,测量值:358.0412。
[0101]
(2)的制备
[0102]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率92%,[α]
25d
=146.88(c 1.12,ch2cl2);核磁测定非对映选择性1:0.18:0.05:0.02,1h nmr(400mhz,chloroform
‑
d)δ7.86
–
7.73(m,4h),7.48
–
7.38(m,5h),7.34
–
7.30(m,2h),6.72(ddd,j=17.0,10.0,10.0hz,1h),6.20(ddd,j=16.9,10.2,9.6hz,1h),5.34(dd,j=10.0,1.5hz,1h),5.26(dd,j=17.0,1.0hz,1h),5.21(dd,j=10.2,1.5hz,1h),5.15(dd,j=16.9,1.0hz,1h),3.98(d,j=
10.0hz,1h),3.94(d,j=9.6hz,1h),1.01(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.3,137.7,135.7,134.1,134.0,133.2,132.9,131.5,130.9,128.2,128.1,127.9,127.6,126.8,126.2,126.1,121.7,120.2,120.0,118.2,84.4,58.4,55.3,52.8,27.2.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0103]
【实施例6】
[0104]
(1)的制备
[0105]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol对溴苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率68%,1h nmr(400mhz,chloroform
‑
d)δ7.53
–
7.45(m,4h),7.24
–
7.14(m,4h),6.17
–
5.99(m,2h),5.35
–
5.20(m,4h),4.02
–
3.94(m,2h),3.75(d,j=7.2hz,1h),3.67(d,j=6.9hz,1h),1.39(s,9h),1.39(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.4,137.6,136.8,135.7,134.4,132.0,131.9,129.9,129.5,122.0,121.8,119.5,118.4,115.5,84.51,84.47,49.1,48.8,44.8,44.4,27.7,27.6.;hrms(esi+)计算值c
16
h
18
brnnao
2+
([m+na]
+
):358.0413,测量值:358.0412。
[0106]
(2)的制备
[0107]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率95%,[α]
25d
=
‑
124.13(c 1.04,ch2cl2);核磁测定非对映选择性1:0.16:0.03:0,1h nmr(400mhz,chloroform
‑
d)δ7.81
–
7.76(m,4h),7.47
–
7.41(m,5h),7.35
–
7.30(m,2h),6.72(ddd,j=17.0,10.0,10.0hz,1h),6.20(ddd,j=16.9,10.2,9.3hz,1h),5.34(dd,j=10.2,1.5hz,1h),5.25(dd,j=17.0,2.0hz,1h),5.21(dd,j=10.0,1.5hz,1h),5.15(dd,j=16.9,2.1hz,1h),3.98(d,j=9.3hz,1h),3.96(d,j=10.0hz,1h),1.01(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.3,137.7,135.7,134.1,134.0,133.2,132.9,131.6,131.5,130.9,128.2,128.1,127.9,127.6,126.8,126.2,126.1,121.7,120.2,120.0,118.2,84.4,58.4,55.3,52.8,27.2.;hrms(esi+)计算值c
29
h
28
brnnao
2+
([m+na]
+
):524.1196,测量值:524.1179。
[0108]
【实施例7】
[0109]
(1)的制备
[0110]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0111]
(2)的制备
[0112]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率83%,[α]
25d
=86.85(c 1.08,ch2cl2);核磁测定非对映选择性1:0.07:0.03:0,1h nmr(400mhz,chloroform
‑
d)δ7.48
–
7.42(m,2h),7.29(d,j=1.9hz,2h),7.27
–
7.26(m,1h),7.22
–
7.17(m,2h),6.53(ddd,j=17.0,10.0,9.8hz,1h),6.10(ddd,j=17.0,10.3,9.4hz,1h),5.33(dd,j=10.0,1.5hz,1h),5.27(dd,j=10.3,1.2hz,1h),5.20(dd,j=17.0,1.6hz,1h),5.16(dd,j=17.0,1.6hz,1h),3.85(d,j=9.4hz,1h),3.75(d,j=9.8hz,1h),1.11(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,141.8,136.9,135.0,133.3,133.0,131.7,130.7,127.8,127.5,122.1,121.1,120.5,117.6,85.0,57.9,54.6,52.6,27.3.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0113]
【实施例8】
[0114]
(1)的制备
[0115]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0116]
(2)的制备
[0117]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率94%,熔点63
–
65℃;[α]
25d
=
‑
21.50(c 1.27,ch2cl2);核磁测定非对映选择性1:0.07:0.03:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.44
–
7.41(m,2h),7.26
–
7.23(m,5h),6.28(ddd,j=16.8,10.2,9.2hz,1h),6.26(ddd,j=16.8,10.4,9.2hz,1h),5.32(d,j=10.2hz,1h),5.32(dd,j=10.4,0.8hz,1h),5.17(dd,j=16.8,2.0hz,1h),5.16(dd,j=16.8,2.0hz,1h),3.82(d,j=9.2hz,1h),3.81(d,j=9.2hz,1h),0.99(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.8,142.0,137.6,135.2,134.8,134.7,131.5,130.8,127.8,127.6,121.9,121.0,120.4,117.7,84.8,57.8,55.5,55.1,27.1.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0118]
【实施例9】
[0119]
(1)的制备
[0120]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0121]
(2)的制备
[0122]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率91%,熔点63
–
65℃;[α]
25d
=20.82(c 1.22,ch2cl2);核磁测定非对映选择性1:0.04:0.02:0,1h nmr(400mhz,chloroform
‑
d)δ7.43(d,j=8.5hz,2h),7.26
–
7.22(m,5h),6.27(dtd,j=16.9,10.4,8.9hz,1h),6.27(ddd,j=16.9,10.2,9.2hz,1h),6.27(ddd,j=17.2,10.2,9.2hz,1h),5.32(dd,j=10.2,1.6hz,1h),5.29(dd,j=10.2,1.6hz,1h),5.17(dd,j=17.2,2.0hz,1h),5.16(dd,j=16.9,2.0hz,1h),3.82(d,j=9.2hz,1h),3.81(d,j=9.2hz,1h),0.99(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.8,142.0,137.6,135.2,134.8,134.7,131.5,130.8,127.8,127.6,121.9,121.0,120.4,117.7,84.8,57.8,55.5,55.1,27.1.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0123]
【实施例10】
[0124]
(1)的制备
[0125]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0126]
(2)的制备
[0127]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol对溴苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率91%,[α]
25d
=
‑
85.43(c 0.94,ch2cl2);核磁测定非对映选择性1:0.07:0.03:0,1h nmr(400mhz,chloroform
‑
d)δ7.48
–
7.43(m,2h),7.29(d,j=1.9hz,2h),7.26(d,j=2.1hz,1h),7.21
–
7.18(m,2h),6.53(ddd,j=17.0,10.0,9.9hz,1h),6.10(ddd,j=16.9,10.2,9.4hz,1h),5.33(dd,j=10.2,1.5hz,1h),5.27(dd,j=10.2,1.1hz,1h),5.22(dd,j=17.0,1.1hz,1h),5.16(dd,j=16.9,1.1hz,1h),3.85(d,j=9.4hz,1h),3.75(d,j=9.9hz,1h),1.11(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,141.8,136.9,134.9,133.3,133.0,131.7,130.7,127.8,127.5,122.1,121.1,120.5,117.6,85.0,57.9,54.6,52.7,27.3.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0128]
【实施例11】
[0129]
(1)的制备
[0130]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol对溴苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率68%,1h nmr(400mhz,chloroform
‑
d)δ7.53
–
7.45(m,4h),7.24
–
7.14(m,4h),6.17
–
5.99(m,2h),5.35
–
5.20(m,4h),4.02
–
3.94(m,2h),3.75(d,j=7.2hz,1h),3.67(d,j=6.9hz,1h),1.39(s,9h),1.39(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.4,137.6,136.8,135.7,134.4,132.0,131.9,129.9,129.5,122.0,121.8,119.5,118.4,115.5,84.51,84.47,49.1,48.8,44.8,44.4,27.7,27.6.;hrms(esi+)计算值c
16
h
18
brnnao
2+
([m+na]
+
):358.0413,测量值:358.0412。
[0131]
(2)的制备
[0132]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率99%,[α]
25d
=88.98(c 0.89,ch2cl2);核磁测定非对映选择性1:0.19:0.02:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.43(d,j=8.6hz,2h),7.31
–
7.28(m,3h),7.19(d,j=1.9hz,2h),6.52(ddd,j=16.9,10.0.9.9hz,1h),6.18(ddd,j=16.9,10.2,9.5hz,1h),5.36(dd,j=10.0,1.4hz,1h),5.28(dd,j=10.2,1.3hz,1h),5.23(dd,j=16.9,1.3hz,1h),5.28(dd,j=16.9,1.4hz,1h),3.86(d,j=9.5hz,1h),3.73(d,j=9.9hz,1h),1.08(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,141.5,137.3,135.0,133.6,132.7,131.6,130.8,128.2,127.5,121.9,121.1,120.6,117.6,85.1,57.9,54.5,52.7,27.3.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0133]
【实施例12】
[0134]
(1)的制备
[0135]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol对溴苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率68%,1h nmr(400mhz,chloroform
‑
d)δ7.53
–
7.45(m,4h),7.24
–
7.14(m,4h),6.17
–
5.99(m,2h),5.35
–
5.20(m,4h),4.02
–
3.94(m,2h),3.75(d,j=7.2hz,1h),3.67(d,j=6.9hz,1h),1.39(s,9h),1.39(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.4,137.6,136.8,135.7,134.4,132.0,131.9,129.9,129.5,122.0,121.8,119.5,118.4,115.5,84.51,84.47,49.1,48.8,44.8,44.4,27.7,27.6.;hrms(esi+)计算值c
16
h
18
brnnao
2+
([m+na]
+
):358.0413,测量值:358.0412。
[0136]
(2)的制备
[0137]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率97%,[α]
25d
=
‑
97.83(c 0.92,ch2cl2);核磁测定非对映选择性1:0.19:0.02:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.45
–
7.41(m,2h),7.31
–
7.28(m,3h),7.19(d,j=1.9hz,2h),6.52(ddd,j=16.9,10.1.9.6hz,1h),6.18(ddd,j=16.9,10.2,9.9hz,1h),5.36(dd,j=10.1,1.3hz,1h),5.28(dd,j=10.2,1.3hz,1h),5.23(dd,j=10.2,1.0hz,1h),5.18(dd,j=16.9,1.0hz,1h),3.87(d,j=9.6hz,1h),3.74(d,j=9.9hz,1h),1.08(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,141.5,137.3,135.0,133.6,132.7,131.6,130.8,128.1,127.5,121.9,121.0,120.6,117.6,85.1,57.8,54.5,52.7,27.3.;hrms(esi+)计算值c
25
h
24
brcl2nnao
2+
([m+na]
+
):542.0260,测量值:542.0257。
[0138]
【实施例13】
[0139]
(1)的制备
[0140]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0141]
(2)的制备
[0142]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率93%,熔点88
‑
90℃,[α]
25d
=80.56(c 0.90,ch2cl2);核磁测定非对映选择性1:0.07:0.04:0,1h nmr(400mhz,chloroform
‑
d)δ7.82
–
7.76(m,4h),7.48
–
7.44(m,3h),7.32(d,j=1.9hz,2h),7.26
–
7.24(m,1h),6.70(dd,j=17.0,10.0,9.9hz,1h),6.15(ddd,j=16.9,10.2,9.3hz,1h),5.34(dd,j=10.1,1.6hz,1h),5.25(dd,j=17.0,0.8hz,1h),5.34(dd,j=10.2,1.2hz,1h),5.17(dd,j=16.8,1.6hz,1h),3.96(d,j=9.9hz,1h),3.93(d,j=9.3hz,1h),1.08(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.2,142.0,135.4,134.9,133.9,133.23,133.21,132.9,128.3,128.2,128.0,127.8,127.6,126.8,126.3,126.2,121.0,120.2,117.8,84.8,58.1,55.3,52.7,27.3.;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0143]
【实施例14】
[0144]
(1)的制备
[0145]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0146]
(2)的制备
[0147]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率98%,熔点98
‑
100℃,[α]
25d
=
‑
34.00(c 0.84,ch2cl2);核磁测定非对映选择性1:0.03:0.03:0,1h nmr(400mhz,chloroform
‑
d)δ7.78(dd,j=9.2,2.3hz,4h),7.50(dd,j=8.6,1.8hz,1h),7.48
–
7.44(m,2h),7.29(d,j=1.9hz,2h),7.26(d,j=1.8hz,1h),6.44(ddd,j=16.9,10.2,8.9hz,1h),6.32(ddd,j=16.9,10.2,8.9hz,1h),5.35(d,j=10.2hz,1h),5.30(d,j=10.2hz,1h),5.21(d,j=16.9hz,1h),5.20(d,j=16.9hz,1h),4.03(d,j=8.9hz,1h),3.90(d,j=8.9hz,1h),0.85(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,142.3,136.0,135.7,134.9,134.8,133.1,132.7,128.2,128.1,127.9,127.7,127.6,127.5,126.7,126.24,126.17,120.9,120.2,117.9,84.5,58.1,56.3,55.2,27.0.;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0148]
【实施例15】
[0149]
(1)的制备
[0150]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0151]
(2)的制备
[0152]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率96%,熔点99
‑
101℃,[α]
25d
=35.64(c 0.94,ch2cl2);核磁测定非对映选择性1:0.03:0.02:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.79(dd,j=9.2,2.2hz,4h),7.50(dd,j=8.7,1.8hz,2h),7.49
–
7.42(m,3h),7.29(d,j=1.9hz,2h),7.26
–
7.24(m,2h),6.44(ddd,j=16.9,10.2,8.9hz,1h),6.32(ddd,j=16.9,10.2,8.9hz,1h),5.35(d,j=10.2hz,2h),5.31(dd,j=10.2,1.2hz,2h),5.209(dd,j=16.9,1.2hz,1h),5.203(dd,j=16.9,1.2hz,1h),4.03(d,j=8.9hz,1h),3.90(d,j=8.9hz,1h),0.85(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ164.9,142.3,136.0,135.7,134.9,134.8,133.1,132.7,128.2,128.1,127.9,127.7,127.6,127.5,126.7,126.2,126.2,120.9,120.2,118.0,84.6,58.1,56.3,55.2,27.0.;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0153]
【实施例16】
[0154]
(1)的制备
[0155]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率50%,1h nmr(400mhz,chloroform
‑
d)δ7.33
–
7.29(m,2h),7.26
–
7.16(m,4h),6.15
–
5.96(m,2h),5.42
–
5.24(m,4h),4.03
–
3.91(m,2h),3.77(d,j=7.1hz,1h),3.68(d,j=7.0hz,1h),1.42(s,9h),1.40(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.13,163.10,141.8,141.1,135.4,135.3,134.7,133.6,128.2,128.0,126.8,126.4,120.3,119.1,115.1,115.0,84.9,84.8,49.0,48.6,44.5,44.1,27.63,27.61.;hrms(esi+)计算值c
16
h
17
cl2nnao
2+
([m+na]
+
):348.0529,测量值:348.0529。
[0156]
(2)的制备
[0157]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 2
‑
萘烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率93%,熔点88
‑
90℃,[α]
25d
=
‑
106.00(c 1.12,ch2cl2);核磁测定非对映选择性1:0.08:0.04:0,1h nmr(400mhz,chloroform
‑
d)δ7.82
–
7.76(m,4h),7.48
–
7.43(m,3h),7.32(d,j=1.9hz,2h),7.26(t,j=1.9hz,1h),6.70(dd,j=17.0,10.0,9.9hz,1h),6.15(ddd,j=16.9,10.2,9.4hz,1h),5.34(dd,j=10.2,1.5hz,1h),5.25(dd,j=17.0,1.2hz,1h),5.24(dd,j=10.0,1.0hz,1h),5.17(dd,j=16.9,1.0hz,1h),3.96(d,j=9.9hz,1h),3.93(d,j=9.4hz,1h),1.08(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.2,142.0,135.4,134.9,133.9,133.2,133.2,132.9,128.3,128.2,128.0,127.8,127.6,126.8,126.3,126.2,121.0,120.2,117.8,84.8,58.1,55.3,52.7,27.3.;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0158]
【实施例17】
[0159]
(1)的制备
[0160]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(s,s,s)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0161]
(2)的制备
[0162]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(s,s,s)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率94%,熔点105
‑
107℃,[α]
25d
=143.60(c 1.50,ch2cl2);核磁测定非对映选择性1:0.15:0.03:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.83
–
7.77(m,4h),7.58(dd,j=8.6,1.9hz,1h),7.45(ddd,j=7.5,3.5,1.9hz,2h),7.29(t,j=1.9hz,1h),7.23(d,j=1.9hz,2h),6.59(ddd,j=17.0,10.0.9.6hz,1h),6.33(ddd,j=16.9,10.1,9.9hz,1h),5.39(dd,j=10.1,1.4hz,1h),5.30(dd,j=10.0,1.2hz,1h),5.26(dd,j=10.1,1.2hz,1h),5.39(dd,j=10.1,1.4hz,1h),4.08(d,j=9.6hz,1h),3.81(d,j=9.9hz,1h),0.89(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.1,141.7,135.7,135.0,134.2,133.2,133.1,132.7,128.21,128.18,128.1,127.9,127.6,127.5,126.5,126.2,126.1,120.9,120.3,117.9,84.8,58.1,54.7,53.5,27.1;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0163]
【实施例18】
[0164]
(1)的制备
[0165]
在25ml反应管中加入0.01mmol[ir(cod)cl]2、0.02mmol(r,r,r)
‑
l1、1.0ml除氧thf和1.0ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.80mmol氰基乙酸叔丁酯、0.40mmol 2
‑
萘烯丙基碳酸甲酯和0.08mmol碳酸铯和4ml四氢呋喃,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率64%,1h nmr(400mhz,chloroform
‑
d)δ7.85
–
7.74(m,8h),7.50
–
7.38(m,6h),6.31
–
6.09(m,2h),5.37
–
5.26(m,4h),4.22
–
4.13(m,2h),3.86(d,j=7.6hz,1h),3.82(d,j=7.1hz,1h),1.34(s,9h),1.33(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ163.74,163.73,136.2,135.9,135.3,135.0,133.3,132.9,132.8,128.7,128.6,127.9,127.8,127.63,127.62,127.4,126.8,126.4,126.3,126.22,126.18,125.7,125.4,119.3,118.2,115.8,115.7,84.30,84.25,49.9,49.7,45.0,44.6,27.64,27.61.;hrms(esi+)计算值c
20
h
21
nnao
2+
([m+na]
+
):330.1465,测量值:330.1468。
[0166]
(2)的制备
[0167]
在25ml反应管中加入0.005mmol[ir(cod)cl]2、0.01mmol(r,r,r)
‑
l1、0.5ml除氧thf和0.5ml除氧正丙胺,50℃下反应30分钟后在减压条件下蒸去溶剂得到铱催化剂。在25℃氮气保护下,再往反应管中依次加入0.20mmol步骤(1)所得产物、0.20mmol 3,5
‑
二氯苯基烯丙基碳酸甲酯和0.20mmol碳酸铯和2ml二氯甲烷,在25℃下反应。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率96%,熔点105
‑
107℃,[α]
25d
=
‑
127.44(c 1.33,ch2cl2);核磁测定非对映选择性1:0.15:0.03:0.01,1h nmr(400mhz,chloroform
‑
d)δ7.83
–
7.77(m,4h),7.58(dd,j=8.6,1.9hz,1h),7.47
–
7.43(m,2h),7.29(t,j=1.9hz,1h),7.23(d,j=1.8hz,2h),6.59(ddd,j=17.0,10.8,9.8hz,1h),6.33(ddd,j=16.9,10.0,9.5hz,1h),5.39(dd,j=10.0,1.4hz,1h),5.29(dd,j=10.8,1.2hz,1h),5.26(dd,j=17.2,1.4hz,1h),5.22(dd,j=16.9,1.2hz,1h),4.08(d,j=9.5hz,1h),3.81(d,j=9.8hz,1h),0.89(s,9h).
13
c nmr(101mhz,chloroform
‑
d)δ165.1,141.7,135.7,135.0,134.2,133.2,133.1,132.7,128.21,128.18,128.1,127.9,127.6,127.5,126.5,126.2,126.1,120.9,120.3,117.9,84.8,58.1,54.7,53.5,27.1.;hrms(esi+)计算值c
29
h
27
cl2nnao
2+
([m+na]
+
):514.1311,测量值:514.1307。
[0168]
【实施例19】
[0169]
的制备
[0170]
将0.2mmol实施例3所得产物溶于2ml二氯乙烷中,加入1ml三氟乙酸,在氩气保护下反应2小时。通过薄层色谱监测反应,反应结束后,减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率79%,核磁测定非对映选择性1:0.04:0.03:0,1h nmr(400mhz,chloroform
‑
d)δ7.81
–
7.72(m,3h),7.67(d,j=8.6hz,1h),7.46(td,j=5.9,5.4,3.2hz,2h),7.36
–
7.26(m,3h),7.16
–
7.08(m,2h),6.31(dddd,j=23.6,16.9,10.2,9.0hz,2h),5.34(t,j=10.0hz,2h),5.21(d,j=16.9hz,2h),4.00(d,j=9.0hz,1h),3.84(d,j=9.1hz,1h).
13
c nmr(101mhz,chloroform
‑
d)δ170.6,137.1,135.3,135.0,134.7,133.0,132.8,131.6,130.6,128.17,128.15,128.0,127.6,126.42,126.39,122.1,120.9,120.7,117.5,58.6,54.8,54.1;hrms(esi+)计算值c
25
h
19
brnna2o
2+
([m+2na
‑
h]
+
):490.0389,测量值:490.0392。
[0171]
【实施例20】
[0172]
的制备
[0173]
将0.2mmol实施例3所得产物、29.2mg氯化锂、1.5ml dmf和13μl水加入到氩气保护的反应管中,回流反应2小时。反应结束后,加入2.5ml饱和氯化铵溶液,用2.5ml乙醚萃取三次,合并有机相用无水硫酸镁干燥。减压下除去溶剂之后通过硅胶柱层析纯化得到产物,产率65%,核磁测定非对映选择性1:0:0:0,1h nmr(400mhz,chloroform
‑
d)δ7.87
–
7.77(m,3h),7.72(d,j=1.8hz,1h),7.51
–
7.45(m,4h),7.42(dd,j=8.5,1.9hz,1h),7.21
–
7.15(m,2h),6.11(dddd,j=32.9,17.0,10.2,8.0hz,2h),5.29(ddt,j=10.1,2.0,0.9hz,2h),5.17(ddt,j=16.9,11.7,1.1hz,2h),3.63(t,j=8.0hz,1h),3.51(t,j=7.8hz,1h),3.37(t,j=7.7hz,1h).
13
c nmr(101mhz,chloroform
‑
d)δ138.1,137.7,137.4,136.4,133.4,132.8,132.0,130.1,128.7,127.9,127.7,127.4,126.3,126.1,125.8,121.7,119.1,118.3,118.2,49.0,48.3,42.8;hrms(esi+)计算值c
24
h
21
brn
+
([m+h]
+
):402.0852,测量值:402.0847。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1