一种提高植物分枝能力的方法、序列及果苗木繁育方法
1.本发明属于植物基因工程技术领域,尤其涉及一种提高植物分枝能力的方法、序列及果苗木繁育方法。
背景技术:
2.植物分枝是影响植物株型形成的重要因素,并对植物生物学特征及农业生产有着重要影响。植物生长过程中,腋芽和顶芽是由芽原基发育而来的,顶芽是茎的发育初期便一次性完成的,主要与植株的主干发育有关,而腋芽是从叶腋中所生出的定芽,常见于种子植物中,主要是与植物的分枝有关,顶芽与腋芽的形成与发育共同调控植株地上部分的生长与植物构型的形成。在植物腋芽形成与分枝发育阶段也会受到许多因素的影响,茎尖会以顶端优势的方式抑制腋芽的形成,进而影响茎的分枝。植物会受到自身激素(生长素、独脚金内酯和细胞分裂素)调节、养分分配和环境因子的影响,被众多复杂信号所调节,以此来调控腋芽的生长并影响植物新的分枝的形成,保证植物正常的生命活动。
3.植物分枝是影响植物株型的关键因素,不仅对植物适应环境非常重要,也影响农作物和园艺作物的栽培方式和产量。尤其在果树领域,植物的分枝高度、分枝数目、分枝长度、分枝角度以及分布方式对于果树的早期树形形成、果树的栽培管理、果树产量意义重大。侧枝的发生源于腋生分生组织的萌发,腋芽萌发后可以保持原品种的优良性状,这无疑在苹果苗木繁育和良种推广方面起到了巨大作用。但侧枝形成的具体机制在很大程度上尚不清楚,其作用机理尚待研究。cbf转录因子是ap2/erf家族中一类重要的转录因子。在植物的进化历程中,cbf转录因子的结构域具有高度保守的pkkragrkkfretrhp氨基酸序列,且能够调控与分枝表型的有关的下游基因的表达,进而参与到植物的生命活动进程中。
4.通过上述分析,现有技术存在的问题及缺陷为:在苹果苗木繁育和良种推广方面培育果树新品种时间长,无法实现短时间内提高植物的产量与品质。
5.解决以上问题及缺陷的难度为:基因的构建步骤繁多,苹果农杆菌转化叶片侵染的成活率较低。
6.解决以上问题及缺陷的意义为:转基因植株转入之后驯化困难,应用于田间还需一定的时间。
技术实现要素:
7.针对现有技术存在的问题,本发明提供了一种提高植物分枝能力的方法、序列及果苗木繁育方法。
8.本发明是这样实现的,一种提高植物分枝能力的方法,所述提高植物分枝能力的方法使用cbf
‑
l基因。
9.进一步,所述提高植物分枝能力的方法具体包括:
10.第一步,利用cbf
‑
l基因的上游引物和下游引物对cbf
‑
l基因进行单克隆扩增,得到扩增产物;
11.第二步,利用克隆所得基因进行超表达载体的构建;
12.第三步,将植物超表达载体转入至“gala
‑
3”植株中。
13.进一步,所述第一步的cbf
‑
l基因的单克隆扩增具体包括:
14.(1)pcr扩增cbf
‑
l基因:以上游引物f和下游引物r为引物对,用如下表1中的40微升体系对cbf
‑
l基因进行单克隆扩增,得到cbf
‑
l核苷酸双链;其中,cbf
‑
l基因的cds序列seqidno:1;上游引物f的核苷酸序列se qidno:2;下游引物r的核苷酸序列seqidno:3;
15.(2)将pcr扩增得到的cbf
‑
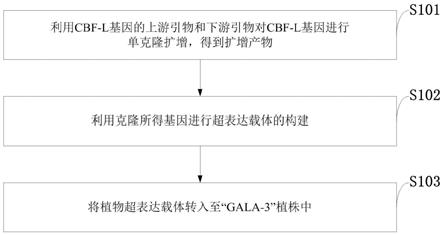
l核苷酸双链用10微升体系进行连接pmd
‑
19
‑
t(simple)载体,在16℃下过夜连接,得到连接产物;
16.(3)连接产物转化感受态细胞:
17.将从
‑
80℃超低温冰箱取出大肠杆菌dh5α感受态细胞,置于冰上融化,吸取20微升的dh5α感受态细胞于1.5ml无菌的的离心管中,加入10微升连接产物,吹打混匀,冰浴30min,42℃水浴热激90s,再冰浴2min,在无菌环境中加入200微升的lb液体培养基,置于37℃、转速为180rpm的摇床中,摇菌1h,30min后将将超净工作台打开进行灭菌,在15min后,开始烧涂布器,一般烧2
‑
3分钟,放到超净工作台上等待至室温;摇菌结束后,取100微升菌液涂lb板,开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到37℃恒温培养箱中培养10~12h,待长出菌斑;
18.(4)挑斑:在无菌超净台中,用无菌的枪头吸取100微升lb液体培养基,打入0.5ml的无菌离心管中,用10微升的无菌枪头挑取10个上述菌斑,置于lb液体培养基中,吹打几次,盖上盖子,在离心管上做好标记,放入摇床中,37℃,180rpm,4
‑
6h,得到菌液;
19.(5)菌液鉴定:摇菌结束后用10微升体系进行pcr鉴定,以上述菌液为模板,选用的上游引物为载体的序列,选用的下游引物为基因的下游引物,按照正常的菌批验证流程进行鉴定,以水为阴性对照;跑一个小孔胶,检验菌液的阳性率,挑选阳性鉴定中比较明亮的菌液。
20.进一步,所述第二步的构建植物超表达载体cbf
‑
l
‑
pbi121:
21.(1)将阳性的菌液提质粒,得到连有cbf
‑
l的pmd
‑
19
‑
t(simple)融合质粒;
22.(2)将连有cbf
‑
l的pmd
‑
19
‑
t(simple)融合质粒和pbi121空载体按照40微升体系进行双酶切,37℃反应2~6h以上,酶切3h;
23.(3)目的基因与目的载体的回收和连接:酶切反应时间结束后,将上述切取目的基因的条带进行胶回收,同时将目的载体的酶切条带也切下进行胶回收,然后用10微升体系对目的基因与目的载体进行连接;
24.(4)将连接产物转化至大肠杆菌dh5α感受态细胞中;然后,将大肠杆菌dh5α感受态细胞从
‑
80℃冰箱中取出,立马放到事先准备好的冰上融化,吸取20微升的大肠杆菌dh5α感受态细胞于一个的1.5ml的无菌离心管中,吸取构建好的连接产物10微升,吹打混匀,冰浴30min,42℃热激90s,再冰浴2min,在无菌环境中加入200微升的lb液体培养基,置于37℃、转速为180rpm的摇床中,摇菌1h,30min后将将超净工作台打开进行灭菌,在15min后,开始烧涂布器,烧2
‑
3分钟,放到超净工作台上等待变至室温,在摇菌结束后,取100微升菌液涂lb板,开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到37℃恒温培养箱中培养10
‑
12h;
25.(5)挑斑:无菌超净台中,用无菌的枪头吸取100微升lb液体培养基,打入0.5ml的
无菌离心管中,用10微升的无菌枪头挑取10个菌斑,置于lb液体培养基中,吹打几次,盖上盖子,在离心管上做好标记,放入摇床中,37℃,180rpm,4
‑
6h;
26.(6)菌液鉴定:摇菌结束后用上表3所示的10微升体系进行pcr鉴定,以菌液为模板,引物为载体的上游引物,基因的下游引物,按照正常的菌批验证流程进行鉴定,以水为阴性对照;跑一个小孔胶,检验菌液的阳性率,挑选阳性鉴定中比较明亮的菌液;
27.(7)将阳性的菌液提质粒,得到植物超表达载体cbf
‑
l
‑
pbi121。
28.进一步,所述第三步的利用农杆菌介导法将植物超表达载体cbf
‑
l
‑
pbi121转入gala
‑
3植株具体包括:
29.(1)将植物超表达载体cbf
‑
l
‑
pbi121转化到农杆菌eha105中:从
‑
80℃超低温冰箱中取出农杆菌eha105感受态细胞,吸取20微升的农杆菌eha105感受态细胞于一个1.5ml的无菌离心管中,吸取超表达载体cbf
‑
l
‑
pbi1215微升,加入50微升的农杆菌eha105感受态细胞中,吹打混匀,冰浴30min,37℃热激90s,再冰浴2min,在超净工作台中将其加入200微升的lb液体培养基中,置于28℃、转速为180rpm的摇床中摇菌4h,在摇菌结束后,取100微升菌液涂lb板,开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到28℃恒温培养箱中培养10
‑
12h;
30.(2)农杆菌介导法将表达载体转入gala
‑
3植株:将获得的农杆菌eha105用yep培养基培养皿中在摇床中以180rpm,28℃振荡培养50ml,培养4
‑
6小时,直至od值为0.4
‑
0.6,用离心机以25℃,5000rpm离心5min收集菌体,用葡萄糖液体培养基将菌液悬浮起来,加入20mg乙酰丁香酮备用;然后,将gala
‑
3植株从继代培养约30天的试管苗上剪取叶片用于遗传转化,选择试管苗顶部3
‑
4片叶展开的幼嫩叶片,剪去叶尖和叶柄部分,将中间部位剪成3mm宽的叶块,置于有农杆菌的液体共培养基中,晃动,每隔2min晃动几次,侵染时间大概8min左右,然后将叶块转移到无菌滤纸上吸干菌液,将表面没有菌液的叶块迅速转移至分装有共培养基的培养皿;待叶片长出转基因小芽,将小芽用扩繁培养基扩增起来;待小芽长成小苗后,放入生根培养基中生根,得到转基因植株。
31.进一步,所述植物为双子叶植物。
32.进一步,所述植物为苹果。
33.进一步,所述植物为嘎啦苹果。
34.本发明的另一目的在于提供一种所述提高植物分枝能力的方法使用的cbf
‑
l基因的cds序列,所述cds序列为seq id no:1。
35.本发明的另一目的在于提供一种果苗木繁育方法,所述果苗木繁育方法使用所述的提高植物分枝能力的方法。
36.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明以转基因植株的形式呈现,将cbf
‑
l在待增强的植物的植株里过表达,增加植物分枝的能力,从而提高果树产量。本发明可以显著增强苹果植株的分枝能力,无需经过长时间年限来培育果树新品种,短时间内提高植物的产量与品质,其简单易行,操作简单,稳定性好。
附图说明
37.图1是本发明实施例提供的提高植物分枝能力的方法流程图。
具体实施方式
38.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
39.针对现有技术存在的问题,本发明提供了一种提高植物分枝能力的方法,利用转基因技术将目的基因扩增并利用农杆菌转化法将其转入苹果苗中,使转基因苗木达到分枝效果,对于果树产量与经济效益的提高具有重大的意义。转化过程中,叶片的成活率较低,可先对叶片进行预培养,进而提高转化效率。与下面结合附图对本发明作详细的描述。
40.如图1所示,本发明提供的提高植物分枝能力的方法包括以下步骤:
41.s101:利用cbf
‑
l基因的上游引物和下游引物对cbf
‑
l基因进行单克隆扩增,得到扩增产物;
42.s102:利用克隆所得基因进行超表达载体的构建;
43.s103:将植物超表达载体转入至“gala
‑
3”植株中。
44.本发明提供的提高植物分枝能力的方法业内的普通技术人员还可以采用其他的步骤实施,图1的本发明提供的提高植物分枝能力的方法仅仅是一个具体实施例而已。在成功扩增cbf
‑
l基因之后进行农杆菌侵染,因为叶片的侵染有一定的难度,可分别采用以下几个方法:
45.下面结合具体实施例对本发明的技术方案作进一步的描述。
46.本发明实施例提供的cbf
‑
l基因在增强果树分枝能力中的应用,具体的,增强果树分枝能力的方法可包括以下步骤:
47.第一步,cbf
‑
l基因的单克隆扩增:
48.(1)pcr扩增cbf
‑
l基因:
49.以上游引物f和下游引物r为引物对,用如下表1中的40微升体系对cb f
‑
l基因进行单克隆扩增,得到cbf
‑
l核苷酸双链;其中,cbf
‑
l基因的cds序列如序列表seqidno:1所示,具体为:atgtcaaagtcaaatcattctat atattttctctacattgtcacactctgtttttgtgtgtgggaacaccggaagttgcctmtgtgggcaacatttctccacgtggcgtcctcctcactctccgtgtgcaactcgcatggacccggggcccactcaagaccctcccaatccaaagctataaaagccacctcactctctccccagttgtcagcctgcaaccccaaaacttgtgctaaaacacactctcaactcacagctttctccgacgcagcagaacaaatgaacacratctccagacaactctccgattccgccgaaaggcccgaatcgagttccgaaagcgtcacgamtcgaagccagccgacttcgttctccgatgaggaggtcattttggcgtccagcacgccgaagaagcgagcggggaggagagttttcaacgagacaaggcaccccgtttacagaggagtgaggaggaggaacaacgacaagtgggtgtgcgaaatgagagaaccaaacaagaagaagtcgaggatatggctcggaacttatccaacggcagagatggcagctcgggcgcatgacgtggcggcattggcctttagagggaggcttgcctgcctcaattttgcagactccgcatggcgcctgcctgtcccrgcttccactgattcagtggatatcaggcgggcggccgcggaggctgcagagacattcaggccagccgagtttggcggagtgtcggaaagtggggatgatgagaaggagagcaagaaaatggagggggagaaggattgtggatgtgcggagcaaagcgattgtggaggtgcggagcaaagcgattgtggaggtgcggagcaaagtggcagctcgttttacttggatgaggaggaaatgttcgccatgccaaggttgcttgatagtatggcggaaggscttctgctctctccacctcgccgttcagctggtagcaacatgaactgggatgatatgggaagcaatgatgatgacgtcaatctgtggagcttctcaaagtaa;上游引物f的核苷酸序列如序列表seqidno:2所示,具体的序列为:atgtcaaagtcaaatcattctatatattttc;下游引
物r的核苷酸序列如序列表seqidno:3所示,具体的序列为:ttactttgagaagctccacagatt。
50.表1
[0051][0052][0053]
(2)将上述pcr扩增得到的cbf
‑
l核苷酸双链用如下表2所示的10微升体系进行连接pmd
‑
19
‑
t(simple)载体,在16℃下过夜连接,得到连接产物。
[0054]
表2
[0055]
组分添加量(微升)pmd
‑
19
‑
t(simple)载体0.5solution15回收产物(cbf
‑
l核苷酸双链)4.5total10
[0056]
(3)连接产物转化感受态细胞:
[0057]
将从
‑
80℃超低温冰箱取出大肠杆菌dh5α感受态细胞,置于冰上融化,吸取20微升的dh5α感受态细胞于1.5ml无菌的的离心管中,加入10微升连接产物,吹打混匀,冰浴30min,42℃水浴热激90s,再冰浴2min,在无菌环境中加入200微升的lb液体培养基,置于37℃、转速为180rpm的摇床中,摇菌1h,30min后将将超净工作台打开进行灭菌,在15min后,开始烧涂布器,一般烧2
‑
3分钟,放到超净工作台上等待至室温。摇菌结束后,取100微升菌液涂lb板(含有抗生素),开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到37℃恒温培养箱中培养10~12h,待长出菌斑。
[0058]
(4)挑斑:在无菌超净台中,用无菌的枪头吸取100微升lb液体培养基(含有抗生素),打入0.5ml的无菌离心管中,用10微升的无菌枪头挑取10个上述菌斑(形状比较规则的),置于lb液体培养基中,吹打几次,盖上盖子,在离心管上做好标记,放入摇床中,37℃,180rpm,4
‑
6h,得到菌液。
[0059]
(5)菌液鉴定:摇菌结束后用如下表3所示的10微升体系进行pcr鉴定,以上述菌液为模板,选用的上游引物为载体的序列,选用的下游引物为基因的下游引物,按照正常的菌批验证流程进行鉴定,以水为阴性对照。跑一个小孔胶,检验菌液的阳性率,挑选阳性鉴定中比较明亮的菌液。
[0060]
表3
[0061]
组分添加量(微升)目的载体上游引物f0.5目的基因下游引物r0.5菌液1mix(1x)8total10
[0062]
第二步,构建植物超表达载体cbf
‑
l
‑
pbi121:
[0063]
(1)将阳性的菌液提质粒(质粒提取方法根据试剂盒步骤进行),得到连有cbf
‑
l的pmd
‑
19
‑
t(simple)融合质粒。
[0064]
(2)将连有cbf
‑
l的pmd
‑
19
‑
t(simple)融合质粒和pbi121空载体按照如表4所示的40微升体系进行双酶切,37℃反应2~6h以上,一般酶切3h。
[0065]
表4
[0066]
组分添加量(微升)10
×
buffer4根据两种限制性内切酶活性共加入4质粒(cbf
‑
l的pmd
‑
19
‑
t(simple)载体或pbi121空载体)20水12total40
[0067]
(3)目的基因与目的载体的回收和连接:酶切反应时间结束后,将上述切取目的基因的条带进行胶回收(按试剂盒进行),同时将目的载体的酶切条带也切下进行胶回收(按试剂盒进行),然后用如表5所示的10微升体系对目的基因与目的载体进行连接。
[0068]
表5
[0069]
组分添加量(微升)t4连接酶110xt4buffer1目的基因和目的载体8total10
[0070]
(4)用如表6所示的体系将上述连接产物转化至大肠杆菌dh5α感受态细胞中;
[0071]
表6
[0072]
组分添加量(微升)感受态细胞(大肠杆菌dh5α)20连接产物10total30
[0073]
然后,将大肠杆菌dh5α感受态细胞从
‑
80℃冰箱中取出,立马放到事先准备好的冰上融化,吸取20微升的大肠杆菌dh5α感受态细胞于一个的1.5ml的无菌离心管中,吸取构建好的连接产物10微升,吹打混匀,冰浴30min,42℃热激90s,再冰浴2min,在无菌环境中加入200微升的lb液体培养基,置于37℃、转速为180rpm的摇床中,摇菌1h,30min后将将超净工
作台打开进行灭菌,,在15min后,开始烧涂布器,一般烧2
‑
3分钟,放到超净工作台上等待变至室温,在摇菌结束后,取100微升菌液涂lb板(带有抗生素),开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到37℃恒温培养箱中培养10
‑
12h。
[0074]
(5)挑斑:无菌超净台中,用无菌的枪头吸取100微升lb液体培养基(含有抗生素),打入0.5ml的无菌离心管中,用10微升的无菌枪头挑取10个菌斑(形状比较规则的),置于lb液体培养基中,吹打几次,盖上盖子,在离心管上做好标记,放入摇床中,37℃,180rpm,4
‑
6h。
[0075]
(6)菌液鉴定:摇菌结束后用上表3所示的10微升体系进行pcr鉴定,以菌液为模板,引物为载体的上游引物,基因的下游引物,按照正常的菌批验证流程进行鉴定,以水为阴性对照。跑一个小孔胶,检验菌液的阳性率,挑选阳性鉴定中比较明亮的菌液。
[0076]
(7)将阳性的菌液提质粒(质粒提取方法根据试剂盒步骤进行),即可得到植物超表达载体cbf
‑
l
‑
pbi121。
[0077]
第三步,利用农杆菌介导法将植物超表达载体cbf
‑
l
‑
pbi121转入gala
‑
3植株(嘎啦苹果植株):
[0078]
(1)将植物超表达载体cbf
‑
l
‑
pbi121转化到农杆菌eha105中:从
‑
80℃超低温冰箱中取出农杆菌eha105感受态细胞,吸取20微升的农杆菌eha105感受态细胞于一个1.5ml的无菌离心管中,吸取超表达载体cbf
‑
l
‑
pbi1215微升,加入50微升的农杆菌eha105感受态细胞中,吹打混匀,冰浴30min,37℃热激90s,再冰浴2min,在超净工作台中将其加入200微升的lb液体培养基中,置于28℃、转速为180rpm的摇床中摇菌4h,在摇菌结束后,取100微升菌液涂lb板(含有抗生素),开始涂板,涂板至板子变干为止,盖上盖子封口做好标记,放到28℃恒温培养箱中培养10
‑
12h。
[0079]
(2)农杆菌介导法将表达载体转入gala
‑
3植株:将获得的农杆菌eha105用yep培养基培养皿中在摇床中以180rpm,28℃振荡培养50ml,培养4
‑
6小时,直至od值为0.4
‑
0.6,用离心机以25℃,5000rpm离心5min收集菌体,用葡萄糖液体培养基(ms粉+蔗糖+葡萄糖)将菌液悬浮起来,加入20mg乙酰丁香酮备用。然后,将gala
‑
3植株从继代培养约30天的试管苗上剪取叶片用于遗传转化,选择试管苗顶部3
‑
4片叶展开的幼嫩叶片,剪去叶尖和叶柄部分,将中间部位剪成3mm宽的叶块,立即置于有农杆菌的液体共培养基中,轻轻晃动,每隔大约2min晃动几次,侵染时间大概8min左右,然后将叶块转移到无菌滤纸上吸干菌液,将表面没有菌液的叶块迅速转移至分装有共培养基的培养皿。待叶片长出转基因小芽,将小芽用扩繁培养基扩增起来。待小芽长成小苗后,放入生根培养基中生根,得到转基因植株。
[0080]
下面结合实验对本发明的技术效果作详细的描述。
[0081]
1、将上面实施例得到的两个月大生根的转基因植株和对照未经处理的ga la
‑
3处于相同外界环境下并在一段时间后进行表型观察,并进行生理数据测定,具体包括以下步骤:
[0082]
(1)选取两个月大生根的长势一致的转基因植株gala
‑
3幼苗与对照组。
[0083]
(2)将对照组与转基因植株进行驯化,并将其处于相同的外界条件之下。
[0084]
2、结果分析:
[0085]
在生根培养基中生长出须根之后,驯化cbf
‑
l超表达植株并生长两个月之后,超表达cbf
‑
l转基因gala
‑
3植株表现出明显的分枝,并且伴有明显的矮化现象,而对照组的
gala
‑
3植株长势强,并没有明显分枝情况,但整体树体高度明显高于转基因植株。这意味着cbf
‑
l能显著增强植物的分枝能力。
[0086]
综上所述,cbf
‑
l转基因gala
‑
3植株具有多分枝的表型。
[0087]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1