具有荧光特性的吡咯并喹唑啉酮骨架化合物、制备方法、用途
1.本发明属于荧光特性分子设计技术领域,具体地说,涉及一种具有荧光特性的吡咯并喹唑啉酮骨架化合物、制备方法、用途。
背景技术:
2.有机荧光物质是一类具有特殊光学性能的化合物,他们能吸收特定频率的光,在电子由激发态回到基态的过程中,发射出相较于吸收波长更长的荧光。分子荧光特性被广泛的应用于染料、oled、有机小分子探针以及防伪油墨各个领域。21世纪以来,荧光特性分子结构与荧光性质的关系,发光机理以及新型荧光特性分子合成是有机化学和材料学共同的研究热点。
3.目前为止,应用广泛的荧光特性分子:有香豆素类、罗丹明类、螺芴类和三芳基胺类等。
[0004][0005]
为构建特定功能,需要基于这类分子骨架进行衍生和修饰,这极大的限制了人们对功能型有机荧光分子的设计思路。鉴于此,我们设计并合成了一种新的荧光特性分子骨架。
技术实现要素:
[0006]
《本发明要解决的技术问题》
[0007]
寻求一种新的方法用以合成设计荧光特性分子骨架。
[0008]
《本发明采用的技术方案》
[0009]
针对上述的技术问题,本发明提供了一种具有荧光特性的吡咯并喹唑啉酮骨架化合物、制备方法、用途。
[0010]
具体地:
[0011]
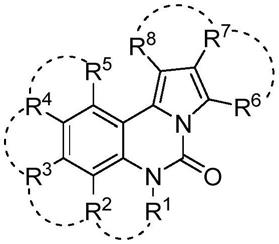
第一,本发明提供了一种具有荧光特性的吡咯并喹唑啉酮骨架化合物,化合物如figure 1所示,
[0012][0013]
其中,r1,r2,r3,r4,r5各自独立地选自:
[0014]
a.氢原子;
[0015]
b.c1-c30的烷基及取代烷基,c1-c30的硅烷基,c1-c30卤代烷基, c2-c30的烯基、共轭及非共轭的多烯基,c2-c30炔基及多炔基;
[0016]
c.卤素,羟基,烷氧基,酰氧基,巯基,硫醚基,硝基,羰基,羧基,酯基,取代或未取代的氨基,亚胺基,氰基,膦酸根,膦,酰胺基,磺酰基,烷氧羰基,芳氧羰基,烷胺羰基,芳胺羰基;
[0017]
d.取代或未取代的c5-c50的芳基;取代或未取代的c5-c50的并芳基;取代或未取代的c6-c50的稠芳基;
[0018]
e.取代或未取代的c7-c50的芳烷基;取代或未取代的c7-c50的芳烷氧基;取代或未取代的c7-c50的芳烷巯基;
[0019]
f.发色基团:任意并环、稠环。
[0020]
r6可选自:
[0021]
a.羧基,羧酸酯基,羧酸酯中醇可选自含有单个或多个c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,c4-c50的芳基,或取代芳基取代的伯醇、仲醇或者叔醇;
[0022]
b.酰胺,酰胺中胺可选自含有单个或多个氢原子,c1-c30的烷基, c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,c4-c50的芳基,或取代芳基取代的氨、伯胺或仲胺;
[0023]
c.芳基或取代芳基;
[0024]
d.腈基;
[0025]
r7可选自:
[0026]
a.氢原子;
[0027]
b.c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基, c4-c50的芳基以及取代芳基;
[0028]
r8可选自:
[0029]
a.芳基或取代芳基;
[0030]
b.发色基团:任意并环,稠环。
[0031]
第二,本发明提供了一种具有荧光特性的吡咯并喹唑啉酮骨架化合物的制备方法,包括如下单独、连续、分离或者不分离、或者一锅法经由以下的主要反应步骤:
[0032]
步骤一、3-(二苯亚甲基氨基)-氧化吲哚与α,β-不饱和羰基化合物发生michael加成反应,生成3-双取代氧化吲哚;
[0033]
步骤二、3-双取代氧化吲哚发生去保护和关环反应,生成3,2
’‑
螺环氧化吲哚亚
胺;
[0034]
步骤三、3,2
’‑
螺环氧化吲哚亚胺发生氧化重排脱氢反应,生成吡咯并喹唑啉酮。
[0035]
第三,本发明提供了具有荧光特性的吡咯并喹唑啉酮骨架化合物,在 (1)有机小分子荧光探针,(2)荧光染料以及荧光染料助剂,(3)防伪油墨添加剂,(4)光电子器件的用途。
[0036]
《本发明达到的有益效果》
[0037]
(1)本发明的吡咯并[1-2c]喹唑啉酮骨架化合物,具有显著荧光特性。
[0038]
(2)本发明的吡咯并[1-2c]喹唑啉酮骨架化合物的制备方法,能够满足合成路线短、原料便宜易得、实用性强以及反应收率高的特点,具有很好的推广应用前景。
附图说明
[0039]
图1-图2为吡咯并喹唑啉酮骨架r1对荧光特性的影响;
[0040]
图3-图4为吡咯并喹唑啉酮骨架r6对荧光特性曲线的影响;
[0041]
图5-图6为吡咯并喹唑啉酮骨架r
2-r5,r8对荧光特性曲线的影响。图7为吡咯并喹唑啉酮类荧光特性化合物合成路线;图8为实施例1中中间体3合成示意图;图9为实施例1中中间体4合成示意图;图10为实施例1中荧光特性分子1合成示意图;图11为实施例7中羧酸酯水解反应示意图;图12为实施例8中硝基还原反应示意图;图13为实施例9中1,3-二苯基吡咯并喹唑啉酮合成示意图。
具体实施方式
[0042]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0043]
《吡咯并喹唑啉酮骨架化合物的结构式》
[0044]
具有荧光特性的吡咯并喹唑啉酮骨架化合物,化合物如figure 1所示,
[0045][0046]
其中,r1,r2,r3,r4,r5各自独立地选自:
[0047]
a.氢原子;
[0048]
b.c1-c30的烷基及取代烷基,c1-c30的硅烷基,c1-c30卤代烷基, c2-c30的烯基、共轭及非共轭的多烯基,c2-c30炔基及多炔基;
[0049]
c.卤素,羟基,烷氧基,酰氧基,巯基,硫醚基,硝基,羰基,羧基,酯基,取代或未取代的氨基,亚胺基,氰基,膦酸根,膦,酰胺基,磺酰基,烷氧羰基,芳氧羰基,烷胺羰基,芳胺羰基;
[0050]
d.取代或未取代的c5-c50的芳基;取代或未取代的c5-c50的并芳基;取代或未取代的c6-c50的稠芳基;
[0051]
e.取代或未取代的c7-c50的芳烷基;取代或未取代的c7-c50的芳烷氧基;取代或未取代的c7-c50的芳烷巯基;
[0052]
f.发色基团:任意并环、稠环。如萘、蒽、菲、三芳胺、吲哚、氧化吲哚、靛蓝、异靛蓝、靛红、香豆素等。任意并环、稠环包括如下:噻吩、苯并噻吩、芳并噻吩;咔唑、苯并咔唑、芳并咔唑;吡啶、苯并吡啶、异喹啉、苯并喹啉、芳并喹啉、芳并异喹啉;芴;呋喃、苯并呋喃、芳并呋喃;吡咯、吲哚、芳并吡咯;吡唑、苯并吡唑、芳并吡唑;噁唑、苯并噁唑、芳并噁唑;异噁唑、苯并异噁唑、芳并异噁唑;噻唑、苯并噻唑、芳并噻唑;异噻唑、苯并异噻唑、芳并异噻唑;咪唑、苯并咪唑、芳并咪唑;吡喃、苯并吡喃、芳并吡喃;哒嗪、苯并哒嗪、芳并哒嗪;嘧啶、苯并嘧啶、芳并嘧啶;吡嗪、苯并吡嗪、芳并吡嗪;吩嗪、苯并吩嗪、芳并吩嗪;噻嗪、苯并噻嗪、芳并噻嗪;蝶啶、苯并蝶啶、芳并蝶啶;吖啶、苯并吖啶、芳并吖啶;吩噻嗪、苯并吩噻嗪或芳并吩噻嗪;
[0053]
r6可选自:
[0054]
a.羧基,羧酸酯基,羧酸酯中醇可选自含有单个或多个c1-c30的烷基, c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,c4-c50的芳基,或取代芳基取代的伯醇、仲醇或者叔醇;
[0055]
b.酰胺,酰胺中胺可选自含有单个或多个氢原子,c1-c30的烷基, c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,c4-c50的芳基,或取代芳基取代的氨、伯胺或仲胺;
[0056]
c.芳基或取代芳基;
[0057]
d.腈基;
[0058]
r7可选自:
[0059]
a.氢原子;
[0060]
b.c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基, c4-c50的芳基以及取代芳基;
[0061]
r8可选自:
[0062]
a.芳基或取代芳基;
[0063]
b.发色基团:任意并环、稠环。如萘、蒽、菲、三芳胺、吲哚、氧化吲哚、靛蓝、异靛蓝、靛红、香豆素等。任意并环、稠环如下:如噻吩、苯并噻吩、芳并噻吩;咔唑、苯并咔唑、芳并咔唑;吡啶、苯并吡啶、异喹啉、苯并喹啉、芳并喹啉、芳并异喹啉;芴;呋喃、苯并呋喃、芳并呋喃;吡咯、吲哚、芳并吡咯;吡唑、苯并吡唑、芳并吡唑;噁唑、苯并噁唑、芳并噁唑;异噁唑、苯并异噁唑、芳并异噁唑;噻唑、苯并噻唑、芳并噻唑;异噻唑、苯并异噻唑、芳并异噻唑;咪唑、苯并咪唑、芳并咪唑;吡喃、苯并吡喃、芳并吡喃;哒嗪、苯并哒嗪、芳并哒嗪;嘧啶、苯并嘧
啶、芳并嘧啶;吡嗪、苯并吡嗪、芳并吡嗪;吩嗪、苯并吩嗪、芳并吩嗪;噻嗪、苯并噻嗪、芳并噻嗪;蝶啶、苯并蝶啶、芳并蝶啶;吖啶、苯并吖啶、芳并吖啶;吩噻嗪、苯并吩噻嗪或芳并吩噻嗪。
[0064]
在吡咯并喹唑啉酮骨架化合物中的r
1-r8中,表述的取代芳基括但不限于c1-c50的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,卤素,羟基,烷氧基,酰氧基、氨基,酰化胺基,硝基,巯基,硫醚,氰基,羰基,羧基,酯基,酰胺基。
[0065]
《吡咯并喹唑啉酮骨架化合物的荧光特性》
[0066]
经紫外光或近紫外光照射后,该骨架结构电子跃迁至激发态。随后,激发态回归基态的过程中发生辐射跃迁,发出大于激发波长的荧光。发明人同时提供了figure1所示的吡咯并[1-2c]喹唑啉酮骨架化合物的荧光激发曲线、荧光发射曲线以及这类化合物的滨松量子产率,从而确定了最强激发波长范围:260-450nm,荧光发射波长范围350-600nm,以及固体荧光量子效率2%-100%之间,溶液量子效率15-100%之间。
[0067]
《吡咯并喹唑啉酮骨架化合物的荧光发射特性与结构之间的关系》
[0068]
发明人对吡咯并喹唑啉酮骨架化合物作为荧光特性功能分子、以及具有的荧光发射技术特性,作了如下归纳:
[0069]
吡咯并喹唑啉酮骨架包括喹唑啉酮结构单元和吡咯环结构单元。
[0070]
取代基r1的影响
[0071]
喹唑啉酮结构单元的取代基r1对于该化合物荧光发射波长影响有限,但是对荧光量子效率影响非常明显。
[0072]
为获得较高荧光量子效率,r1优选c1-c30的烷基及取代烷基,c1-c30 的硅烷基,c1-c30卤代烷基,c2-c30的烯基及共轭及非共轭的多烯基, c2-c30炔基及多炔基;取代或未取代的c5-c50的芳基;取代或未取代的 c5-c50的并芳基;取代或未取代的c6-c50的稠芳基,可获得中等到优秀的荧光量子效率。
[0073]
取代基r2,r3,r4,r5的影响
[0074]
喹唑啉酮结构单元的取代基r2,r3,r4,r5强烈影响该吡咯并喹唑啉酮骨架结构的荧光发射波长和荧光量子效率。
[0075]
r2,r3,r4,r5优选氢原子,供电子取代基如羟基,烷氧基,酰氧基,巯基,硫醚基,取代或未取代的氨基,酰化胺基。
[0076]
取代基r6的影响
[0077]
吡咯环结构单元取代基r6对荧光发射波长影响较小,对荧光量子效率影响较大。为获得较高荧光量子效率,r6优选羧酸酯基,羧酸酯中醇可选自含有单个或多个c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基, c2-c30炔基,c4-c50的芳基,或取代芳基取代的伯醇、仲醇或者叔醇;酰胺,酰胺中胺可选自含有单个或多个氢原子,c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,c4-c50的芳基,或取代芳基取代的氨、伯胺或仲胺。
[0078]
取代基r7的影响
[0079]
吡咯环结构单元的取代基r7对荧光量子效率和荧光发射波长的影响较小,可以任选自氢原子c1-c30的烷基,c1-c30卤代烷基,c2-c30的烯基, c2-c30炔基,c4-c50的芳基以及取代芳基。
[0080]
取代基r8的影响
[0081]
吡咯环结构单元的取代基r8对荧光发射波长以及荧光量子效率影响较大。因而,r8优选芳基或取代芳基,芳基取代基包括但不限于c1-c50的烷基,c1-c30卤代烷基,c2-c30的烯基,c2-c30炔基,卤素,羟基,烷氧基,酰氧基、氨基,酰化胺基,巯基,硫醚,酯基,酰胺基。发色基团:任意稠环,如萘、蒽、菲、芴、三芳胺、吲哚、氧化吲哚、靛蓝、异靛蓝、靛红、香豆素等。任意稠环可以是:噻吩、苯并噻吩、芳并噻吩;咔唑、苯并咔唑、芳并咔唑;吡啶、苯并吡啶、异喹啉、苯并喹啉、芳并喹啉、芳并异喹啉;呋喃、苯并呋喃、芳并呋喃;吡咯、吲哚、芳并吡咯;吡唑、苯并吡唑、芳并吡唑;噁唑、苯并噁唑、芳并噁唑;异噁唑、苯并异噁唑、芳并异噁唑;噻唑、苯并噻唑、芳并噻唑;异噻唑、苯并异噻唑、芳并异噻唑;咪唑、苯并咪唑、芳并咪唑;吡喃、苯并吡喃、芳并吡喃;哒嗪、苯并哒嗪、芳并哒嗪;嘧啶、苯并嘧啶、芳并嘧啶;吡嗪、苯并吡嗪、芳并吡嗪;吩嗪、苯并吩嗪、芳并吩嗪;噻嗪、苯并噻嗪、芳并噻嗪;蝶啶、苯并蝶啶、芳并蝶啶;吖啶、苯并吖啶、芳并吖啶;吩噻嗪、苯并吩噻嗪或芳并吩噻嗪。
[0082]
《吡咯并喹唑啉酮骨架化合物的合成路线》
[0083]
如scheme1(图7)所示(以下方案仅为示意图,只代表反应特例和部分,不能被解释或理解为对本发明的限制)。
[0084][0085]
《吡咯并喹唑啉酮骨架化合物的合成步骤》
[0086]
步骤一:在碱性催化剂(base)作用下3-(二苯亚甲基氨基)-氧化吲哚2与α,β-不饱和羰基化合物3(不饱和酮,不饱和酮酸酯,不饱和酮酰胺或不饱和酮氰)在碱的催化作用下,于溶剂s1中、t1温度下发生加成反应,经t1小时构建3-双取代氧化吲哚类化合物4。
[0087]
步骤二:在酸(acid)催化作用下,以s2为溶剂、在t2温度条件下 3-双取代氧化吲哚类化合物4完成去保护和关环反应,经t2小时生成螺-3,2'
‑ꢀ
吡咯啉氧化吲哚5。该步反应没有严格的过程区分,在酸性条件下,水解与关环可以同步进行,在合适的条件下也可分离得到铵盐后再分步关环。一锅法或者经独立的分离、分步反应的方法都是本方法的特征之一。
[0088]
步骤三:在t3温度条件下以s3为溶剂,氧化剂促进下,经t3小时反应后3,2'-二氢吡咯烷螺环氧化吲哚5发生重排脱氢反应生成吡咯并[1-2c]喹唑啉酮1。
[0089]
骨架化合物1的制备可以单独、连续,分离或者不分离、或者一锅法经由以上的主要反应步骤,其过程以及分离纯化可以根据不同的反应转化结果进行综合考虑,反应转化率以及过程的不同组合等对不同底物及目标产物反应的差异性结果都不应理解为对本路线及合成方法的新型性、独特性的限制。
[0090]
《吡咯并喹唑啉酮骨架化合物合成步骤中的具体要点》
[0091]
在步骤一中,选择3-(二苯基亚甲基氨基)氧化吲哚2为合成子,是本发明的关键技术之一。二苯甲酮保护下的3-氨基氧化吲哚,具有合适的反应活性,能在碱催化作用下与α,β-不饱和羰基化合物3发生michael反应,构建3位双取代氧化吲哚中间体4,反应条件温和、收率高。
[0092]
催化michael加成反应的碱可选自无机碱和/或有机碱。具体地,
[0093]
无机碱,如氨气、碱金属、碱金属的氧化物及碱金属的氢氧化物、碳酸盐及碳酸氢盐等;其中,碱金属的氧化物/氢氧化物包括氢氧化钠/氧化钠、氢氧化钾/氧化钾、氢氧化钙/氧化钙、氢氧化钡/氧化钡、氢氧化锂/氧化锂等;碳酸盐及碳酸氢盐,包括碳酸钠/碳酸
氢钠、碳酸钾/碳酸氢钾、碳酸镁、碳酸钙、碳酸锂、碳酸铯等;
[0094]
有机碱,如甲醇钠/钾、乙醇钠/钾、叔丁醇钠/钾等;各种c1-c9的醇的碱金属盐类,钠氢、氨基钠等;三乙胺、吡啶、哌啶、二异丙基乙基胺、 4-二甲氨基吡啶(dmap)、三乙烯二胺(dabco)、1,8-二偶氮杂双螺环[5.4.0] 十一-7-烯(dbu)、1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)以及金鸡纳碱类叔胺化合物。进一步地,优选dbu,dabco作为催化剂。
[0095]
在步骤二中,水解反应去掉保护基的同时关环形成螺-3,2
’‑
吡咯啉氧化吲哚5。步骤二的特征在于在酸性环境中不饱和羰基化合物与去保护后的伯胺形成亚胺。
[0096]
酸可选自有机酸或无机酸;所述有机酸包括醋酸、α单取代或多取代醋酸如2-氯醋酸,三氯醋酸,三氟醋酸、甲酸、草酸、柠檬酸或苹果酸,磺酸,丙酮酸。所述无机酸包括盐酸、硫酸、磷酸、硝酸、对甲苯磺酸、高氯酸、盐酸水溶液、硫酸水溶液、磷酸水溶液、硝酸水溶液、对甲苯磺酸水溶液或高氯酸水溶液;进一步地,优选稀盐酸、稀氢溴酸水溶液来实现步骤二转化过程。
[0097]
在步骤三中,核心在于螺-3,2
’‑
吡咯啉氧化吲哚5发生氧化重排脱氢生成吡咯并[1,2-c]喹唑啉酮。螺环亚胺的脱氢氧化重排反应是未见报道的新反应,也是合成吡咯并喹唑啉酮骨架化合物的核心反应步骤。
[0098]
氧化脱氢剂可选自2,3-二氯-5,6-二氰对苯醌(ddq),二氧化硒,二氧化锰,硝酸铈铵等常用的氧化剂。进一步地,氧化脱氢试剂优选ddq。
[0099]
在上述三个步骤中,所述溶剂(s1、s2以及s3)包含但不限于:水、 c1-c8醇类溶剂、酰胺类溶剂、砜类溶剂、芳烃类溶剂、惰性烷烃类溶剂、醚类溶剂。
[0100]
具体地,c1-c8醇类溶剂,如甲醇、乙醇、异丙醇、叔丁醇、正丁醇等;酰胺类溶剂,如n,n-二甲基甲酰胺(dmf)、n,n-二乙基甲酰胺(def)、甲酰胺、n,n-二甲基乙酰胺(dma)等;砜类溶剂,如二甲亚砜(dmso)、环丁砜等;腈类溶剂,如丙腈、丁腈、苯甲腈等;芳烃类溶剂,如甲苯、二甲苯、卤代苯、均三甲苯等;惰性烷烃类溶剂,如二氯甲烷、二氯乙烷、氯仿、环己烷、正己烷、1,2-二甲氧基乙烷(dme)等;醚类溶剂,如四氢呋喃、二氧六环、甲基叔丁基醚、乙醚等。进一步地,优选水、叔丁醇、异丙醇或者其任意比例的组合/混合。
[0101]
上述溶剂的用量通常为原料质量用量的1:1~1:5,溶剂多少对反应影响不是太明显,用量越少,对底物及产物的溶解度越少、不利于物料搅拌及热量/温度控制,用量越大,设备效率低、反应时间更长、降低后处理效率、增加能耗及后处理成本;通常2-6倍重量/体积比就能达到较理想的综合效果。
[0102]
在上述三个步骤中,所述合适温度(t1,t2以及t3)在20℃-溶剂回流温度。反应的温度低于20℃时仍可以反应,但通常会延长反应时间,温度越高,反应速度越快,但反应体系温度越高、不利于能源与设备控制,综合以上情况,优选25-80℃。反应时间(t1、t2以及t3),以底物反应完全为标准,随催化剂、溶剂和温度的变化而改变。
[0103]
《吡咯并喹唑啉酮骨架化合物的用途》
[0104]
吡咯并喹唑啉酮骨架化合物至少具有如下方面的用途:(1)作为有机小分子荧光探针,包括但不限于定量或定性的生物大分子、阳离子、阴离子以及其他小分子化合物荧光检测探针。(2)作为荧光染料以及荧光染料助剂,用于衣物,纸张的染色或增白。(3)作为防伪油墨添加剂,用于货币、商标以及商品的荧光防伪标识。(4)作为光电子器件,制备电致发光或光致发光电子器件。
[0105]
《吡咯并喹唑啉酮骨架化合物的应用场景》
[0106]
独立吡咯并喹唑啉酮骨架化合物或吡咯并喹唑啉酮骨架化合物作为添加成分的功能型荧光材料。荧光材料的功能包含但不限于前述(1)-(4) 中的所述的应用场景。
[0107]
《实施例》
[0108]
实施例1
[0109]
一种吡咯并喹唑啉酮骨架化合物的制备方法,包括如下步骤:
[0110]
步骤一,在50ml单口烧瓶中加入0.4g(1mmol)合成子2a、0.2g(1.1 mmol)不饱和酮酸酯3a以及5ml二氯甲烷。在20mg三乙胺(0.2mmol) 的催化作用下于室温反应6h。tlc检测反应进行完全,柱层析(洗脱剂 ea:pe=1:5)纯化,以78%收率得到中间体4aa。其合成示意图如图8所示。
[0111][0112]
步骤二,取中间体0.592g(1mmol)中间体4aa溶解于10ml thf溶液中,加入4-7滴1m稀盐酸溶液,在磁力搅拌下反应。反应2小时后tlc 检测反应完全。加入1ml饱和碳酸钠溶液中和盐酸,再分别加入10ml蒸馏水和10ml乙酸乙酯进行萃取。随后再加入10ml*2次乙酸乙酯进行萃取,合并有机相,干燥。后经柱层析(ea:pe=1:10)以接近定量的收率得到螺环亚胺5aa。其合成示意图如图9所示。
[0113][0114]
步骤三,将0.41g(1mmol)螺环亚胺5aa溶解于5ml甲苯中,加入等当量的ddq在50℃条件下反应6h后,tlc检测反应进行完全。反应体系通过湿法上样,柱层析分离纯化,以78%收率得到荧光特性物质1aa。其固体最大吸收波长为376nm,荧光发射波长为414nm,量子产量为13%。其溶液最大吸收波长为378nm,发射波长为415nm,量子产量为70%。其合成示意图如图10所示。
[0115][0116][0117]
化合物相应的化学式结果如下所示:
[0118]
methyl 6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo [1,2-c]quinazoline-3-carboxylate(1aa):chemical property:white solid,59%yield,mp:177-179℃,rf=0.4(ea:pe=1:6) 1h nmr(300mhz,cdcl3)δ7.66(dd,j=8.1,1.5hz,1h),7.53
–
7.38 (m,5h),7.34(ddd,j=8.6,7.2,1.5hz,1h),7.24(t,j=7.1hz,1h),7.03(s, 1h),6.95(ddd,j=8.2,7.1,1.2hz,1h),4.26(dd,j=9.0,6.7hz,2h),3.96(s, 3h),1.79(p,j=7.7hz,2h),1.50(h,j=7.4hz,2h),1.01(t,j=7.3hz,3h). 13c nmr(75mhz,cdcl3)δ162.0,145.5,135.2,134.0,129.5,128.8, 128.5,127.7,127.3,123.8,122.8,122.6,122.5,121.8,115.9,114.4,52.4,43.8, 29.2,20.1,13.7.hrms(esi)m/z calcd for c23h23n2o3+(m+h)+375.1703; found 375.1703.
[0119]
实施例2
[0120]
步骤一中,将反应催化剂由三乙胺换做dabco,其他条件与实施例1 相同,反应10小时后tlc检测反应完全。柱层析(洗脱剂ea:pe=1:5) 纯化,以89%收率得到中间体4aa。
[0121]
实施例3
[0122]
步骤一中,将反应的催化剂由(et)3n换作k2co3,其他条件与实施例1 相同,反应24小时后tlc检测反应完全。柱层析(洗脱剂ea:pe=1:5) 纯化,以56%收率得到中间体4aa。
[0123]
实施例4
[0124]
步骤一中,将反应底物2a换作2b,其他反应条件与实施例1相同,反应6小时后tlc检测反应完全。柱层析(洗脱剂ea:pe=1:5)纯化,以86%收率的到中间体4ba。
[0125]
实施例5
[0126]
将实施例1中的中间体4aa换做4ba,其他条件与实施例1相同。同样的以接近定量的收率得到螺环亚胺5ba。
[0127]
实施例6
[0128]
将实施例1中的螺环亚胺5aa换做5ba,其他条件相同。以79%收率得 到荧光特性物质1ba。其固体最大吸收波长为378nm,荧光发射波长为406 nm,滨松量子产率为53%。液体最大吸收波长为381nm,发射波长414nm, 滨松量子产率为71%。化合物相应的化学式结果如下所示:
[0129]
methyl 6-butyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c] quinazoline-3-carboxylate(1ba):chemical property:white solid,79%yield,rf:0.4(pe:ea=5:1)1h nmr (300mhz,cdcl3)δ7.66(dd,j=8.1,1.5hz,1h),7.55
–
7.39(m,5h),7.34 (ddd,j=8.6,7.2,1.5hz,1h),7.24(t,j=7.1hz,1h),7.03(s,1h),6.95(ddd, j=8.2,7.1,1.2hz,1h),4.26(dd,j=9.0,6.7hz,2h),3.96(s,3h),1.79(p,j =7.7hz,2h),1.50(h,j=7.4hz,2h),1.01(t,j=7.3hz,3h).
13
c nmr(75 mhz,cdcl3)δ162.0,145.5,135.2,134.0,129.5,128.8,128.5,127.7,127.3, 123.8,122.8,122.6,122.5,121.8,115.9,114.4,52.4,43.8,29.2,20.1, 13.7.hrms(esi)m/z calcd for c
23h23
n2o
3+
(m+h)
+
375.1703,found 375.1703
[0130]
实施例7
[0131]
在实施例6的基础上,将1ba溶于1ml thf中,在加入0.5ml饱和 氢氧化钾溶液,在碱性环境下的水解制备了带有羧酸官能团的吡咯并[1,2-c] 喹唑啉酮化合物1bb。其溶液最大激发波长为382nm,最大发射波长为408 nm,溶液荧光量子为16%。其合成示意图如图11所示,化合物相应的化学 式结果如下所示:
[0132][0133]
6-butyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylic acid (1bb):
chemical property:white solid,85%yield,mp:184-186℃, rf=0.4(ea:pe=1:6).1h nmr(400mhz,cdcl3)δ15.14(s,1h),7.79(s, 1h),7.72(dd,j=8.2,1.5hz,1h),7.53
–
7.39(m,6h),7.34(dd,j=8.6,1.1 hz,1h),7.06(ddd,j=8.2,7.2,1.1hz,1h),4.57
–
4.13(m,2h),1.88
–ꢀ
1.82(m,2h),1.60
–
1.50(m,2h),1.05(t,j=7.4hz,3h).13c nmr(101 mhz,cdcl3)δ158.5,148.4,133.6,131.8,130.5,128.5,128.4,128.1,128.0, 127.3,123.5,123.2,123.0,122.0,115.0,113.8,43.8,28.3,19.1,12.7.hrms (esi)m/z calcd for c22h21n2o3+(m+h)+361.1547;found 361.1545.
[0134]
实施例8
[0135]
在成功构建1-对硝基苯基-5-羰基-6-苄基吡咯并[1,2-c]喹唑啉酮-3-甲酸酯的基础上,通过金属铁粉在饱和氯化铵溶液中进行还原制备了1-对氨基苯基-5-羰基-6-苄基吡咯并[1,2-c]喹唑啉酮-3-甲酸酯1ac。其固体最大激发波长为407nm.发射波长为480nm,固体量子效率为3%;溶液最大激发波长为398nm,发射波长476nm,固体滨松量子产率为35%。其合成示意图如图12所示。
[0136][0137]
化合物相应的化学式结果如下所示:
[0138]
methyl 1-(4-aminophenyl)-6-benzyl-5-oxo-5,6-dihydro pyrrolo[1,2-c]quinazoline-3-carboxylate(1ac):chemicalproperty:white solid,76%yield,mp:159-161℃,rf=0.4(ea:pe=1:6). 1
h nmr(300mhz,cdcl3)δ7.77(dd,j=8.1,1.4hz,1h),7.37
–
7.30(m, 4h),7.27(dd,j=7.0,1.6hz,3h),7.23-7.12(m,2h),7.05(s,1h),6.86-6.74 (m,2h),5.53(s,2h),3.97(s,3h).
13
c nmr(75mhz,cdcl3)δ162.2,146.3, 146.1,135.9,134.2,130.5,128.8,128.2,127.5,127.3,126.6,124.8,123.6, 123.5,122.9,122.6,122.4,116.2,115.4,115.2,52.5,47.5,29.6.hrms(esi) m/z calcd for c
26h22
n3o
3+
(m+h)
+
424.1656;found 424.1655.
[0139]
实施例9
[0140]
将实施例1中的螺环亚胺5aa换做5ad,其他条件相同。以79%收率得 到荧光特性物质1ad。其溶液最大吸收波长为378nm,荧光发射波长为406 nm,滨松量子产率为53%。其合成示意图如图13所示,化合物相应的化学 式结果如下所示:
[0141][0142]
[0143]
1,3-diphenylpyrrolo[1,2-c]quinazolin-5(6h)-one(1ad):chemicalproperty:whitesolid,74%yield,mp:181-183℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,dmso-d6)δ11.35(s,1h),7.56-7.43(m,7h),7.42-7.30(m,3h),7.30-7.20(m,2h),7.04-6.82(m,1h),6.64(s,1h).
13
cnmr(75mhz,dmso)δ145.9,135.7,133.3,133.0,132.0,129.6,129.4,128.9,127.6,127.5,127.0,126.8,125.2,122.2,122.1,121.5,118.8,115.4,114.7.hrms(esi)m/zcalcdforc
23h17
n2o
+
(m+h)
+
337.133;found337.1334.
[0144]
实施例10
[0145]
将实施例1中的2a换做含四氢喹啉结构的3-氨基氧化吲哚席夫碱2c,完成三步反应后,以46%收率得到8-羰基-12-苯基-5,6-二氢-4h,8h-吡啶并[3,2,1-ij]吡咯并[1,2-c]喹唑啉酮-10-羧酸甲酯1ca。其溶液最大激发波长为377nm,最大发射波长为438nm,滨松量子产率为20%。化合物相应的化学式结果如下所示:
[0146]
methyl8-oxo-12-phenyl-5,6-dihydro-4h,8h-pyrido[3,2,1-ij]pyrrolo[1,2-c]quinazoline-10-carboxylate(1ca):chemicalproperty:whitesolid,46%yield,mp:178-180℃,rf=0.4(ea:pe=1:6)1hnmr(400mhz,cdcl3)δ7.49-7.42(m,5h),7.11(dq,j=7.5,1.2hz,1h),7.03(s,1h),6.86(t,j=7.7hz,1h),4.26-4.16(m,2h),3.96(s,3h),2.93(t,j=6.2hz,2h),2.13(p,j=6.1hz,2h).
13
cnmr(101mhz,cdcl3)δ161.2,144.4,134.4,130.4,128.6,127.8,127.5,126.7,126.6,124.2,122.0,121.5,121.1,120.9,120.7,114.5,51.5,42.5,26.5,19.8.hrms(esi)m/zcalcdforc22h19n2o3+(m+h)+359.1390;found359.1391.
[0147]
实施例11
[0148]
将实施例1中的2a换做酰胺氮原子2-氯乙基取代的3-氨基氧化吲哚席夫碱2d,同时将不饱和酮酸甲酯3a换做不饱和酮酸异丙酯3e。完成三步反应后,以47%收率得到1-(2-氯乙基)-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸异丙酯1de。其溶液最大激发波长为375nm,最大发射波长为412nm,滨松量子产率为66%。化合物相应的化学式结果如下所示:
[0149]
isopropyl6-(2-chloroethyl)-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1de):
chemicalproperty:whitesolid,47%yield,mp:154-156℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,cdcl3)δ7.66(d,j=8.0hz,1h),7.52-7.39(m,5h),7.39-7.25(m,2h),7.02(d,j=14.5hz,2h),5.33(p,j=6.3hz,1h),4.60(t,j=7.4hz,2h),3.87(t,j=7.4hz,2h),1.42(d,j=6.3hz,6h).
13
cnmr(75mhz,cdcl3)δ160.9,145.5,135.1,133.9,129.5,128.9,128.6,127.9,127.0,123.9,123.6,123.2,123.0,122.2,116.0,114.1,69.1,45.2,39.3,21.8.hrms(esi)m/zcalcdforc
23h22
cln2o
3+
(m+h)
+
409.1314(cl
35
),411.1284(cl
37
);found409.1316(cl
35
),411.1288(cl
37
).
[0150]
实施例12
[0151]
将实施例1中的2a换做酰胺氮原子2-乙酸甲酯取代基取代的3-氨基氧化吲哚席夫碱2e,同时将不饱和酮酸甲酯3a换做不饱和酮酸异丙酯3e。完成三步反应后,以60%收率得到6-(2-乙酰基-2-甲氧基)-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸异丙酯1ee。其溶液最大激发波长为369nm,最大发射波长为415nm,滨松量子产率为73%。化合物相应的化学式结果如下所示:
[0152]
isopropyl6-(2-methoxy-2-oxoethyl)-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ee):chemicalproperty:whitesolid,60%yield,mp:151-153℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,cdcl3)δ7.70-7.62(m,1h),7.54-7.39(m,5h),7.37-7.28(m,1h),6.99(dd,j=15.3,7.5hz,3h),5.31(p,j=6.2hz,1h),5.08(s,2h),3.79(s,3h),1.40(d,j=6.3hz,6h).
13
cnmr(75mhz,cdcl3)δ168.3,160.8,145.8,135.1,134.1,129.5,128.9,128.6,127.9,127.1,123.9,123.8,123.2,122.9,122.4,115.9,113.6,69.1,52.7,45.1,21.8.hrms(esi)m/zcalcdforc
24h23
n2o
5+
(m+h)
+
419.1602;found419.1602.
[0153]
实施例13
[0154]
将实施例1中的2a换做酰胺氮原子甲基取代的3-氨基氧化吲哚席夫碱2f,完成三步反应后,以47%收率得到6-甲基-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1fa。其溶液最大激发波长为380nm,最大发射波长为414nm,滨松量子产率为55%。化合物相应的化学式结果如下所示:
[0155]
methyl6-methyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1fa):
chemicalproperty:whitesolid,47%yield,mp:140-142℃,rf=0.4(ea:pe=1:6)1hnmr(300mhz,cdcl3)δ7.65(dd,j=8.1,1.4hz,1h),7.53-7.39(m,5h),7.36(ddd,j=8.6,7.2,1.5hz,1h),7.26(d,j=2.4hz,1h),7.06-6.93(m,2h),3.96(s,3h),3.74(s,3h).
13
cnmr(75mhz,cdcl3)δ162.1,135.2,135.0,129.6,128.9,128.6,127.8,127.3,123.5,122.9,122.8,122.0,115.7,114.4,52.5,31.2.hrms(esi)m/zcalcdforc
20h17
n2o
3+
(m+h)
+
333.1234;found333.1240.
[0156]
实施例14
[0157]
将实施例1中不饱和酮酸酯3a中苯基换做对甲氧基苯基3f,完成三步反应后,以53%收率得到6-苄基-5-羰基-1-(4-甲氧基苯基)-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1af。其溶液最大激发波长为384nm,最大发射波长为434nm,滨松量子产率为57%。化合物相应的化学式结果如下所示:
[0158]
methyl1-(4-methoxyphenyl)-6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1af):chemicalproperty:whitesolid,53%yield,mp:187-189℃,rf=0.4(ea:pe=1:6)1hnmr(300mhz,cdcl3)δ7.67(dd,j=8.1,1.4hz,1h),7.43-7.36(m,2h),7.31(d,j=3.1hz,4h),7.22-7.11(m,2h),7.07-6.97(m,3h),6.93(ddd,j=8.2,6.8,1.5hz,1h),5.52(s,2h),3.92(d,j=21.1hz,6h).
13
cnmr(75mhz,cdcl3)δ162.1,159.3,146.3,135.8,134.2,130.7,128.8,128.4,127.5,127.3,127.2,126.6,123.6,123.3,122.9,122.7,121.9,116.1,115.3,114.3,55.3,52.5,47.6.hrms(esi)m/zcalcdforc
27h23
n2o
4+
(m+h)
+
439.1652;found439.1651.
[0159]
实施例15
[0160]
将不饱和酮酸酯3a中苯基换做对氟基苯基3g,完成三步反应后,以47%收率得到6-苄基-5-羰基-1-(4-氟苯基)-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1ag。其溶液最大激发波长为372nm,最大发射波长为415nm,滨松量子产率为81%。化合物相应的化学式结果如下所示:
[0161]
methyl1-(4-fluorophenyl)-6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ag):
chemicalproperty:thicksolid,63%yield,rf=0.4(ea:pe=1:6)1hnmr(300mhz,cdcl3)δ7.58(dd,j=8.0,1.4hz,1h),7.53-7.39(m,2h),7.32(d,j=6.2hz,4h),7.25-7.12(m,4h),7.04(d,j=0.9hz,1h),6.94(ddd,j=8.2,7.0,1.5hz,1h),5.52(s,2h),3.96(d,j=1.0hz,3h).
13
cnmr(75mhz,cdcl3)δ164.2,162.1,160.9,146.2,135.7,134.3,131.4,131.3,131.1,131.1,128.9,128.6,127.6,127.5,126.6,123.5,123.0,122.9,122.9,121.0,116.1,115.8,115.5,52.5,47.7.hrms(esi)m/zcalcdforc
26h20
fn2o
3+
(m+h)
+
427.1453;found427.1452.
[0162]
实施例16
[0163]
将不饱和酮酸酯3a中苯基换做2-噻吩取代基3h,完成三步反应后,以66%收率得到6-苄基-5-羰基-1-(2-噻吩基)-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1ah。其溶液最大激发波长为380nm,最大发射波长为418nm,滨松量子产率为12%。化合物相应的化学式结果如下所示:
[0164]
methyl1-(thiophen-2-yl)-6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ad):chemicalproperty:whitesolid,66%yield,mp:183-185℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,cdcl3)δ7.80(dd,j=8.1,1.5hz,1h),7.44(dd,j=4.6,1.8hz,1h),7.36-7.22(m,6h),7.21-7.13(m,3h),7.10(d,j=1.1hz,1h),6.99(ddd,j=8.2,7.0,1.3hz,1h),5.52(s,2h),3.96(d,j=1.5hz,3h).
13
cnmr(75mhz,cdcl3)δ161.9,146.0,135.6,134.3,128.9,128.7,127.7,127.6,127.5,126.6,123.7,123.7,123.2,122.7,115.6,115.3,113.8,52.6,47.6.hrms(esi)m/zcalcdforc
24h19
n2o3s
+
(m+h)
+
415.1111;found415.1113.
[0165]
实施例17
[0166]
将3-氨基氧化吲哚席夫碱2a换做5-氟-3-氨基氧化吲哚2g,完成三步反应后,以56%收率得到9-氟-6-苄基-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1ga。其溶液最大激发波长为384nm,最大发射波长为411nm,滨松量子产率为39%。化合物相应的化学式结果如下所示:
[0167]
methyl9-fluoro6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ga):
chemicalproperty:whitesolid,56%yield,mp:180-182℃,rf=0.4(ea:pe=1:6).1hnmr(400mhz,cdcl3)δ7.45-7.36(m,5h),7.27-7.20(m,5h),7.03(dd,j=9.3,4.6hz,1h),6.98(s,1h),6.84(ddd,j=9.2,7.6,2.9hz,1h),5.43(s,2h),3.90(s,3h).
13
cnmr(101mhz,cdcl3)δ;found427.1452.
[0168]
实施例18
[0169]
将3-氨基氧化吲哚席夫碱2a换做5-甲氧基-3-氨基氧化吲哚席夫碱2h,完成三步反应后,以47%收率得到9-氟-6-苄基-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸甲酯1ha。其溶液最大激发波长为390nm,最大发射波长为425nm,滨松量子产率为18%。化合物相应的化学式结果如下所示:
[0170]
methyl9-methoxy-6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ha):chemicalproperty:whitesolid,47%yield,mp:158-160℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,cdcl3)δ7.55-7.39(m,5h),7.33-7.27(m,4h),7.13-7.01(m,3h),6.78(dd,j=9.2,2.8hz,1h),5.50(s,2h),3.97(s,3h),3.40(s,3h).
13
cnmr(75mhz,cdcl3)δ162.3,155.1,146.1,135.9,135.2,129.9,128.9,128.8,128.2,128.0,127.5,127.2,126.6,122.9,122.4,122.2,116.7,116.6,106.5,55.0,52.5,47.7.hrms(esi)m/zcalcdforc
26h21
n2o
3+
(m+h)
+
409.1547;found409.1546.
[0171]
实施例19
[0172]
将不饱和酮酸酯3b中酯基取代基换做乙基3i,完成三步反应后,以60%收率得到6-苄基-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸乙酯1ai。其溶液最大激发波长为380nm,最大发射波长为412nm,滨松量子产率为46%。化合物相应的化学式结果如下所示:
[0173]
ethyl6-benzyl-5-oxo-1-phenyl-5,6-dihydropyrrolo[1,2-c]quinazoline-3-carboxylate(1ai):chemicalproperty:whitesolid,60%yield,mp:157-159℃,rf=0.4(ea:pe=
1:6).1hnmr(300mhz,cdcl3)δ7.68(dd,j=8.0,1.4hz,1h),7.56-7.42(m,5h),7.34(d,j=4.3hz,4h),7.29-7.15(m,3h),7.10(s,1h),6.93(ddd,j=8.2,6.6,1.7hz,1h),5.54(s,2h),4.47(q,j=7.1hz,2h),1.43(t,j=7.1hz,3h).
13
cnmr(75mhz,cdcl3)δ161.6,146.2,135.8,135.2,134.2,129.5,128.8,128.8,128.4,127.8,127.4,127.2,126.6,123.5,123.3,122.9,122.8,122.1,115.9,115.2,61.4,47.5,14.2.hrms(esi)m/zcalcdforc
28h25
n2o
3+
(m+h)
+
437.1860,found437.1859.
[0174]
实施例20
[0175]
将不饱和酮酸酯3b中酯基取代基换做异丙基3e,完成三步反应后,以59%收率得到6-苄基-5-羰基-1-苯基-5,6-二氢吡咯并[1,2-c]喹唑啉酮-3-羧酸异丙酯1ae。其溶液最大激发波长为378nm,最大发射波长为415nm,滨
[0176]
isopropylchemicalproperty:whitesolid,59%yield,mp:142-144℃,rf=0.4(ea:pe=1:6).1hnmr(300mhz,cdcl3)δ7.68(dd,j=8.0,1.4hz,1h),7.57-7.40(m,5h),7.34(d,j=4.3hz,4h),7.30-7.15(m,3h),7.10(s,1h),6.93(ddd,j=8.2,6.6,1.7hz,1h),5.54(s,2h),4.47(q,j=7.1hz,2h),1.43(t,j=7.1hz,3h).
13
cnmr(75mhz,cdcl3)δ161.6,146.2,135.8,135.2,134.2,129.5,128.8,128.8,128.4,127.8,127.4,127.2,126.6,123.5,123.3,122.9,122.8,122.1,115.9,115.2,61.4,47.5,14.2.hrms(esi)m/zcalcdforc
28h25
n2o
3+
(m+h)
+
437.1860;found437.1859.
[0177]
《试验例》
[0178]
对产物1ba、1de、1ee、1fe、1aa、1ca、1ai、1ae、1bb、1ad、1ac、1af、1ga、1ha、1ag、1ah测定对荧光特性曲线的影响。
[0179]
其中,图1-图2为吡咯并喹唑啉酮骨架r1对荧光特性的影响;图3-图4为吡咯并喹唑啉酮骨架r6对荧光特性曲线的影响;图5-图6为吡咯并喹唑啉酮骨架r
2-r5,r8对荧光特性曲线的影响。
[0180]
其中,上述各产物的结构式如下所示:
[0181][0182]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1