酰胺化合物的制造方法与流程
1.本发明涉及一种酰胺化合物的制造方法。
背景技术:
2.拉科酰胺为具有阵痛作用和抗痉挛作用的氨基酸衍生物(专利文献1:us5773475)。
3.作为拉科酰胺的合成方法,专利文献2中已知有使n-boc-d-丝氨酸使用甲基化剂和有机锂化合物或者在甲基化剂和相转移催化剂的存在下反应,进行o-甲基化,接着通过n-苄基酰胺化、脱保护、乙酰化而制造的方法。
4.专利文献1:us5773475
5.专利文献2:日本专利第5128281号公报
技术实现要素:
6.通过上述专利文献2的方法所制造的经n-苄基酰胺化的化合物的收率未必令人满意,另外,拉科酰胺的析晶收率也未必令人满意。本发明提供一种拉科酰胺的经改良的制造方法。
7.本发明人等为了解决上述课题而进行了深入研究,结果发现通过在拉科酰胺的析晶中调整析晶母液的水分,从而可高效地得到经纯化的目标物。另外,在由d-丝氨酸得到目标物的工序中也发现了改良点,从而完成了下述的拉科酰胺的制造方法。
8.本发明提供一种拉科酰胺(以下,记为式(1)的酰胺化合物)的制造方法。本发明包含以下的项中记载的实施方式,但不限定于这些。
9.1.一种式(1)的纯化酰胺化合物的制造方法,其特征在于,从包含式(1)的酰胺化合物和相对于式(1)的酰胺化合物1摩尔为2.0摩尔以下的水分的析晶母液中析晶出式(1)的化合物。(以下,记为“本发明的纯化酰胺化合物的制造方法”)。
[0010][0011]
2.一种式(1)的纯化酰胺化合物的制造方法,包括:将式(2)的氨基化合物乙酰化而制造前项1所述的式(1)的酰胺化合物的工序,制备包含所生成的式(1)的酰胺化合物和相对于式(1)的酰胺化合物1摩尔为2.0摩尔以下的水分的溶液的工序,以及前项1所述的工序。
[0012][0013]
3.一种式(1)的纯化酰胺化合物的制造方法,包括:使盐酸作用于式(3)的化合物
而制造式(2)的氨基化合物的工序,以及前项2所述的工序。
[0014][0015]
(式中,boc表示叔丁氧基羰基)
[0016]
4.一种上述式(3)的化合物的制造方法,在氯甲酸异丁酯的溶液中滴加式(4)的羧酸化合物、n-甲基吗啉的混合溶液,并进一步加入苄胺。(以下,记为“本发明的boc化酰胺化合物的制造方法”)。
[0017][0018]
(式中,boc表示叔丁氧基羰基)
[0019]
5.一种式(3)的化合物的制造方法,包括:将四氢呋喃和水作为溶剂,在碱金属氢氧化物的存在下使式(5)的化合物与硫酸二甲酯反应而制造式(4)的化合物的工序,以及前项4所述的工序。(记为“本发明的boc化羧酸化合物的制造方法”)。
[0020][0021]
(式中,boc表示叔丁氧基羰基)
[0022][0023]
(式中,boc表示叔丁氧基羰基)
[0024][0025]
(式中,boc如上所述)
[0026]
6.一种式(3)的化合物的制造方法,包括:将d-丝氨酸的氨基进行叔丁氧基羰基化而制造前项5所述的式(5)的化合物的工序,以及前项5的工序。
[0027]
7.一种式(1)的纯化酰胺化合物的制造方法,包括:前项4、5或6所述的式(3)的化合物的制造工序,以及前项3所述的工序。
[0028]
8.一种前项1所述的析晶母液,包含式(1)的化合物和相对于式(1)的化合物1摩尔为2.0摩尔以下的水。
[0029]
根据本发明的制造方法,能够高效地纯化目标酰胺化合物,能够制造高品质的目标物。另外,发现一种提高拉科酰胺的制造工序的收率,将多个工序有效地连接的工业上有
利的制造方法。
具体实施方式
[0030]
以下,对本发明进行详细说明。应予说明,本说明书中“包含(comprise)”还包含“本质上由
…
构成(essentially consist of)”的含义和“仅由
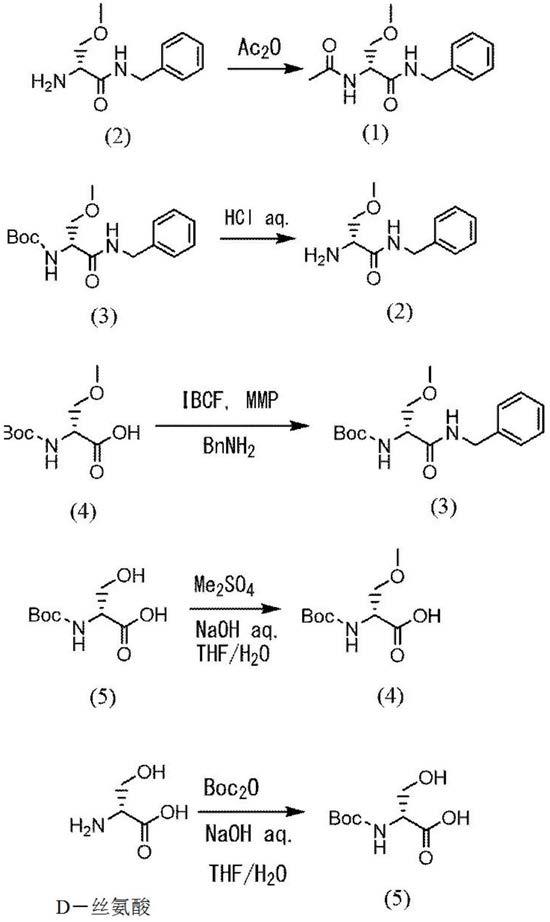
…
构成(consist of)”的含义。
[0031]
对以从包含式(1)的酰胺化合物和相对于式(1)的酰胺化合物1摩尔为2.0摩尔以下的水分的析晶母液中晶析出式(1)的化合物为特征的式(1)的纯化酰胺化合物的制造方法(“本发明的纯化酰胺化合物的制造方法”)进行说明。析晶中使用的包含式(1)的酰胺化合物的溶液典型地通过如下所述的方法而得到。
[0032]
式(1)的化合物例如可以通过将式(2)的化合物乙酰化而制造。乙酰化典型地可使用乙酸酐。从能够有效地作业的观点考虑,在式(2)的化合物与乙酸酐的反应中,优选使用包含化合物(2)的制造工序中得到的式(2)的盐酸盐的水溶液。
[0033]
作为反应中使用的溶剂,例如可以使用水、乙酸甲酯、乙酸乙酯、乙酸异丙酯等酯系溶剂、甲乙酮、甲基异丁基酮等酮系溶剂或它们的混合物作为溶剂。水与乙酸乙酯的混合液为优选的溶剂。
[0034]
式(2)的化合物与乙酸酐(ac2o)的反应可以在氢氧化钠水溶液、碳酸氢钠(nahco3)、碳酸氢钾(khco3)或它们的混合物的存在下进行。
[0035]
反应温度通常为0℃~溶剂的沸点的范围内,20~50℃的范围为优选的温度。
[0036]
相对于式(2)的化合物1摩尔,优选使用0.9~2.0摩尔的乙酸酐(ac2o),从经济性的观点考虑,更优选1.0~1.1摩尔。通过对反应混合物进行例如分液操作、以及利用碳酸氢钠水、水等的分液清洗操作而除去副生成的无机盐、有机酸盐等,得到包含式(1)的化合物的有机溶剂溶液。
[0037]
有机溶剂溶液的水分含量的调整例如可以通过将水与通过分液操作而得到的包含式(1)的化合物的溶液的溶剂一起浓缩除去而实施。水分含量的调整可以使用例如硫酸钠、硫酸镁、分子筛等脱水剂。水分含量的确认例如可以通过卡尔费休滴定法进行测定。水分含量只要相对于式(1)的化合物1摩尔为2.0摩尔以下即可。使用将水分含量调节为上述规定的量的包含式(1)的化合物的有机溶剂溶液来实施析晶。
[0038]
作为有机溶剂,例如可以使用乙酸甲酯、乙酸乙酯、乙酸异丙酯等酯系溶剂、甲乙酮、甲基异丁基酮等酮系溶剂或它们的混合物作为溶剂。从效率性的观点考虑,优选使用与将式(2)的化合物乙酰化时的反应中使用的溶剂相同的有机溶剂,乙酸乙酯为优选的溶剂。
[0039]
有机溶剂的使用量以整体计相对于式(1)的化合物10重量份,通常为30~100重量份,优选30~50重量份。
[0040]
上述有机溶剂的量可以通过浓缩进行调整,也可以进一步将上述有机溶剂馏去到其下限值以下后加入有机溶剂而调整到上述范围。析晶的开始温度通常在40~70℃的范围进行,也可以使用晶种。也可以在上述有机溶剂溶液或从该有机溶剂溶液中析出一部分式(1)的酰胺化合物的析晶浆料混合物中加入相对于式(1)的酰胺化合物的不良溶剂。作为不良溶剂,例如可以使用环己烷、正己烷,优选环己烷。不良溶剂的使用量相对于析晶中使用的溶剂10重量份,通常为3~20重量份,优选为3~10重量份。接下来,将所得到的浆料混合
物冷却。冷却温度通常为-10℃~20℃,从收率和操作性的观点考虑,优选为-5℃~5℃。冷却的速度可以在1小时1℃~20℃的范围内、优选1小时5℃~20℃的范围进行。
[0041]
对于冷却后的混合物,在液体中析出式(1)的酰胺化合物,获得该固体(晶体)并进行干燥,由此得到式(1)的酰胺化合物。析出的式(1)的酰胺化合物可以依照公知的固液分离方法而获得。具体而言,可举出过滤、倾析等固液分离操作。所得到的式(1)的酰胺化合物的晶体可以根据需要利用溶剂进行清洗。作为清洗中使用的溶剂,没有特别限定,可使用与析晶溶剂相同的溶剂(优选为乙酸乙酯与环己烷的混合物)。分离出的式(1)的酰胺化合物可以在常压或减压下进行干燥。
[0042]
式(2)的化合物通常可以通过使用盐酸将式(3)的化合物进行脱boc(叔丁氧基羰基)化而制造。在使用式(3)的化合物和盐酸的脱boc化的反应中,从能够有效地作业的观点考虑,优选使用制造式(3)的化合物时得到的包含式(3)的化合物的溶液。
[0043]
作为反应中使用的溶剂,可以使用甲苯等芳香族系溶剂、乙酸甲酯、乙酸乙酯、乙酸异丙酯等酯系溶剂、甲乙酮、甲基异丁基酮等酮系溶剂作为溶剂,优选甲苯。
[0044]
相对于式(3)的化合物1摩尔,优选使用1~10摩尔的盐酸,从反应性、经济性的观点考虑,更优选3~5摩尔的盐酸。反应温度通常在0℃~溶剂的沸点内,优选10~30℃的范围。反应后,式(2)的化合物以盐酸盐的形式包含在水层中,因此可以通过分液而与有机溶剂分离,以水溶液的形式得到。
[0045]
式(3)的化合物可以通过在氯甲酸异丁酯的溶液中滴加式(4)的羧酸化合物、n-甲基吗啉的混合溶液,并进一步滴加苄胺而制造。式(3)的化合物可以通过公知的方法来制造,但根据本发明的boc化酰胺化合物的制造方法,能够以更良好的收率制造式(3)的化合物。
[0046]
在式(4)的化合物与氯甲酸异丁酯和苄胺的反应中,从能够有效作业的观点考虑,优选使用式(4)的化合物的制造工序中得到的包含式(4)的化合物的溶液。作为反应中使用的溶剂,可以使用甲苯等芳香族系溶剂、乙酸甲酯、乙酸乙酯、乙酸异丙酯等酯系溶剂、甲乙酮、甲基异丁基酮等酮系溶剂作为溶剂,优选甲苯。反应温度优选在10℃以下的温度进行,更优选-15~0℃的范围。
[0047]
氯甲酸异丁酯(ibcf)、n-甲基吗啉(mmp)、苄胺的使用量相对于式(4)的化合物1摩尔优选使用0.9~2.0摩尔,更优选使用1.0~1.1摩尔。
[0048]
可以通过利用水、盐酸水、碳酸氢钠水等的分液清洗操作从式(4)的化合物与氯甲酸异丁酯和苄胺的反应而生成的反应混合物中除去副生成的无机盐、有机酸盐等,可以以有机层的形式得到包含式(3)的化合物的溶液。通过采用如上所述的反应方法,羧基的反应性提高,能够收率良好地得到式(3)的化合物。
[0049]
式(4)的化合物典型地是将四氢呋喃(thf)和水作为溶剂,在碱金属氢氧化物的存在下使式(5)的经boc化的d-丝氨酸与硫酸二甲酯反应而制造的。
[0050]
在式(5)的化合物与硫酸二甲酯的反应中,从能够有效地作业的观点考虑,优选使用制造式(5)的化合物时得到的包含式(5)的化合物钠盐的水溶液。从反应性的观点考虑,追加的溶剂优选为使硫酸二甲酯溶解并容易与水混合的溶剂,例如可以使用四氢呋喃、丙酮、乙腈、二甲基甲酰胺、二甲基乙酰胺、n-甲基吗啉、二甲基亚砜、甲醇、乙醇、2-丙醇、叔丁醇等,这些溶剂中,优选四氢呋喃。从反应性的观点考虑,溶剂相对于水的使用量相对于
水10重量份,优选使用1~10重量份。从经济性的观点考虑,更优选使用2~5重量份。
[0051]
作为碱金属氢氧化物,可以使用氢氧化钠、氢氧化钾、氢氧化锂等,其中,优选氢氧化钠。从反应性的观点考虑,碱金属氢氧化物的使用量优选与硫酸二甲酯的使用量相比过量0.05~1摩尔,更优选过量0.1~0.5摩尔。硫酸二甲酯的使用量相对于式(5)的化合物1摩尔优选3~10摩尔,更优选5~8摩尔。反应温度没有特别限定,但从防止消旋化的观点考虑,优选更低的温度,优选-10~10℃。通过在反应后的反应混合物中添加有机溶剂,并进一步在所得到的混合物中添加酸进行中和,从而能够将式(4)的羧酸化合物萃取到有机溶剂中。作为添加的酸,例如可举出盐酸、硫酸、硝酸等无机酸;乙酸、甲酸、丙酸、草酸、柠檬酸等有机酸。由于ph优选调节为2以下,因此优选使用盐酸。萃取中使用的有机溶剂可以使用甲苯等芳香族系溶剂、乙酸甲酯、乙酸乙酯、乙酸异丙酯等酯系溶剂、甲乙酮、甲基异丁基酮等酮系溶剂,优选甲苯。通过萃取操作而得到的含有式(4)的化合物的溶液可以通过浓缩而除去有机溶剂。
[0052]
式(5)的化合物典型地是将四氢呋喃(thf)和水作为溶剂,在碱的存在下使d-丝氨酸与二碳酸二叔丁酯反应而制造的。
[0053]
在该反应中,作为溶剂,通常使用水,也可以混合有机溶剂。从反应性的观点考虑,有机溶剂优选为使二碳酸二叔丁酯溶解并容易与水混合的溶剂,例如可以使用四氢呋喃、丙酮、乙腈、二甲基甲酰胺、二甲基乙酰胺、n-甲基吗啉、二甲基亚砜、甲醇、乙醇、2-丙醇、叔丁醇等,优选四氢呋喃。
[0054]
水的使用量只要能够溶解d-丝氨酸和通过反应而生成的式(5)的化合物的钠盐即可,相对于d-丝氨酸10重量份,通常为3~10重量份。二碳酸二叔丁酯的使用量相对于d-丝氨酸1摩尔优选1.0~2.0摩尔,更优选1.0~1.5摩尔。
[0055]
作为上述碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾等,其中,优选氢氧化钠,也可以将氢氧化钠与碳酸钠或碳酸氢钠混合而使用。碱的使用量相对于d-丝氨酸1摩尔优选1.0~3.0摩尔,更优选1.1~1.3摩尔。
[0056]
d-丝氨酸与二碳酸二叔丁酯的反应温度没有特别限定,从反应性的观点考虑,优选30~50℃。可以将通过反应而生成的混合物通过利用甲苯等有机溶剂的分液清洗操作而除去残留的二碳酸二叔丁酯试剂等,可以由水层得到包含式(5)的化合物碱金属盐(优选钠盐)的溶液。
[0057]
在本发明的方法中,从d-丝氨酸到式(1)的化合物,可以在不分离中间体(式(5)~式(2))的情况下直接以溶液状态相连地制造,工序之间的衔接容易,作为一种有效的工业性制造方法是优异的。根据该方法,能够制造减少了下述式(6)的化合物的含量的式(1)的纯化酰胺化合物。
[0058]
式(6)(以下,有时也载为oh体)的化合物为来自制造式(4)的化合物时残留的原料即式(5)的化合物的杂质,具有对式(1)的酰胺化合物进行了脱甲基化的结构。
[0059][0060]
在本发明的方法中,式(1)的酰胺化合物能够以良好的收率由d-丝氨酸来制造,所得到的式(1)的酰胺化合物的纯度通常可以为99.9%以上,进一步可以为99.95%以上。
另外,能够将所得到的式(1)的酰胺化合物中的oh体的含量通常减少到小于0.05%,进一步减少到小于0.03%。
[0061]
以下的方案中示出本发明的酰胺化合物的制造工序的典型例。
[0062][0063]
实施例
[0064]
以下,举出实施例对本发明进一步详细地进行说明。但是,本发明并不限定于这些实施例等。
[0065]
制造例1
[0066]
1)式(5)的化合物的制造
[0067]
将水(350ml)、25%氢氧化钠水溶液(152g,0.95摩尔)、碳酸氢钠(16g,0.19摩尔)、d-丝氨酸(100g,0.95摩尔)的混合液升温到40℃,加入四氢呋喃(50ml)。在40℃下用3h以上向该溶液滴加二碳酸二叔丁酯(249g,1.14摩尔)与四氢呋喃(50ml)的混合液。在40℃保温,确认原料消失后,加入甲苯(200ml),在40℃进行分液清洗,由水层得到式(5)的化合物的钠盐溶液。式(5)的化合物的收率为100%,hplc纯度为97.6%。
[0068]
2)式(4)的化合物的制造
[0069]
在式(5)的化合物的钠盐溶液(0.48摩尔)中加入四氢呋喃(160ml)后,冷却到0℃,一边保持温度一边在0℃同时注入硫酸二甲酯(420g,3.33摩尔)和50%氢氧化钠水溶液(285g,3.57摩尔)。同时注入后,用约2h升温到20℃并保温。确认原料消失后,加入甲苯(500ml),在20℃加入35%盐酸将ph调节为1~2。分液后,将得到的有机层在20℃用20%食盐水(100ml)清洗。从得到的有机层减压馏去约350g的溶剂,得到式(4)的化合物的溶液。由式(5)的化合物得到的式(4)的化合物的收率为99%,hplc纯度为96.3%,光学纯度为97.6%。
[0070]
3)式(3)的化合物的制造
[0071]
将氯甲酸异丁酯(67g,0.49摩尔)与甲苯(220ml)混合,冷却到-10℃。在-10℃向该溶液滴加将在式(4)的化合物的溶液(0.47摩尔)中加入n-甲基吗啉(50g,0.49摩尔)而得的混合液。将混合物在-10℃保温,确认原料消失后,在-10℃滴加异丙醇(44ml)与苄胺(52g,0.49摩尔)的混合液。滴加结束后,用约2h升温到10℃并保温。确认中间体消失后,将混合物依次用水(196ml)、3.5%盐酸(98ml)、8%碳酸氢钠水溶液(98ml)进行清洗,得到式(3)的化合物的甲苯溶液。由式(4)的化合物得到的式(3)的化合物的收率为96.9%。
[0072]
4)式(2)的氨基化合物的制造
[0073]
将式(3)的化合物甲苯溶液(0.44摩尔)调温到15℃,一边保持温度一边滴加35%盐酸(167g,1.60摩尔)。将混合物在15℃保温,确认原料消失。冷却到5℃后,向混合物滴加水(96ml),进行分液,由水层得到式(2)的氨基化合物盐酸盐的水溶液。
[0074]
5)式(1)的纯化酰胺化合物的制造
[0075]
在30℃以下向式(2)的化合物的盐酸盐水溶液滴加50%氢氧化钠水溶液(110g,1.37摩尔),加入碳酸氢钠(27g,0.32摩尔)。向其中进一步加入乙酸乙酯(720ml)后,升温到35℃,一边保持温度一边滴加乙酸酐(47g,0.46摩尔)。将混合物在35℃保温,确认原料消失后,将混合物分液,接着用8%碳酸氢钠水溶液(96ml)、水(48ml)进行清洗。得到的有机层中的oh体的含量为0.3%。(oh体的含量是指由高效液相色谱图中的峰的面积值并基于下式而算出的值(式(6)的oh体的面积值/(式(6)的oh体的面积值+式(1)的化合物的面积值))
×
100)。在得到的有机层中加入乙酸乙酯(141ml)后,减压馏去约700g的溶剂。在蒸馏残渣中加入乙酸乙酯188ml后在50℃以上进行过滤,用乙酸乙酯50ml进行清洗。在滤洗液中加入乙酸乙酯(500ml)后,减压馏去约420g的溶剂。确认蒸馏残渣中的水分相对于式(1)的化合物1摩尔为2.0摩尔以下后调温到60℃,接种晶种后,保温2小时。用1小时以上向生成的浆液(slurry mass)滴加环己烷(235ml)后保温1小时,用约6小时冷却到0℃。过滤后,用冷却到0℃的环己烷(141ml)与乙酸乙酯(141ml)的混合溶液清洗,将得到的晶体减压干燥,得到纯化的式(1)的化合物。收量为92.3g,收率为84.2%(由d-丝氨酸得到的通算收率为80.7%)。hplc纯度为99.98%(oh体0.02%),光学纯度为99.9%ee。
[0076]
制造例2
[0077]
1)式(5)的化合物的制造
[0078]
将水(330ml)、25%氢氧化钠水溶液(183g,1.14摩尔)、d-丝氨酸(100g,0.95摩尔)的混合液升温到40℃,加入四氢呋喃(50ml)。在40℃下用3h以上向该溶液滴加二碳酸二叔丁酯(249g,1.14摩尔)与四氢呋喃(50ml)的混合液。在40℃保温,确认原料消失后,加入甲苯(200ml),在40℃进行分液清洗,由水层得到式(5)的化合物的钠盐溶液。式(5)的化合
物的收率为100%,hplc纯度为98.6%。
[0079]
2)式(4)的化合物的制造
[0080]
在式(5)的化合物的钠盐溶液(0.48摩尔)中加入四氢呋喃(160ml)后,冷却到0℃,一边保持温度一边滴加硫酸二甲酯(420g,3.33摩尔)。接着在0℃滴加50%氢氧化钠水溶液(285g,3.57摩尔)。在0℃保温,确认原料消失后,加入甲苯(1000ml),在0℃加入35%盐酸将ph调节为1~2。分液后,将得到的有机层在0℃用20%食盐水(100ml)清洗。从得到的有机层中减压馏去约700g的溶剂,得到式(4)的化合物的溶液。由式(5)的化合物而得到的式(4)的化合物的收率为99%,hplc纯度为96.4%,光学纯度为98.9%。
[0081]
比较例1
[0082]
1)式(5)的化合物的制造
[0083]
将水(125ml)、碳酸氢钠水溶液(24g,1.14摩尔)、d-丝氨酸(25g,0.24摩尔)的混合液升温到30℃。向该溶液滴加二碳酸二叔丁酯(60g,0.27摩尔)。在30℃保温,确认原料消失后,加入甲苯(50ml),在30℃进行分液清洗,由水层得到式(5)的化合物的钠盐溶液。式(5)的化合物的收率为100%,hplc纯度为99.4%。
[0084]
2)式(4)的化合物的制造
[0085]
在式(5)的化合物的钠盐溶液(0.14摩尔)中加入四氢呋喃(45ml)后,冷却到0℃,加入50%氢氧化钠水溶液(5.7g,0.07摩尔)。接着一边保持温度一边在0℃同时注入硫酸二甲酯(108g,0.86摩尔)和50%氢氧化钠水溶液(69g,0.86摩尔)。同时注入后,在0℃保温,确认原料消失后,加入甲苯(150ml),在0℃加入35%盐酸将ph调节为1~2。分液后,将得到的有机层在0℃用20%食盐水(30ml)进行清洗。由得到的有机层得到式(4)的化合物的溶液。由式(5)的化合物得到的式(4)的化合物的收率为99%,hplc纯度为96.6%,光学纯度为97.6%。
[0086]
3)式(3)的化合物的制造
[0087]
将式(4)的化合物的溶液(0.14摩尔)冷却到-10℃,一边保持温度一边依次滴加氯甲酸异丁酯(21.5g,0.16摩尔)、n-甲基吗啉(21.6g,0.21摩尔)。将混合物在-10℃保温,确认原料消失后,在-10℃滴加异丙醇(15ml)与苄胺(16.0g,0.15摩尔)的混合液。滴加结束后,用约2h升温到10℃并保温。确认中间体消失后,将混合物用水(60ml)、3.5%盐酸(30ml)、8%碳酸氢钠水溶液(30ml)进行清洗,以有机层的形式得到式(3)的化合物的甲苯溶液。由式(4)的化合物得到的式(3)的化合物的收率为87.8%。
[0088]
参考例1、2和制造例6、7、8
[0089]
在式(6)的oh体的含量分别如表1所示的式(1)的化合物的析晶前液(mass)(析晶母液)中设定为表1中记载的各水分含量,除此以外,以与制造例5相同的溶剂、溶剂比率进行析晶、过滤、清洗,将得到的晶体进行减压干燥而得到式(1)的化合物。将所得到的晶体中的式(6)的oh体的含量和由式(3)的化合物得到的式(1)的化合物的收率示于表1。
[0090]
[表1]
[0091][0092]
*oh体的含量是指由高效液相色谱图中的峰的面积值并基于下式而算出的值(式(6)的oh体的面积值/(式(6)的oh体的面积值+式(1)的化合物的面积值))
×
100)
[0093]
**水相对于式(1)的酰胺化合物1摩尔的摩尔比
[0094]
比较例2专利文献2中记载的方法
[0095]
1)式(4)的化合物的制造
[0096]
将甲苯(75ml)、式(5)的化合物(15g,0.07摩尔)和四丁基溴化铵(0.9g,0.003摩尔)的悬浮液冷却到10℃以下。向其中加入20%氢氧化钠水溶液(14.6g,0.07摩尔),将得到的混合物熟化30分钟。一边将温度保持在10℃以下一边加入硫酸二甲酯(36.9g,0.29摩尔)和50%氢氧化钠水溶液(26.5g,0.33摩尔),将反应混合物熟化1小时以上。在混合物中加入水(45ml)进行分液。将水层用50%柠檬酸水溶液调节至ph3.5以下,用二氯甲烷(2
×
62ml,1
×
45ml)进行萃取,将萃取液混合,进行脱水浓缩,得到式(4)的化合物。(浓缩后23.8g,表观收率100%,hplc纯度95.6%,光学纯度96.5%)
[0097]
2)式(3)的化合物的制造
[0098]
将式(4)的化合物溶液冷却到-10℃以下,在-5℃以下加入氯甲酸异丁酯(9.0ml,0.07摩尔),接着在-5℃以下加入n一甲基吗啉(7.6ml,0.07摩尔),将混合物在-5℃以下熟化30分钟以上。在-5℃以下加入溶解于二氯甲烷的苄胺(7.8ml,0.07摩尔),将混合物加温到室温。熟化1小时以上后,将混合物用水(29ml)、1n-盐酸水溶液(29ml)、8%碳酸氢钠水溶液(29ml)和水(29ml)清洗而得到式(3)的化合物溶液。由式(4)的化合物得到的式(3)的化合物的收率为90.7%。
[0099]
产业上的可利用性
[0100]
根据本发明的方法,能够高效地制造高品质的酰胺化合物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1