一种具有免疫增强作用的血红栓菌均一多糖及其应用
1.本发明属于医药领域,尤其涉及一种具有免疫增强作用的血红栓菌多糖结构及其活性和以该多糖为活性组分的组合物,以及它们在免疫佐剂中的应用。
背景技术:
2.人体免疫系统包括先天性免疫系统和获得性免疫系统,与机体其他系统相互协调,共同维持机体内环境稳定和生理平衡的功能。作为机体识别、杀伤、清除入侵异物和癌变细胞的第一道防线,巨噬细胞在抵抗微生物感染和癌症预防的防御系统中发挥着重要作用。多糖可以通过刺激巨噬细胞、增强巨噬细胞的吞噬能力、促进相关细胞因子的分泌、促进淋巴细胞的增值、激活补体等方式调节免疫应答。真菌多糖,作为真菌子实体中的重要活性成分,因其高效的免疫调节作用和毒副作用小的特点,已成为目前国内外众多领域的研究热点。
3.血红栓菌(trametes sanguinea),是一种药用真菌,属于多孔菌科栓菌属,分布于吉林、河北、山西、陕西等地;子实体侧生无柄,木栓质,菌盖扁半球形,单生至瓦状叠生,橙色至红色,有微细绒毛至无毛,稍有皱纹;以干燥子实体入药,味微辛、涩,性温,具有祛风除湿,清热解毒,行气,止血,止痒等功效。其扶正驱邪的药用功效与现代药理的免疫调节作用不谋而合。但目前对其研究主要集中于漆酶类物质,对其中富含的多糖成分研究甚少,现代药理学研究表明,多糖是真菌中的重要活性成分,其具有安全、无毒、生物活性学活性的优良特性,对血红栓菌多糖的结构和活性研究可推动该类物质在免疫佐剂中的应用,为栓菌属中药资源的开发利用提供科学依据。
技术实现要素:
4.本发明的目的在于针对现有技术的不足,提供一种具有免疫增强作用的血红栓菌均一多糖及其应用。本发明中的血红栓菌均一多糖具有显著的免疫增强作用,且对骨髓源性巨噬细胞无细胞毒作用;其高效、低毒的成药性优势显示了其作为免疫佐剂药物的独特优势。
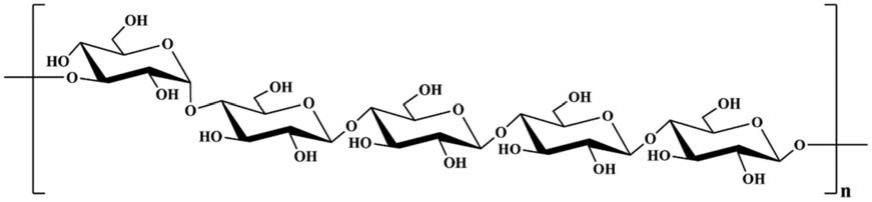
5.本发明的目的是通过以下技术方案来实现的:一种血红栓菌均一多糖,结构如下:
6.所述血红栓菌均一多糖为包含
→
3)-α-glcp-(1
→
和
→
4)-β-glcp-(1
→
两种连接片段以1:4比例构成的线性葡聚糖。
7.一种上述血红栓菌均一多糖的应用为,血红栓菌均一多糖具有免疫增强活性。
8.一种上述血红栓菌均一多糖的应用为,血红栓菌均一多糖具有特异的激活tlr4受体的作用。
9.一种上述血红栓菌均一多糖的应用为,治疗有效量的血红栓菌均一多糖与药学上可接受的载体结合,单独或者和其他物质组合用于制备免疫佐剂类药物。
10.进一步地,所述药物为汤剂、丸剂、散剂、膏剂、冲剂、口服液剂、胶囊剂或片剂等。
11.本发明的有益效果是:本发明血红栓菌均一多糖ts2-2a为结构中同时含有α和β两种构型的新颖葡聚糖,且可特异性激活细胞表面的i型跨膜糖蛋白trl4受体,促进no和细胞因子在巨噬细胞中的释放,从而发挥免疫增强活性,具有此类结构的tlr4特异性激动剂暂未见报道。所述均一多糖,在生物医药领域具有多种潜在的应用前景,可望作为新型糖类免疫佐剂,用于多种疾病的预防及治疗。
12.与现有的药物相比,本发明所述血红栓菌均一多糖作为免疫佐剂应用的优势在于,多糖制备简单,结构新颖,无细胞毒活性,有显著的免疫增强作用。血红栓菌多糖制备过程所使用溶剂价廉易得且无毒;制备所得血红栓菌均一多糖结构新颖,无细胞毒活性,具有显著的免疫增强作用,是理想的开发免疫佐剂药物的先导化合物,具有良好的应用前景。
附图说明
13.为更清楚的说明本发明例,下面将对实施例中所需要的附图做简要地介绍:
14.图1为所述血红栓菌均一多糖结构的结构式;
15.图2为血红栓菌均一多糖的分子量及单糖组成分析结果示意图;其中,(a)为所述血红栓菌均一多糖的高效凝胶渗透色谱图;(b)为所述血红栓菌均一多糖的柱前衍生高效液相色谱图,(a)为单糖标准品的柱前衍生高效液相色谱图,(b)为所述血红栓菌均一多糖ts2-2a的高效凝胶渗透色谱图;
16.图3为所述血红栓菌均一多糖的红外光谱图;
17.图4为血红栓菌均一多糖的各核磁图谱示意图;其中,(a)为所述血红栓菌均一多糖的1hnmr谱;(b)为所述血红栓菌均一多糖的
13
c nmr及部分dept谱;(c)为所述血红栓菌均一多糖的1h-1h cosy谱;(d)为所述血红栓菌均一多糖的1h-13c hsqc谱;(e)为所述血红栓菌均一多糖的1h-13c hmbc谱;
18.图5为血红栓菌均一多糖的结构分析示意图;其中,(a)为所述血红栓菌均一多糖的一级质谱图;(b)为所述血红栓菌均一多糖降解所得2糖片段的二级质谱图;(c)为所述血红栓菌均一多糖降解所得3糖片段的二级质谱图;(d)为所述血红栓菌均一多糖降解所得4糖片段的二级质谱图;(e)为所述血红栓菌均一多糖降解所得5糖片段的二级质谱图;(f)为所述血红栓菌均一多糖降解所得6糖片段的二级质谱图;
19.图6为血红栓菌均一多糖的高级结构解析示意图;其中,(a)为所述血红栓菌均一多糖的电子力学显微镜的平面图;(b)为所述血红栓菌均一多糖的电子力学显微镜的立体图;
20.图7为血红栓菌均一多糖的免疫增强活性研究结果示意图;其中,(a)为所述血红栓菌均一多糖对raw264.7细胞活力的影响;(b)为所述血红栓菌均一多糖对raw264.7细胞分泌tnf-α的影响;(c)为所述血红栓菌均一多糖对raw264.7细胞分泌no的影响;(d)为所述血红栓菌均一多糖对raw264.7细胞tnf-αmrna表达的影响;(e)为所述血红栓菌均一多糖对
30000的葡聚糖g-50凝胶。
31.本发明的多糖和药物组合物可用于制备免疫佐剂。以小鼠巨噬细胞raw264.7细胞为实验模型,对血红栓菌均一多糖的免疫活性进行评价,结果显示,血红栓菌均一多糖对小鼠巨噬细胞raw264.7细胞无细胞毒作用,且可促进细胞因子no、tnf-α和il-6的分泌;定量rt-pcr检测结果显示,血红栓菌均一多糖可在mrna水平激活raw264.7细胞。通过测定tlr4拮抗剂处理前后的血红栓菌均一多糖诱导的细胞因子tnf-α的m-rna分泌水平发现,经tlr4拮抗剂处理后,血红栓菌均一多糖诱导的细胞因子tnf-α的m-rna与未经tlr4拮抗剂处理的相比其分泌水平明显降低;且与正常小鼠相比,c57bl/10scnj(tlr4-/-)免疫缺陷小鼠中,ts2-2a或lps诱导的细胞因子tnf-α、il-6、ifn-β和ip-10的mrna表达显著降低。以上结果都说明血红栓菌均一多糖是通过特异性激活tlr4发挥其免疫增强活性的;其作为特异性tlr4激动剂在糖类免疫佐剂的开发中具有显著优势。上述细胞株及实验动物均采用市售产品。
32.上述制备的血红栓菌均一多糖,其作为特异性tlr4激动剂发挥高效低毒的免疫增强作用,可与一种或多种药学上可接受的载体结合,用于单独或者和其他物质组合用于制备免疫佐剂类药物。
33.上述药学上可接受的载体是指药学领域的药物载体。如:稀释剂、赋形剂如水、生理盐水、葡萄糖、甘露醇、甘油、乙醇机器混合物等;填充剂如淀粉、蔗糖等;粘合剂如纤维素衍生物、海藻酸盐、明胶和聚乙烯吡咯烷酮;润湿剂如甘油;崩解剂如碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如吐温-80;润滑剂如滑石、硬脂酸钙、硬脂酸镁和聚乙二醇等。另外还可以在组合物中加入其他辅料如香味剂、甜味剂等。所述药物可以为:汤剂、丸剂、散剂、膏剂、冲剂、口服液剂、胶囊剂、片剂、注射剂等形式。
34.当本发明血红栓菌均一多糖被用做药物时,可将治疗有效剂量的血红栓菌多糖施用于哺乳动物,其中该治疗有效剂量通常至少200μg/kg体重,较佳的给药剂量约为200μg/kg体重~20mg/kg体重。具体剂量还应考虑给药方式、病人健康状况等因素。
35.实施例1血红栓菌均一多糖制备
36.(1)制备血红栓菌热水提多糖tsl2
37.取血红栓菌子实体2kg,加约5~6倍量95%乙醇回流脱脂3次,1h/次,沸腾后,保持微沸状态,避免过高温度。将脱脂后血红栓菌晾干后粉碎,取粉末150g,加纯净水3000ml,磁力搅拌4h,离心所得沉淀加入纯净水3000ml,于100℃水浴磁力搅拌1h,冷却后抽滤,重复提取2次,合并滤液,浓缩至原体积1/10后,搅拌并缓缓加入至5倍体积95%乙醇中,4℃冰箱中静置过夜。6000r/min离心10min得沉淀部分,分别加入2倍于沉淀体积的无水乙醇、乙醚和丙酮充分搅拌洗涤沉淀并离心,所得沉淀于50℃烘箱中烘干。烘干后样品置于截留分子量为3000的透析袋中流水透析至体积不在变化,6000r/min离心10min,取上清液浓缩后冷冻干燥,得热水提多糖tsl2,得率为8.05%。
38.(2)制备血红栓菌均一多糖ts2-2a
39.利用deae-sepharose fast flow阴离子交换柱对热水提多糖tsl2进行初步分离,分别以0、0.05、0.1、0.2mol/l的nacl溶液进行梯度洗脱,收集洗脱浓度为0.1mol/l的nacl溶液,洗脱液经透析除盐、浓缩后冷冻干燥即得初步分离的多糖ts2-2a。初步分离多糖ts2-2a再经sephadex g-50凝胶色谱柱进一步纯化,以0.5mol/l的nh4hco3溶液为流动相,流速为0.3ml/min,部分自动收集器收集。以硫酸苯酚法检测,收集相应峰尖部分,反复加水减压干
燥去除nh4hco3,冷冻干燥即得血红栓菌均一多糖ts2-2a。
40.实施例2血红栓菌均一多糖的分子量及单糖组成分析
41.(1)血红栓菌均一多糖纯度及分子量测定
42.准确配制5mg/ml的血红栓菌均一多糖ts2-2a溶液,以不同分子量的葡聚糖(mw:2700da,5250da,9750da,13050da,36800da,64650da)为标准品,采用高效凝胶渗透色谱(hpgpc)法检测其纯度及分子量。结果如图2(a)所示。
43.由图2(a)可知,血红栓菌均一多糖ts2-2a在hpgpc色谱图上显示为单一对成分,表明其纯度较高;将样品的保留时间(tr)带入标准回归方程y=-0.3068x+8.8066中,即可求得其分子量,经计算血红栓菌均一多糖ts2-2a的分子量为15kda。
44.(2)血红栓菌均一多糖单糖组成测定
45.准确称取血红栓菌均一多糖tsl2-2a 2mg,以等摩尔配制的十糖标准品(甘露糖、鼠李糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖)为标准品,pmp-hplc法测定各多糖单糖组成,测定结果见图2(b)。
46.由图2(b)中ts2-2a的高效凝胶渗透色谱图(a)与单糖标准品的柱前衍生高效液相色谱图(b)的比对可知,血红栓菌均一多糖ts2-2a只含有一种单糖,为葡聚糖。
47.实施例3血红栓菌均一多糖的结构研究
48.(1)血红栓菌均一多糖糖苷键连接方式测定
49.利用改良的hakomori法对血红栓菌均一多糖ts2-2a进行甲基化分析,根据美国佐治亚大学糖复合物研究中心(ccrc)的糖质谱库(ccsd)对气相-质谱峰进行分析,确定各多糖结构中糖苷键连接方式。结果如表1所示。
50.表1:血红栓菌多糖的甲基化数据分析
51.甲基化糖基质谱片段摩尔比连接方式2,4,6-me
3-glc101,117,129,1611.0
→
3)-glcp-(1
→
2,3,6-me
3-glc87,101,1174.0
→
4)-glcp-(1
→
52.由表1可知,均一多糖ts2-2a连接方式较为简单,共含有2种连接方式,包括
→
3)-glcp-(1
→
和
→
4)-glcp-(1
→
,其摩尔比为1.0:4.0,其中以
→
4)-glcp-(1
→
为主,说明血红栓菌均一多糖ts2-2a为直连葡聚糖。
53.(2)血红栓菌均一多糖一级结构鉴定
54.以纯kbr压片为空白,适量样品与kbr粉末混合压片测定样品的红外图谱。图3为所述血红栓菌均一多糖的红外光谱图。由图3可知,血红栓菌均一多糖ts2-2a的红外光谱中含有多糖的特征吸收峰,在3422.2cm-1
处的强吸收峰为o-h伸缩振动峰;2919.6cm-1
处为c-h伸缩振动峰;1642.1cm-1
为典o-h弯曲振动峰;1402.9cm-1
处为c-h变角振动峰;1200-1000cm-1
为c-o-c伸缩振动峰。
55.取50mg血红栓菌均一多糖样品,用d2o溶解后冻干,反复交换2次,冻干后样品溶于0.5ml d2o中并转移至核磁管中,利用bruker ultra shield plus 600mhz核磁共振波谱仪测定样品的1h nmr、
13
c nmr、1h-1
h cosy、1h-13
c hsqc、和1h-13
c hmbc图谱。图4(a)为所述血红栓菌均一多糖的1h nmr谱;图4(b)为所述血红栓菌均一多糖的
13
c nmr及部分dept谱;图4(c)为所述血红栓菌均一多糖的1h-1
h cosy谱;图4(d)为所述血红栓菌均一多糖的1h-13
c hsqc谱;图4(e)为所述血红栓菌均一多糖的1h-13
c hmbc谱。综合分析血红栓菌均一多糖的
各核磁图谱(图4),可获得其糖苷键构型及各连接片段连接顺序等信息。由血红栓菌均一多糖ts2-2a的1h nmr谱可知,其异头质子区共有2个端基氢信号,依次标记为a和b,其中a片段的氢信号位于δh5.19ppm,说明其代表的连接方式为α构型,化学位移值为δh4.47ppm的b片段其代表的连接方式为β构型,且二者比例约为1:4,与甲基化结果一致,可初步推断片段a代表
→
3)-α-glcp-(1
→
,片段b代表
→
4)-β-glcp-(1
→
。在
13
c nmr和dept谱中,其异头区有δc101.08和δc102.45ppm两个异头碳信号,与1h nmr谱异头氢信号相对应。二维图谱可给出多糖结构的进一步信息,1h-1
h cosy图谱可给出相邻碳上氢的相关信号,通过顺序归属可以得到同一糖环上氢的完整信号,1h-13
c hsqc谱可给出同碳上碳氢相关信号,结合1h-1
h cosy图谱可以归属处同一糖环上的碳氢信号。在1h-13
c hsqc谱(图4c)中,δc101.08ppm和δc102.45ppm处的异头碳信号分别与δh5.19ppm和4.47ppm的异头氢信号相关;δc78.51ppm信号归属为(1
→
4)-β-glcp的c-4信号,δc74.09ppm信号归属为(1
→
3)-α-glcp的c-3信号,与未被取代的c-4及c-3相比,其化学位移值明显向低场位移。
56.将10mg的ts2-2a溶解于2ml 0.1mol/l的三氟乙酸(tfa)溶液中,100℃下反应9h,反应终止后旋蒸除去tfa,进行一级质谱分析,选取一级质谱中聚合度分别为2、3、4、5和6的片段进行二级质谱分析。图5(a)为所述血红栓菌均一多糖的一级质谱图;图5(b)为所述血红栓菌均一多糖降解所得2糖片段的二级质谱图;图5(c)为所述血红栓菌均一多糖降解所得3糖片段的二级质谱图;图5(d)为所述血红栓菌均一多糖降解所得4糖片段的二级质谱图;图5(e)为所述血红栓菌均一多糖降解所得5糖片段的二级质谱图;图5(f)为所述血红栓菌均一多糖降解所得6糖片段的二级质谱图。根据各图谱数据表征,可初步推断血红栓菌均一多糖的一级结构为由
→
3)-α-glcp-(1
→
和
→
4)-β-glcp-(1
→
以1:4的比例连接构成线性葡聚糖。
57.为进一步验证血红栓菌均一多糖ts2-2a的结构,对其进行酸水解并利用质谱对其寡糖结构进行解析。经条件摸索,确定血红栓菌均一多糖ts2-2a的降解条件为0.1m tfa,100℃水解9h。由图5(a)可知,血红栓菌均一多糖ts2-2a降解产物的一级质谱中主要存在单电荷离子峰m/z 377、539、701、863、1025和1187,可推断其应为2糖、3糖、4糖、5糖、6糖和7糖,并对其中的2-6糖片段进行ms/ms分析。由图5(b)-5(d)可知,其含有特征的糖苷键断裂离子片段b1(m/z 161)和c1(m/z 179),
2,5
a1(m/z 101)、
0,2
a1(m/z 119)、
2,4
a2(m/z 221)和
2,5
a2(m/z 263)等环内断裂离子片段的出现证明了(1
→
4)糖苷键的存在。由五糖和六糖的ms/ms图谱可知,其二级质谱图中缺少环间的跨环裂解离子,说明其结构中有(1
→
3)糖苷键的存在。
58.所述血红栓菌均一多糖通过核磁共振图谱,红外光谱及质谱表征,推测其一级结构片段如图1所示。核磁共振数据见表2。
59.表2:血红栓菌均一多糖ts2-2a的核磁数据
60.ꢀꢀ
h1/c1h2/c2h3/c3h4/c4h5/c5h6a,6b/c6ah5.193.903.683.453.303.65,3.83
→
3)-α-glcp-(1
→
c101.0870.1274.0968.1774.8760.81bh4.473.293.333.593.423.73,3.89
→
4)-β-glcp-(1
→
c102.4572.9769.6878.5175.5860.02
61.(3)血红栓菌均一多糖的高级结构解析
62.将血红栓菌均一多糖样品溶解于超纯水中,配成浓度约为5μg/ml溶液,用胶头滴管吸取少量样本溶液于云母片上,经干燥处理后,置于原子力学显微镜下对样本进行扫描,结果见图6(a)和6(b)。
63.图6(a)为所述血红栓菌均一多糖的电子力学显微镜的平面图;图6(b)为所述血红栓菌均一多糖的电子力学显微镜的立体图。
64.血红栓菌均一多糖ts2-2a的afm图谱可直观显示其分子形态。如图6(a)和(b)所示,ts2-2a多糖链呈现大小均匀、规则的火焰状聚集体,其高度约为8.51nm,远高于单一多糖链高度,表明ts2-2a不是以单链分子存在,而是多条糖链聚集形成分子聚集体。多糖链中存在的大量羟基,分子间或分子内存在氢键相互作用,导致糖链相互缠绕,形成非线性椭圆形或圆柱形结构。
65.实施例3血红栓菌均一多糖的免疫增强活性研究
66.(1)血红栓菌均一多糖对raw264.7细胞的毒性试验
67.c57bl/10scnj(tlr4缺失型,tlr4-/-)和对照c57bl/10(野生型,tlr4
+
/
+
)小鼠(16~20g,6~8周龄)购自江苏gempharmatech有限公司,饲养在标准实验室光照条件下(12h光照/12h暗周期,25
±
2℃,湿度55
±
5%)。所有的老鼠都可以免费获得食物和水。所有程序均严格遵守中华人民共和国关于实验动物使用和护理的立法,并符合浙江中医药大学实验动物关爱与福利伦理委员会制定的指导方针。raw264.7细胞系为小鼠巨噬细胞系,来源于中国科学院上海细胞库。细胞在37℃添加10%胎牛血清(100u/ml青霉素和100μg/ml链霉素)的湿式培养箱中培养。
68.采用mtt法检测血红栓菌均一多糖对raw264.7细胞的存活率。取对数生长期的raw264.7细胞,以1
×
106个/ml接种与96孔板中,每空100μl。37℃,5%co2的恒温培养箱中培养24h,弃去上清液,加入不同浓度(0、0.0001、0.001、0.01、0.1、1、5、50、100μg/ml)的血红栓菌均一多糖溶液的培养基,继续培养24h。弃去含药培养基后,加mtt,37℃继续孵育4h后,终止培养,用移液枪轻轻吸掉上清液,加入dmso(150μl/孔),振摇均匀后,用酶标仪在570nm处测定每个孔的光密度od值,各平行孔的od值取平均数,计算细胞活力,将各测试孔的od值减去本底od值,计算药物对肿瘤细胞的抑制率。
69.细胞活力=给药孔平均光密度值/对照组平均光密度值
×
100%
70.抑制率=(1-给药孔平均光密度值/对照组平均光密度值)
×
100%
71.根据细胞活力绘制化合物对raw264.7细胞的生长抑制曲线,结果如图7(a)所示。图7(a)的生长抑制曲线表明,在多糖浓度为0-100μg/ml浓度范围内,raw264.7细胞存活率均超过90%,说明血红栓菌均一多糖对raw264.7细胞无细胞毒活性,说明其高效低毒的免疫增强作用在其作为活性先导化合物的抗肿瘤药物开发中具有显著优势。
72.(2)血红栓菌均一多糖对raw264.7细胞因子的影响
73.取对数生长期的raw264.7细胞,以8
×
104个/ml接种于96孔板中,每孔100μl。用dmem新鲜培养基在37℃,5%co2的恒温培养箱中培养24h后,弃去上清液。然后每孔加入100μl不同浓度的血红栓菌均一多糖(0、0.1、1、5、50、100μg/ml)、lps(1μg/ml)或ts2-2a(50μg/ml)的培养液,将细胞放入培养箱继续培养12h,用试剂盒测定上清液中tnf-α和no的表达量,具体步骤参照试剂盒说明书。结果如图7(b)和7(c)所示。
74.由图7(b)和7(c)可知,以脂多糖(lps)为阳性对照,在0-100μg/ml范围内,ts2-2a
以浓度依赖的方式促进raw264.7细胞分泌tnf-α,且浓度达到100μg/ml时,其促进raw264.7细胞分泌tnf-α的水平稍低于1μg/ml lps;在中等浓度50μg/ml时,血红栓菌均一多糖同样能促进raw264.7细胞分泌no。
75.(3)血红栓菌均一多糖对raw264.7细胞tnf-α和inos mrna表达的影响
76.将raw264.7细胞和骨髓巨噬细胞以10
×
10~5细胞/孔培养成12孔板,分别加入不同浓度的ts2-2a(1、5、50μg/ml)、脂多糖(1μg/ml)或培养液。培养板在37℃下孵育6h,用trizol试剂提取raw264.7细胞的总rna。用superscript ii逆转录酶和寡核苷酸引物将rna样品反转录成cdna。用itaq universal实时荧光pcr系统扩增cdna,测定mrna的含量。结果如图7(d)和7(e)所示。本实施例中使用的引物序列如表3所示。
77.表3:rt-pcr的寡核苷酸引物序列
[0078][0079][0080]
由图7(d)和7(e)可知,血红栓菌均一多糖作用6h后,raw264.7细胞诱导一氧化氮合酶和肿瘤坏死因子-α的表达水平呈浓度依赖性上调,说明其是在mrna水平激活raw264.7细胞,发挥其免疫增强作用。
[0081]
实施例4血红栓菌均一多糖发挥免疫增强活性的机制研究
[0082]
取雄性c57bl/10scnj(tlr4-/-)或c57bl/10(tlr4
+
/
+
)小鼠(6~8周龄)的胫骨和股骨,剪断骨端。取供体股骨和胫骨,用装有磷化铅的无菌1ml注射器冲洗骨髓,通过无菌70μm滤网获得单细胞悬液。单细胞悬液以1000rpm离心10min。离心后,去掉上清液,加入红细胞裂解液。用等体积的pbs停止裂解,然后在1000rpm下离心5min。然后去除上清液,加入pbs洗涤,然后再次离心。然后将细胞悬浮并接种于6孔板(106个细胞/孔)中,在37℃的dmem中过夜。次日在细胞上清液中加入m-csf(20ng/ml)继续培养。每隔3天倒入一半的旧培养基,加入等量的新鲜培养基。第6天即可制备骨髓源性巨噬细胞进行实验。
[0083]
(1)tlr4阻断剂对血红栓菌免疫增强活性的影响
[0084]
按照实施例3中(2)的步骤进行实验。取对数生长期的raw264.7细胞,以8
×
104个/ml接种于96孔板中,每孔100μl。用dmem新鲜培养基在37℃,5%co2的恒温培养箱中培养24h后,弃去上清液。然后每孔加入100μl不同浓度的血红栓菌均一多糖(0、5、50μg/ml)、lps(1μg/ml)和tak-242的培养液,将细胞放入培养箱继续培养12h,用试剂盒测定上清液中tnf-α的表达量,以未加tka-242的为对照组,具体步骤参照试剂盒说明书。结果如图8(a)所示。由图8(a)可知,当ts2-2a(5、50μg/ml)或脂多糖(1μg/ml)与细胞孵育时,tnf-α的分泌呈浓度依赖性增加(p《0.001)。ts2-2a和tak242联合作用明显抑制raw264.7细胞tnf-α的分泌(p《0.001)。lps和tak-242联合作用也可得到相同的结果。
[0085]
按照实施例3中(3)的步骤进行试验,以c57bl/10scnj(tlr4-/-)小鼠骨髓源巨噬细胞组为对照组,测定mrna的含量。结果如图8的(b)、(c)、(d)和(e)所示。由图8的(b)、(c)、(d)和(e)可知,在c57bl/10(tlr4
+
/
+
)小鼠骨髓来源的巨噬细胞中,50μg/mlts2-2a和1μg/mllps能显著增加细胞因子tnf-α、il-6、ifn-β和ip-10mrna的表达(p《0.01)。而ts2-2a或lps诱导的c57bl/10scnj(tlr4-/-)小鼠上述细胞因子的mrna表达明显降低(p《0.01)。以上结果说明血红栓菌均一多糖ts2-2a是通过特异性激活raw264.7细胞tlr4进而诱导tnf-α的分泌增加。
[0086]
综上所述,本发明的血红栓菌均一多糖,制备简单,具有高效免疫增强作用,且无细胞毒作用,是理想的免疫佐剂开发的先导化合物,具有良好的应用前景。
[0087]
本发明中所描述的具体实施例,仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
[0088]
尽管本发明较多地使用了术语,但并不排除使用其它术语的可能性。使用这些术语仅仅是为了更方便地描述和解释本发明的本质;把它们解释成任何一种附加的限制都是与本发明精神相违背的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1