MAC3A和MAC3B在植物器官大小调控中的应用
mac3a和mac3b在植物器官大小调控中的应用
技术领域
1.本技术属于植物基因工程技术领域,具体涉及两个拟南芥基因mac3a和mac3b在植物器官大小调控中的应用。
背景技术:
2.植物器官大小是植物的重要性状之一,也是农作物的关键农艺性状。器官大小与植物的生物量和作物产量密切相关。生长发育研究认为,植物器官的大小受外界环境因子和内部信号分子复杂而又精密协同的调控,其中内部信号分子的调控占主导地位。在育种过程中,育种者往往根据器官大小来选择优良性状,进而提高作物产量。因此,挖掘更多参与植物器官大小调控的基因具有重要理论意义和育种应用价值。
3.已有研究表明,mac3a(mos4
‑
associated complex 3a,又名at1g04510)和mac3b(mos4
‑
associated complex 3b,又名at2g33340)属于包含u
‑
box结构域的e3泛素连接酶家族成员,是mos4(modifier of snc1(snc1:suppressor of npr1
‑
1 constitutive 1(npr:nonexpresser of pr(pathogenesis
‑
related)genes,病程相关基因非表达子)))相关复合体的两个核心亚基。
4.根据拟南芥体内u
‑
box蛋白的结构特点,将其分为9类,其中mac3a和mac3b属于第vi类pub,含有调控蛋白
‑
蛋白相互作用的c
‑
末端wd40重复序列。同时,mac3a和mac3b均属于核蛋白,并且具有e3连接酶活性,在植物免疫和发育中起着重要的作用,与mirna的生物合成直接相关。鉴于此基因具有多效性效应,因此对于mac3a / 3b蛋白在植物生长发育过程中的具体作用的进一步研究和探讨,对于这两个基因功能的进一步解析和明确以及对于作物新品种培育都具有积极的科研应用价值。
技术实现要素:
5.针对拟南芥中两个u
‑
box家族蛋白(mac3a、mac3b)基因,在其现有研究基础上,通过对其生物发育功能的进一步研究,本技术目的在于提供这两个基因在在植物器官大小调控方面的新应用,从而为植物生长发育调控、植物新品种培育等奠定一定技术基础。
6.本技术所采取的技术方案详述如下。
7.mac3a和mac3b基因在调控植物器官大小方面的应用,这两个基因与植物器官大小相关,其中mac3a和mac3b可以形成异源二聚体,mac3b自身也可形成同源二聚体,但mac3a自身不能形成同源二聚体;具体表型影响方面而言:将这两个基因(mac3a和mac3b基因)超表达后,与野生型相比,超表达株系(或者说基因超表达新品种)表现出器官变大的表型;所述器官,具体指子叶、花瓣、种子;具体表型表现为:与野生型相比,mac3a和mac3b超表达植株的子叶均变大;mac3a超表达植株的花瓣器官、种子器官也变大。
8.所述mac3a和mac3b基因的制备方法,采用pcr扩增方法制备获得,pcr扩增时,以拟南芥cdna为模板,pcr扩增mac3a时,引物序列设计如下:at1g04510
‑
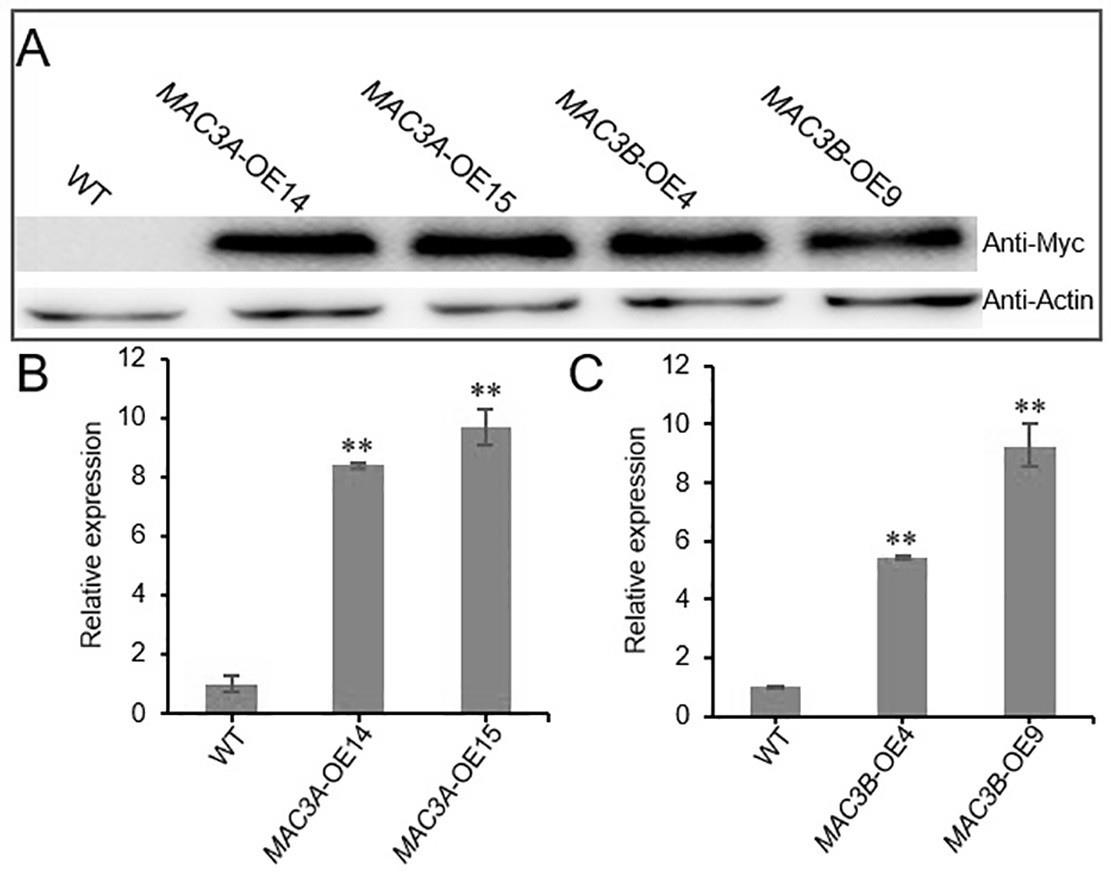
f:5
’‑ꢀ
ggggacaagtttgtacaaaaaagcaggctgcatgaattgtgcaatttccggcg
ꢀ‑3’
,at1g04510
‑
r:5
’‑ꢀ
ggggaccactttgtacaagaaagctgggtgactgaagattcagcacaagattca
‑3’
,pcr扩增mac3b时,引物序列设计如下:at2g33340
‑
f:5
’‑ꢀ
ggggacaagtttgtacaaaaaagcaggctgcatgaactgtgcaatttcaggag
ꢀ‑3’
,at2g33340
‑
r:5
’‑ꢀ
ggggaccactttgtacaagaaagctgggtgcgagtcttgcgcagagtcatc
‑3’
。
9.利用所述mac3a和mac3b基因培育植物新品种方法,利用基因工程技术,在将mac3a和/或mac3b基因进行超表达后,用于培育器官增大的植物新品种;所述器官,为子叶和/或花瓣和/或种子;所述植物,具体例如为拟南芥。
10.具体超表达时,利用含有35s启动子的超表达载体myc(pcmv
‑
myc)进行基因超表达。
11.植株器官大小的发育调控是发育生物学的一个重要研究领域,研究和探讨参与植物器官大小调控的相关基因,可以加深对植物器官大小分子调节机制的理解,对于作物品种培育具有重要的科研价值。
12.基于拟南芥基因组研究,已发现了部分与植物发育直接相关的基因,并对其调控网络以及调控通路有了初步的认识。mac3a和mac3b基因即是最新发现的与植物发育相关的基因,但对于这两个基因对于植物发育的深入影响仍然不够清楚和明确。本技术中,通过对mac3a和mac3b基因的进一步研究,证明了这两个基因参与了植物器官大小的调控,尤其是在将两个基因进行超表达后,超表达株系材料表现出了典型的器官变大的表型。基于此结果,可为植物器官生长调控、农作物育种或者其它经济作物品种选育奠定一定技术基础。
附图说明
13.图1为mac3a和mac3b超表达植株的鉴定;其中:(a)wt、mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9植株中mac3a/3b蛋白表达水平;(b)wt、mac3a
‑
oe14和mac3a
‑
oe15植株中的mac3a定量pcr分析;(c)wt、mac3b
‑
oe4和mac3b
‑
oe9植株中mac3b的定量pcr分析;**p<0.01(t检验);图2为mac3a和mac3b超表达转基因植株的表型分析;其中:(a)萌发7天的wt(col
‑
0)、mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9的子叶大小;比例尺= 1 cm;(b)wt(col
‑
0)、mac3a
‑
oe14和mac3a
‑
oe15的花瓣大小;比例尺=1cm;(c)wt(col
‑
0)、mac3b
‑
oe4和mac3b
‑
oe9的花瓣大小;比例尺=1cm;(d)wt(col
‑
0)、mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9的种子大小;比
例尺= 200 μm;(e)萌发7天的wt(col
‑
0)、mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9的子叶面积比较(n = 50);(f)生长20天的wt、mac3a
‑
oe14和mac3b
‑
oe4幼苗的第一对真叶的表皮毛分支数目的分布比较(n = 20);(g)wt(col
‑
0)、mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9的种子面积比较(n = 320);(h)wt(col
‑
0)、mac3a
‑
oe14和mac3a
‑
oe15的花瓣长度(pl)、花瓣宽度(pw)和花瓣面积的统计比较(pa)(n = 27);(i)wt(col
‑
0)、mac3b
‑
oe4和mac3b
‑
oe9的花瓣长度(pl)、花瓣宽度(pw)和花瓣面积(pa)的统计比较(n = 31);数值为平均值
±
标准差。**p<0.01(t检验);图3为采用激光共聚焦显微镜通过观察荧光情况来显示的mac3a / b在亚细胞定位结果;其中mcherry组荧光信号表示细胞核;图中比例尺= 10 μm;图4为mac3a / b的互作验证;其中:(a)双分子荧光互补分析;用激光扫描共聚焦显微镜观察yfp荧光;比例尺= 10 μm;(b)免疫共沉淀分析;用gfp
‑
trap
‑
a琼脂糖珠孵育总蛋白提取物,分别用gfp和ha抗体进行免疫印迹检测。
具体实施方式
14.下面结合实施例对本技术技术方案做进一步解释说明。在介绍具体实施例前,为便于本领域技术人员详细了解本技术的相关研发情况,就下述实施例中所涉及的部分实验材料情况简介如下。
15.生物材料:含有35s启动子的超表达载体myc(pcmv
‑
myc)、pgwb417、pgwb405,bifc重组载体pspy
‑
neyfp、pspy
‑
ceyfp,co
‑
ip载体等,均为转基因现有技术中常见质粒,可由公开渠道获得;农杆菌gv3101感受态细胞,购自上海唯地生物技术有限公司。
16.实施例1本实施例中,主要是通过对mac3a和mac3b基因的超表达对植物表型影响情况来分析这两个基因对植物生长表型的影响情况,具体的mac3a和mac3b基因的超表达株系构建情况简介如下。
17.(一)构建35s启动子驱动的超表达载体35s::mac3a/mac3b
‑
myc(即:35s::mac3a
‑
myc和35s::mac3b
‑
myc)具体构建过程参考如下。
18.首先,采用trizol法(trizol试剂,thermo公司产品)提取获得了拟南芥rna,并反转录合成cdna(参考现有技术常规操作即可,不再赘述)。
19.随后,参考拟南芥cdna数据库以及载体序列(含有35s启动子的超表达载体myc(pcmv
‑
myc))设计相应的pcr扩增引物,并利用gateway载体构建技术进行载体构建。具体而
言:第一步,进行bp反应:首先设计含有attb1和attb2位点序列的目的基因扩增引物,随后,使用高保真聚合酶进行pcr扩增,在利用凝胶电泳检测pcr产物后,纯化、回收目的条带;pcr扩增时,具体引物序列设计如下:at1g04510
‑
f:5
’‑ꢀ
ggggacaagtttgtacaaaaaagcaggctgcatgaattgtgcaatttccggcg
ꢀ‑3’
,at1g04510
‑
r:5
’‑ꢀ
ggggaccactttgtacaagaaagctgggtgactgaagattcagcacaagattca
‑3’
,at2g33340
‑
f:5
’‑ꢀ
ggggacaagtttgtacaaaaaagcaggctgcatgaactgtgcaatttcaggag
ꢀ‑3’
,at2g33340
‑
r:5
’‑ꢀ
ggggaccactttgtacaagaaagctgggtgcgagtcttgcgcagagtcatc
‑3’
。
20.具体bp反应体系参考如下:pcr产物,目的基因的长度(bp)
×ꢀ
0.0165 ng;pdonr
‑
vector,75 ng;5
ꢀ×ꢀ
bp
‑
clonase
ꢀⅱ
,1 μl;ddh2o,加至4 μl;溶液混匀后于25
°
c恒温水浴锅中反应1 h,随后向体系中加入0.5 μl proteinase k混合均匀,37
°
c反应10 min,随后冰上放置5 min,进行大肠杆菌感受态转化。
21.第二步,进行lr反应:提取第一步转化后含有目的基因片段的bp融合载体pentr
‑
mac3a(以及pentr
‑
mac3b)进行后续实验,并选取表达载体pgwb417进行lr反应;反应体系具体参考设计如下:pentr
‑
mac3a(或pentr
‑
mac3b),25 ng;pgwb417,50 ng;5
ꢀ×ꢀ
lr
‑
clonase
ꢀⅱ
,1 μlddh2o,加至4 μl;溶液混匀后于25
°
c恒温水浴锅中反应1 h,随后向体系中加入0.5 μl proteinase k混合均匀,37
°
c反应10 min,随后冰上放置5 min,进行大肠杆菌dh5α感受态转化。
22.随后,将转化后菌液涂布在含有100 ng/μl壮观霉素的lb抗性板上,在37℃培养箱中过夜培养以进行抗性筛选。筛选后,随机挑取圆滑扁平的乳白色阳性菌斑,标记后进行菌斑pcr鉴定,具体15
µ
l鉴定体系设计如下:对于pgwb417
‑
mac3a的菌斑鉴定体系如下:2
ꢀ×ꢀ
taq mix,7.5 μl;at1g04510
‑
f,0.5 μl;at1g04510
‑
r,0.5 μl;ddh2o,6.5 μl。
23.对于pgwb417
‑
mac3b的菌斑鉴定体系如下:2
ꢀ×ꢀ
taq mix,7.5 μl;
at2g33340
‑
f,0.5 μl;at2g33340
‑
r,0.5 μl;ddh2o,6.5 μl。
24.pcr扩增后,电泳检测,通过条带亮度及电泳检测结果初步判定转化菌斑是否重组有目的序列。再挑取对应菌斑至含有100 ng/μl壮观霉素的液体lb培养基中,37℃振荡培养过夜,次日提取质粒,并将所提取质粒进行测序鉴定,确保质粒重组正确。
25.需要解释说明的是,本技术所涉及的mac3a和mac3b基因的编码框碱基序列如seq id no.1和seq id no.2所示,或者具体参考如下:mac3a(at1g04510,1572bp,seq id no.1):atgaattgtgcaatttccggcgaagttccggaggagcctgtggtttctaagaagtcgggtttgctttacgagaagcggctaatccagacgcatatatccgattatgggaaatgcccggttactggtgagccacatactcttgatgacattgttcccatcaaaactgggaagatcgtaaagccgaaaccattacacacagctagcatccctggattgcttggaacgtttcagactgaatgggacagtttgatgctatcaaattttgctttggaacaacaactgcatactgcgaggcaagagctaagtcacgctttgtatcagcatgatgctgcttgtcgtgtgattgctaggcttaaaaaagaaagagacgaatcacgacaattgcttgcagaggctgaaaggcagttgcctgcagcccccgaagttgccacatcgaatgctgctcttagtaatggtaaacgaggtatcgatgatggtgagcaggggcctaatgcaaagaaaatgcgtcttggaatttcggctgaagttatcacagaactcacagattgtaatgctgctctttctcagcagcgtaaaaagagacagatccctaaaacattggcttcagtcgatgctctggagaagttcacccaactctcaagccacccccttcacaagaccaacaaacctggaattttttcaatggacatcctacattctaaggatgtcatcgctacgggaggaattgatacaactgccgttctctttgatcgtccttcaggacaaatcttatcaacgctgactggtcactcaaagaaggttacaagcatcaagttcgttggtgacactgatcttgtgttaactgcttcatccgacaagacagtccgcatctggggatgttccgaggatgggaactatacctctagacatacactgaaagatcattctgccgaggtgcgagctgtaactgtccacgcaacgaataaatactttgtgtcagcatcacttgacagtacatggtgcttctatgatctgtcctccggtttatgccttgctcaggtgacagatgcttccgaaaacgacgtgaattacacggctgctgcttttcatcctgatggtctcattcttggaactggtaccgctcaatctattgttaagatttgggatgtaaaaagtcaggcaaatgtggcaaagtttggtggacacaatggagaaatcacctctatatcattctctgaaaacggttatttccttgcgactgctgcactggatggtgttaggttgtgggacttgcgcaagttaaagaacttccgaacctttgactttccagatgcaaactcggtggagtttgaccatagcggatcttatcttggcattgctgcttcagatataagagtattccaagcagctagtgtaaaagcagaatggaacccaatcaagactcttcccgatctgtccggtacaggtaaagcaacaagtgttaagtttggactcgactccaaatacatagcagtcggttcaatggaccgtaatctcaggatatttggtttacctgatgatgacaatactgaagattcagcacaagattcatga。
26.mac3b (at2g33340,1578bp,seq id no.2)atgaactgtgcaatttcaggagaagttcccgtggagccagtggtttcgacgaagtcaggattactcttcgagagacgactaatcgaaagacatatatcggattatgggaagtgcccggttactggcgaaccacttaccattgatgacattgttcccatcaaaactggggagatcataaagccgaaaacattgcatacagctagtatccctggattgctcggaacgttccagaatgaatgggacggtttgatgctatcaaattttgcactggagcaacaactacatactgcaaggcaagagctaagtcatgccttgtatcagcatgattctgcttgtcgtgtgattgctagacttaaaaaagaaagagacgaagcacgccaattactggccgaggttgagagacatatacctgcggcccctgaagctgtgacagctaatgctgctctgagtaatggtaaacgagctgccgttgacgaggaactgggtcctgatgcaaagaaattgtgtcctggaatttcagctgaaattattacggaattgactgattgtaatgctgctctttcccagaagcgaaaaaagcgacagattcctcaaacattg
gcgtcaatagatactttggagaggttcactcagctatcaagccacccacttcacaagaccaacaaaccaggcatttgttcgatggacattctacattctaaggatgtcattgctactggaggagttgatgcaactgctgttctctttgatcgcccttctggacaaatcttgtcaacactgactggtcactcgaagaaggttacaagcgtaaaatttgtaggcgactctgatcttgttttgactgcttctgctgacaagacagtccgtatctggcggaatcctggggatgggaattatgcttgtgggtatacattgaatgatcattctgcggaggtgcgagctgtaactgtgcatcccacaaataaatactttgtctcggcatctcttgatggtacatggtgcttctacgatctgtcctctggctcatgccttgcacaggtatcagatgattcaaagaatgtagattacacggctgctgcttttcatcccgatggtctcattctcggaaccggtacttctcaatctgttgttaagatttgggacgttaaaagtcaggcaaatgtggctaagtttgatggacacactggggaagttacagctatatctttctctgaaaatggttacttcctcgcgacagctgcagaggatggtgttaggttgtgggatctgcgcaagttaaggaacttcaaatcatttttatctgcagatgcgaactctgtggagtttgatcctagcggatcttatctcggtattgctgcatcagatatcaaagtataccagacggcaagtgtgaaagctgaatggaaccttatcaagacactcccagatctctccggcactggtaaagctacgtgtgtgaagtttggttcagatgcacagtacgttgcagtcggttcgatggaccgtaacctacggatatttggtcttcctggtgatgaaaaagccaacgtcgatgatgactctgcgcaagactcgtga。
27.(二)转化农杆菌在25 μl的农杆菌gv3101感受态细胞中,加入2 μl上述步骤(一)中鉴定正确的重组超表达质粒,进行转化操作,具体而言:将农杆菌gv3101感受态细胞与重组超表达质粒混合均匀后,先冰上静置孵育5分钟,接着液氮速冻5分钟,之后迅速在37℃水浴中静置5分钟,之后再在冰上静置5分钟;随后加入1 ml yep液体培养基,放于28℃摇床振荡孵育2 h;再后,使用无菌涂布棒将菌液均匀涂布到含有100 ng/μl壮观霉素和100 ng/μl利福平的yep固体平板上,28℃培养箱倒置培养2天。最后,进行菌落pcr鉴定,挑选鉴定正确的2
‑
3个阳性单菌落进行混合摇菌后直接应用,或者将培养后菌液
‑
80℃保藏待用。
28.(三)转化、制备超表达株系的转基因材料将拟南芥野生型植株培育生长到开花期时进行农杆菌侵染转化,具体操作而言:取步骤(二)中的农杆菌转接到5 ml含有100 ng/μl壮观霉素和100 ng/μl利福平的液体yep培养基中,28℃恒温摇床过夜震荡培养;然后将菌液转移到10 ml集菌管中,室温条件下、5000 g离心10 min;弃上清后用含1/2 ms盐和5%蔗糖的重悬液将沉淀轻轻吹打均匀,并调节od
600
约0.8
‑
1.0,加入0.01% silwet l77,以此作为侵染液;随后采用花序侵染转化法进行操作。
29.对侵染后拟南芥野生型植株继续培育并收获种子。将收获种子进一步种植后,在含有50 ng/μl卡那霉素抗性的ms固体培养基上进行抗性筛选和pcr鉴定,最终获得mac3a和mac3b超表达转基因株系植株。
30.(四)超表达转基因株系鉴定对所获得的mac3a和mac3b稳定遗传的转基因株系的超表达材料(将其命名为mac3a
‑
oe14、mac3a
‑
oe15、mac3b
‑
oe4和mac3b
‑
oe9)分别进行分子鉴定和蛋白水平检测,以对mac3a 和mac3b基因表达情况进行评价,具体操作简介如下。
31.首先,将野生型和超表达植株的种子分别种植在ms固体培养基上,提取7天幼苗的总rna,并反转录合成cdna;随后,基于qrt
‑
pcr技术,设计mac3a和mac3b定量检测用引物对以对超表达转基因
株系的转录水平进行检测;qrt
‑
pcr检测时,引物序列设计如下:mac3a
‑
qrt
‑
f:5
’‑ꢀ
gctgactggtcactcaaagaa
ꢀ‑3’
,mac3a
‑
qrt
‑
r:5
’‑ꢀ
gttcccatcctcggaacatc
ꢀ‑3’
;mac3b
‑
qrt
‑
f:5
’‑ꢀ
tcaagacactcccagatctctc
ꢀ‑3’
,mac3b
‑
qrt
‑
r:5
’‑ꢀ
tatccgtaggttacggtccatc
ꢀ‑3’
;actin
‑
qrt
‑
f:5
’‑
gtaacattgtgctcagtggtggta
‑3’
,actin
‑
qrt
‑
r:5
’‑
gatagaaccaccaatccagacact
‑3’
。
32.qrt
‑
pcr分析结果表明,超表达转基因植株中mac3a和mac3b基因的转录水平明显高于野生型(图1(b)和(c)),这一结果表明转基因株系的构建是成功的。
33.进一步地,分别提取7天幼苗的总蛋白,以actin蛋白做内参,利用myc抗体检测了mac3a
‑
myc和mac3b
‑
myc融合蛋白的表达情况。结果表明,超表达植株中均有mac3a
‑
myc或mac3b
‑
myc融合蛋白的表达,但野生型植株中没有融合蛋白的表达(图1(a)),这一结果也进一步表明,转基因植株中mac3a和mac3b基因是能够进行正常的转录表达和发挥生物功能的。
34.(五)具体表型差异鉴定对获得的t3代超表达株系纯合体的种子,发明人进一步培育后,通过将其与野生型植株对比,以研究和明确mac3a和mac3b基因对植物具体生长影响情况。具体实验情况,简介如下。
35.首先,将t3代超表达纯合体种子与同一时期野生型的种子消毒清洗后点在ms固体培养基上,放于4℃春化3天,随后转移至相同光照培养间培养生长(植株生长温度为22℃,光照周期为16h,黑暗周期为8h)。
36.对叶片表型观察时,选择7天幼苗的子叶进行表型观察,具体而言:剪取需观察的植物材料的同一发育时期的子叶放置在ms平板上,用相机进行拍照(须放置标尺),用imagej(1.4.3.67版本)软件测量子叶面积,每种材料分别统计50片子叶,并选取少数拍典型照片。
37.统计分析后,结果表明,与野生型相比,mac3a和mac3b超表达材料均表现出子叶变大的表型,mac3a
‑
oe14和mac3a
‑
oe15分别增加了25%和27%,mac3b
‑
oe4和mac3b
‑
oe9分别增加了5.8%和9%(图2(a)和图2(e))。
38.之后剪取生长20天植株的第一对真叶,放置在体式显微镜下观察表皮毛分支并拍照,统计不同表皮毛分叉的数目,每种材料分别统计20片真叶。
39.统计分析结果显示,与野生型相比,mac3a和mac3b超表达材料均表现出二叉分支增加(分别为9.9%和9.3%),三叉、四叉分支略微减少的表型(分别为5.3%和3.2%,4.6%和6.1%)(图2(f))。
40.对花器官观察时,具体而言:当植株进入开花阶段后,剪取每种植株同一花期的30片花瓣放于普通ms培养基上,拍照并用imagej软件对花瓣的长度、宽度以及面积进行测量。
41.结果表明,与wt相比,mac3a超表达植株的花瓣的长度、宽度和面积均比wt的大(分别增加了3.3%和5.1%,4.4%和6%,7.3%和10.6%)(图2(b)和图2(h)),但mac3b超表达植株的花瓣没有表现出显著差异(图2(c)和图2(i))。
42.对种子观察时,具体而言:当植株果荚成熟后,选取各种植株主茎上从下往上数第四个到第十一个角果的种子进行收集干燥,随后放置在体式显微镜下进行拍摄,用imagej软件测量种子的面积,每种材料分别统计320粒种子。
43.统计分析结果显示,与野生型相比,mac3a超表达植株的种子面积均比wt的大(分别为4%和9.5%),但mac3b超表达植株没有表现出明显差异(图2(d)和图2(g))。
44.基于上述结果,可以看出,mac3a和mac3b基因与植物器官大小调控之间具有直接关系,具体而言:与野生型相比,mac3a超表达植株的子叶、花和种子均显著增大,但mac3b超表达植株只表现出子叶变大的表型。据此可初步推测认为mac3a在调控拟南芥器官大小方面占主导作用。
45.实施例2在实施例1基础上,为进一步直观地研究mac3a和mac3b的基因功能,利用亚细胞定位、bifc和co
‑
ip实验,发明人进一步构建了相关重组质粒载体,并进行了相关分析。具体实验过程简介如下(相关操作,未详细说明部分,参考前述实施例或者现有技术常规操作即可)。
46.(一)亚细胞定位情况首先,利用gateway载体构建技术,发明人构建了mac3a和mac3b相关的超表达载体进行亚细胞定位实验,具体而言:参考实施例1操作,选取实施例1中的含有目的基因片段的bp融合载体pentr
‑
mac3a/mac3b进行lr反应实验,同时选取表达载体pgwb405构建获得融合表达载体:35s::mac3a
‑
gfp和35s::mac3b
‑
gfp。
47.随后,通过瞬时转化烟草的方法观察mac3a和mac3b的亚细胞定位,具体而言,分别将前述构建的35s::gfp、35s::mac3b
‑
gfp、35s::mac3a
‑
gfp瞬时转化40日龄左右的n. benthamiana烟草,48小时后观察荧光。
48.结果如图3所示,以mcherry荧光信号标识细胞核,当将35s::gfp注射入烟草叶片时,在表皮细胞的细胞核、细胞质和细胞膜上均可以观察到荧光,当分别将35s::mac3b
‑
gfp、35s::mac3a
‑
gfp注射入烟草叶片时,gfp荧光仅在细胞核中观察到,并且绿色荧光信号和细胞核特异性荧光mcherry信号完全重合,表明mac3a和mac3b均定位于细胞核。
49.结果表明,mac3a、mac3b均是核定位蛋白,这一结果也为二者可能在细胞核中发挥功能提供了理论基础。
50.(二)bifc实验首先,以拟南芥cdna作为模板,扩增mac3a和mac3b基因的编码框碱基序列如seq id no.1和seq id no.2所示。基于一步克隆构建技术,设计pcr扩增用引物序列,并进行pcr扩增;具体pcr扩增用引物序列设计如下:mac3a
‑
nyfpf: 5
’‑ꢀ
gagaacacgggggactctagaatgaattgtgcaatttccggcg
‑3’ꢀ
,mac3a
‑
nyfpr: 5
’‑ꢀ
cccgggagcggtaccctcgagactgaagattcagcacaagattca
‑3’ꢀ
;mac3a
‑
cyfpf: 5
’‑ꢀ
gagaacacgggggactctagaatgaattgtgcaatttccggcg
‑3’ꢀ
,mac3a
‑
cyfpr: 5
’‑ꢀ
cccgggagcggtaccctcgagactgaagattcagcacaagattca
‑3’ꢀ
;mac3b
‑
nyfpf: 5
’‑ꢀ
gagaacacgggggactctagaatgaactgtgcaatttcaggagaa
‑3’ꢀ
,mac3b
‑
nyfpr: 5
’‑ꢀ
cccgggagcggtaccctcgagcgagtcttgcgcagagtcatc
‑3’ꢀ
;mac3b
‑
cyfpf: 5
’‑ꢀ
gagaacacgggggactctagaatgaactgtgcaatttcaggagaa
‑3’ꢀ
,
mac3b
‑
cyfpr: 5
’‑ꢀ
cccgggagcggtaccctcgagcgagtcttgcgcagagtcatc
‑3’ꢀ
。
51.其次,对瞬时表达载体pspy
‑
neyfp和pspy
‑
ceyfp分别进行xbai、xhoi双酶切(37℃、3 h),并回收酶切产物(利用omega公司的纯化回收试剂盒,参考其说明书进行操作)。
52.随后,使用无缝克隆法(一步克隆法)将目的基因和酶切后的载体片段进行连接重组,连接重组时,20
µ
l反应体系设计如下:5
ꢀ×ꢀ
ce ii buffer,4 μl;酶切后线性化克隆载体,160 ng;pcr扩增产物,60 ng;ddh2o,加至20 μl;37℃连接1 h。
53.再后,将连接产物转化大肠杆菌进行筛选、检测,确保所构建bifc重组载体质粒重组正确。
54.最后,通过双分子荧光互补(bimolecular fluorescence complementation,bifc)实验进行体外实验,具体而言:分别将前述构建的35s::nyfp和35s::cyfp、35s::mac3a
‑
nyfp和35s::mac3b
‑
cyfp、35s::mac3a
‑
nyfp和35s::mac3a
‑
cyfp、35s::mac3b
‑
nyfp和35s::mac3b
‑
cyfp两两注射入40日龄左右的n. benthamiana烟草叶片中,48小时后观察荧光。
55.结果如图4(a)所示,可以看出:当将35s::mac3a
‑
nyfp和35s::mac3b
‑
cyfp共转入烟草叶片时,在表皮细胞的细胞核内可观察到黄色荧光,同样地,当共转35s::mac3b
‑
nyfp和35s::mac3b
‑
cyfp时也可观察到荧光。但是共转35s::nyfp和35s::cyfp以及35s::mac3a
‑
nyfp和35s::mac3a
‑
cyfp时都无荧光现象发生。
56.结果表明,mac3a和mac3b可以形成异源二聚体,mac3b自身也可形成同源二聚体,但mac3a自身不能形成同源二聚体。
57.(三)co
‑
ip实验首先,利用前述构建的亚细胞定位载体35s::mac3a
‑
gfp和35s::mac3b
‑
gfp作为co
‑
ip载体进行实验同时,参考前述操作,扩增mac3b基因的编码框碱基序列如seq id no.2所示,利用一步克隆的方法构建获得:35s::mac3b
‑
ha融合表达载体。构建过程中,引物序列设计如下:mac3bhainf: 5
’‑ꢀ
ggtaccgcgggcccgggatccatgaactgtgcaatttcaggagaa
‑3’ꢀ
,mac3bhainr: 5
’‑ꢀ
tgggtaacctgccatggatcccacgagtcttgcgcagagtca
‑3’ꢀ
。
58.随后,分别将35s::mac3b
‑
ha和35s::mac3b
‑
gfp、35s::mac3b
‑
ha和35s::mac3a
‑
gfp瞬时转化40日龄左右的n. benthamiana烟草,48小时后提取蛋白进行co
‑
ip实验。
59.结果表明,以总蛋白作为input,分别用gfp和ha抗体进行免疫印迹分析,均能检测到mac3a和mac3b对应大小的条带(约70 kda),表明蛋白成功表达。之后用gfp
‑
trap
‑
a琼脂糖珠孵育总蛋白提取物,分别用gfp和ha抗体进行免疫印迹检测,在output中均检测到了mac3b
‑
ha的条带,证明mac3a和mac3b以及mac3b和mac3b之间存在相互作用(图4(b))。
60.综上实验数据表明:mac3a和mac3b可以形成异源二聚体,而mac3b自身可形成同源二聚体,但mac3a自身不能形成同源二聚体。
61.综合实施例1、2结果而言,发明人分析认为:转基因植株mac3a超表达材料表现出
器官变大的表型,但是mac3b超表达材料只有子叶变大的表型,表明mac3a在调控拟南芥器官大小方面占主导作用。互作实验证明mac3a和mac3b可以形成异源二聚体,mac3b自身可形成同源二聚体,但mac3a自身不能形成同源二聚体。这种差异可能是导致mac3a和mac3b超表达材料器官表型不尽相同的原因之一。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1