植原体病害的柯氏法则验证方法
1.本发明属于微生物领域,具体涉及一种植原体病害的柯氏法则验证方法。
背景技术:
2.植原体(phytoplasma)过去称作类菌原体(mycoplasma-like organism,简称mlo),是一类专性寄生于植物韧皮部和部分半翅目昆虫唾腺细胞、无细胞壁且由叶蝉和飞虱等刺吸式口器昆虫传播的小型原核生物,属于原核生物界软壁菌门、柔膜菌纲、无胆甾原体目、无胆甾原体科、植原体暂定属(ca.genus phytoplasma)。
3.在过去的几十年里,由于植原体难于离体培养,分子检测技术不发达,又无法根据其形态学和培养形状等传统细菌学研究的方法对其进行检测,所以早期对植原体的检测,通常是通过观察寄主植物所表现出来的症状,或对感病植物组织进行超薄切片观察。
4.柯氏法则:
5.(1)在病植物上常伴随有一种病原微生物存在;
6.(2)该微生物可在离体的或人工培养基上分离纯化而得到纯培养;
7.(3)将纯培养接种到相同品种的健株上,出现症状相同的病害;
8.(4)从接种发病的植物上再分离到其纯培养,性状与接种物相同。
9.细菌性病害以及真菌性病害等都可以通过柯氏法则来对其进行验证,而关于植原体(phytoplasma)病害还不存在类似于真菌细菌的柯氏法则验证。
技术实现要素:
10.本发明所要解决的技术问题为:目前植原体的检测主要是由分子手段为主,本研究从生物学角度出发,针对植原体的检测,提出一种类似于真菌细菌的“柯氏法则”验证方法,提供一种对植原体病害间接的检测手段,为植原体病害的鉴定提供更进一步的证据。
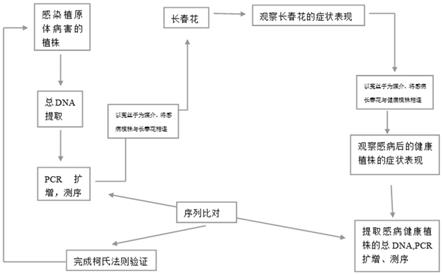
11.本发明的技术方案为:植原体病害的柯氏法则验证方法,包括以下步骤:
12.(1)鉴定:提取疑似感染植原体病害的植株总dna,利用pcr技术检测,测序,从分子水平确定该病害属于植原体病害;
13.(2)传染:将疑似感染植原体病害的植株通过菟丝子与长春花连起来,观察长春花的表现症状,确认感病;
14.(3)回接:将感病长春花通过菟丝子与步骤(1)的植株相同的健康植株相连,观察健康植株的表现症状,提取感病后的健康植株总dna,pcr扩增测序;
15.(4)比对:将步骤(3)的测序结果与步骤(1)的测序结果进行比对,比较同源性,完成植原体病害的“柯氏法则”验证。
16.与现有技术相比,本发明具有以下有益效果:
17.本发明从生物学角度出发,针对植原体的检测,提出一种类似于真菌细菌的“柯氏法则”验证方法,提供了一种对植原体病害间接的检测手段,为植原体病害的鉴定提供更进一步的证据。
附图说明
18.图1是本发明验证方法的示意图。
具体实施方式
19.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
20.实施例1
21.一、鉴定:提取疑似感染植原体病害植株总dna,利用pcr技术检测,测序,确定该病害属于植原体病害;(以柳树花变叶植原体病害为例)
22.1.植物总dna提取
23.dna提取结合漆艳香、gao等植原体dna提取方法,有所改动。
24.(1)称取1.0g植物组织液氮研磨后,取0.2g装入2ml预冷离心管中(约离心管的1/4体积),加入600μl 65℃预热的ctab缓冲液(2%ctab,100mm tris-hcl,ph8.0,1.4m nacl,20mm edta,ph 8.0,1%pvp-40,1%β-巯基乙醇);
25.(2)置于65℃水浴锅中水浴60min,其间每隔10min轻轻上下颠倒混匀一次;
26.(3)水浴结束后取出离心管,温度降至室温后加入600μl氯仿:异戊醇(24:1),上下振荡混匀至乳白色,12000r/min离心10min;
27.(4)吸取上清液转移至新的离心管中,加入与上清液等体积的氯仿:异戊醇(24:1)进行二次抽提,上下振荡混匀,12000r/min离心10min;
28.(5)吸取上清液转移至新的离心管中,加入等体积-20℃预冷的异丙醇,轻轻颠倒混匀,在-20℃放置60min;
29.(6)12000r/min离心10min,用移液枪吸小心将上清液移除(切不可把沉淀吸出);
30.(7)沉淀中加入2倍体积的95%乙醇和1/10体积的3m醋酸钠,轻轻上下颠倒数次混匀,之后12000r/min离心10min;
31.(8)用移液枪小心将离心管中的液体移尽,再加入1.0ml 70%乙醇,上下颠倒数次,12000r/min离心5min,用移液枪吸尽乙醇溶液,放置在超净工作台内打开风机干燥10min(不可过于干燥);
32.(9)加入50ul灭菌双蒸水,放置在50℃水浴锅中水浴30min,促进核酸的溶解;
33.(10)取1ul总dna于thermo nd-2000微量分光光度计检测dna浓度,琼脂糖凝胶电泳检测dna完整性,并将所提取的dna统一稀释至浓度为50~100ng/μl置于-20℃保存,用于后续pcr扩增,取5μl总dna做琼脂糖凝胶电泳检测其完整性。
34.2琼脂糖凝胶电泳
35.(1)称取0.32g琼脂糖放入250ml三角瓶中,加入40ml 1
×
tbe缓冲液,摇匀,放入微波炉中溶解。
36.(2)将冲洗好的胶槽与梳子组装好,待琼脂糖凝胶温度降至60℃左右不烫手时,向凝胶中加入4μl 1%eb溶液,轻轻摇匀,将琼脂糖凝胶溶液倒入胶槽内,静置30分钟,使其完全凝固。
37.(3)轻轻拔出梳子,将凝胶放入电泳槽内,向电泳槽内加入1
×
tbe缓冲液至末过凝胶2-3mm即可。
38.(4)将待检测dna样品和6
×
dna loading buffer按照5:1比例充分混匀后依次点入凝胶点样孔中,最后点入5μl dl2000 dna marker。
39.(5)盖上电泳槽盖,接通电源,120v电压电泳30min。
40.(6)电泳结束后,关闭电源,取出凝胶,放置在凝胶成像仪下观察电泳结果并保存照片。
41.3引物合成
42.植原体16s rrna基因通用引物对r16mf2/r16mr1(catgcaagtcgaacgga/cttacccccaatcatcga)和r16f2/r16r2(acgactgctaagactgg/tgacgggcggtgtgtacaaaccccg),由生工合成。
43.4柳树花变叶植原体16s rrna pcr扩增
44.植原体16sr rna基因扩增采用植原体通用引物r16mf2/r16mr1和r16f2/r16r2分别进行直接pcr和巢式pcr,以健康的竹柳总dna为阴性对照,栆疯病dna为阳性对照,无菌双蒸水为空白对照。
45.直接pcr以植物总dna为模板,以r16mf2/r16mr1为扩增引物,反应体系如下:
46.10
×
pcr buffer 2.5μl
47.2.5mm dntps 1μl
48.r16mf2(10μmol/l)1μl
49.r16mr1(10μmol/l)1μl
50.模板dna 1μl
51.taq dna聚合酶(5u/μl)0.5μl
52.加ddh2o至25μl
53.直接pcr反应条件为:94℃,预变性3min;94℃,变性30sec,55℃退火30sec,72℃延伸2min,30个循环,最后72℃延伸10min,4℃保温。
54.巢式pcr(nest-pcr)
55.直接pcr结束后,将pcr产物稀释30倍,取1μl作为巢式pcr模板,以r16f2/r16r2为扩增引物,反应体系与条件如下:
56.10
×
pcr buffer 2.5μl
57.2.5mm dntps 1μl
58.r16f2(10μmol/l)1μl
59.r16r2(10μmol/l)1μl
60.模板dna 1μl
61.taq dna聚合酶(5u/μl)0.5μl
62.加ddh2o至25μl
63.94℃3min;94℃30sec;57℃30sec;72℃2min;30个循环;72℃10min;4℃保存。
64.5琼脂糖凝胶电泳检测
65.琼脂糖凝胶制备与电泳检测具体步骤详见3.3.2实验步骤。巢式pcr产物在1%琼脂糖凝胶电泳检测,引物对r16f2/r16r2扩增后预期目标大小条带应该约为1200bp,观察并拍照记录结果。
66.6基因克隆与序列分析
67.pcr产物胶回收纯化
68.对电泳检测呈阳性的pcr产物用生工生物工程(上海)股份有限公司sanprep柱式胶回收试剂盒进行回收,具体操作步骤参照试剂盒说明书。
69.回收产物连接反应
70.连接反应体系:
[0071][0072][0073]
连接反应条件:16℃,30min;4℃过夜连接。
[0074]
转化
[0075]
(1)从-80℃冰箱中取出dh5α感受态细胞,加入50μl到离心管中,取5μl连接产物加入感受态细胞中,轻轻吹打混匀,冰上静置30min。
[0076]
(2)将冰浴好的离心管置于提前设置好的42℃水浴锅中水浴90s。
[0077]
(3)取出离心管冰上放置5min。
[0078]
(4)加入300μl lb液体培养基,混匀后转入15ml离心管中,37℃,220r/min复苏90min至浑浊状态。
[0079]
(5)打开无菌操作台,紫外灭菌30min,在酒精灯焰下涂布棒用外焰灭菌后冷却至室温。
[0080]
(6)取100μl复苏后的菌液加到含amp(50μg/ml)、iptg(24mg/ml)和x-gal(20mg/ml)的lb固体培养基上,涂布棒涂布均匀。
[0081]
(7)倒置培养皿,于37℃培养箱中培养12~16h。
[0082]
(8)向15ml离心管中加入3ml lb液体培养基和3μl amp,用无菌移液枪吸头挑取白色单菌落放入菌液中,37℃220r/min过夜培养。
[0083]
质粒dna提取
[0084]
质粒dna提取采用生工生物工程(上海)股份有限公司sanprep柱式质粒dna小量提取试剂盒提取,具体操作步骤参照试剂盒说明书。
[0085]
测序
[0086]
重组质粒dna委托生工生物工程(上海)股份有限公司测序,测序方法采用桑格双脱氧法进行双向测序。(序列一)
[0087]
二、传染:将疑似感染植原体病害的植株通过菟丝子与长春花连起来,分别在感染30天、60天时,观察长春花的表现症状,提取长春花总dna,通过pcr扩增,测序:
[0088]
取发病和健康柳树枝条扦插于温室内培养,以菟丝子作为桥梁进行植原体传染试验,处理重复3次,当菟丝子完全寄生于柳树枝条和长春花上30天和60天后,观察长春花的生长状况,并提取dna,以健康柳树枝条传染的长春花作为健康对照,用通用引物对r16mf2/r16mr1进行巢式pcr检测。
[0089]
三、回接:将感病长春花通过菟丝子与健康的植株相连,观察健康植株的表现症
状,提取健康植物总dna,pcr扩增测序:
[0090]
取发病和健康长春花于温室内培养,以菟丝子作为桥梁进行植原体传染试验,处理重复3次,当菟丝子完全寄生于柳树枝条和长春花上30天和60天后,观察柳树的生长状况,并提取dna,以健康长春花传染的柳树作为健康对照,用通用引物对r16mf2/r16mr1进行巢式pcr检测,测序(序列二)。
[0091]
四、比对:将感病后的健康植株的测序结果(序列二)与最初测定的感病植株(序列一)序列进行对比,比较同源性,完成植原体病害的“柯氏法则”验证。
[0092]
同源性比较:将序列一与序列二在ncbi数据库中进行blast比对,再利用dnaman等软件确定这两条序列的同源性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1