一种替格瑞洛关键中间体及其制备方法与流程
1.本发明涉及一种替格瑞洛关键中间体及其制备方法,属于药物化学技术领域。
背景技术:
2.替格瑞洛是由阿斯利康开发的化学结构为环戊三唑磷嘧啶的第一个口服、作用可逆的adp 受体拮抗剂,可直接作用于p2y12受体,无需代谢激活。其与抗血栓一线治疗药物氯吡格雷clopidogrel 属同靶点药物,但两者又有所区别:首先,后者为前体药物,需经人体cyp2c19代谢酶代谢成活性成分方可起效,如果cyp2c19基因缺失,还会造成严重的“氯吡格雷抵抗”,而替格瑞洛为活性药物,不需代谢降解可直接起效;其次,氯吡格雷为不可逆的结合血小板,而替格瑞洛为可逆性结合血小板,因此氯吡格雷减少血小板的数量后只能输注血小板,而替格瑞洛停药后血小板的功能可以自行恢复。
3.wo2011036479、wo2012138981、wo2012142983、cn101143864a、cn102731467a、cn102659815a、cn102675321a等专利报道了使用不同的合成路线制备替格瑞洛的方法。分析已公开的合成路线和制备方法后发现,无论选用何种合成路线,其制备过程大多涉及以下中间体2
‑
[[(3ar,4s,6r,6as)
‑6‑
氨基四氢
‑
2,2
‑
二甲基
‑
4h
‑
环戊烯并
‑
1,3
‑
二氧杂环戊烷
‑4‑
基]氧基]乙醇l
‑
酒石酸盐(式d化合物) ,并且是由其游离态(式c)与l
‑
酒石酸成盐制得的。
[0004]
中国发明专利申请cn107382953a、wo2012063126和期刊文献(bioorganic&medicinal chemistry letters,2012,22,3598~3602)等公开了一种式(c)化合物的制备方法:
其中,pg为苄基、对甲基苯甲基、对氯苯甲基、对甲氧基苯甲基、萘甲基、二苯甲基或三苯甲基;所述酰基pg1为苄氧羰基、对甲基苯甲氧羰基、对氯苯甲氧羰基或对甲氧基苯甲氧羰基。化合物(iii’)先与溴乙酸乙酯反应,再还原酯基,最后脱去氨基保护基得到式(c)化合物,式(c)化合物与l
‑
酒石酸成盐制得的式(d)化合物。4步反应收率只有62.9%,且该方法中还原步骤使用硼氢化钠、四氢锂铝等高危试剂,不利于规模化生产。
[0005]
中国发明专利申请cn111087379a公开了一种直接引入乙二醇基的式(c)化合物的制备方法:由化合物(9)和乙二醇在nafion
‑
h酸性树脂的作用下直接反应上乙二醇基得到化合物(10),化合物(10)再通过钯碳加氢脱去苄基保护得到式(c)化合物,收率83.3%。该方法路线虽短,但是该nafion
‑
h酸性树脂价格高昂,产量稀少,无法应用于规模化生产。
[0006]
中国发明专利申请cn106496179a公开了另一种式(c)化合物的制备方法:将化合物(iii)、相转移催化剂、氢化钠加入反应容器中,甲苯作为反应溶剂,滴加2
‑
溴乙醇,回流即可得到化合物(iv),化合物(iv)再通过钯碳加氢脱去苄基保护得到式(c)化合物。该方法化合物(iii)制备化合物(iv)过程中,
ꢀ‑
oh
‑
烷基化反应常伴随显著的仲氨基nh
‑
烷基化或季铵盐形成的副反应,在放大生产时导致收率降低,文献报道收率达84.7%,但申请人重复该实验时,发现第一步原料化合物(iii)在体系中反应不完,始终有64.07%的剩余,且杂质较多,随着反应时间的延长没有变化,该方法无法重复,且此步反应需使用氢化钠,存在安全风险,不宜工业化生产。
[0007]
ep2666771公开了另一种乙二醇基上的羟基被保护的式(c)化合物的制备方法:该方法原子利用率较低,化合物(viii)制备化合物(xi)过程中,也需使用氢化钠,存在安全风险,并且化合物(xi)制备式(c)化合物过程中氧上脱苄需要高温高压(100 ℃及以上,5 mpa及以上),而且还需使用大剂量的催化剂,不宜工业化生产。
技术实现要素:
[0008]
本发明要解决的技术问题是克服现有技术缺点,提供一种无危险试剂应用的、原子利用率高、收率高、纯度高、成本低廉且适于工业化安全放大生产的式(c)化合物的制备方法。
[0009]
为解决上述技术问题,首先,本发明提供一种式(a)化合物,
其中,p1、p2为氨基保护基,(1)p1、p2分别独立地选自苄基、对甲氧基苄基或者苄氧羰基,或者(2)p1选自苯亚甲基或者邻苯二甲酰基,且p2不存在。
[0010]
式(a)化合物可选自以下具体结构:。
[0011]
其次,本发明还提供式(a)化合物的制备方法:其中,p1、p2为氨基保护基:(1)p1、p2分别独立地选自苄基、对甲氧基苄基或者苄氧羰基,或者(2)p1选自苯亚甲基或者邻苯二甲酰基,且p2不存在;l为离去基团,选自卤素、oms、ots或者ons;以式(i)、式(ii)化合物为原料,在碱和催化剂存在的条件下,在极性非质子溶剂中制备得到式(a)化合物。
[0012]
式(i)化合物可以通过(3ar,4s,6r,6as)
‑6‑
氨基
‑
2,2
‑
二甲基
‑
六氢环戊基[d] [1,3]二恶酚
‑4‑
醇为原料,按常规方法上氨基保护基p1和p2制备得到。
[0013]
式(ii)化合物可以通过乙二醇乙烯醚为原料,与甲基磺酰氯、对甲苯磺酰氯或硝基苯磺酰氯等反应制备得到,或从市场上直接购买得到。
[0014]
所述碱选自叔丁醇钠、叔丁醇钾、氢氧化钠、氢氧化钾或者碳酸钾。
[0015]
所述催化剂选自四丁基溴化铵、四丁基氯化铵或者18
‑
冠醚
‑
6。
[0016]
所述极性非质子溶剂选自四氢呋喃、甲苯、甲基叔丁基醚、二氯甲烷或者甲基四氢呋喃。
[0017]
其中,式(i)化合物∶催化剂∶碱的摩尔比为1∶0.01~0.1∶1~10。
[0018]
将本发明式(a)化合物在酸存在的条件下,脱去乙烯基,即可制备得到式(b)化合物:其中,p1、p2为氨基保护基:(1)p1、p2分别独立地选自苄基、对甲氧基苄基或者苄氧羰基,或者(2)p1选自苯亚甲基或者邻苯二甲酰基,且p2不存在;其中,所述酸选自盐酸、硫酸或者醋酸。
[0019]
进一步的,式(b)化合物脱去氨基保护基p1和p2制备得到式(c)化合物:。
[0020]
更进一步的,式(c)化合物与l
‑
酒石酸成盐制得式(d)化合物:。
[0021]
本发明实施例中,式(d)化合物的制备方法为:其中,p1、p2为氨基保护基,(1)p1、p2分别独立地选自苄基、对甲氧基苄基或者苄氧羰基,或者(2)p1选自苯亚甲基或者邻苯二甲酰基,且p2不存在;l为离去基团,选自卤素、oms、ots或者ons;包含以下几个步骤:(a)以式(i)、式(ii)化合物为原料,在碱和催化剂存在的条件下,在极性非质子溶剂中制备得到式(a)化合物;
(b)式(a)化合物在酸存在的条件下,脱去乙烯基制备得到式(b)化合物;(c)式(b)化合物脱去氨基保护基p1和p2制备得到式(c)化合物;(d)式(c)化合物与l
‑
酒石酸成盐制备得到式(d)化合物。
[0022]
本发明的有益效果:1、本发明式(i)、式(ii)化合物制备式(a)化合物的过程中,由于式(i)化合物的氨基被p1和p2两个氨基保护基保护,没有裸露的活泼氢,克服了现有技术中
‑
oh
‑
烷基化反应常伴随显著的仲氨基nh
‑
烷基化或季铵盐形成的副反应的缺陷,本发明反应收率高、纯度高。
[0023]
2、制备式(a)化合物的反应用碱采用叔丁醇钠、叔丁醇钾、氢氧化钠、氢氧化钾或者碳酸钾,避免了使用氢化钠,试剂友好,操作便利,提高了工艺和生产安全性。
[0024]
3、式(a)化合物的乙烯基通过式(ii)化合物在
‑
oh
‑
烷基化反应一步引入,并且式(ii)化合物中的乙烯基也并非通过上保护生成,而是采用含有乙烯基的起始物料;式(a)化合物的乙烯基在酸性条件中直接脱除,比其他常规的羟基保护基如脱苄需要高温高压(100 ℃及以上,5 mpa及以上)的苛刻条件简单温和,成本大幅降低,适于工业化放大生产。
[0025]
本发明制备步骤中,所用试剂或基团的缩写分别表示:ph
ꢀꢀꢀꢀꢀ
苯基bn
ꢀꢀꢀꢀꢀ
苄基cbz
ꢀꢀꢀꢀ
苄氧羰基oms
ꢀꢀꢀ
甲基磺酰氧基ots
ꢀꢀꢀꢀ
对甲苯磺酰氧基ons
ꢀꢀꢀꢀ
硝基苯磺酰氧基。
附图说明
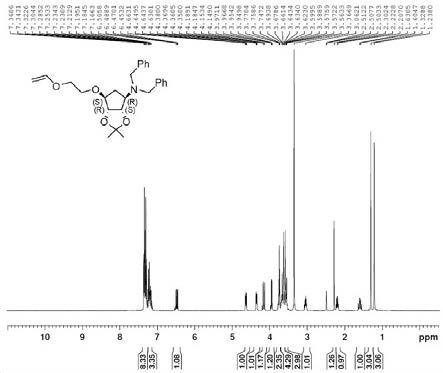
[0026]
图1、实施例1中化合物i
‑
1的1h
‑
nmr核磁谱图。
[0027]
图2、实施例1中化合物a
‑
1的1h
‑
nmr核磁谱图。
[0028]
图3、实施例1中化合物b
‑
1的1h
‑
nmr核磁谱图。
[0029]
图4、实施例1中化合物c的1h
‑
nmr核磁谱图。
[0030]
图5、实施例1中化合物c的气相色谱图。
[0031]
图6、实施例1中化合物d的1h
‑
nmr核磁谱图。
[0032]
图7、实施例1中化合物d的气相色谱图。
[0033]
图8、实施例5中化合物i
‑
5的1h
‑
nmr核磁谱图。
[0034]
图9、实施例6中化合物i
‑
6的1h
‑
nmr核磁谱图。
[0035]
图10、实施例7中化合物i
‑
7的1h
‑
nmr核磁谱图。
[0036]
图11、实施例7中化合物a
‑
7的1h
‑
nmr核磁谱图。
[0037]
图12、实施例8中控液相色谱图。
具体实施方式
[0038]
实施例1
eq.),控温25 ℃分批加入叔丁醇钾(75.2 g, 0.67 mol, 5.0 eq.),降温至5 ℃,滴加化合物
ⅰ‑
2(53.3 g, 0.13 mol, 1.0 eq.)和化合物
ⅱ‑
2(31.2 g, 0.19 mol, 1.4 eq.)的四氢呋喃溶液,滴毕保温反应5 h。将反应液缓慢加入冰水(332.5 g)中,分层分液,有机相用158.3 g水洗涤,有机相脱溶至基本无馏分,得化合物a
‑
2(53.9 g),收率85.97%。
[0043]
步骤(b)向反应瓶中依次加入水(97.2 g),硫酸(16.4 g),甲苯(205 g),加入化合物a
‑
2(52.2 g, 0.11 mol, 1.0 eq.),控温15 ℃搅拌12 h。用氢氧化钠调节体系ph至10~11,搅拌15 min,分层分液,有机相用97.2 g水洗涤,有机相脱溶至基本无馏分,得化合物b
‑
2(46.9 g),收率95.15%。
[0044]
步骤(c)向高压釜中加入四氢呋喃(353 g),化合物b
‑
2(39.8 g),钯炭(10%, 4 g),氮气置换三次,氢气置换三次,加氢2~3 mpa,控温60 ℃反应5 h。降温抽滤,滤液脱溶得化合物c(19.2 g),收率98.03%,gc纯度96.38%。
[0045]
步骤(d)参考实施例1步骤(d)完成。
[0046]
实施例3步骤(a)向反应瓶中加入甲基叔丁基醚(235.5 g)、18
‑
冠醚
‑
6(1.9 g, 0.01 mol, 0.1 eq.)、氢氧化钠(29.3 g, 0.73 mol, 10.0 eq.)、化合物
ⅰ‑
3(32.3 g, 0.07 mol, 1.0 eq.)和化合物
ⅱ‑
3(30.0 g, 0.11 mol, 1.5 eq.),升温回流反应8 h。将反应液缓慢加入冰水(323 g)中,搅拌15 min后静置分液,上层有机相用123 g水洗,有机相脱溶至基本无馏分,得化合物a
‑
3(32.9 g),收率87.9%。
[0047]
步骤(b)向反应瓶中依次加入水(29 g)、醋酸(62.8 g)、化合物a
‑
3(29.5 g),控温25 ℃搅拌12 h。用氢氧化钠调节体系ph至10~11,加入甲基叔丁基醚(432 g),搅拌15 min,静置15 min分液,下层水层丢弃,再加入水(62.8g),搅拌15 min,静置15 min分液,下层水层丢弃。上层有机相脱溶至基本无馏分,得化合物b
‑
3(26.6 g),收率95.01%。
[0048]
步骤(c)向高压釜中加入四氢呋喃(253 g),化合物b
‑
3(22.5 g),钯炭(10%, 2.3 g),氮气置换三次,氢气置换三次,加氢2~3 mpa,控温55℃反应5 h。降温抽滤,滤液脱溶得化合物c(9.9 g),收率98.33%。
[0049]
步骤(d)参考实施例1步骤(d)完成。
[0050]
实施例4步骤(a)向反应瓶中加入二氯甲烷(706 g)、四丁基溴化铵(3.5 g, 0.01 mol, 0.08 eq.)、氢氧化钾(66.9 g, 1.19 mol, 8.9 eq.),化合物
ⅰ‑
4(53.3 g, 0.13 mol, 1.0 eq.)和化合物
ⅱ‑
4(20 g, 0.19 mol, 1.4 eq.),升温回流反应26 h。将反应液缓慢加入冰水(332.5 g)中,搅拌15 min后静置分液,下层有机相再用158.3 g水洗,搅拌15 min后静置分液,下层有机相脱溶至基本无馏分,得化合物a
‑
4(50.2g),收率80%。
[0051]
步骤(b)向反应瓶中依次加入水(160 g),盐酸(161 g),甲苯(645 g),加入化合物a
‑
4(45.3 g),控温15 ℃搅拌12 h。用氢氧化钠调节体系ph至10~11,搅拌15 min,静置15 min分液,下层水层丢弃,再加入水(97.2 g),搅拌15 min,静置15 min分液,下层水层丢弃。控温50 ℃将有机相脱溶至基本无馏分,得化合物b
‑
4(40.6 g),收率94.91%。
[0052]
步骤(c)向高压釜中加入四氢呋喃(353 g),化合物b
‑
4(39.8 g),钯炭(10%, 4 g),氮气置换三次,氢气置换三次,加氢2~3 mpa,控温60 ℃反应5 h。降温压滤,滤液脱溶得化合物c(19 g),收率97.01%。
[0053]
步骤(d)参考实施例1步骤(d)完成。
[0054]
实施例5步骤(a)向反应瓶中加入甲基四氢呋喃(665 g),四丁基溴化铵(2.1 g, 0.01 mol, 0.03 eq.),碳酸钾(89.8 g, 0.65 mol, 3.0 eq.),化合物
ⅰ‑
5(56.6 g, 0.22 mol, 1.0 eq.)和化合物
ⅱ‑
5(45.8 g, 0.3 mol, 1.4 eq.),升温回流反应24 h。将反应液缓慢加入冰水(332.5 g)中,搅拌15 min后静置分液,上层有机相再用158.3 g水洗,搅拌15 min后静置分
液,有机相脱溶至基本无馏分,得化合物a
‑
5(68.2 g),收率95.01%。
[0055]
步骤(b)和(c)向反应瓶中依次加入水(59.6 g),盐酸(59.6 g),甲苯(283 g),加入化合物a
‑
5(65 g),控温20 ℃搅拌12 h。分液,有机层丢弃,水相再用甲苯(97 g)反萃一次,再将水相用氢氧化钠调节ph至10~11,加入二氯甲烷萃取(500 ml
×
3),将二氯甲烷层脱溶至基本无馏分,得化合物c(38.8 g),收率91.05%。
[0056]
步骤(d)参考实施例1步骤(d)完成。
[0057]
实施例6步骤(a)向反应瓶中加入甲苯(265.3 g),四丁基溴化铵(5.7 g, 0.02 mol, 0.1 eq.),控温25 ℃分批加入叔丁醇钾(29.6 g, 0.26 mol, 1.5 eq.),降温至5 ℃,滴加化合物
ⅰ‑
6(53.3 g, 0.18 mol, 1.0 eq.)和化合物
ⅱ‑
1(59.6 g, 0.25 mol, 1.4 eq.)的甲苯溶液,滴毕保温反应5 h。将反应液缓慢加入冰水(332.5 g)中,搅拌15 min后静置分液,下层水层丢弃,上层有机相再用158.3 g水洗,搅拌15 min后静置分液,下层水层丢弃。有机相脱溶至基本无馏分,得化合物a
‑
6(59.7 g),收率90.98%。
[0058]
步骤(b)向反应瓶中依次加入水(160 g),盐酸(161 g),甲苯(645 g),加入化合物a
‑
6(45.3 g),控温15 ℃搅拌12 h。用氢氧化钠调节体系ph至10~11,搅拌15 min,静置15 min分液,下层水层丢弃,再加入水(97.2 g),搅拌15 min,静置15 min分液,下层水层丢弃。有机相脱溶至基本无馏分,得化合物b
‑
6(40.0 g),收率94.92%。
[0059]
步骤(c)向反应瓶中依次加入乙醇(70 g),水(70 g),化合物b
‑
6(35 g),控温60 ℃滴加水合肼(7.6 g),滴毕反应6 h。用氢氧化钠调节ph至13~14,加入二氯甲烷萃取(500ml
×
3),将二氯甲烷层脱溶至基本无馏分,得化合物c(19.9 g),收率90.9%。
[0060]
实施例7
步骤(a)向反应瓶中加入甲苯(265.3 g),四丁基溴化铵(4.4 g, 0.01 mol, 0.1 eq.),控温25 ℃分批加入叔丁醇钠(19.5 g, 0.2 mol, 1.5 eq.),降温至5 ℃,滴加化合物
ⅰ‑
7(52 g, 0.14 mol, 1.0 eq.)和化合物
ⅱ‑
1(46 g, 0.19 mol, 1.4 eq.)的甲苯溶液,滴毕保温反应5 h。将反应液缓慢加入冰水(332.5 g)中,搅拌15 min后静置分液,下层水层丢弃,上层有机相再用158.3 g水洗,搅拌15 min后静置分液,下层水层丢弃。有机相脱溶至基本无馏分,得化合物a
‑
7(58.4 g),收率94.95%,hplc纯度96.62%。
[0061]
步骤(b)向反应瓶中依次加入水(160 g),盐酸(161 g),甲苯(645 g),加入化合物a
‑
7(45.3 g),控温15 ℃搅拌12 h。用氢氧化钠调节体系ph至10~11,搅拌15 min,静置15 min分液,下层水层丢弃,再加入水(97.2 g),搅拌15 min,静置15 min分液,下层水层丢弃。有机相脱溶至基本无馏分,得化合物b
‑
7(40.6 g),收率95.08%。
[0062]
步骤(c)向高压釜中加入四氢呋喃(353 g),化合物b
‑
7(39.8 g),钯炭(10%, 4 g),氮气置换三次,氢气置换三次,加氢2~3 mpa,控温60 ℃反应12 h。降温抽滤,滤液脱溶得化合物c(19.6 g),收率96.91%。
[0063]
实施例8按照cn106496179a的方法重复实验:向反应瓶中加入化合物ⅲ(26.33 g),四丁基溴化铵(1 g),甲苯(100 ml),搅拌下分批加入氢化钠(4.8 g),滴加2
‑
溴乙醇(25 g),加热回流反应20 h,冷却至室温,检测化合物ⅲ剩余64.07%,并且杂质较多,继续回流反应8小时,冷却至室温,检测反应没有变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1