一种新型冠状病毒Delta突变株的检测试剂盒的制作方法
一种新型冠状病毒delta突变株的检测试剂盒
技术领域
1.本发明涉及病毒检测技术领域,特别涉及一种新型冠状病毒delta突变株的检测试剂盒。
背景技术:
2.delta主要有d614g、 t478k、l452r和p681r等关键突变位点。
3.基因测序是目前最常用新冠变种鉴定技术,但存在速度慢、检测灵敏度较低、检测成本高的缺点,无法满足现场检测的需求,也不能做到高通量检测大量样本,采用rt-pcr方法可有效的解决了上述问题。
4.专利文献《一种鉴定新型冠状病毒印度变种的qrt-pcr方法》(申请号: 202110713012.9)公开了检测印度变异株的l452r、t478k、p681r三个突变位点,对每个变异位点设计两对引物,其中上游引物3’端分别匹配变异和非变异点,即变异上游引物和非变异上游引物,两对上游引物共用一个下游引物。
5.要检测样本是否有l452r、t478k、p681r突变时,需要6个不同的rt-pcr反应体系,并且检测结果需要根据扩增结果ct值的差值来判断是否存在突变,检测方法较为繁琐,成本高。
技术实现要素:
[0006][0007]
本发明的主要目的是提供一种新型冠状病毒delta突变株的检测试剂盒,旨在解决现有新型冠状病毒delta突变株检测方法较为繁琐,成本高的问题。
[0008]
为实现上述目的,本发明提出一种新型冠状病毒delta突变株的检测试剂盒,包括用于扩增含所述delta突变株的l452r突变位点和t478k突变位点及其之间的碱基序列的第一引物和第二引物,所述第一引物的3’末端碱基与所述l452r突变位点匹配,所述第二引物的3’末端碱基与所述t478k突变位点匹配。
[0009]
可选地,所述第一引物和/或所述第二引物的3’端倒数第二个或倒数第三个碱基与模板碱基序列错配。
[0010]
可选地,所述第一引物的碱基序列为5
’‑
taaggttggtggtaattataat taccg-3’,或5
’‑
ctaaggttggtggtaattataattaacg-3’;
[0011]
所述第二引物的碱基序列为5
’‑
aaaccttcaacaccattacaaggtt
‑ꢀ3’
,或5
’‑
aaaccttcaacaccattacaagatt-3’。
[0012]
优选地,所述第一引物的碱基序列为 5
’‑
ctaaggttggtggtaattataattaacg-3’,所述第二引物的碱基序列为 5
’‑
aaaccttcaacaccattacaagatt-3’。
[0013]
可选地,所述检测试剂盒还包括探针,所述探针序列为 5
’‑
tgtttaggaagtctaatctc-3’,其中,5’端带有fam基团,3’端带有 bhq1基团。
[0014]
可选地,所述检测试剂盒还包括逆转录酶和taq酶。
[0015]
可选地,所述检测试剂盒还包括ung酶。
[0016]
可选地,所述检测试剂盒还包括阳性质控品、阴性质控品、复溶液和内标质控品,所述阳性质控品为含目的检测基因的rna假病毒,所述阴性质控品为rnase free h2o,所述复溶液为稳定剂,所述内标质控品为含内标检测基因的rna假病毒。
[0017]
可选地,所述内标检测基因为人类基因组管家基因rnasep。
[0018]
可选地,所述检测试剂盒中的试剂为预混冻干粉形态。
[0019]
本发明技术方案通过在新型冠状病毒delta突变株的两个突变位点l452r 和t478k上分别设计arms引物作为第一引物、第二引物(双arms引物),从而能够更加特异性的扩增含上述突变位点的目标序列,而对不含上述突变位点的序列,其扩增效率较低或无扩增,不需要根据扩增结果ct值的差值来判断是否存在突变,从而特异性地检测被测样本中的delta突变株,使其操作简便,成本低。
附图说明
[0020]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
[0021]
图1为双arms引物的工作原理示意图;
[0022]
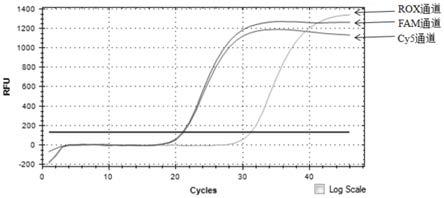
图2为检测2019新型冠状病毒l452r和t478k突变型模板(1.0e+08 copies/ml)结果;
[0023]
图3为检测2019新型冠状病毒l452r和t478k野生型模板(1.0e+08 copies/ml)结果。
[0024]
本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
[0025]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0026]
本发明提出一种新型冠状病毒delta突变株的检测试剂盒,包括用于扩增含所述delta突变株的l452r突变位点和t478k突变位点及其之间的碱基序列的第一引物和第二引物,所述第一引物的3’末端碱基与所述l452r突变位点匹配,所述第二引物的3’末端碱基与所述t478k突变位点匹配。
[0027]
其中,第一引物和第二引物可以为上游引物或下游引物,当第一引物为上游引物时,第二引物为下游引物;当第一引物为下游引物时,第二引物为上游引物。
[0028]
本发明技术方案通过在新型冠状病毒delta突变株的两个突变位点l452r 和t478k上分别设计arms引物作为第一引物、第二引物(双arms引物),从而能够更加特异性的扩增含上述突变位点的目标序列,而对不含上述突变位点的序列,其扩增效率较低或无扩增,不需要根据扩增结果ct值的差值来判断是否存在突变,从而特异性地检测被测样本中的delta突变株,使其操作简便,成本低。
[0029]
具体的,arms为扩增阻滞突变系统,由于dna聚合酶缺乏3'-5'外切酶活性,如果引物的3'末端碱基不能与靶dna正确互补配对,那么靶dna就不能被有效地扩增,pcr引物3'未
端的错配导致扩增产物的急剧减少。因此,本技术利用delta突变株的l452r突变位点和t478k突变位点连续的特性,将用于扩增含delta突变株的l452r突变位点和t478k突变位点及其之间的碱基序列的第一引物和第二引物的3’末端碱基分别与l452r突变位点和 t478k突变位点匹配,从而该第一、第二引物可以正常扩增delta突变株的碱基序列,而对于不是delta突变株的新型冠状病毒,由于其不含有l452r突变位点和t478k突变位点,也即在l452r突变位点和t478k突变位点对应的位置不能与上述第一、第二引物匹配,因而该第一、第二引物不能扩增delta 突变株以外的新型冠状病毒,或扩增量极少。
[0030]
请参阅图1,图1为双arms引物的工作原理示意图,其中连续3个碱基的中间一个碱基为突变碱基,两条arms引物的3’末端碱基与野生型模板均不互补,不能有效的扩增,与突变型模板均互补,可以有效的扩增。
[0031]
可以理解的是,该第一引物和第二引物除了3’末端需要与l452r突变位点和t478k突变位点匹配以外,其引物长度设计按照本领域技术人员所知的常规要求设计,例如长度可以为10~35bp。
[0032]
在一优选实施例中,第一引物和/或第二引物的3’端倒数第二个或倒数第三个碱基与模板碱基序列错配。理论上,taq dna聚合酶必须在引物3’末端碱基与模板完全互补情况下才能进行有效的聚合反应,但由于taq dna严谨性受多因素影响,某些情况下,即使引物的3’末端碱基与模板不互补,延伸仍然可以进行,因而仅靠引物3’末端一个碱基的错配不能充分而可靠地区分两个等位基因,进而造成假阳性结果。为了提高引物延伸的特异性,可在3’末端倒数第2位或第3位碱基处引入一个错配碱基,该错配碱基与3’末端的错配碱基共同作用,使引物在与其3’末端不互补的模板中扩增产物率显著降低,但是当不互补的模板浓度非常高时,仍然会出现假阳性结果,而设计两条 arms引物,作为第一、第二引物分别存于两个突变位点的3’端,且在3’末端倒数第2位或第3位碱基处引入一个错配碱基,可以进一步显著提高引物的特异性。
[0033]
可以理解的是,该错配碱基只要满足不与模板序列碱基对应位置匹配即可,例如模板碱基为c,该错配碱基可以为c以外的任何碱基,例如可以为a、 g或t,从而可以提高第一引物和/或第二引物对突变型模板和野生型模板的区分度,提高检测准确性。
[0034]
具体的,在新型冠状病毒delta突变株中包含t452r突变位点和t478k突变位点的碱基序列为:
[0035]035]
其中,带下划线并加粗的碱基为突变碱基,为t452r 突变位点,为t478k突变位点。
[0036]
可选地,所述第一引物的碱基序列为l452r-f1:f1:或l452r-f2:f2:其中,带下划线并加粗的碱基为突变碱基,小写字母为人为引入的错配碱基;
[0037]
所述第二引物的碱基序列为t478k-s-r1:1:或t478k-s-r2:r2:其中,带下划线并加粗的碱基为突变碱基,小写字母为人为引入的错配碱基。
[0038]
优选地,所述第一引物的碱基序列为所述第二引物的碱基序列为物的碱基序列为
[0039]
可选地,所述检测试剂盒还包括探针,所述探针序列为 5
’‑
tgtttaggaagtctaatctc-3’(seq id no.5),其中,5’端带有fam 基团,3’端带有bhq1基团。
[0040]
可选地,所述检测试剂盒还包括逆转录酶和taq酶。
[0041]
可选地,所述检测试剂盒还包括ung酶。ung酶可以从单链或双链dna 中消除尿嘧啶,而对rna中的尿嘧啶和单一尿嘧啶分子则无任何作用,因此,使用ung酶和taq酶热启动,预防非特异性pcr扩增和污染,保证pcr结果的准确性。
[0042]
可选地,所述检测试剂盒还包括阳性质控品、阴性质控品、复溶液和内标质控品。
[0043]
可选地,所述阳性质控品为含目的检测基因的rna假病毒,所述阴性质控品为rnase free h2o,所述复溶液为稳定剂,所述稳定剂为procelin300等,所述内标质控品为含内标检测基因的rna假病毒。
[0044]
具体的,rna假病毒是非病毒rna被与病毒外型相同的蛋白质外壳包裹成的微生物颗粒,假病毒具有模拟真病毒结构、能够抵抗核酸酶降解、稳定、安全性高的特点,可以作为良好的质控品。
[0045]
具体的,阳性质控品的目的检测基因包括2019-ncov基因组l452r和t 478k突变位点序列(seq id no.1),和2019-ncov基因组orf1ab序列: tagtgctaaaccaccgcctggagatcaatttaaacacctcataccactta tgtacaaaggacttccttggaatgtagtgcgtataaagattgtacaaatg ttaagtgacacacttaaaaatctctctgacagagtcgtatttgtcttatg ggcacatggctttgagttgacatctatgaagtattttgtgaaaataggac ctgagcgcacctgttgtctatgtgatagacgtgccacatgcttttccact gcttcagacacttatgcctgttggcatcattctattggatttgattacgtc tataatccgtttatgattgatgttcaacaatggggttttacaggtaaccta caaagcaaccatgatctgtattgtcaagtccatggtaatgcacatgtagc ta(seq id no.16)。
[0046]
内标质控品含有的内标检测基因为人类基因组管家基因rnasep,序列为: atgggacttcagcatggcggtgtttgcagatttggacctgcgagcgggt tctgacctgaaggctctgcgcggacttgtggagacagccgctcaccttg gctattcagttgttgctatcaatcatatcgttgactttaaggaaaagaaa caggaaattgaaaaaccagtagctgtttctgaactcttcacaactttgc caattgtacagggaaaatcaagaccaattaaaattttaactagattaaca attattgtctcggatccatctcactgcaatgttttgagagcaacttcttc aagggcccggctctatgatgttgttgcagtttttccaaagacagaaaag cttt(seq id no.17)。
[0047]
可选地,所述内标检测基因为人类基因组管家基因rnasep。
[0048]
人类基因组管家基因rnasep的引物和探针序列如下:
[0049]
rnasep-f:5
’‑
agatttggacctgcgagcg-3’(seq id no.13);
[0050]
rnasep-r:5
’‑
gagcggctgtctccacaagt-3’(seq id no.14);
[0051]
rnasep-p:rox-5
’‑
ttctgacctgaaggctctgcgcg-3
’‑
bhq2(seqid no.15)。
[0052]
在一优选实施例中,所述检测试剂盒中的试剂为预混冻干粉形态,从而可以常温运输,节约了冷链运输的成本,且使用方便,操作时只需要将冻干粉溶解即可,省去了常规液体试剂盒中使用时多种成分的配置步骤。
[0053]
下面将结合具体实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0054]
实施例1引物设计
[0055]
分别针对2019-ncov的s基因l452r突变位点和t478k突变位点设计引物,并且以2019-ncov的orf1ab保守序列以及人类基因组管家基因rnasep 作为双内参,通过引物探针的筛选优化,得到扩增效率更高和特异性佳的引物对。
[0056]
其中,orf1ab基因的引物探针序列如下:
[0057]
orf1ab-f:5
’‑
cacatggctttgagttgacatct-3’(seq id no.10);
[0058]
orf1ab-r:5
’‑
gtctgaagcagtggaaaagcat-3’(seq id no.11);
[0059]
orf1ab-p:cy5-5
’‑
ataggacctgagcgcacctgttgtct-3
’‑
bhq3 (seq id no.12)。
[0060]
人类基因组管家基因rnasep的引物探针序列如下:
[0061]
rnasep-f:5
’‑
agatttggacctgcgagcg-3’(seq id no.13);
[0062]
rnasep-r:5
’‑
gagcggctgtctccacaagt-3’(seq id no.14);
[0063]
rnasep-p:rox-5
’‑
ttctgacctgaaggctctgcgcg-3
’‑
bhq2(seqid no.15)。
[0064]
l452r突变位点的引物探针序列如下:
[0065]
l452r突变位点上游引物序列:
[0066]
l452r-f1:f1:加粗并带下划线的为突变碱基;
[0067]
l452r-f2:f2:加粗并带下划线的为突变碱基,小写字母为人为引入的错配碱基;
[0068]
l452r突变位点下游引物及探针序列:
[0069]
452-r1:5
’‑
cagttgaaatatctctctcaaaaggt-3’(seq id no.4);
[0070]
452-p1:fam-5
’‑
tgtttaggaagtctaatctc-3
’‑
bhq1(seq idno.5)。
[0071]
t478k突变位点的引物探针序列如下:
[0072]
t478k突变位点上游引物序列:
[0073]
t478k-s-r1:r1:加粗并带下划线的为突变碱基;
[0074]
t478k-s-r2:r2:加粗并带下划线的为突变碱基,小写字母为人为引入的错配碱基。
[0075]
t478k突变位点下游引物及探针序列:
[0076]
478-s-f1:5
’‑
ctaaggttggtggtaattataattacc-3’(seq id no.8);
[0077]
452-p1:fam-5
’‑
tgtttaggaagtctaatctc-3
’‑
bhq1(seq idno.9)。
[0078]
用rt-pcr分别检测2019-ncov含l452r、t578k突变的假病毒(mutant, m)和未含l452r、t578k突变的假病毒(wild,w),其中l452r突变位点的rt-pcr反应液如表1所示,t578k突变位点的rt-pcr反应液如表2所示。
[0079]
表1 l452r的rt-pcr反应液
[0080]
成分pcr终浓度mgcl24mmdatp0.2mmdgtp0.2mmdctp0.2mmdutp0.4mmkcl70mmtris-hcl(ph 8.3)20mmbsa1mg/ml海藻糖1%(nh4)2so420mm甘油2%tritonx-1000.01%l452r-f1/l452r-f20.2mm452-r10.2mm452-p10.2mm
[0081]
表2 t478k的rt-pcr反应液
[0082][0083]
[0084]
酶混合液包括:2u的taq酶,0.5u的ung酶,20u的逆转录酶,12u 的rnase抑制剂。进行rt-pcr反应时,将rt-pcr反应液和酶混合液混合,用无菌无核酶水补足使每个反应的总体积达到20μl,最后加入5μl rna, rt-pcr扩增程序如表3所示。
[0085]
表3 rt-pcr扩增程序
[0086][0087]
实验结果
[0088]
检测结果如表4所示,扩增效率比较:arms引物分别扩增浓度为1.0e+03、 1.0e+04、1.0e+05、1.0e+06、1.0e+07、1.0e+08copies/ml的突变型模板(m),结果l452r-f1扩增效率与l452r-f2相当,t478k-s-r1扩增效率与t478k-s-r2 相当,说明l452r-f1和l452r-f2均可用于作为第一引物,t478k-s-r1和 t478k-s-r2均可作为第二引物。
[0089]
特异性比较:arms引物扩增野生型模板,不扩增或扩增后的ct值增大的引物特异性较好。δct为arms引物分别扩增浓度为1.0e+08copies/m的突变型模板(m)和野生型模板(w)的ct值的差值,结果l452r-f2特异性优于 l452r-f1,t478k-s-r2特异性优于t478k-s-r1,说明l452r-f2作为第一引物的检测效果优于l452r-f1,t478k-s-r2作为第二引物的检测效果优于 t478k-s-r1,因此,最终选择l452r-f2作为检测l452r和t578k突变位点的第一引物,t478k-s-r2作为第二引物,制备检测试剂盒用于检测新型冠状病毒的delta突变株。
[0090]
表4 l452r和t578k突变位点的引物设计筛选结果
[0091][0092]
实施例2试剂盒检测新型冠状病毒及其delta突变株
[0093]
将实施例1设计和筛选的引物以及酶混合液和其它rt-pcr反应物制备得到预混
rt-pcr检测冻干粉试剂作为检测试剂盒的一部分,预混rt-pcr检测冻干粉试剂的具体成分如表5所示,该检测试剂盒还包括上述实施例记载的阳性质控品、阴性质控品、复溶液procelin300、内标质控品。
[0094]
表5预混rt-pcr检测冻干粉试剂的具体成分
[0095][0096][0097]
用冻干试剂盒,分别检测2019-ncov含l452r、t578k突变的假病毒 (mutant,m)和未含l452r、t578k突变的假病毒(wild,w),具体包括以下步骤:
[0098]
(1)使用磁珠吸附法提取新冠病毒rna;
[0099]
(2)根据测试样本数,包括待测样本、1个阴性质控品和1个阳性质控品,计算并配置各反应混合液,将复溶液加入到冻干粉中使其充分溶解混匀;
[0100]
(3)将复溶物分装到不同的pcr反应管中,每个pcr管分装20μl;
[0101]
(4)分别往不同的pcr反应管中加入5μl待测样本、5μl阴性质控品、 5μl阳性质控品;
[0102]
(5)将各个反应管按一定顺序放入荧光pcr仪上进行荧光定量pcr检测,pcr扩增程序如表3所示;
[0103]
(6)荧光rt-pcr扩增结束后,根据fam通道、cy5通道和rox通道的ct值检测2019-ncov是否存在,若存在,可确定这种病毒是否为delta突变株,其检测结果判断方法如下:
[0104]
1、质量控制:
[0105]
1.1阴性质控品:fam和cy5通道无ct值或ct值》38,rox通道ct值≤38且扩增曲线呈s型;
[0106]
1.2阳性质控品:fam和cy5通道ct值≤33,rox通道ct值≤38,且扩增曲线呈s型;
[0107]
1.3以上要求需在同一次实验中同时满足,否则,本次实验无效,需重新进行。
[0108]
2、待测样品结果判定方式如表6所示。
[0109]
检测2019新型冠状病毒l452r和t478k突变型模板(1.0e+08copies/ml) 结果如图2所示,其中fam通道的ct值为21.39,cy5通道的ct值为21.35,扩增效率一致。
[0110]
检测2019新型冠状病毒l452r和t478k野生型模板(1.0e+08copies/ml) 结果如图3所示,其中cy5通道的ct值为21.35,fam通道无ct值,即当模板浓度≤1.0e+08copies/ml,arms引物对未突变模板无非特异性扩增。
[0111]
表6待测样品结果判定方式
[0112][0113]
实施例3比较液体试剂和冻干试剂的检测效果
[0114]
本实施例比较液体试剂和实施例2的冻干粉试剂制备的试剂盒的检测效果,分别检测2019-ncov含l452r、t578k突变的假病毒(mutant,m)。
[0115]
液体试剂包括rt-pcr反应液、酶混合液,其中rt-pcr反应液如表7所示。
[0116]
表7液体试剂盒的rt-pcr反应液成分
[0117]
[0118][0119]
酶混合液包括:2u的taq酶,0.5u的ung酶,20u的逆转录酶,12u 的rnase抑制剂。用液体试剂进行rt-pcr反应时,将rt-pcr反应液和酶混合液混合,用无菌无核酶水补足使每个反应的总体积达到20μl,最后加入5 μl rna。
[0120]
用实施例2的冻干粉试剂进行rt-pcr反应时,将复溶液加入到冻干粉中使其充分溶解混匀,然后将复溶物分装到pcr管中,每管20μl,最后加入5 μl rna。
[0121]
使用表3所示的扩增程序分别进行pcr扩增,结果如表8所示,用液体试剂和冻干粉试剂分别检测2019-ncov含l452r、t578k突变的假病毒 (mutant,m),结果液体试剂与冻干试剂的效果无差异,说明该试剂盒以冻干粉形态试剂制备效果不会受到影响,但是为预混冻干粉形态,可以常温运输,节约了冷链运输的成本,且使用方便,操作时只需要将冻干粉溶解即可,省去了常规液体试剂盒中使用时多种成分的配置步骤。
[0122]
表8液体试剂和冻干粉试剂的检测结果
[0123][0124]
[0125]
对比例1
[0126]
用实施例1筛选得到的双arms引物和专利《一种鉴定新型冠状病毒印度变种的qrt-pcr方法》(申请号:202110713012.9)中公布的检测l452r 和t478k的引物,比较两种方法的引物特异性。
[0127]
根据专利申请文件《一种鉴定新型冠状病毒印度变种的qrt-pcr方法》中公布的引物探针序列分别进行合成,其中l452r突变位点的上游引物序列为:5
’‑
gattctaaggttggtggtaattataattatcg-3’,下游引物序列为: 5
’‑
ggaaaccatatgattgtaaaggaaagtaac-3’;taqman探针的序列为: 5
’‑
ctatcaggccggtagcacaccttg-3’;t478k突变位点的上游引物序列为:5
’‑
tatcaggccggtaggaa-3’;下游引物序列为: 5
’‑
ttgctggtgcatgtagaagttc-3’;taqman探针的序列为: 5
’‑
ccaacccactaatggtgttggttaccaacc-3’。本次比较实验对l452r 和t478k的探针5’端分别标记了fam和vic,3’端标记了bhq1。
[0128]
本方案使用的第一引物为l452r-f2,第二引物为t478k-s-r2,taqman 探针为452-p1。
[0129]
配制反应体系:每个反应体系体积为25μl,其中含5x的rt-pcr反应液5μl,25x酶混合液1μl,10μm上游引物0.5μl,10μm下游引物0.5μl, 10μm taqman探针0.5μl,无菌无rnase水12.5μl,rna模板5μl。
[0130]
用本方案与对比文件的引物分别检测2019-ncov含l452r、t578k突变的假病毒(mutant,m)和未突变的假病毒(wild,w),pcr扩增程序如表 3所示,检测结果如表9所示。
[0131]
根据表9可知,两种方法检测浓度为1.0e+03、1.0e+04、1.0e+05、 1.0e+06、1.0e+07、1.0e+08copies/ml的突变型(m)模板时无显著差异;检测未突变型模板(w)时,本方案对浓度≤1.0e+08copies/ml的模板无非特异性扩增,而对比文件方案对浓度为1.0e+08/1.0e+07copies/ml的模板有非特异性扩增,只有当浓度≤1.0e+06copies/ml的模板时才没有非特异性扩增。
[0132]
表9本方案与对比方案的检测结果
[0133][0134]
综上可知,使用本方案的引物制备的试剂盒检测含l452r、t578k突变位点的delta突变株的特异性更高,并且本方案只需要使用一对引物进行扩增,且不需要根据扩增结果ct值的差值来判断是否存在突变,即可特异性地检测被测样本中的delta突变株,操作简便,成本低。
[0135]
以上所述仅为本发明的可选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1