一种检测藜麦茎腐病菌的引物组和试剂盒及其检测方法
1.本发明涉及植物病原菌检测技术领域,尤其涉及一种检测藜麦茎腐病菌的引物组和试剂盒及其检测方法。
背景技术:
2.黎麦起源于南美洲安第斯山脉,已有5000多年的栽培历史,又称藜谷、南美藜、昆诺阿藜等,整个生育期会受多种病虫害的侵染。目前报道的藜麦病害有分生孢子叶斑病、甲孢叶斑病或尾孢叶斑病、黑斑病、叶斑病、穗枯病、褐斑病、菌核病、叶霉病、霜霉病、黑茎病、病毒病、根腐病和炭疽病,其中茎腐病和叶斑病是中国藜麦危害最严重的病害。
3.黎麦茎腐病原菌主要侵染藜麦植株的茎杆和顶梢部分,症状初期为水浸状小斑点,环绕茎杆逐渐扩展,导致茎杆变褐色腐烂,形成软腐状。湿度大时,在茎杆上逐渐长出排列整齐、繁茂的真菌菌丝,顶部为黑色或深褐色的球状大型孢子囊和小型孢子囊。植株茎杆侵染后变褐色枯死并产生了大量的病菌孢子引起植株顶梢枯死。
4.藜麦叶斑病症状为圆形或近圆形斑点,直径1~4mm。斑点边缘为棕色,中心为黄色和白色,斑点上有小黑点,在疾病晚期有中央穿孔。主要的病原菌有藜钉孢,交链格孢菌、细极链格孢菌、芸薹链格孢菌,感病初期将会出现一些黄色或者斑点,后期逐渐变为一种褐色或深褐色螺纹状,严重时病斑中央将产生穿孔现象,病斑大小程度不一。
5.目前对植物真菌的检测有以下几种方法:采用半选择性培养基或液体培养基分离培养,但其结果易受其它杂菌的干扰,且需要进行再接种的生物学试验才能确定。幼苗生长法鉴定需要一个具有一定温湿度环境的温室,一个种子批至少种植10000株幼苗,如果有大量的样品需要鉴定时,工作量大,费时费力。最近发展起来的实时荧光pcr有较高的检测效率和灵敏度,但需要更昂贵的试剂和仪器,适合于相关的科学研究。
技术实现要素:
6.本发明的目的在于提供一种检测藜麦茎腐病菌的引物组和试剂盒及其检测方法,具有灵敏度高、特异性强、检测准确度高的优点,可用于藜麦茎腐病菌(叶片,茎段和土壤中)的检测,对藜麦茎腐病菌病害的早期快速检测、土壤病菌群体分布及病害的防治具有重要意义。
7.为了实现上述发明目的,本发明提供以下技术方案:
8.本发明提供了一种检测藜麦茎腐病菌的引物组,包括上游检测引物jp1和下游检测引物jp2;所述上游检测引物jp1的核苷酸序列如seq id no:1所示,所述下游检测引物jp2的核苷酸序列如seq id no:2所示。
9.jp1(seq id no:1):5
’‑
gttttccatagagtgggtgt-3’;
10.jp2(seq id no:2):5
’‑
gagtttcctccggcttattg-3’。
11.本发明提供了一种检测藜麦茎腐病菌的试剂盒,包括检测引物jp1/jp2和检测试剂。
12.进一步地,检测试剂包括2
×
pfu-pcr mastermix,通用引物its1/its4,检测引物jp1/jp2和ddh2o。
13.本发明还提供了利用所述引物组检测藜麦茎腐病菌的方法,包括以下步骤:
14.(1)提取样品的基因组dna;
15.(2)以步骤(1)中提取的基因组dna为模板,利用通用引物its1/its4进行第一轮pcr扩增,获得扩增产物;
16.(3)以步骤(2)中所述扩增产物为模板,利用所述检测引物进行第二轮pcr扩增,根据扩增结果判定样品中是否含有藜麦茎腐病菌,若扩增产物出现500bp大小的条带,则样品中存在藜麦茎腐病菌;否则,不存在。
17.进一步地,通用引物its1的核苷酸序列如seq id no:3所示,通用引物its4的核苷酸序列如seq id no:4所示。
18.its1(seq id no:3):5
’‑
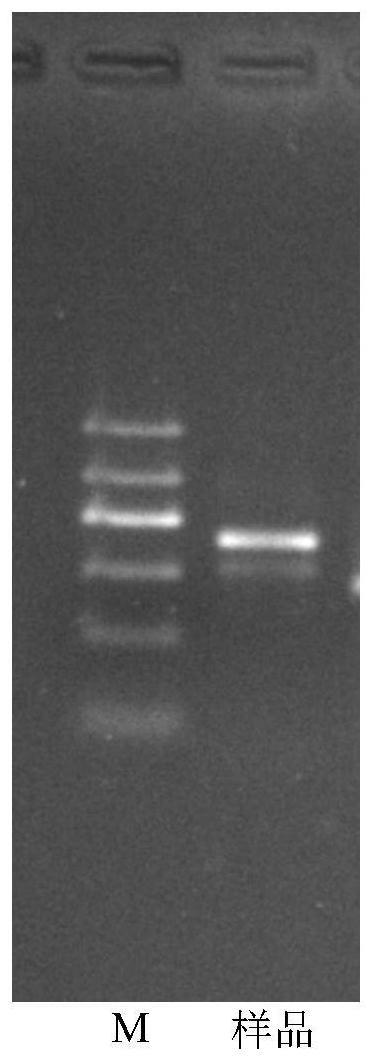
ggaagtaaaagtcgtaacaagg-3’;
19.its4(seq id no:4):5
’‑
tcctccgcttattgatatgc-3’。
20.进一步地,步骤(2)中第一轮pcr扩增的反应程序为:95℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸60s,变性、退火、延伸进行35个循环;72℃最终延伸5min。
21.进一步地,步骤(2)中第一轮pcr扩增的体系,以50μl计,包括以下组分:2
×
pfu-pcr mastermix 25μl,10μm的引物its1 2μl,10μm的引物its4 2μl,模板2μl,ddh2o 19μl。
22.进一步地,步骤(3)中第二轮pcr扩增的反应程序为:95℃预变性5min;94℃变性40s,55℃退火40s,72℃延伸60s,变性、退火、延伸进行35个循环;72℃最终延伸5min。
23.进一步地,步骤(3)中第二轮pcr扩增的体系,以50μl计,包括以下组分:2
×
pfu-pcr mastermix 25μl,10μm的引物jp1 4μl,10μm的引物jp2 4μl,模板4μl,ddh2o 13μl。
24.与现有技术相比,本发明具有以下有益效果:
25.(1)本发明利用真菌的通用引物its1和its4为引物,以藜麦茎腐病菌基因组dna为模板,扩增出茎腐病dna片段,然后通过藜麦上常见的几种真菌rdna-its区序列进行比对,根据序列差异,设计出对藜麦茎腐病菌基因组dna有高度特异性的一对引物,对常见的几种藜麦病原真菌基因组dna进行pcr扩增,只有以茎腐病病菌基因组dna为模板的反应体系中能扩增出一条500bp左右的特异性条带,其余菌株dna模板及清水对照均无扩增产物。并且利用特异性引物能从藜麦茎腐病菌叶片、茎段和土壤样品中扩增出特异性的条带。表明此特异性引物可以用于藜麦组织茎腐病菌的分子检测及病害的早期诊断。
26.(2)本发明所述试剂盒检测灵敏度高,可以检测到50-100fg/μl水平的茎腐病菌基因组dna。
27.(3)本发明所述检测引物特异性强,检测准确度高,可用于藜麦茎腐病菌(叶片,茎段和土壤中)的检测,对藜麦茎腐病菌病害的早期快速检测,土壤病菌群体分布及病害的防治具有重要意义。
附图说明
28.图1为茎腐病菌基因pcr电泳图;图中,泳道m:dna marker,标准分子量,dl-2000;
29.图2为实施例2中检测引物pcr的特异性电泳图;图中,泳道ck:以双蒸水为模板;泳道1~2:以木霉基因组dna为模板的两个重复样品;泳道3~4:以灰霉dna为模板的两个重复
样品;泳道5~7:以黑星霉基因组dna为模板的三个重复样品;泳道8~11:以茎腐病基因组dna为模板的四个重复样品;泳道m:dna marker,标准分子量,dl-2000;
30.图3为实施例3中检测引物pcr的灵敏度电泳图;图中,泳道1~5分别是检测引物浓度为50fg/μl,100fg/μl,1pg/μl,10pg/μl,100pg/μl的pcr扩增产物;泳道6:双蒸水对照;泳道m:dna marker,标准分子量,dl-2000;
31.图4为实施例4中从叶片、茎段和土壤中提取样本的pcr电泳图;图中,泳道1:致病菌对照;泳道2~3:叶片样品;泳道4~5:茎段样品;泳道6~7:土壤样品;泳道8:清水对照;泳道m:dna marker,标准分子量,dl-2000。
具体实施方式
32.本发明提供了一种检测藜麦茎腐病菌的引物组,包括上游检测引物jp1和下游检测引物jp2;所述上游检测引物jp1的核苷酸序列如seq id no:1所示,所述下游检测引物jp2的核苷酸序列如seq id no:2所示;具体如下:
33.jp1(seq id no:1):5
’‑
gttttccatagagtgggtgt-3’;
34.jp2(seq id no:2):5
’‑
gagtttcctccggcttattg-3’。
35.本发明提供了一种检测藜麦茎腐病菌的试剂盒,包括检测引物jp1/jp2和检测试剂。
36.在本发明中,检测试剂包括2
×
pfu-pcr mastermix,通用引物its1/its4,检测引物jp1/jp2和ddh2o。
37.在本发明中,2
×
pfu-pcr mastermix购买自上海生物工程股份有限公司。
38.在本发明中,通用引物的核苷酸序列具体如下:
39.its1(seq id no:3):5
’‑
ggaagtaaaagtcgtaacaagg-3’;
40.its4(seq id no:4):5
’‑
tcctccgcttattgatatgc-3’;
41.本发明还提供了一种利用所述引物组检测藜麦茎腐病菌的方法,包括以下步骤:
42.(1)提取样品的基因组dna;
43.(2)以步骤(1)中提取的基因组dna为模板,利用通用引物its1/its4进行第一轮pcr扩增,获得扩增产物;
44.(3)以步骤(2)中所述扩增产物为模板,利用所述的检测引物进行第二轮pcr扩增,根据扩增结果判定样品中是否含有藜麦茎腐病菌,若扩增产物出现500bp大小的条带,则样品中存在藜麦茎腐病菌;否则,不存在。
45.在本发明中,首先提取样品的基因组dna,提取方法参照上海生工真菌dna提取试剂盒的说明书。
46.本发明在获得所述样品的基因组dna后,以提取的基因组dna为模板,利用通用引物its1/its4进行第一轮pcr扩增,获得扩增产物。在本发明中,所述第一轮pcr扩增的反应程序优选为:95℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸60s,变性、退火、延伸进行35个循环;72℃最终延伸5min。所述第一轮pcr扩增的体系,以50μl计,包括以下组分:2
×
pfu-pcr mastermix 25μl,10μm的引物its1 2μl,10μm的引物its4 2μl,模板2μl,ddh2o 19μl。
47.在本发明获得所述扩增产物后,以所述扩增产物为模板,利用所述的检测引物
jp1/jp2进行第二轮pcr扩增;所述第二轮pcr扩增的反应程序优选为:95℃预变性5min;94℃变性40s,55℃退火40s,72℃延伸60s,变性、退火、延伸进行35个循环;72℃最终延伸5min。所述第二轮pcr扩增的体系,以50μl计,包括以下组分:2
×
pfu-pcr mastermix 25μl,10μm的引物jp1 4μl,10μm的引物jp2 4μl,模板4μl,ddh2o 13μl。
48.本发明在所述第二轮pcr扩增结束后,根据扩增结果判定样品中是否含有藜麦茎腐病菌,如果扩增产物出现500bp大小的条带,则样品中存在藜麦茎腐病菌;如果扩增产物没有出现500bp大小的条带,则样品中不存在藜麦茎腐病菌。
49.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
50.实施例1
51.本实施例提供了藜麦茎腐病原菌的提取方法,藜麦品种:陇藜1号;播期:5月;播种地点:北京延庆区永宁镇南山健原,土质为壤土。取病菌样品时间;7~8月。
52.将取自藜麦的病样进行病原菌分离,经过常规组织分离方法对病菌进行分离培养。再据柯赫法则将分离的病菌回接到藜麦叶片上,接种后10天到15天后,根据接种叶片产生相同病害症状并发现相同病斑时,判定为藜麦茎腐病菌。
53.供试菌株培养:将各菌株接种到马铃薯葡萄糖液体培养基中,28℃,145r/min振荡培养4~7d,抽滤收集菌丝体,然后置于干热灭菌箱中60℃烘干,-20℃冷冻保存备用。将菌种接种到琼脂培养基上,28℃,培养4~7d。
54.将分离病原菌株接种于pda平板上在28℃培养箱中培养5-7天,在无菌条件下收集菌丝100mg,提取病原菌基因组dna(参照上海生工真菌dna提取试剂盒的说明书),利用真核生物的通用引物its1和its4进行pcr扩增,其中its1和its4引物的序列分别为(5
’‑
ggaagtaaaagtcgtaacaagg-3’)和(5
’‑
tcctccgcttattgatatgc-3’)。pcr(50μl反应体系)条件如下:加入2倍pfu-pcr mastermix(pcr buffer,taq dna聚合酶)25μl,10μm的引物its1 2μl,10μm的引物its4 2μl,模板dna2μl,ddh2o 19μl。反应程序:95℃预变性3min,94℃变性30s,55℃30s,72℃延伸60s,变性、退火、延伸进行35个循环,72℃最终延伸5min,产物放在4℃保存。pcr产物送到上海生工进行测序,得到藜麦茎腐病菌的核苷酸序列如seq id no:5所示,茎腐病菌基因pcr电泳图如图1所示。测序结果在ncbi网站上的blast工具进行序列比对,dna序列经过ncbi的blast进行比对后的结果如下:
55.样品l2-1-2
56.source:phoma sp.kacc 42444(茎腐菌)
57.accession:ef600948
58.organism:eukaryota;fungi;dikarya;ascomycota;pezizomycotina;dothideomycetes;pleosporomycetidae;pleosporales;pleosporineae;didymellaceae;phoma.
59.同源性:100%。
60.实施例2引物特异性试验
61.本实施例提供了藜麦茎腐病原菌检测引物的特异性试验方法,以提取的所有藜麦茎腐病菌株基因组dna为模板,用通用引物its1/its4进行pcr扩增,pcr电泳检测,所有dna模板均能扩增出一条约500bp大小的目的条带,而ck(双蒸水)无扩增产物,说明所提取的基
因组dna模板符合扩增要求。用所设计的特异性引物jp1/jp2对所有菌株藜麦病原真菌(藜麦中的木霉,黑星霉和灰霉)的基因组dna进行pcr扩增,pcr(50μl反应体系)条件如下:加入2倍pfu-pcr mastermix(pcr buffer,taq dna聚合酶)25μl,10μm的引物jp1 4μl,10μm的引物jp2 4μl,模板dna4μl,ddh2o 13μl。反应程序:95℃预变性5min,94℃变性40s,55℃40s,72℃延伸60s,变性、退火、延伸重复35个循环,72℃最终延伸5min,产物放在4℃保存。电泳结果发现仅有藜麦茎腐病病菌基因组dna能扩增出一条500bp左右的特异性条带,与预计结果一致,其他藜麦病原真菌没有扩增出特异性带。结果如图2所示,所设计的引物具有相对的特异性,能够区别茎腐病菌与其它藜麦病原真菌。
62.实施例3
63.本实施例提供了藜麦茎腐病原菌检测引物的灵敏度试验方法,用特异性引物jp1/jp2对100pg/μl、10pg/μl、1pg/μl、100fg/μl和50fg/μl的藜麦茎腐病菌株基因组dna进行扩增,结果模板浓度为50fg/μl的pcr扩增产物中还能分辨出一条约500bp的特异性条带(图3),相当于50fg基因组dna。而双蒸水对照无明显的扩增产物。
64.实施例4
65.本实施例提供了从田间取含有茎腐病症状的藜麦叶片、茎段样品、藜麦种植土壤样品,以特异性引物jp1和jp2为引物进行pcr扩增进行茎腐病菌的检测,结果表明叶片、茎段和土样中都检测到了大约500bp的pcr片段(图4),说明藜麦叶片,茎段和土样中都有茎腐病菌存在,此jp1/jp2引物具有特异性,能够用于茎腐病菌的分子快速检测。
66.由以上实施例和实验例可知,本发明提供了一种检测藜麦茎腐病菌的引物组和试剂盒及其检测方法,具有灵敏度高、特异性强、检测准确度高的优点,可用于藜麦茎腐病菌(叶片,茎段和土壤中)的检测,对藜麦茎腐病菌病害的早期快速检测、土壤病菌群体分布及病害的防治具有重要意义。
67.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1