一种降低黄酒中尿素和氨基甲酸乙酯积累的菌株及其应用
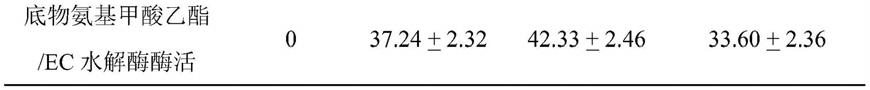
1.本发明涉及一种降低黄酒中尿素和氨基甲酸乙酯积累的菌株及其应用,属于酿酒及食品安全领域。
背景技术:
2.氨基甲酸乙酯(ethyl carbamate,ec)是广泛存在于发酵食品中的一种天然物质,由于ec被认为是一种对人类具有潜在遗传毒性和致癌性的化合物,已被国际癌症研究机构(iarc)列为2a类致癌物。许多发酵食品(如面包、酱油、泡菜)和发酵酒精饮料(如白酒、葡萄酒、黄酒)中都含有ec。在各类酒精饮料中,啤酒中ec含量极低且不易检测,而葡萄酒中ec平均含量为7 22μg/l。黄酒或清酒的平均含量为200~300μg/l。前人的研究表明,酒精饮料中ec的形成主要与其前体尿素有关,尿素是由酵母中精氨酸裂解产生的。由于尿素浓度直接影响ec含量。因此降低黄酒中尿素含量是减少ec积累的主要途径。
3.尿素一方面来源于原料中,另一方面主要是由saccharomyces cerevisiae代谢精氨酸所产生。s.cerevisiae是黄酒发酵中重要菌株,也是尿素产生的主要来源。因此大多数研究集中在s.cerevisiae。例如,通过抑制酿酒酵母中编码精氨酸酶的car1基因用于降低细胞质中尿素浓度。使用这种方法,与野生型菌株相比,ec的形成可以减少至少60%。但是这种方法浪费了培养基中的精氨酸,影响了产品的口感;过度表达dur1,2基因(编码尿素酰胺酶,可将尿素降解为氨)或dur3基因(编码尿素通透酶)是抑制ec含量的另一种方法。通过过度表达这些基因,尿素降解菌株产生的ec分别比原始菌株少87%和15%。然而,这种方法也可能会影响酒的味道。此外,加入现已上市的酸性尿素酶,可以有效去除黄酒中的尿素,间接抑制ec的形成。然而,脲酶对人体有害的镍离子的特殊要求限制了脲酶的利用。另一种酶是氨基甲酸酯酶,它可以直接催化葡萄酒产品中ec的分解。
4.虽然现在分子技术很成熟了,但经过改造的菌株可能会引起意想不到的问题。因此,急需得到一种在不破坏黄酒微生物系统的条件下,降低黄酒发酵中的尿素和ec含量的方法。
技术实现要素:
5.本发明提供了一株酿酒酵母(saccharomyces cerevisiae)g2,已于2021年11月02日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 20211359。
6.所述酿酒酵母(saccharomyces cerevisiae)g2是从来源于黄酒发酵醪样品中分离得到的,该菌株经测序分析,其its2序列如seq id no.1所示,将测序得到的序列在genbank中进行核酸序列比对,结果显示与酵母属的核酸序列相似度高达99%,根据同源性搜索结果,使用mega 7.0生物学软件对测试菌株和相关菌株的多个序列进行比对分析及neighbor-joining方法构建系统发育树,结果显示菌株属于酵母属的酿酒酵母,将其命名为酿酒酵母(saccharomyces cerevisiae)。
7.所述酿酒酵母(saccharomyces cerevisiae)g2在ypd固体培养基上的菌落呈乳白
色,圆形,边缘整齐。
8.本发明还提供了含有上述酿酒酵母(saccharomyces cerevisiae)g2的微生物制剂。
9.在本发明的一种实施方式中,所述微生物菌剂中,酿酒酵母(saccharomyces cerevisiae)g2的含量至少为:1
×
108cfu/ml。
10.本发明还提供了一种产品,所述产品中含有上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物菌剂。
11.在本发明的一种实施方式中,所述产品为食品、药品或化学品。
12.在本发明的一种实施方式中,所述产品中,酿酒酵母(saccharomyces cerevisiae)g2的含量至少为:1
×
108cfu/ml。
13.本发明还提供了一种发酵剂,所述发酵剂中含有上述酿酒酵母(saccharomyces cerevisiae)g2。
14.在本发明的一种实施方式中,所述发酵剂中还含有发酵乳杆菌(lactobacillus fermentum)。
15.本发明还提供了一种发酵剂,所述发酵剂中,酿酒酵母与发酵乳杆菌按照活菌数为(1
×
108~1
×
10
10
cfu/ml):(1
×
104~1
×
105cfu/ml)的比例进行配制。
16.在本发明的一种实施方式中,所述发酵乳杆菌为发酵乳杆菌cctcc no:m 20211358,已于2021年11月02日保藏于中国典型培养物保藏中心,命名为发酵乳杆菌(lactobacillus fermentum)d6。
17.在本发明的一种实施方式中,所述发酵剂中,活菌数含量至少为:1
×
104cfu/ml。
18.本发明还提供了一种降解尿素的方法,所述方法为,将上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂添加至含有尿素的环境中进行降解。
19.在本发明的一种实施方式中,所述酿酒酵母(saccharomyces cerevisiae)g2添加量至少为:1
×
108cfu/ml。
20.本发明还提供了一种降解氨基甲酸乙酯的方法,所述方法为,将上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂添加至含有氨基甲酸乙酯的环境中进行降解。
21.在本发明的一种实施方式中,所述酿酒酵母(saccharomyces cerevisiae)g2添加量至少为:1
×
108cfu/ml。
22.本发明还提供了一种酿造酒或蒸馏酒的制备方法,所述方法为,向原料中添加上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂,进行发酵制备得到酿造酒或蒸馏酒。
23.在本发明的一种实施方式中,所述方法具体为:向黄酒发酵醪中添加酿酒酵母(saccharomyces cerevisiae)g2、发酵乳杆菌及两株菌的混合。
24.在本发明的一种实施方式中,所述酿造酒或蒸馏酒包括黄酒、白酒、葡萄酒或果酒类。
25.本发明还提供了上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂在降低酿造酒或蒸馏酒中尿素和氨基甲酸乙酯积累中的应
用。
26.在本发明的一种实施方式中,将上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂添加至酿造酒或蒸馏酒的酿造过程中。
27.在本发明的一种实施方式中,所述酿造酒或蒸馏酒包括黄酒、白酒、葡萄酒或果酒类。
28.本发明还提供了上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂在模拟黄酒发酵中降低尿素和ec含量。
29.本发明还提供了上述酿酒酵母(saccharomyces cerevisiae)g2,或上述微生物制剂,或上述产品,或上述发酵剂在黄酒发酵中调控氨(胺)类有害物的应用。
30.有益效果
31.本发明提供了一株酿酒酵母(saccharomyces cerevisiae)g2,该酿酒酵母可降解尿素,和同时可产氨基甲酸乙酯水解酶的发酵乳杆菌(lactobacillus fermentum)d6,同时添加到黄酒发酵中,在经过前酵和后酵阶段,最终检测发酵结束后的黄酒中的尿素和氨基甲酸乙酯含量均比对照组有明显的降低,降低量分别为70.06和68.73%。
32.因此,本发明中的酿酒酵母(saccharomyces cerevisiae)g2实现了对混菌发酵食品体系内氨(胺)类有害物的有效减控,在传统发酵食品中具有重要应用前景。
33.生物材料保藏
34.一株酿酒酵母(saccharomyces cerevisiae),分类学命名为saccharomyces cerevisiae g2,已于2021年11月02日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 20211359,保藏地址为中国武汉,武汉大学。
35.一株发酵乳杆菌(lactobacillus fermentum),分类学命名为lactobacillus fermentum d6,已于2021年11月02日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 20211358,保藏地址为中国武汉,武汉大学。
附图说明
36.图1:酿酒酵母(saccharomyces cerevisiae)g2的发酵液中的脲酶的活性。
37.图2:酿酒酵母和发酵乳杆菌的菌落形态特征;其中,a为酿酒酵母(saccharomyces cerevisiae)g2在ypd上菌落形态特征,b为发酵乳杆菌(lactobacillus fermentum)d6在mrs培养基上菌落形态特征。
38.图3:酿酒酵母和发酵乳杆菌的pcr鉴定电泳结果图;其中,a为酿酒酵母(saccharomyces cerevisiae)g2(的pcr鉴定电泳结果图,b为发酵乳杆菌(lactobacillus fermentum)d6的pcr鉴定电泳结果。
39.图4:基于its ii和16s序列及neighbor-joining法构建的系统发育树,其中,a为酿酒酵母,b为发酵乳杆菌。
40.图5:酿酒酵母和发酵乳杆菌黄酒发酵中对尿素和ec含量的影响。
具体实施方式
41.下述实施例中所涉及的黄酒酿造过程当中的酒母由湖州老恒和公司提供(浙江,湖州),下述实施例中所涉及的麦曲购自湖州老恒和酿造有限公司。
42.下述实施例中所涉及的培养基如下:
43.ypd培养基:酵母粉10g/l,蛋白胨20g/l,葡萄糖20g/l,固体培养基额外添加2%琼脂;
44.初筛培养基:葡萄糖20g/l,ynb(无氨基酸和硫酸铵)1.74g/l,硫酸铵5g/l,尿素5g/l;
45.复筛培养基:葡萄糖20g/l,蛋白胨20g/l,酵母粉10g/l,尿素5g/l;
46.检测培养基:ynb合成培养基(无氨基酸和硫酸铵)1.74g/l,尿素0.6g/l,葡萄糖20g/l,用于检测尿素利用性能;
47.mrs分离培养基:蛋白胨10g/l,牛肉浸膏8g/l,酵母粉4g/l,葡萄糖20g/l,三水乙酸钠5g/l,柠檬酸铵2g/l,磷酸氢二钾2g/l,硫酸镁七水0.2g/l,硫酸锰一水0.04g/l,吐温80 1ml/l,筛选时添加0.4g/l纳他霉素,固体培养基额外添加2%琼脂;
48.lb分离培养基:胰蛋白胨10g/l,酵母提取物5g/l,nacl 10g/l,纳他霉素100mg/l,121℃灭菌20min;
49.ynb(添加2%葡萄糖及氨基酸)培养基:ynb(无氨基酸和硫酸铵)1.74g/l,尿素或氨基甲酸乙酯5g/l,葡萄糖20g/l。
50.筛选培养基:胰蛋白胨10g/l,酵母提取物5g/l,nacl 10g/l,5g/l尿素或5g/l氨基甲酸乙酯,5mg/l溴甲酚紫。
51.上述培养基的灭菌条件均为115℃,15min。
52.下述实施例中所涉及的检测方法如下:
53.尿素和ec检测方法
54.尿素检测方法采用柱前衍生高效液相色谱荧光检测器(hplc-fld)对发酵液中尿素含量进行检测。具体操作:400μl样品,600μl 0.02mol/l占吨氢醇,100μl 1.5mol/l盐酸溶液,避光反应30min。
55.ec的浓度通过气相色谱质谱联用(gs/ms)测定。具体操作:取2ml样品,加入100μld5-氨基甲酸乙酯(内标),混匀,与gc-ms检测。
56.脲酶或ec水解酶活性检测
57.取经适当稀释后的酶液200μl,添加到含有800μl,340mm ec(或500mm尿素)的柠檬酸-磷酸氢二钠缓冲液中(50mm,ph 4.5),混匀后,在37℃条件下反应20min。立即加入1ml终止剂,振荡混匀后,再依次加入1ml显色剂i,1ml显色剂ii。再次混匀后,于37℃继续反应20min。于625nm下检测吸光度值。而后根据所绘制的氨离子标准曲线,计算反应体系所生成的氨的量,以此来计算酶活。其中,显色剂i为:15g苯酚和0.625g亚硝基铁氰化钠,超纯水溶解并定容至250ml。显色剂ii为:13.125g naoh和7.5ml次氯酸钠,超纯水溶解并定容至250ml。
58.酶活定义为在常压、37℃及ph 4.5条件下,每分钟分解1μmol ec或尿素所需要的酶量做为一个酶活力单位。
59.下述实施例中所涉及的分子生物学鉴定方法如下:
60.its2和16s rdna基因的pcr扩增与序列测定:以提取的基因组dna为模板扩增its2 rdna,以its2通用pcr引物f:(5'-gcatcgatgaagaacgcagc-3')和r:(5'-tcctccgcttattgatatgc-3')扩增its2区域序列350bp,以16s通用引物27f:(5
′‑
agagtttgatcctggctcag-3
′
)和1492r(5
′‑
ggttaccttgttacgactt-3
′
),扩增16s rdna基因1500bp。pcr扩增条件:94℃预变性3min,94℃变性1min,55℃退火1min,72℃延伸2min,30个循环;72℃再延伸10min。反应体系(50μl):10umol/l上下游引物各1μl,100-200ng/μl dna模板1μl,2x pfu pcr master mix 25μl,双蒸水22μl。pcr扩增产物在1%的琼脂糖凝胶电泳检测,在紫外成像系统上拍照分析,结果如图3a~b所示,其中,酵母g2(a)和乳酸菌d6(b);分子量大小与预测大小一致。将验证后的pcr扩增产物送至生工生物工程(上海)股份有限公司测序分析。
61.下述实施例中所涉及的挥发性物质含量的检测方法
62.将黄酒酒精度稀释至6%vol,取6ml稀释后黄酒液,加入到20ml顶空瓶中,加2.0g nacl,7.4ul内标(10mg/l叔戊醇)。使用50/30μm dvb/car/pdms萃取头(使用前250℃老化30min),50℃下吸附40min,250℃解吸7min,用于gc-ms测定。
63.色谱条件:色谱柱tg-waxms(60m
×
0.25μm
×
0.25mm),进样口温度250℃。程序升温:50℃保持2min,3℃/min升温至145℃,15℃/min升温至230℃,保持15min。载气:高纯氦气(》99.999%),分流,流速为1.0ml/min。
64.ms条件:离子化方式ei,发射电流25μa,电子能量70ev,离子源温度为260℃传输线温度230℃,扫描范围29~350amu。
65.实施例1:酿酒酵母(saccharomyces cerevisiae)g2的筛选和分离
66.预筛:称取1g黄酒发酵醪样品与无菌ep管中,用1ml无菌生理盐水充分混匀,稀释至合适倍数后取100μl,涂布于含有尿素为唯一氮源的ynb固体培养基中,置于30℃恒温培养箱中培养,直至平板上长出单菌落,采用qpix420生物筛选系统挑取或手动挑取。
67.初筛:用微生物筛选系统qpix420或手动挑选将预筛平板上单菌落转接至含有初筛培养基的48孔板中,然后于孔板摇床中,在30℃,220r/min条件下培养48h,将48孔板3500r/min离心5min,取80μl上清液于96pcr板中,加入20μl二乙酰一肟硫胺脲和100μl磷酸高铁铵溶液,100℃反应10min,反应结束冷却至室温用酶标仪检测吸光度值od
525
。选择吸光度值低的进行摇瓶复筛。
68.最终得到一株酵母g2。
69.得到的菌株的菌落形态特征如图2a所示。
70.实施例2:产脲酶和ec水解酶菌株乳酸菌d6的筛选
71.初筛:称取1g黄酒发酵醪与无菌ep管中,取1ml无菌生理盐水充分混匀,稀释至合适倍数后取100μl涂布于分离培养中,于37℃恒温培养箱中培养数天直至长出单菌落。利用qpix420筛选系统进行筛菌,将单菌落挑取至装有筛选培养基的48孔板中,于37℃厌氧培养数小时。由于脲酶或ec水解酶可与相应的底物反应产生氨,使溴甲酚紫由紫色变为黄色,根据颜色反应,选取初筛目的菌株。
72.复筛:选取初筛的目的菌株接种于mrs培养基中培养72h,取菌液于冷冻离心机中,4℃,10000rpm,离心10min,收集上清,获取粗酶。
73.最终得到一株乳酸菌d6。
74.同时筛选得到菌株a1,菌株d6,菌株d1,菌株d7,菌株d9。
75.得到的菌株的菌落形态特征如图2b所示。
76.实施例3:系统发育树的构建
77.使用blast将酿酒酵母g2的its2(核苷酸序列如seq id no.1所示)和乳酸菌d616s rdna(核苷酸序列如seq id no.2所示)测序结果在ncbi上比对,根据同源性搜索结果,使用mega 7.0生物学软件对测试菌株和相关菌株的多个序列进行比对分析及neighbor-joining方法构建系统发育树。结果见图4a~b。
78.结果表明,酵母g2与酿酒酵母(saccharomyces cerevisiae)的its2 rrna序列同源性最高,相似度达到99%。
79.乳酸菌d6与发酵乳杆菌(lactobacillus fermentum)的16s rrna序列同源性最高,相似度达到99%。
80.使用分子软件mega7.0与酵母g2和乳酸菌d6相似度较高的10株菌株进行多序列比对分析,并利用neighbor-joining方法构建系统发育树。
81.由图4可以看出,酵母g 2与酿酒酵母同源性最高,鉴定为酿酒酵母(s.cerevisiae),乳酸菌d6与发酵乳杆菌同源性最高,鉴定为发酵乳杆菌(l.fermentum),并分别送至保藏单位进行保藏。
82.按照上述方法,对菌株a 1,d 1,d 7,d 9进行鉴定,结果显示,菌株a 1为:副干酪乳杆菌lactobacillus paracasei,命名为:副干酪乳杆菌lactobacillus paracasei a 1;菌株d 1为:副干酪乳杆菌lactobacillus paracasei,命名为副干酪乳杆菌lactobacillus paracasei d 1;菌株d 7为:发酵乳杆菌lactobacillus fermentum,命名为:发酵乳杆菌lactobacillus fermentum d 7;菌株d 9为:副干酪乳杆菌lactobacillus paracasei,命名为:副干酪乳杆菌lactobacillus paracasei d 9。
83.实施例4:酿酒酵母降解尿素实验
84.具体方法如下:
85.(1)将保藏的酿酒酵母(saccharomyces cerevisiae)g2添加至ypd培养基中,在30℃条件下培养12h,制备得到种子液;
86.(2)将制备得到的种子液按照1%(v/v)的添加量,添加至ynb(添加2%葡萄糖及氨基酸)培养基中,分别向培养基中添加终浓度为5g/l的尿素(得到培养体系1)、终浓度为5g/l的氨基甲酸乙酯(得到培养体系2),分别得到培养体系;
87.(3)将培养体系1在30℃、220r/min摇床培养72h后,检测脲酶的活性为193
±
0.28u/mg(如图1所示)。
88.(4)将培养体系2在30℃、220r/min摇床培养144h;分别在72h,96h,120h,144h时检测培养体系中的ec水解酶的活性,结果如表1所示。
89.表1:不同培养时间得到的ec水解酶的活性
[0090][0091][0092]
结果显示,本发明的酿酒酵母g2能够发酵生成脲酶和ec水解酶。
[0093]
实施例5:发酵菌剂的制备
[0094]
具体步骤如下:
[0095]
(1)酿酒酵母的培养
[0096]
将酿酒酵母s.cerevisiae g 2接种至ypd固体培养基中,在30℃条件下进行培养48h,然后将无菌水倒入上述培养基中,刮出板上的细胞,收集菌体。
[0097]
(2)发酵乳杆菌的培养
[0098]
将发酵乳杆菌l.fermentum d 6接种至mrs固体培养基中培养,在37℃条件下进行培养48~72h,然后将无菌水倒入上述培养基中,刮出板上的细胞,收集菌体。
[0099]
(3)发酵菌剂的制备
[0100]
将步骤(1)收集到的酿酒酵母s.cerevisiae g 2菌体接种于ypd固体培养基上进行活化,30℃培养48h,将0.85%(w/v)的无菌nacl溶液倒在上述培养基上,刮除板上的细胞,分散,血细胞计计数,此时,酿酒酵母s.cerevisiae g 2活菌数为:1
×
109cfu/ml。
[0101]
将步骤(1)收集到的发酵乳杆菌l.fermentum d 6菌体接种于mrs固体培养基上进行活化,37℃培养48~72h,将0.85%(w/v)的无菌nacl溶液倒在上述培养基上,刮除板上的细胞,分散,血细胞计计数,此时,发酵乳杆菌l.fermentum d 6的活菌数为:1
×
105cfu/ml。
[0102]
实施例6:筛选菌株在黄酒发酵中的应用
[0103]
本实施例所涉及的菌株的培养是按照实施例5的方法培养制备得到的。
[0104]
具体步骤如下:
[0105]
(1)将糯米(100g)在25℃下浸泡在水中(糯米:水=1:1(w/v))48~72h。然后洗涤并蒸锅蒸25分钟。
[0106]
(2)发酵醪的制备:
[0107]
实验具体分为四组:
[0108]
(i)麦曲以10%(相对于糯米,w/v),酒母以7%(相对于糯米,w/v)与蒸米混合均匀进行发酵(对照组),制备得到发酵醪1;
[0109]
(ii)麦曲10%,酒母7%(相对于糯米,w/v),酿酒酵母s.cerevisiae g2与蒸米混合均匀进行发酵;其中,添加的酿酒酵母s.cerevisiae g2的活菌数为:1
×
108cfu/ml,制备得到发酵醪2;
[0110]
(iii)麦曲10%,酒母7%(相对于糯米,w/v),发酵乳杆菌l.fermentum d6与蒸米混合均匀进行发酵;其中,添加的发酵乳杆菌l.fermentum d6的活菌数为:1
×
105cfu/ml,制备得到发酵醪3;
[0111]
(iv)麦曲10%,酒母7%(相对于糯米,w/v),酿酒酵母s.cerevisiae g2和发酵乳杆菌l.fermentum d6与蒸米混合均匀进行发酵;其中,酿酒酵母s.cerevisiae g2的活菌数为:1
×
108cfu/ml,发酵乳杆菌l.fermentum d6的活菌数为:1
×
105cfu/ml,制备得到发酵醪4;
[0112]
(3)发酵:
[0113]
前发酵:分别将步骤(2)制备的发酵醪1~4在30℃下,静置发酵5~6天以完成前发酵;
[0114]
后发酵:前发酵结束后,分别将各组的温度降到15℃,并且在15℃条件下进行25天的后酵。
[0115]
发酵结束后,过滤发酵醪,分别将各组制备得到的滤液(黄酒),在4℃下保存以便进一步分析。所有这些程序一式三份。
[0116]
(4)分别检测制备得到的黄酒当中的尿素和ec的含量,结果如表2及图5所示:
[0117]
表2:不同组的黄酒当中的尿素和ec的含量
[0118][0119]
结果显示,与对照组比较,i、ii、iii中尿素含量分别降低了80.00%、70.06%和94.16%,ec浓度分别降低了60.32%、68.73%和77.71%。
[0120]
因此,强化功能菌株对降低黄酒发酵过程中所产生的尿素和ec浓度是有效的。
[0121]
实施例7:模拟发酵样品的挥发性化合物质检测
[0122]
具体实施方式同实施例6,分别将各组制备得到的滤液(黄酒)进行挥发性物质检测,挥发性化合物采用hs-spme-gc-ms联用技术鉴定,对黄酒中的主要的挥发性化合物的进行定量分析,如表3所示。
[0123]
表3:不同组制备得到的黄酒中的挥发性化合物的含量
[0124]
[0125][0126]
注:n.d表示没有检测到。
[0127]
主要挥发性化合物包括12种醇类、14种酯类、1种酮类、4种酸类和3种醛类。由结果
分析知,强化发酵剂提高了乙酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸等挥发性化合物的含量,尤其是混合强化发酵剂黄酒中(iii)。
[0128]
结果显示:可以增香的酯类物质,如乙酸乙酯、己酸乙酯、辛酸乙酯等含量有显著增加。乙醇含量也有所递增。
[0129]
这些结果反映了黄酒中微生物群落与挥发性化合物之间的复杂关系,说明风味物质的产生是微生物与生化反应协同作用的结果。黄酒香气和风味的形成归因于黄酒酿造过程中糖化剂和液化剂产生的各种代谢产物。
[0130]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1