修复皮肤屏障的肽及制备化妆品的用途的制作方法
1.本发明属于化妆品领域,具体涉及一种修复皮肤屏障的肽及制备化妆品的用途。
背景技术:
2.皮肤是人体的第一道防线,具有重要的屏障功能,可以保护机体免受各种物理、化学及微生物等外界环境因素侵袭。这道屏障还是个多功能屏障,包括物理屏障、微生物屏障、色素屏障、抗氧化屏障、神经屏障和免疫屏障等。其中物理屏障最重要,是其他屏障的基础,它主要依赖的是由角质形成细胞为主的表皮。
3.角质形成细胞是表皮的主要构成细胞,数量占表皮细胞的80%以上,角质形成细胞的增殖和迁移活性直接关系到皮肤屏障功能的维持和受损后的修复。
4.人表皮角质形成细胞(hacat细胞)源自一位62岁患有黑色素瘤男性的病灶外围正常皮肤,目前已经成为表皮屏障功能研究最为常用的细胞。
5.随着绿色健康理念的深入人心,化妆品活性成分也更多地强调绿色、环保、健康、有效。天然成分在化妆品中的应用越来越常见。在诸多天然成分中,蛋白是含量相对较丰富的一种物质,其存在于植物、动物和微生物中,且易于获得。但是,蛋白是无法直接用作化妆品活性成分的,因为其分子量过大,皮肤细胞根本无法吸收。蛋白的酶解研究应运而生。然后,蛋白酶解的研究难度显然较大,因为一方面酶解过程不太容易精准控制,另一方面得到的酶解肽的高级结构通常被破坏而缺乏活性。
技术实现要素:
6.本发明目的在于克服现有技术不足,提供一种修复皮肤屏障的肽及制备化妆品的用途。
7.本发明上述目的通过如下技术方案实现:
8.一种酶解肽,通过如下步骤制备:
9.步骤1、总蛋白的提取
10.将大苞鸢尾的种子粉末用二氯甲烷热回流脱脂,干燥;将脱脂种子粉末加入蒸馏水加热提取,控制ph值为8.0;收集提取液,先过滤再离心,收集上清液并调节ph值至4.7,离心收集沉淀,蒸馏水复溶、透析,冷冻干燥,得到总蛋白;
11.步骤2、酶解
12.将总蛋白加入蒸馏水,55℃保温,调节ph值至8.5,加入碱性蛋白酶,酶解5h;酶解结束后,沸水灭酶,冷却至常温,离心,取上清,冷冻干燥得酶解粗品;
13.步骤3、超滤
14.将酶解粗品用蒸馏水复溶,依次采用截留相对分子质量为5kda和3kda的超滤膜进行超滤,收集3~5kda的组分,冷冻干燥得酶解肽。
15.优选地,蒸馏水提取总蛋白时的提取温度为65℃。
16.优选地,离心条件为10000r/min离心20min。
17.优选地,碱性蛋白酶加入质量为底物质量的2%。
18.优选地,酶解时每20min测定并调节1次ph值。
19.上述任一酶解肽用于制备促进皮肤屏障修复的化妆品的用途。
20.有益效果:
21.本发明提供一种大苞鸢尾种子酶解肽,活性研究结果发现该酶解肽既可以促进人角质形成细胞hacat细胞增殖,又可以促进hacat细胞迁移,而角质形成细胞的增殖和迁移活性直接关系到皮肤屏障功能的维持和受损后的修复,因此,本发明提供的酶解肽具有促进皮肤屏障修复活性的作用,可以用于开发制备促进皮肤屏障修复的化妆品。
附图说明
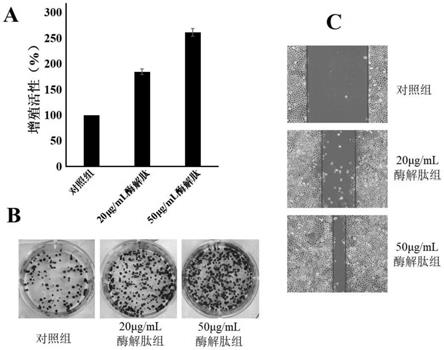
22.图1为酶解肽的sem图;图2为酶解肽的氨基酸组成;图3为活性结果,其中a为mtt测定的增殖活性,b为克隆形成结果,c为细胞迁移测定结果。
具体实施方式
23.下面结合实施例具体介绍本发明实质性内容,但并不以此限定本发明的保护范围。
24.实施例1:酶解肽的制备
25.1、材料
26.收集鸢尾科鸢尾属植物大苞鸢尾(iris bungei maxim.)的种子,干燥后粉碎,过40目筛。
27.碱性蛋白酶(200u/mg)购自上海源叶生物科技有限公司。
28.调节ph用氢氧化钠和盐酸等试剂均为分析纯。
29.2、方法
30.2.1总蛋白的提取
31.将大苞鸢尾的种子粉末按照料液比1:2.5(kg/l)加入二氯甲烷进行脱脂,热回流提取3次,每次2.5h。将干燥的脱脂种子粉末按照料液比1:5(kg/l)加入蒸馏水于65℃加热提取3h,控制ph值为8.0(每20min测定并调节1次ph值)。收集提取液,先过滤再离心,离心条件为10000r/min离心20min,收集上清液并调节ph值至4.7(大苞鸢尾种子蛋白的等电点),10000r/min离心20min收集沉淀,蒸馏水复溶、透析,冷冻干燥,得到总蛋白。
32.2.2酶解
33.将总蛋白按照料液比1:20(g/ml)加入蒸馏水,水浴至55℃保温,调节ph值至8.5,加入碱性蛋白酶,碱性蛋白酶质量为底物质量的2%,酶解5h,酶解过程中每20min测定并调节1次ph值;酶解结束后,沸水灭酶10min,冷却至常温,10000r/min离心20min,取上清,冷冻干燥得酶解粗品。
34.2.3超滤
35.将酶解粗品用蒸馏水复溶,依次采用截留相对分子质量为5kda和3kda的超滤膜进行超滤,收集3~5kda的组分,冷冻干燥得酶解肽。
36.3、结果
37.酶解肽的sem图如图1所示,氨基酸组成测定结果如图2所示,甘氨酸、赖氨酸、天冬
氨酸、谷氨酸、丙氨酸和脯氨酸占比较高。
38.实施例2:促进皮肤屏障修复活性
39.1、材料
40.永生化人角质形成细胞(hacat)购自atcc。
41.酶解肽按实施例1方法制备。
42.2、方法
43.2.1细胞培养
44.将hacat细胞用含有10%胎牛血清和1%双抗的dmem培养基在37℃、5%co2、饱和湿度下培养,按常规方法消化传代。取对数生长期细胞用于试验。
45.2.2细胞增殖活性—mtt法
46.取对数生长期的hacat细胞,消化后用含有10%胎牛血清和1%双抗的dmem培养基制成细胞悬液,细胞浓度为2
×
105/ml,接种于96孔板,每孔100μl,在37℃、5%co2、饱和湿度下培养。12h后,药物组更换为含有20、50μg/ml酶解肽的dmem完全培养基培养,同时设置不加酶解肽培养的细胞为对照组,以及不含细胞的培养液为空白组。继续培养48h后,每孔加入20μl浓度为5mg/ml的mtt溶液,孵育4h,弃上清液,每孔加入150μl dmso,振荡使结晶物充分溶解,测定各孔490nm波长下od值,根据公式计算药物组细胞增殖活性:增殖活性(%)=(od药物组-od空白组)/(od对照组-od空白组)
×
100%。对照组细胞增殖活性相当于100%。每个浓度3个复孔。
47.2.3细胞增殖活性—克隆形成实验
48.取对数生长期的hacat细胞,消化后用含有10%胎牛血清和1%双抗的dmem培养基制成细胞悬液,接种于6孔板中并分散均匀,每孔1000个细胞,在37℃、5%co2、饱和湿度下培养。6h后,药物组更换为含有20、50μg/ml酶解肽的dmem完全培养基培养,同时设置不加酶解肽培养的对照组。14d后终止培养,弃去细胞培养液,pbs洗涤两次。用甲醇固定细胞30min,随后用0.1%结晶紫染色20min。倒置显微镜下观察各组克隆数并拍照。
49.2.4细胞迁移活性
50.取对数生长期的hacat细胞,消化后用含有10%胎牛血清和1%双抗的dmem培养基制成细胞悬液,细胞浓度为2.5
×
105/ml,接种于6孔板,每孔2ml,在37℃、5%co2、饱和湿度下培养。12h后,使用无菌枪头在孔中央划痕,pbs冲洗3次去除划痕区残留细胞,药物组更换为含有20、50μg/ml酶解肽的dmem完全培养基培养,同时设置不加酶解肽培养的对照组。继续培养6h后,倒置显微镜下观察划痕区大小并拍照。
51.3、结果
52.mtt测定结果如表1和图3中a所示,克隆形成实验结果如图3中b所示,通过mtt测定结果和克隆形成实验结果可以发现,不同浓度的酶解肽均有效促进hacat细胞增殖,且高浓度酶解肽的促增值效果更优。细胞迁移活性测定结果如图3中c所示,不同浓度的酶解肽均有效促进hacat细胞迁移,划痕区明显收缩,且高浓度酶解肽的促迁移效果更优。
53.表1mtt测定结果
54.组别对照组20μg/ml酶解肽50μg/ml酶解肽增殖活性100%(184.7
±
5.5)%(261.5
±
7.3)%
55.通过实施例2活性研究结果可知,实施例1制备的酶解肽既可以促进人角质形成细
胞hacat细胞增殖,又可以促进hacat细胞迁移,而角质形成细胞的增殖和迁移活性直接关系到皮肤屏障功能的维持和受损后的修复,因此,实施例1制备的酶解肽具有促进皮肤屏障修复活性的作用,可以用于开发制备促进皮肤屏障修复的化妆品。
56.上述实施例的作用在于具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于该具体实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1