一种谷草转氨酶测定试剂、试剂球的制备方法及测定芯片与流程
1.本技术实施例涉及检测试剂技术领域,尤其涉及一种谷草转氨酶测定试剂、试剂球的制备方法及测定芯片。
背景技术:
2.谷草转氨酶广泛分布于多种器官和组织,主要集中在肝脏,心脏和肾脏。谷草转氨酶在心肌细胞中含量最高,当心肌细胞受到损伤时,大量的酶释放入血,使血清含量增加,临床一般常作为心肌梗塞和心肌炎的辅助检查。
3.但是,目前临床上用于测定谷丙转氨酶的试剂大多检测准确度不够高,对于临床使用参考意义有较大的局限性。
技术实现要素:
4.本技术实施例提供一种谷草转氨酶测定试剂、试剂球的制备方法及测定芯片,测定结果准确度较高。
5.第一方面,本技术实施例中提供了一种谷草转氨酶测定试剂,其特征在于,包括以下组分:
[0006][0007]
在一些实施例中,所述缓冲液包括三羟甲基氨基甲烷缓冲液、盐酸缓冲液和咪唑缓冲液中的至少一种。
[0008]
在一些实施例中,所述稳定剂包括牛血清白蛋白、甘油和胆酸钠中的至少一种。
[0009]
在一些实施例中,所述赋形剂包括海藻糖、葡聚糖1万、葡聚糖4万和蔗糖中的至少一种。
[0010]
在一些实施例中,所述所述表面活性剂一般采用曲拉通x-100。
[0011]
在一些实施例中,所述谷草转氨酶测定试剂呈球状,体积在3.0ul-3.5ul之间。
[0012]
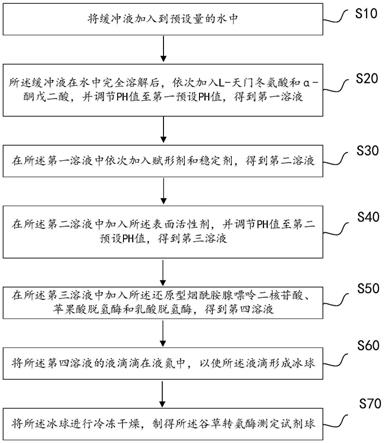
第二方面,本技术实施例中提供了一种谷草转氨酶测定试剂球制备方法,步骤如下:
[0013]
将缓冲液加入到预设量的水中;
[0014]
所述缓冲液在水中完全溶解后,依次加入l-天门冬氨酸和α-酮戊二酸,并调节ph值至第一预设ph值,得到第一溶液;
[0015]
在所述第一溶液中依次加入赋形剂和稳定剂,得到第二溶液;
[0016]
在所述第二溶液中加入所述表面活性剂,并调节ph值至第二预设ph值,得到第三溶液;
[0017]
在所述第三溶液中加入所述还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶和乳酸脱氢酶,得到第四溶液;
[0018]
将所述第四溶液的液滴滴在液氮中,以使所述液滴形成冰球;
[0019]
将所述冰球进行冷冻干燥,制得所述谷草转氨酶测定试剂球。
[0020]
在一些实施例中,所述第一预设ph值的范围为7.5-7.7。
[0021]
在一些实施例中,所述第二预设ph值的范围为7.8-8.0。
[0022]
第三方面,本技术实施例中还提供了一种谷草转氨酶测定芯片,所述谷草转氨酶测定芯片包括芯片本体和所述谷草转氨酶测定试剂,其中,所述谷草转氨酶测定试剂设置于所述芯片本体内部。
[0023]
本技术实施例的有益效果是:区别于现有技术,本技术实施例提供的谷草转氨酶测定试剂包括:缓冲液、l-天门冬氨酸、α-酮戊二酸、赋形剂、稳定剂、表面活性剂、还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶以及d-乳酸脱氢酶。该谷草转氨酶测定试剂包含有效的稳定剂成分,提高了测定试剂中酶和还原型烟酰胺腺嘌呤二核苷酸的稳定性,在很大程度上提高了测定结果的准确度。
附图说明
[0024]
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图作简单地介绍。显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0025]
图1为本技术一实施例提供的谷草转氨酶测定试剂球的制备方法的流程示意图;
[0026]
图2为本技术一实施例提供的谷草转氨酶测定芯片的临床相关性分析图;
[0027]
图3为本技术一实施例提供的谷草转氨酶测定芯片的线性范围分析图。
具体实施方式
[0028]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0029]
需要说明的是,如果不冲突,本发明实施例中的各个特征可以相互组合,均在本发明的保护范围之内。另外,虽然在装置示意图中进行了功能模块的划分,在流程图中示出了逻辑顺序,但是在某些情况下,可以以不同于装置示意图中的模块划分,或流程图中的顺序执行所示出或描述的步骤。
[0030]
除非另有定义,本说明书所使用的所有的技术和科学术语与属于本发明的技术领
域的技术人员通常理解的含义相同。本说明书中在本发明的说明书中所使用的术语,例如“第一”、“第二”、“第三”等,只是为了描述具体的实施方式的目的,不是用于限制本发明。本说明书所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0031]
本技术实施例提供的谷草转氨酶测定试剂的检测原理如下:检测样本与谷草转氨酶测定试剂接触,谷草转氨酶催化l-天冬氨酸的氨基转移与苹果酸脱氢酶催化的反应偶联,使还原型烟酰胺腺嘌呤二核苷酸氧化成氧化型烟酰胺腺嘌呤二核苷酸。还原型烟酰胺腺嘌呤二核苷酸在340nm处有特异吸收峰,其被氧化的速率与样本中的谷草转氨酶的活性成正比,在340nm处测定原型烟酰胺腺嘌呤二核苷酸下降速率,即可测出谷草转氨酶活性,进而确定谷草转氨酶的浓度。
[0032]
为了便于读者理解本发明,下面结合具体的实施例进行说明。
[0033]
本技术实施例提供一种谷草转氨酶测定试剂,包括以下组分:
[0034][0035]
在一些实施例中,缓冲液包括三羟甲基氨基甲烷缓冲液、盐酸缓冲液和咪唑缓冲液中的至少一种。
[0036]
缓冲液对溶液的酸碱性能起到很好的缓冲作用。缓冲液是一种能在加入少量酸或碱和水时抵抗ph改变的溶液,比如三羟甲基氨基甲烷缓冲液,三羟甲基氨基甲烷缓冲液是应用较为广泛的缓冲液,其溶液呈弱碱性,ph缓冲范围为7.0-9.0,三羟甲基氨基甲烷缓冲液还可以与盐酸缓冲液组成三羟甲基氨基甲烷盐酸缓冲液。
[0037]
在一些实施例中,稳定剂包括牛血清白蛋白、甘油和胆酸钠中的至少一种。
[0038]
稳定剂能够使本技术实施例提供的试剂中酶的活性稳定,减少因长期储存、温度变化、运输颠簸等造成的试剂性能下降,确保测定结果的准确度,比如,牛血清白蛋白,牛血清白蛋白一般做为稳定剂被用于限制酶或者修饰酶的保存溶液和反应液中,因为有些酶在低浓度下不稳定或活性低。加入牛血清白蛋白后,它可能起到"保护"或"载体"作用,不少酶类添加牛血清白蛋白后能使其活性大幅度提高。
[0039]
赋形剂包括海藻糖、葡聚糖1万、葡聚糖4万和蔗糖中的至少一种。
[0040]
赋形剂能够赋予谷草转氨酶测定试剂良好的外观,使谷草转氨酶测定试剂疏松多孔,易于冻干和复溶。
[0041]
表面活性剂是一类同时带有极性亲水基和非极性疏水基的工业助剂,能够在工业
生产过程中改变溶液界面体系状态,起到润滑、乳化、分散、抗静电等作用。在本技术实施例中,表面活性剂一般采用曲拉通x-100。
[0042]
曲拉通x-100是一种比较温和的表面活性剂,常作为添加剂使蛋白保持稳定,尤其是膜蛋白。
[0043]
在一些实施例中,l-天门冬氨酸、α-酮戊二酸、还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶以及d-乳酸脱氢酶均作为反应底物,与样本中的谷草转氨酶产生特异性反应。
[0044]
在一些实施例中,谷草转氨酶测定试剂的最适宜的ph值为7.5-8.0时,谷草转氨酶测定试剂中各种酶的活性最好。ph值过大或者过小都会影响酶分子对反应底物分子的结合和催化。
[0045]
在一些实施例中,可以采用ph试纸等方法测试该谷草转氨酶测定试剂混合液的ph值,并通过加入ph调节液调整该谷草转氨酶测定试剂混合液的ph值至预设值。
[0046]
在另一些实施例中,可以使用盐酸或者氢氧化钠调整溶液的ph值,也可以使用其他ph调节液,此处只是对本实施例技术方案的简单说明,不构成对技术方案的限制。
[0047]
在一些实施例中,谷草转氨酶测定试剂呈球状,体积在3.0ul-3.5ul之间。在实际应用中,可以将呈液体状的谷草转氨酶试剂通过定量控制滴珠点胶机直接滴在液氮中结成冰球,并使冰球体积控制在3.0-3.5ul,之后将冰球置于真空冷冻干燥机中进行冻干,氮气复压后可以将冻干试剂球收集保存在干燥的铝瓶中。
[0048]
本技术实施例还提供一种谷草转氨酶测定试剂球的制备方法,请参阅图1,包括如下步骤:
[0049]
s10:将缓冲液加入到预设量的水中;
[0050]
具体的,可以在烧杯中加入一定毫升的蒸馏水,再称取一定量的缓冲液成分,将缓冲液成分加入到蒸馏水中,搅拌至完全溶解。
[0051]
s20:当缓冲液在水中完全溶解后,依次加入l-天门冬氨酸和α-酮戊二酸,并调节ph值至第一预设ph值,得到第一溶液;
[0052]
依次加入l-天门冬氨酸和α-酮戊二酸并使其溶解完全,溶解完全后调节溶液的ph值。
[0053]
在一些实施例中,第一预设ph值为7.5-7.7。
[0054]
s30:在第一溶液中依次加入赋形剂和稳定剂,得到第二溶液;
[0055]
s40:在第二溶液中加入表面活性剂,并调节ph值至第二预设ph值,得到第三溶液;
[0056]
加入表面活性剂后调节溶液的ph值。
[0057]
在一些实施例中,第二预设ph值为7.8-8.0。
[0058]
s50:在第三溶液中加入还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶和乳酸脱氢酶,得到第四溶液;
[0059]
依次加入还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶和乳酸脱氢酶,并溶解完全,第四溶液中含有赋形剂和稳定剂,保证了酶的性质稳定,第四溶液还可以制备成形态良好的冻干试剂球。
[0060]
s60:将第四溶液的液滴滴在液氮中,以使液滴形成冰球;
[0061]
在一些实施例中,配制好混合液后,可以通过点胶机将混合液的液滴滴在液氮中,使液滴在液氮中凝结成冰球。本领域技术人员可以根据实际需要调整滴入液氮中的混合液
的液滴的大小,并通过控制液滴的大小来调整冰球的体积。
[0062]
在一些实施例中,冰球的体积为3.0ul-3.5ul。
[0063]
s70:将冰球进行冷冻干燥,制得谷草转氨酶测定试剂球。
[0064]
在获得冰球后,将冰球置于真空冷冻干燥机进行冷冻干燥,获得谷草转氨酶测定试剂球,待氮气复压后将谷草转氨酶测定试剂球收集并保存在干燥的铝瓶中。
[0065]
冷冻干燥后,冰球中除水外的各组分(缓冲液、非离子型去垢剂、阴离子染料、赋形剂)本身留在冻结时的冰架中,因此冷冻干燥后的冰球疏松多孔且体积不变,由于冰球干燥前始终处于冻结状态,同时冰晶均匀分布于物质中,升华过程不会因脱水而发生浓缩现象。冷冻干燥后得到的试剂球呈海绵状疏松多孔,体积基本与干燥前的冰球保持不变,极易溶于水而恢复原状。
[0066]
从而,通过该方法制备出的含有上述任一实施例试剂组分的谷草转氨酶测定试剂球,具有较好的形态及复融溶解性,还能完全冻干;且具有较高的稳定性和精密度。
[0067]
本技术实施例还提供了一种谷草转氨酶测定芯片,该谷草转氨酶测定芯片包括芯片本体和如上任一实施例所述的试剂,其中,谷草转氨酶测定试剂设置于芯片本体内部。
[0068]
在一些实施例中,芯片本体由注塑成型的塑料基底和光学膜通过粘结胶层粘贴而成,芯片本体包括样本槽、稀释液槽、定量槽、混合槽、废液槽、液流通道和比色孔等结构。芯片本体还包括多个可存放试剂球的比色孔,检测样本进入比色孔后与试剂球发生化学反应。
[0069]
在一些实施例中,该谷草转氨酶测定芯片可以应用于poct分析仪,领用poct分析仪检测37℃下340nm波长处吸光度的变化值,并使用校准品进行定标,可计算得到样本中谷草转氨酶的浓度。
[0070]
可以理解的是,基于赋形剂能够赋予试剂球良好的外观,使试剂球疏松,从而,使得试剂球与检测样本接触后,溶解性良好,与样本反应充分。
[0071]
为进一步阐述本技术的技术方案,以下提供本技术谷草转氨酶测定试剂的若干实施例。
[0072]
在一些实施例中,谷草转氨酶测定试剂可以是以下组分:
[0073][0074][0075]
其中,谷草转氨酶测定试剂的ph值在7.5-8.0。
[0076]
具体的:
[0077]
实施例一:
[0078]
上述谷草转氨酶测定试剂可以是以下组分:三羟甲基氨基甲烷缓冲液50mmol/l、l-天门冬氨酸800mmol/l、α-酮戊二酸100mmol/l、海藻糖10g/l、牛血清白蛋白5g/l、曲拉通x-1000.1g/l、还原型烟酰胺腺嘌呤二核苷酸0.5mmol/l、苹果酸脱氢酶5u/l、d-乳酸脱氢酶1u/l,该谷草转氨酶测定试剂的ph值在7.6。
[0079]
实施例二:
[0080]
上述谷草转氨酶测定试剂可以是以下组分:三羟甲基氨基甲烷缓冲液160mmol/l、l-天门冬氨酸710mmol/l、α-酮戊二酸80mmol/l、海藻糖4g/l、牛血清白蛋白1.2g/l、曲拉通x-100 2.5g/l、还原型烟酰胺腺嘌呤二核苷酸0.3mmol/l、苹果酸脱氢酶3u/l、d-乳酸脱氢酶6u/l,该谷草转氨酶测定试剂的ph值在7.9。
[0081]
实施例三:
[0082]
上述谷草转氨酶测定试剂可以是以下组分:三羟甲基氨基甲烷缓冲液200mmol/l、l-天门冬氨酸500mmol/l、α-酮戊二酸10mmol/l、海藻糖100g/l、牛血清白蛋白0.5g/l、曲拉通x-100 5g/l、还原型烟酰胺腺嘌呤二核苷酸0.1mmol/l、苹果酸脱氢酶0.5u/l、d-乳酸脱氢酶10u/l,该谷草转氨酶测定试剂的ph值在8.0。
[0083]
在另一些实施例中,谷草转氨酶测定试剂还可以是以下组分:
[0084][0085][0086]
其中,谷草转氨酶测定试剂的ph值在7.5-8.0。
[0087]
具体的:
[0088]
实施例四:
[0089]
上述谷草转氨酶测定试剂可以是以下组分:盐酸缓冲液200mmol/l、l-天门冬氨酸500mmol/l、α-酮戊二酸10mmol/l、葡聚糖1万100g/l、胆酸钠5g/l、曲拉通x-100 5g/l、还原型烟酰胺腺嘌呤二核苷酸0.1mmol/l、苹果酸脱氢酶0.5u/l、d-乳酸脱氢酶1u/l,该谷草转氨酶测定试剂的ph值在7.8。
[0090]
实施例五:
[0091]
上述谷草转氨酶测定试剂可以是以下组分:盐酸缓冲液140mmol/l、l-天门冬氨酸650mmol/l、α-酮戊二酸50mmol/l、葡聚糖1万60g/l、胆酸钠2g/l、曲拉通x-100 4.2g/l、还
原型烟酰胺腺嘌呤二核苷酸0.3mmol/l、苹果酸脱氢酶3.6u/l、d-乳酸脱氢酶6u/l,该谷草转氨酶测定试剂的ph值在7.5。
[0092]
实施例六:
[0093]
上述谷草转氨酶测定试剂可以是以下组分:盐酸缓冲液50mmol/l、l-天门冬氨酸800mmol/l、α-酮戊二酸100mmol/l、葡聚糖1万10g/l、胆酸钠0.5g/l、曲拉通x-100 0.1g/l、还原型烟酰胺腺嘌呤二核苷酸0.5mmol/l、苹果酸脱氢酶5u/l、d-乳酸脱氢酶10u/l,该谷草转氨酶测定试剂的ph值在7.6。
[0094]
在另一些实施例中,谷草转氨酶测定试剂还可以是以下组分:
[0095][0096][0097]
其中,谷草转氨酶测定试剂的ph值在7.5-8.0。
[0098]
具体的:
[0099]
实施例七:
[0100]
上述谷草转氨酶测定试剂可以是以下组分:咪唑缓冲液50mmol/l、l-天门冬氨酸800mmol/l、α-酮戊二酸10mmol/l、蔗糖100g/l、甘油5g/l、曲拉通x-100 0.1g/l、还原型烟酰胺腺嘌呤二核苷酸0.1mmol/l、苹果酸脱氢酶5u/l、d-乳酸脱氢酶10u/l,该谷草转氨酶测定试剂的ph值在8.0。
[0101]
实施例八:
[0102]
上述谷草转氨酶测定试剂可以是以下组分:咪唑缓冲液100mmol/l、l-天门冬氨酸700mmol/l、α-酮戊二酸80mmol/l、蔗糖40g/l、甘油4g/l、曲拉通x-100 2g/l、还原型烟酰胺腺嘌呤二核苷酸0.4mmol/l、苹果酸脱氢酶3.8u/l、d-乳酸脱氢酶5u/l,该谷草转氨酶测定试剂的ph值在7.7。
[0103]
实施例九:
[0104]
上述谷草转氨酶测定试剂可以是以下组分:咪唑缓冲液200mmol/l、l-天门冬氨酸500mmol/l、α-酮戊二酸100mmol/l、蔗糖10g/l、甘油0.5g/l、曲拉通x-100 5g/l、还原型烟酰胺腺嘌呤二核苷酸0.5mmol/l、苹果酸脱氢酶0.5u/l、d-乳酸脱氢酶1u/l,该谷草转氨酶测定试剂的ph值在7.6。
[0105]
下面结合具体的测试对比实验,对采用本技术实施例1中的谷草转氨酶测定试剂制成的芯片(下称谷草转氨酶测定芯片1)的性能进行说明。
[0106]
在空气湿度8%的环境中,向谷草转氨酶测定芯片1中注入检测样本,然后,使用分析仪vp10进行检测,检测37℃下340nm波长吸光度的变化值。并使用校准品进行定标,可计算得到检测样本中谷草转氨酶浓度。
[0107]
1)精密度测试:采用谷草转氨酶测定芯片1检测已知谷草转氨酶浓度的检测样本1,该检测样本1的谷草转氨酶浓度为36u/l,检测20次,得到20个检测到的浓度值。
[0108]
计算这20个浓度值的均值、标准差和变异系数,得到均值为35.81u/l,标准差sd=1.42,变异系数cv=3.97%。
[0109]
可知,测得浓度(35.81u/l)与实际浓度(36u/l)十分接近,准确度高,并且,标准差和变异系数均较小,说明谷草转氨酶测定芯片1的稳定性好。
[0110]
2)准确度测试:采用谷草转氨酶测定芯片1测试已知谷草转氨酶浓度为39u/l的检测样本2,重复检测三次,获得浓度值,计算测得的浓度值的平均值为39.89u/l,相对偏差为-0.28%。
[0111]
可知,测得浓度39.89u/l与实际浓度39u/l接近,准确度高,并且,相对偏差较小。
[0112]
3)临床相关性分析
[0113]
准备不同浓度谷草转氨酶的血清样本集a1和a2,即a1包括50份不同浓度谷草转氨酶的血清样本,a2与a1一样,也包括50份不同浓度谷草转氨酶的血清样本,采用某品牌对比试剂盘检测样本集a1中各血清样本的谷草转氨酶浓度,以及,采用谷草转氨酶测定芯片1(本法)检测样本集a2中各血清样本的谷草转氨酶浓度。检测结果如表1所示:
[0114]
表1临床相关性分析的检测结果
[0115]
[0116][0117]
将表1中,某品牌对比试剂盘对应的检测浓度值作为x轴的值,将谷草转氨酶测定芯片1(本法)对应的检测浓度值作为y轴的值,得到两组检测结果之间的相关方程如下:
[0118]
y=1.0005x+0.9029;
[0119]
该相关方程的拟合线如图2所示,其中,相关系数r=0.9994,相关系数越接近1代表两组数据之间的相关性越强。因此,本技术实施例提供的谷草转氨酶测定芯片1与某品牌对比试剂盘的测试结果相关性强。
[0120]
4)线性范围测试
[0121]
要求在[5,1600]u/l区间内,其线性相关系数r≥0.990。
[0122]
根据试剂的最大上限浓度,收集浓度大于待检试剂线性范围上限浓度的新鲜血清或与新鲜血清具有相同的基体状态的样本(或血清中加入待测物质纯品)作为高值样本,浓
度极低或无该分析物的样本作为低限样本,但因低限样本难以收集,一般以生理盐水代替。
[0123]
测试方法如下:将高低浓度标准血清样品以不同比例混合成6个不同浓度的血清样本,采用本技术实施例提供的谷草转氨酶测定芯片1分别测试6个血清样本的谷草转氨酶浓度,每个血清样本测试3次,分别求出6个血清样本中谷草转氨酶测得浓度值的平均值y。以每个样本稀释后的浓度x为自变量,以每个样本的测得浓度值均值y为因变量求出线性回归方程,如下:
[0124]
y=0.9154x+67.845;
[0125]
该相关方程的拟合线如图3所示,其中,相关系数r=0.9933,相关系数r越接近1,则说明采用本技术实施例提供的谷草转氨酶测定芯片1测得的结果与稀释后的实际结果越接近,即测得值接近实际值,本技术实施例提供的谷草转氨酶测定芯片1稳定性较好,测定结果更加准确。
[0126]
5)热稳定性测试
[0127]
在8%空气湿度环境中,将本技术实施例提供的谷草转氨酶测定芯片1封袋,在37℃避光环境中贮存0、2、3、4、6、8天后,以校准品和质控品为检测样本,测试本技术实施例提供的谷草转氨酶测定芯片1的准确度,相对偏差应在
±
10.0%以内。
[0128]
具体的,准备两组质控品(样本1和样本2),分别采用达到上述存储要求后的谷草转氨酶测定芯片1分别检测样本1和样本2,对于同种类的谷草转氨酶测定芯片1,检测三次。
[0129]
表2为样本1通过存储各天数后的谷草转氨酶测定芯片1检测到的检测结果,表3为样本2通过存储各天数后的谷草转氨酶测定芯片1检测到的检测结果。其中,平均值为三次检测到的浓度的平均值,靶值为样本中谷草转氨酶的实际浓度。
[0130]
从表2和表3中可以得出,本技术实施例提供的谷草转氨酶测定芯片1在环境中存储2、3、4、6和8天后,相对偏差的绝对值仍在10.0%以内,因此,具有较好的热稳定性,在环境中储存多天后仍能确保其检测结果的准确度。
[0131]
表2样本1的检测结果
[0132]
样本1123平均值靶值(u/l)相对偏差热稳定性0天41.6040.2640.2040.6941-0.76%热稳定性2天40.8341.5341.6241.33410.80%热稳定性3天40.8640.5341.7841.06410.14%热稳定性4天40.8440.3041.6740.9441-0.15%热稳定性6天40.4640.6441.5940.9041-0.25%热稳定性8天41.1540.3541.1540.8841-0.28%
[0133]
表3样本2的检测结果
[0134]
样本2123平均值靶值(u/l)相对偏差热稳定性0天145.01147.28140.01144.101440.07%热稳定性2天149.64138.86140.85143.12144-0.61%热稳定性3天147.23146.13143.54145.631441.13%热稳定性4天140.10141.57145.25142.31144-1.18%热稳定性6天146.35142.88146.83145.351440.94%热稳定性8天143.72143.01139.80142.18144-1.27%
[0135]
6)长期稳定性测试
[0136]
在8%空气湿度环境中,将本技术实施例提供的谷草转氨酶测定芯片1封袋,在2-8℃避光环境中贮存0、3、6、9、12、15个月后,以校准品和质控品为检测样本,测试该谷草转氨酶测定芯片1的准确度,相对偏差应在
±
10.0%以内。具体的,准备两组质控品(样本3和样本4),分别采用在2-8℃避光环境中贮存0、3、6、9、12、15个月后的谷草转氨酶测定芯片1检测样本3和样本4,对于同种类的谷草转氨酶测定芯片1,检测三次。
[0137]
表4为在2-8℃避光环境中贮存0、3、6、9、12、15个月后的谷草转氨酶测定芯片1对样本3的检测结果,表5为在2-8℃避光环境中贮存0、3、6、9、12、15个月后的谷草转氨酶测定芯片1对样本4的检测结果。其中,平均值为三次检测到的浓度的平均值,靶值为样本中谷草转氨酶的实际浓度。
[0138]
从表4和表5中可以得出,本技术实施例提供的谷草转氨酶测定芯片1在环境中存储0、3、6、9、12、15个月后,相对偏差的绝对值仍在10.0%以内,因此,具有较好的长期稳定性,在环境中储存较长时间后仍能确保其检测结果的准确度。
[0139]
表4样本3的检测结果
[0140]
样本3123平均值靶值(u/l)相对偏差长期稳定性0月35.6933.7633.2034.2235-2.24%长期稳定性3月35.3435.9435.9435.74352.11%长期稳定性6月35.0835.5036.7635.78352.23%长期稳定性9月36.8334.8233.4435.03350.09%长期稳定性12月36.2535.3435.8435.81352.31%长期稳定性15月36.3834.8436.4435.89352.53%
[0141]
表5样本4的检测结果
[0142]
样本4123平均值靶值(u/l)相对偏差长期稳定性0月149.62151.89148.07149.861481.26%长期稳定性3月143.79146.20144.41144.80148-2.16%长期稳定性6月155.99149.74146.21150.651481.79%长期稳定性9月144.00144.27145.95144.74148-2.20%长期稳定性12月153.61151.98140.34148.641480.43%长期稳定性15月149.53144.77155.61149.971481.33%
[0143]
7)抗干扰能力
[0144]
干扰性试验:制备空白对照组和实验组,实验组加入不同的干扰物质,使其在血清中的浓度达到如下表6所示的要求。然后分别测定含有如下四种干扰物质的谷草转氨酶的含量,每种干扰物质重复三次,取平均值。测定结果见下表6。表6为干扰物质存在时的谷草转氨酶测定芯片1对谷草转氨酶含量的检测结果。相对偏差(%)=(干扰样本的测定均值-对照组测定均值)/对照组测定均值
×
100%。
[0145]
表6抗干扰测试结果
[0146]
项目类型测值相对偏差结论空白对照组35.00u/l//
测含30mg/dl的抗坏血酸35u/l样本36.29u/l3.68%合格测含40mg/dl的胆红素35u/l样本36.04u/l2.96%合格测含400mg/dl血红蛋白35u/l样本36.06u/l3.03%合格测含500mg/dl甘油三酯35u/l样本35.68u/l1.95%合格
[0147]
由上表6可看出,本技术实施例提供的谷草转氨酶测定芯片1在干扰物质存在时测试值的相对偏差的绝对值仍在10.0%以内,因此,本技术实施例提供的谷草转氨酶测定芯片1具有较好的抗干扰性,在多种干扰物质中仍能确保其检测结果的准确度。
[0148]
综上所述,本技术实施例提供的谷草转氨酶测定试剂包括:缓冲液、l-天门冬氨酸、α-酮戊二酸、赋形剂、稳定剂、表面活性剂、还原型烟酰胺腺嘌呤二核苷酸、苹果酸脱氢酶以及d-乳酸脱氢酶。该谷草转氨酶测定试剂包含有效的稳定剂成分,提高了测定试剂中酶和还原型烟酰胺腺嘌呤二核苷酸的稳定性,以使其在检测谷草转氨酶浓度时稳定性更好,抗干扰能力强,提高了测定结果的准确度。
[0149]
谷草转氨酶测定试剂可制成谷草转氨酶测定试剂球;谷草转氨酶测定试剂可置于测定芯片体内,制成谷草转氨酶测定芯片,利用反应体系在340nm处吸光度的变化可计算出检测样本中谷草转氨酶浓度的含量,操作简单、快捷。
[0150]
最后应说明的是:以上实施例仅用以说明本技术的技术方案,而非对其限制;在本技术的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本技术的不同方面的许多其它变化,为了简明,它们没有在细节中提供;尽管参照前述实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本技术各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1