免疫调节功能增强型脐带间充质干细胞、干细胞制剂及脐带间充质干细胞的制备方法与流程
1.本发明涉及干细胞提取技术领域,具体是一种免疫调节功能增强型脐带间充质干细胞、干细胞制剂及脐带间充质干细胞的制备方法。
背景技术:
2.人体的免疫系统是保护机体免受病原微生物入侵,维持身体健康的重要防护屏障,当其由于自身原因或外在因素影响造成免疫系统异常时,其正常免疫防御功能发生紊乱,机体对自身抗原发生免疫反应,从而引起各种自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎、干燥综合症、皮肌炎等。
3.自身免疫性疾病发病人群广泛,表现为多组织器官损伤或功能障碍,一般病程较长,常呈现反复发作和慢性迁延的过程,具有较高的致残率和致死率,大多数自身免疫性疾病尚无根治方法。
4.近年来,随着研究的深入,间充质干细胞逐渐被广泛应用于再生生物学和实验生物学,并逐渐推广于临床。其多向分化潜能、免疫调节、造血支持以及低免疫原性、无免疫排斥等特点,已在难治性和重症自身免疫性疾病的干预中得到应用,为患者提供了新选择。但是,目前提取到的间充质干细胞免疫调节功能相对较弱,且对自身免疫性疾病的针对性较差,所以,发明人认为提供一种免疫调节功能增强型脐带间充质干细胞是非常有必要的。
技术实现要素:
5.本发明就是为了解决上述技术问题,所提出了一种免疫调节功能增强型脐带间充质干细胞、干细胞制剂及脐带间充质干细胞的制备方法。
6.第一方面,本技术提供一种免疫调节功能增强型脐带间充质干细胞的制备方法,采用了如下的技术方案。
7.一种免疫调节功能增强型脐带间充质干细胞的制备方法,包括以下步骤:
8.s1.取多根脐带组织,每根脐带组织洗净后均剪成2-3mm3组织块,分别加入原代培养基进行培养,3-4小时后翻面,继续培养7-10天,得到p0代细胞;
9.s2.待细胞融合度达到50%-60%,吸弃培养上清并对细胞进行洗涤,然后加入消化液使细胞脱落;
10.s3.离心去上清,细胞沉淀用完全培养基重悬并采用100um滤网过滤,按照1:1-1.5的比例接种于完全培养基中,培养3-4天,得到p1代细胞;
11.s4.待细胞融合度达到80%以上,分别取培养上清采用酶联免疫吸附法检测pge2、ido、tgf-β分泌水平,吸弃培养上清并洗涤细胞,加入消化液使细胞脱落;
12.s5.离心弃上清,细胞沉淀用完全培养基重悬并采用100um滤网过滤,按照1.5-2.5*104/cm2的密度接种于完全培养基中,培养3-4天,得到p2代细胞;
13.s6.待细胞融合度达到80%以上,根据步骤s4细胞因子分泌水平检测结果,选取细
胞因子分泌水平高的细胞,吸弃培养上清并洗涤细胞,加入消化液使细胞脱落;
14.s7.离心去上清,细胞沉淀用定向诱导培养基重悬并采用100um滤网过滤,按照1.5-2.5*104/cm2的密度接种于定向诱导培养基,培养2-4天,得到p3代细胞;
15.s8.待细胞融合度达到90%以上,吸弃培养上清并对细胞进行洗涤,然后加入消化液使细胞脱落;
16.s9.离心去上清,细胞沉淀用定向诱导培养基重悬并采用100um滤网过滤,按照1.5-2.5*104/cm2的密度接种于定向诱导培养基,培养2-4天,得到p4代细胞;
17.s10.按照步骤s8-s9,使细胞继续进行传代培养一次,得到p5代细胞;
18.s11.待细胞融合度达到90%以上,吸弃培养上清并洗涤细胞,加入消化液使细胞脱落;
19.s12.离心去上清,细胞沉淀用完全培养基重悬并采用100um滤网过滤,按照1.5-2.5*104/cm2的密度接种于完全培养基,继续培养2-4天,即为免疫调节功能增强型脐带间充质干细胞。
20.进一步的,所述完全培养基为含有体积分数为10-15%的胎牛血清的dmem/f12培养基。
21.进一步的,所述定向诱导培养基为含有体积分数为5%-15%的胎牛血清、终浓度为100-500iu/ml的ifn-γ因子、终浓度为100-500iu/ml的tnf-α因子的dmem/f12培养基。
22.第二方面,本技术提供一种免疫调节功能增强型脐带间充质干细胞,采用了如下的技术方案。
23.一种上述免疫调节功能增强型脐带间充质干细胞的制备方法制备得到的脐带间充质干细胞。
24.第三方面,本技术提供一种干细胞制剂,采用了如下的技术方案。
25.一种干细胞制剂,包括上述脐带间充质干细胞。
26.本发明获得了如下有益效果。
27.本技术通过筛选种子细胞、条件诱导培养的方式获得间充质干细胞,其免疫调节相关因子分泌水平显著提高,强化了间充质干细胞调节免疫功能的特性,对自身免疫性疾病的治疗更具有针对性。另外,本技术的制备方法为细胞层面技术,无基因工程改造,操作简便易重复,全程安全可控,细胞制剂使用风险更低。
附图说明
28.图1是本发明10根脐带细胞因子分泌实验结果图;
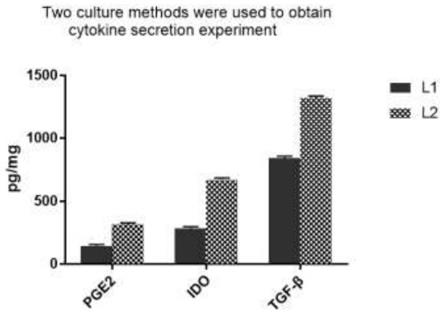
29.图2是本发明两种培养方法获得细胞因子分泌实验结果图;
30.图3是本发明t细胞集落形成实验结果图。
具体实施方式
31.以下参照实施例对本发明进行进一步的技术说明。
32.一种免疫调节功能增强型脐带间充质干细胞的制备方法,包括以下步骤:
33.(1)经授权,取检测合格的10(u1-u10)根优质脐带组织,在75%酒精烧杯中浸润10秒取出,氯化钠注射液去血清洗3次后剪成2-3mm3组织块均匀平铺于10个t-75培养瓶底部
(每根脐带组织一瓶),按照15ml/瓶补加原代培养基后倒放入37℃、5%co2培养箱中,3小时后翻面,继续培养。1瓶原代培养基内含胎牛血清112ml、dmem/f12培养基500ml。
34.(2)培养10天(p0),细胞融合度达到50%,移液管吸弃培养上清,氯化钠注射液清洗细胞一次,按照2ml/瓶加入typle消化液使细胞从培养瓶底部脱落,每瓶中加入20ml生理盐水吹打细胞至完全脱落后,将全部液体转入1个50ml离心管中配平离心。
35.(3)300g离心8分钟,去上清,细胞沉淀用15ml完全培养基重悬,通过100um滤网过滤至新的50ml离心管中,按照1:1的比例接种于10个t-75细胞培养瓶中(p1),放入37℃,5%co2培养箱中继续培养。1瓶完全培养基含胎牛血清56ml、dmem/f12培养基500ml。
36.(4)培养3天,细胞融合度达到80%,分别从培养瓶中各取5ml培养上清,酶联免疫吸附法检测pge2、ido、tgf-β表达水平,移液管吸弃其余培养上清,氯化钠注射液清洗细胞一次,按照2ml/瓶加入typle消化液使细胞从培养瓶底部脱落,每瓶中加入20ml生理盐水吹打细胞至完全脱落后,将全部液体转入1个50ml离心管中配平离心。
37.(5)300g离心8分钟,弃上清,吸取10ml完全培养基重悬细胞,通过100um滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,每组按照2*104/cm2接种3个t-75细胞培养瓶(剩余细胞弃掉),每瓶补加完全培养基至总体积15ml/瓶(p2),放入37℃,5%co2培养箱中继续培养。
38.(6)培养3天,细胞融合度均达到80%以上,根据(4)中因子分泌水平检测结果(表1、图1),选取u3脐带细胞,继续传代培养。弃上清,氯化钠注射液清洗细胞一次,按照2ml/瓶加入typle消化液使细胞从培养瓶底部脱落,以20ml生理盐水清洗三瓶细胞,全部液体平均转入2个50ml离心管(l1、l2)中配平离心,离心力300g离心8分钟。
39.表1 10根脐带细胞因子分泌实验
[0040][0041]
(7)离心后弃上清,l1中细胞以10ml完全培养基重悬细胞,通过100um滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉),每瓶补加完全培养基至40ml(p3);l2中细胞以10ml定向诱导培养基(1瓶定向诱导培养基含胎牛血清56ml、dmem/f12培养基500ml、终浓度400iu/mlifn-γ因子、终浓度200iu/ml tnf-α因子)重悬细胞,通过100u滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉)(p3),每瓶补加定向诱导培养基至40ml,放入37℃,5%co2培养箱中继续培养。
[0042]
(8)培养3天,细胞融合度均达到90%,l1和l2两组细胞分别操作,吸弃上清,氯化钠注射液清洗细胞一次,按照3ml/瓶加入typle消化液使细胞从培养瓶底部脱落,每组以20ml生理盐水清洗三瓶细胞,全部液体转入1个50ml离心管中配平离心,离心力300g离心8分钟。
[0043]
(9)离心后弃上清,l1中细胞以10ml完全培养基重悬细胞,通过100um滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉),每瓶补加完全培养基至40ml(p4);l2中细胞以10ml定向诱导培养基(1瓶定向诱导培养基含胎牛血清56ml、dmem/f12培养基500ml、终浓度400iu/mlifn-γ因子、终浓度200iu/ml tnf-α因子)重悬细胞,通过100u滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉)(p4),每瓶补加定向诱导培养基至40ml,放入37℃,5%co2培养箱中继续培养。
[0044]
(10)培养3天,细胞融合度均达到90%,l1和l2两组细胞分别操作,吸弃上清,氯化钠注射液清洗细胞一次,按照3ml/瓶加入typle消化液使细胞从培养瓶底部脱落,每组以20ml生理盐水清洗三瓶细胞,全部液体转入1个50ml离心管中配平离心,离心力300g离心8分钟。
[0045]
(11)离心后弃上清,l1中细胞以10ml完全培养基重悬细胞,通过100um滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉),每瓶补加完全培养基至40ml(p5);l2中细胞以10ml定向诱导培养基(1瓶定向诱导培养基含胎牛血清56ml、dmem/f12培养基500ml、终浓度400iu/mlifn-γ因子、终浓度200iu/ml tnf-α因子)重悬细胞,通过100u滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种3个t-175细胞培养瓶(剩余细胞弃掉)(p5),每瓶补加定向诱导培养基至40ml,放入37℃,5%co2培养箱中继续培养。
[0046]
(12)培养3天,细胞融合度均达到90%,l1和l2两组细胞分别操作,分别从培养瓶中各取5ml培养上清(l1a、l1b、l1c;l2a、l2b、l2c),酶联免疫吸附法检测pge2、ido、tgf-β表达水平(表2、图2),移液管吸弃其余培养上清吸弃上清,氯化钠注射液清洗细胞一次,按照3ml/瓶加入typle消化液使细胞从培养瓶底部脱落,每瓶细胞以20ml生理盐水清洗细胞,全部液体转入1个50ml离心管中配平离心,离心力300g离心8分钟。
[0047]
表2 两种培养方法获得细胞因子分泌实验
[0048]
因子(pg/ml)/编号l1al1bl1cl2al2bl2cpge2128142154287331322ido225302321628675713tgf-β828844852126014221281
[0049]
(13)离心后弃上清每瓶细胞以5ml完全培养基重悬细胞,通过100um滤网过滤细胞后取200ul细胞悬液计数,根据计数结果,按照2*104/cm2接种1个10cm直径培养平皿(l1a、l1b、l1c;l2a、l2b、l2c,剩余细胞弃掉),每个平皿补加完全培养基至15ml(p6);放入37℃,5%co2培养箱中继续培养。
[0050]
t淋巴细胞的制备:
[0051]
①
经新生儿父母授权同意,取得胎儿脐带血用于科学研究。将经抗凝处理的脐血120ml加入250ml离心管中,等倍加入氯化钠注射液稀释,充分混匀备用。
[0052]
②
将稀释后的脐血分别缓慢加入到8支含有ficoll淋巴细胞分离液50ml离心管中,严格配平后离心,离心参数:500g、23分钟。每支50ml离心管含ficoll 15ml、脐血30ml。
[0053]
③
离心后用移液管将白膜层全部吸出至1个新的250ml离心管中,补加氯化钠注射液至200ml配平离心,离心参数:500g、10分钟。
[0054]
④
离心后弃上清,用dmem/f12培养基重悬细胞,计数,备用。
[0055]
免疫抑制实验:
[0056]
①
取p6代细胞培养48h后,细胞融合度均达到50%,吸弃全部培养上清,每个平皿以10ml生理盐水清洗2次;
[0057]
②
将分离获得的t淋巴细胞加入6个平皿中共培养,同时再加入到3个新的培养平皿中(c1、c2、c3),每个接种1
×
107个t淋巴细胞,每个平皿中加入15ml t细胞扩增培养基(1640培养基中含有体积分数5%的胎牛血清、2mgpha,终浓度400iu/ml的il-2)。继续培养72h,10倍物镜每个平皿选取3个视野统计t细胞集落数量(表3、图3)。
[0058]
表3 t细胞集落形成实验
[0059][0060]
本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1