可结合人乳头瘤病毒的抗体20F6及其应用的制作方法
可结合人乳头瘤病毒的抗体20f6及其应用
技术领域
1.本发明涉及生物医药领域。更特别地,涉及一种可特异性结合hpv病毒的单克隆抗体及其应用。
背景技术:
2.人乳头瘤病毒(human papillomavirus,hpv)是世界范围内一组极为常见的病毒。是一种嗜上皮性病毒,在人和动物中分布广泛,有高度的宿主特异性,只有人类会被hpv感染。两种类型的人乳头瘤病毒(16型和18型)引起70%的宫颈癌和宫颈癌前病变。几乎所有宫颈癌病例都是由人乳头瘤病毒感染导致。全球每年宫颈癌的新发病例为52.8万。在中国大陆已上市三种hpv疫苗(二价、四价和九价),均可用于预防高危型hpv,但目前接种率仍较低,部分个体即使接种疫苗仍无抗病毒抗体产生,且疫苗不能治疗已获人乳头瘤病毒感染或宫颈癌等与人乳头瘤病毒有关的疾病。
3.目前,临床上尚无直接针对hpv的特异性治疗药物,主要通过物理治疗及干扰素等辅助治疗,难以彻底清除体内病毒,易于复发。因此,需要研发出专门针对hpv病毒的抗体,作为宫颈癌等与hpv感染有关的疾病的治疗药物。
技术实现要素:
4.本发明通过用抗原免疫balb/c小鼠,获取单克隆抗体,可特异性结合人乳头瘤病毒。基于这些研究,本发明提供了一种可结合人乳头瘤病毒的抗体,包括重链可变区和轻链可变区,其中,所述重链可变区包括三个cdr区,序列分别如seq id no:3-5;所述轻链可变区包括三个cdr区,序列分别如seq id no:6-8所示。
5.在一个具体实施方案中,所述重链可变区序列如seq id no:1所示,所述轻链可变区序列如seq id no:2所示。尽管本实施方案提供了带有骨架区序列的重链可变区序列和轻链可变区序列,但是本领域技术人员应当清楚,抗体对抗原的结合取决于重链可变区的cdr序列和轻链可变区的cdr序列,本领域技术人员在知晓本发明提供的重链可变区cdr序列和轻链可变区的cdr序列之后,可通过结合不同的骨架区序列来获得不同的重链可变区和轻链可变区,进而组合成不同的重链和轻链,这些变化都包含在本发明的保护范围之下。
6.本发明还提供了上述抗体在制备人乳头瘤病毒检测剂中的应用,所述人乳头瘤病毒为hpv16、hpv18、hpv31、hpv33、hpv45、hpv52和hpv58中的一种或多种组合。
7.在一个具体实施方案中,所述检测剂为elisa检测剂或免疫荧光检测剂。
8.本发明还提供了上述抗体在制备人乳头瘤病毒感染治疗药物中的应用,所述人乳头瘤病毒为hpv16、hpv18、hpv31、hpv33、hpv45、hpv52和hpv58中的一种或多种组合。
9.本发明还提供了编码上述抗体的核酸。
10.本发明还提供了上述核酸在制备用于hpv感染的治疗或预防药物中的应用。
11.在一个具体实施方案中,所述hpv感染为hpv16感染。
12.可使用上述核酸搭载到例如aav等表达载体中,制备成基因治疗药物,注射至人体
内,用于治疗hpv感染。
13.本发明针对高危病毒hpv16进行中和抗体药物开发,通过制备hpv16 vlp、免疫balb/c小鼠、利用电融合技术平台等,筛选到特异性结合包括hpv16、hpv18在内的多种hpv亚型的单克隆抗体,并鉴定了其序列。本发明为hpv感染的临床诊断和治疗提供潜在的抗体新药。
附图说明
14.图1为3免后小鼠抗血清效价检测曲线;
15.图2为融合后杂交瘤克隆上清以hpv16 vlp进行elisa初筛的结果汇总图;
16.图3为单克隆抗体20f6的分型统计图;
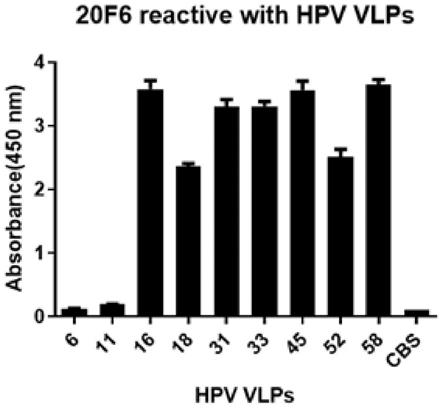
17.图4为单克隆抗体20f6与9个hpv亚型vlp蛋白elisa反应性的统计图;
18.图5为单克隆抗体20f6与9个亚型胞内hpv vlp颗粒结合的荧光显微镜照片;
19.图6为单克隆抗体20f6与9个高危亚型hpv假病毒的中和反应活性检测结果图;
20.图7为不同浓度的单克隆抗体50a11及20f6对hpv16假病毒中和活性的浓度-抑制率曲线;
21.图8为单克隆抗体20f6与hpv16 vlp蛋白的亲和力检测图。
具体实施方式
22.1.免疫原的制备
23.我们应用hpv16 vlp包装载体,转染293tt细胞后,裂解细胞,成熟、包装并纯化得到hpv16 vlp。
24.2.小鼠免疫与抗血清的获得
25.用50μg hpv16 vlp蛋白与50μl弗氏完全佐剂的乳化混合物对6-8周龄balb/c小鼠进行初免,在第21天、42天用25μg hpv16 vlp蛋白与50μl弗氏不完全佐剂加强免疫2次,第2次加强免疫1周后,采血检测抗血清滴度;第2次加强免疫3周后进行冲击免疫,腹腔注射50μg hpv16 vlp,3天后,取小鼠脾脏进行杂交瘤电融合。
26.抗血清效价通过elisa检测,用浓度为0.2μg/ml的hpv16 vlp蛋白包被检测板,每孔加入梯度稀释的抗血清或者纯化的抗体100μl(对照为免疫前小鼠血清),37℃孵育1.5h,洗涤2次,每孔加入1:10000稀释的辣根过氧化物酶标记的goat anti-mouse igg(h+l)二抗,37℃孵育1h,洗涤4-6次后,加100μl tmb底物,37℃孵育10min,50μl 0.2m的h2so4中止反应,测定od 450nm。elisa检测血清效价规定为在od450是空白对照的2.1倍以上并且大于0.2的最高稀释倍数。
27.结果如图1所示,3免后2只小鼠血清效价均≥7.29x105,可见该抗原可诱导小鼠产生特异性针对hpv16 vlp蛋白的高滴度抗血清。
28.3.杂交瘤的制备
29.取效价相对高的m3号小鼠,经腹腔注射50μg hpv16 vlp进行冲击免疫,3天后,取小鼠脾脏细胞进行杂交瘤电融合。在无菌环境下,取小鼠脾脏,经红细胞裂解液裂解去除红细胞后,制成脾细胞悬液后与sp2/o细胞按照2:1比例混合,以电融合缓冲液洗涤后重悬于电融合缓冲液中。电融合完毕,静置5分钟后轻缓收集细胞于dmem完全培养基中静置于37
℃。10min后离心,500rpm室温离心5分钟,弃上清,加入hat培养液(次黄嘌呤、氨基喋呤、胸腺嘧啶核苷)轻轻重悬细胞,将细胞铺于96孔板中,每孔200μl。
30.4.筛选分泌抗hpv16 vlp单克隆抗体的杂交瘤细胞
31.融合后第7天,用间接elisa法筛选杂交瘤细胞。筛选结果如图2所示。选择od较高的阳性克隆进行特异性检测及亚克隆化,并用梯度稀释法及有限稀释法连续克隆化2-3次,直至到100%细胞阳性率,最后挑出两株稳定分泌抗hpv16 vlp的单克隆抗体细胞株,命名为50a11、20f6。将克隆化好的细胞扩增培养后冻存于液氮。
32.5.单克隆抗体的制备和纯化
33.将单克隆细胞株20f6以1
×
106/只的量注入弗氏不完全佐剂预处理的雌性小鼠腹腔,7天左右待小鼠腹部膨大时抽取腹水。采用protein g亲和纯化方法纯化单克隆抗体,以sds-page测定单克隆抗体的纯度,纯度达到90%以上。以bca法测定纯化抗体的浓度。
34.6.本发明特异性抗体的特征分析
35.1)免疫球蛋白亚型鉴定
36.采用洛阳佰奥通实验材料中心的小鼠单克隆抗体亚型鉴定检测试剂盒,鉴定细胞株分泌的抗体的亚型,结果如图3所示,单克隆抗体20f6为igg2a亚型。
37.2)序列测定
38.对抗体进行测序,结果如下,单克隆抗体20f6的重链可变区序列如seq id no:1所示,轻链可变区序列如seq id no:2所示。进一步的研究分析显示,两株抗体的cdr区序列如表1所示。
39.表1单克隆抗体20f6的cdr序列
[0040][0041]
3)间接elisa鉴定单克隆抗体的反应性
[0042]
通过包被不同亚型的hpv vlp蛋白,鉴定单克隆抗体20f6与hpv16 vlp反应的特异性。以碳酸盐缓冲液(ph9.6)稀释hpv vlps,0.25μg/ml,100μl/孔进行包被。37℃包被1小时后以pbst洗涤两遍后进行封闭,封闭液为4%脱脂奶粉,250μl/孔,37℃孵育1小时后以pbst洗涤两遍进行上样,37℃孵育1.5小时。pbst洗涤两遍后加入二抗:山羊抗鼠hrp抗体,37℃孵育50分钟。pbst洗涤4遍后加入tmb显色,每孔100μl,室温显色10分钟后,每孔加入70μl 1m hcl进行终止,于450nm波长处进行读数。
[0043]
结果如图4所示,在elisa水平,在9个高危hpv亚型vlp中,单克隆抗体20f6除与hpv6及hpv11不结合外,与其他亚型hpv vlp均具有结合活性,即,在elisa实验中,单克隆抗体20f6对hpv16、hpv18、hpv31、hpv33、hpv45、hpv52、hpv58 vlp均有较好的结合活性。
[0044]
4)免疫荧光试验鉴定单克隆抗体的反应特性及反应特异性
[0045]
将表达各亚型vlp的载体转染293tt细胞48小时后,以4%多聚甲醛固定细胞,室温30分钟后以0.5%曲拉通x-100进行穿透,室温20分钟。10%fbs in pbs进行封闭,37℃1小时。以杂交瘤上清作为一抗,同时作无中和效应抗体8a5为对照,37℃孵育2小时。二抗为
alexa fluor 488goat anti mouse igg(h+l),4℃孵育45分钟。洗涤干净后于荧光显微镜下进行观察。结果如图5所示,在荧光实验中,单克隆抗体20f6对hpv6、hpv16、hpv18、hpv31、hpv33、hpv45、hpv52、hpv58的胞内表达vlp颗粒均表现出结合活性,尤其是对hpv16、hpv18、hpv31、hpv45、hpv52、hpv58表现出较强的结合活性,而另一个单克隆抗体8a5未表现出结合活性。
[0046]
5)单克隆抗体的体外中和反应特性及特异性检测
[0047]
以hpv假病毒进行体外中和试验。将杂交瘤上清或腹水纯化抗体稀释为不同浓度,与各亚型hpv假病毒共同孵育,37℃一小时后,加入预先铺好的2*104/孔的293tt细胞中,置于5%c02、37℃培养箱中培养48小时。去除上清,加入细胞裂解液后转移至化学发光板中,加入化学发光底物液进行读数,读取rlu读值。计算中和抑制率,抑制率=[1-(样品组的rlu-细胞对照组cc的rlu均值)/(无抗体对照处理组的rlu-细胞对照组cc的rlu均值)]
×
100%。
[0048]
结果如图6所示,单克隆抗体20f6除对于hpv16 psv具中和作用外,对hpv18、hpv31、hpv33、hpv45、hpv52、hpv58假病毒亦具一定的中和反应活性,尤其对hpv16和hpv31具有较高的中和活性。
[0049]
6)单克隆抗体hpv16假病毒中和反应ic50的测定
[0050]
将杂交瘤单克隆上清以双抗夹心elisa测定浓度后,进行hpv16假病毒的中和反应实验。操作同5)所述,计算得出每个浓度下的中和抑制率后,将抑制率数值对抗体浓度进行曲线拟合,计算ic50,ic50表示抑制率为50%时抗体的浓度。
[0051]
结果如图7所示,单克隆抗体20f6对hpv16的ic50为35.5ng/ml,可有效中和hpv16。
[0052]
将单克隆抗体20f6的dna编码序列搭载到aav病毒载体中制备成aav-20f6基因药物,进行小鼠实验,结果显示,接受上述基因药物注射的小鼠对hpv16的感染具有治疗和预防效果。
[0053]
7)fortebio检测抗体与hpv16 vlp蛋白的亲和力
[0054]
将hpv16 vlp蛋白耦联于ar2g生物传感器,检测单克隆抗体20f6与hpv16 vlp蛋白的亲和力水平。将耦联好抗原的生物传感器以0.02%pbst平衡后,结合待测抗体,时间180s-300s,再于0.02%pbst中解离,时间180s,以fortebio数据分析软件8.0版本,1:1结合模式拟合分析,得出抗体与hpv16 vlp蛋白的结合kd值如图8所示。
[0055]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1