一种基于CRISPR/Cas12的肝素检测方法及其检测试剂盒
一种基于crispr/cas12的肝素检测方法及其检测试剂盒
技术领域
1.本发明属于分析检测技术领域,具体涉及一种基于crispr/cas12的肝素检测方法及其检测试剂盒。
背景技术:
2.肝素(heparin)是一种高度硫酸化的线性糖胺聚糖,天然存在于肥大细胞中,现在主要从牛肺或猪小肠黏膜提取。肝素的主要功能是:1)抗凝血:增强抗凝血酶3与凝血酶的亲和力,加速凝血酶的失活;抑制血小板的粘附聚集;增强蛋白c的活性,刺激血管内皮细胞释放抗凝物质和纤溶物质。2)抑制血小板,增加血管壁的通透性,调控血管新生。3)具有调节血脂的作用。4)肝素还具有抗炎、抗过敏的作用。众所周知,肝素目前在医学领域应用广泛,在临床中是迅速达到抗凝作用的首选药物,此外肝素的另一重要临床应用是在心脏、手术和肾脏透析时维持血液体外循环畅通。特别是在covid-19爆发期间,肝素也显示出巨大的潜力。但是过度使用肝素会引起出血、血小板减少等严重并发症,因此及时监测肝素水平至关重要。
3.目前临床上可通过活化凝血时间(act)和活化部分凝血活酶时间(aptt)检测肝素,同时也开发了比色法,荧光法和电化学免疫分析法等分析方法。尽管现有技术中的有些方法具有很好的敏感性,但是仍具有检测不精确,操作复杂,耗时长且特异性差等不足。此外,为了克服现有技术中针对肝素的poct方法都采用竞争性结合的机制,需要使用鱼精蛋白等中间体实现,所以不能直接与肝素结合进行检测。而目前市面上售卖的肝素检测试剂盒,利用的主要是肝素的抗凝活性,需要借助肝素的抗凝活性才能实现检测。因此,需要开发一种快速、灵敏高选择性检测肝素含量的方法。
技术实现要素:
4.发明目的:针对现有技术存在的问题,本发明提供了一种基于crispr/cas12的肝素检测方法,本发明设计了特定的crrna基于crispr/cas12进行肝素检测方法,为肝素的药物安全质量问题提供一种快速、简便和高灵敏的检测手段,同时也为crispr/cas系统检测非核酸目标物的应用提供新的技术方案,进一步揭示crispr/cas在分析检测领域的应用潜力。
5.同时本发明还提供了一种基于crispr/cas12的肝素检测方法的检测试剂盒。
6.技术方案:为了实现上述目的,本发明提供一种基于crispr/cas12的肝素检测方法,包括如下步骤:
7.(1)设计dnaprobe和crrna序列;
8.(2)将crrna,cas12a,缓冲液,fq,肝素预组装后加入dnaprobe进行孵育,孵育后进行灭活后进行荧光测定。
9.其中,所述crrna为crrna1-crrna18中的任一种或任几种的组合,其中crrna1-crrna18的序列分别如seq id no.1-18所示。
10.其中,所述dnaprobe为序列分别如seq id no.19-36所示,其分别对应crrna1-crrna18的序列seq id no.1-18,其中dna probe序列的设计需要其能够与crrna按照碱基互补配对原则相结合。
11.其中,所述cas12为lbcas12a、fncas12a中任意一种cas12酶。
12.其中,所述缓冲液包括缓冲液1和缓冲液2,其中缓冲液1为含有mn
2+
的水溶液,浓度为10mm,能够促进酶活性;缓冲液2为10x ne buffer 2.1。
13.其中,所述ssdna(fq)为6-fam-ttatt-bhq1。
14.其中,所述dna probe浓度为5-500nm;所述crrna浓度为50-100nm,cas12与crrna的浓度比值为1-2:1。
15.作为优选,所述dna probe浓度为50nm;所述crrna浓度为100nm,cas12与crrna的浓度比值为2:1。
16.其中,所述预组装为室温预组装10-20min;孵育为37℃,30-40min;灭活65℃,10-20min。
17.作为优选,所述预组装为室温预组装10min;孵育37℃,30min;灭活后为65℃,10min。
18.本发明所述的基于crispr/cas12的肝素检测方法中使用的试剂盒,包括crrna、dna probe、缓冲液、cas12、ssdna(fq)。
19.其中,所述crrna为crrna1-crrna18中的任一种或任几种的组合,其中crrna1-crrna18的序列分别如seq id no.1-18所示;所述dna probe为序列分别如seq id no.19-36所示,其分别对应crrna1-crrna18的序列seq id no.1-18;所述ssdna(fq)为6-fam-ttatt-bhq1。
20.本发明提供的基于crispr/cas12的肝素检测crrna或者所述的基于crispr/cas12的肝素检测试剂盒,可以用于检测环境、动物体内(如牛肺或猪小肠黏膜)、溶液以及体液(如血液)中的肝素浓度。
21.其中,所述试剂盒应用的具体过程为:将crrna,cas12a,缓冲液,fq、肝素预组装后加入dna probe进行孵育,孵育后进行灭活后进行荧光测定。
22.作为优选,本发明基于crispr/cas12的肝素检测试剂盒设计和检测包括如下步骤:
23.a)设计dna probe和crrna序列,dna probe与crrna结合后启动cas12的核酸酶活性;
24.b)确定检测时使用的最适dna probe浓度、缓冲液的ph、cas12与crrna的浓度比以及肝素在反应体系中的时间;
25.c)确定对肝素的有效检测范围;
26.d)检测血浆样品中肝素的浓度,探究crispr/cas12方法的准确性和实际应用性。
27.更进一步地,所述基于crispr/cas12的肝素检测试剂盒设计和检测包括如下步骤:
28.(1)dna probe浓度的优化,实验所使用的dna probe浓度范围至关重要,设置合理的浓度梯度并进行测试,从中选择出最适用于本发明的浓度。本发明设置的dna probe浓度区间为5-500nm,得到的最适浓度为50nm。
29.(2)探究合适的孵育时间、缓冲液的ph,以及cas12与crrna的浓度,设置合理的ph和时间梯度,体系混合后需要用37℃金属浴孵育10min后65℃孵育10min灭活。通过酶标仪检测不同条件下荧光强度的变化来选择最适条件。
30.①
肝素与crispr/cas12体系孵育时间0-1h,每隔5min设置一个梯度,测定荧光强度,计算荧光切割率得到最适孵育时间为30min;
31.②
ph设定范围6.0-9.0,测定荧光强度,通过与对照组的荧光比值获得的最适ph为8;
32.③
添加进入crispr/cas12系统中的cas12与crrna的浓度比值,通过固定cas12浓度为200nm,调整crrna浓度范围在50-500nm,通过计算与对照组的荧光比值,确定crrna浓度为100nm,cas12与crrna的浓度比值为2:1,以及最终反应所需时间为40min。
33.(3)配置不同浓度的肝素溶液,加入crispr/cas12体系,带负电荷的肝素和带正电荷的cas12凹槽间发生结合,肝素浓度越高,cas12结合越多,切割能力越弱产生的荧光强度越弱。以肝素浓度为x轴,对应的与空白组的荧光比率f1/f0为y轴作图,得到肝素浓度与荧光比率之间的线性方程为y=-0.0263
×
x+0.739且线性相关系数r2为0.998,根据线性方程可计算出对应的肝素浓度。所述的检测方法能够排除其它生物分子的干扰,对肝素的检测限可以达到1.857ng/ml;
34.(4)本发明方法可用于血浆中检测肝素含量,确定的肝素有效检测范围为0.5ng/ml-20ng/ml,检测限为0.36ng/ml(0.02nm),并且表现出极高的灵敏度和选择性。
35.本发明通过肝素与cas12a结合,进一步抑制cas12的非特异性切割能力,通过荧光探针放大信号。本发明研究发现带强负电荷的肝素与cas12带正电荷的凹槽结合,锁定其构象,从而阻止cas12-crrna复合物的形成,进一步抑制cas12的ruvc结构域的dnase活性,无法切割带荧光信号标记的ssdna(fluorophore-quencher,fq),即阻碍切割携带荧光团和猝灭团双修饰的单链dna,通过检测荧光即可得知待检样品中是否含有肝素。基于此,本发明构建了一种基于crispr/cas12快速检测肝素的试剂盒和方法,其中设计了精准度最高、灵敏度最高的crrna保证了肝素检测的效果,即肝素浓度越高,荧光强度则越低,通过荧光强度的变化确定肝素的浓度。本发明的检测方法操作方便快捷,可在37℃的环境下40min内完成检测,检测成本低廉,不需要借助肝素的抗凝活性就能实现检测,对临床肝素用量的早期监测诊断与防控具有重要意义,具有广阔的应用前景。
36.本发明利用肝素与cas酶的特殊结合,能够更直接的进行检测,不需要鱼精蛋白等中间物作为转化,同时不需要借助肝素的抗凝活性就能实现肝素的直接检测。
37.有益效果:与现有技术相比,本发明具有如下优点:
38.(1)本发明建立的检测方法优势为成本低,无需昂贵仪器设备。本发明的检测方法只需恒温金属浴及荧光检测仪,所有仪器设备成本低,而不需专业规范的实验室。
39.(2)本发明提出的基于crispr/cas12系统的检测方法,具有灵敏度高且检测范围适宜的优点,更直接且检测限低,并且操作简单,生物相容性好,光学性能好。使得现代医学更加灵敏、准确、快速分析肝素含量在临床应用中的正常病理过程。
40.(3)本发明提出的检测试剂盒,原料来源广泛,可以实现肝素的直接检测,且检测限低。
附图说明
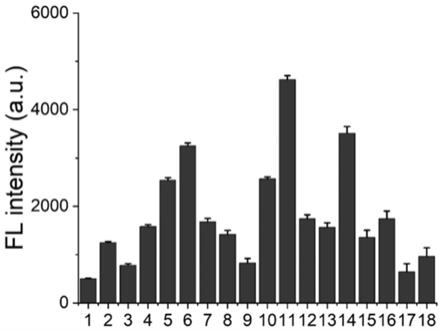
41.图1为本发明18个crrna对肝素样品crispr/cas12系统检测的荧光值。
42.图2为本发明mn
2+
对crispr/cas12检测肝素的影响。
43.图3为本发明基于crispr/cas12检测肝素的dna probe浓度(a)、ph(b)、cas12与crrna浓度(c)比以及总时间(d)优化。
44.图4为本发明基于crispr/cas12检测肝素方法中肝素浓度与荧光比率的线性关系图。
45.图5为本发明基于crispr/cas12检测肝素方法的选择性实验图。
具体实施方式
46.以下结合具体实施例进一步说明本发明,但实施例并不对本发明做任何形式的限定。
47.本发明以下实施例的统计学分析:所有的实验至少3次重复,结果采用平均值和标准误差表示。
48.药品和试剂:实验中所使用的所有dna均由生工生物工程(上海,中国)合成,并且经hap纯化。肝素钠,又称肝素,购自于上海生工生物工程;lbcas12a购买于new england;其他化合物均可从市场上购买得到。
49.实施例1
50.crrna的筛选:
51.crispr/cas12的检测核心在于crrna的质量,故crrna质量与检测方法的灵敏的准确度直接相关。为了筛选效率最高的得crrna我们设计了18个crrna如下表1所示:
52.表1
53.[0054][0055]
实施例2
[0056]
crispr/cas12a系统检测肝素体系如下表2:
[0057]
表2
[0058]
[0059][0060]
具体过程为:将上述cas酶(lbcas12a)、crrna、mn
2+
水溶液、10x ne buffer2.1、fq、肝素依次加入pcr管中组成预组装,室温静置10min后,再加入dna probe水溶液避光离心,其中缓冲液ph为8,离心后溶液放入37℃恒温金属浴中反应,反应时长为30min,65℃灭活后后转移至384酶标板中,用酶标仪读取荧光值,其检测条件λex:484nm,λem:530nm。
[0061]
实施例3
[0062]
筛选效率最高的crrna,对肝素样品按实施例2的方法处理后,反应体系中的crrna使用上述制备的18个crrna及其对用的dna probe,反应结束后用酶标仪读取荧光值。
[0063]
结果如图1所示,反应结束后crrna1的荧光值最低,说明在这18个crrna中这效果最好,灵敏度最高。
[0064]
表3结果所示为本发明最优的dna probe,fq以及crrna序列。
[0065]
表3基于crispr/cas12a检测肝素所需序列
[0066][0067]
实施例4
[0068]
确认mn
2+
水溶液对于酶活性的影响,对肝素样品按实施例2的方法处理后,反应结束后用酶标仪读取荧光值。
[0069]
结果如图2所示,反应结束后未加mn
2+
水溶液组的荧光差值较大,说明mn
2+
水溶液能够影响酶活,进一步影响检测结果。
[0070]
实施例5
[0071]
对基于crispr/cas12a检测肝素方案进行系统性优化:
[0072]
将crrna,cas12a,mn
2+
水溶液、10x ne buffer 2.1、fq、肝素溶液室温预组装10min后加入dna probe进行孵育,孵育条件为37℃30min,后65℃10min灭活后进行荧光测定。通
过更改反应条件进行整体的系统优化。
[0073]
如图3a所示,研究了不同浓度的dna probe(其他按实施例2的体系和浓度保持不变),通过计算不同浓度的dna probe(5-500nm)与对照组的荧光比值,最终确定dna probe浓度为50nm。如图3b所示,溶液的酸碱度可能会影响肝素与cas12a的结合,因此研究了ph(6-9)对肝素响应的影响(其他按实施例2的体系和浓度保持不变),当ph值为8时,获得了肝素与cas12a的结合最佳的信号响应。图3c表明cas12a的浓度固定在200nm,并引入不同量的crrna(50-500nm)(其他按实施例2的体系和浓度保持不变),当crrna的最终浓度达到100nm时,获得了最低的荧光比值,这表明在该系统中,crrna与cas12a的最佳比例为1:2。为了提高检测效率,根据裂解率的结果研究了crispr/cas12a系统的孵育时间,如图3d所示,在30min时获得最高的切割速率。通过以上优化,得到了整个反应体系的最佳条件,可以发现该方法可以在40min内实现检测,与需要借助鱼精蛋白进行转换的间接法相比具有较高的简便性。
[0074]
实施例6
[0075]
将crrna,cas12a,mn
2+
水溶液,10x ne buffer 2.1,fq,肝素室温预组装10min后,反应体系与实施例2相同,即在最优的体系下;其中,肝素浓度分别为0.5、1、3、5、8、10、15、20ng/ml的溶液肝素。再加入浓度为50nm的dna probe进行孵育,孵育条件为37℃30min,后65℃10min灭活后进行荧光测定。
[0076]
结果如图4所示,荧光比率(f1/f0)为y轴,肝素浓度为x轴,随肝素浓度增加,荧光比值呈线性下降的趋势,通过指数拟拟合出一条曲线,其相应线性方程为y=-0.0263x+0.739,r2=0.998,这说明该方法可以在0.5-20ng/ml检测肝素,实际上本发明方法可以在更大的浓度区间(达到500ng/ml以上)和高灵敏度下检测肝素,并且相对于现有技术具有宽的检测范围和低的检测限,检测结果更优良,检测限0.36ng/ml(0.02nm)。
[0077]
实施例7
[0078]
为进一步测试试剂盒的敏感度,对肝素的选择性研究,反应体系与实施例2相同,即在最优的体系下。具体包括以下步骤:
[0079]
将crrna,cas12a,mn
2+
水溶液,10x ne buffer 2.1,fq,肝素溶液(10ng/ml),室温预组装10min后加入10倍浓度的其他干扰物,包括:达肝素钠、依诺肝素钠、磺达肝癸钠、硫酸乙酰肝素、硫酸软骨素、透明质酸、牛血清白蛋白、血红蛋白以及dna probe进行孵育,孵育条件为37℃30min,后65℃10min灭活后进行荧光测定。
[0080]
从图5可以看出只有加入肝素的荧光降低,其他物质对crispr系统的荧光干扰很小,荧光强度基本没有变化。说明该测定方法特异性良好,在糖胺聚糖中,只对肝素有优异的选择性,能够应用在人体中对肝素的测定领域。
[0081]
实施例8
[0082]
新鲜人血浆样品中对肝素的检测研究,具体包括以下步骤:
[0083]
1)通过在稀释10倍新鲜血浆中添加肝素标准品,配制成浓度为5、10和15ng/ml肝素血浆溶液;
[0084]
2)对步骤1)的各个溶液用荧光检测法进行分析,步骤与实施例6中的方案相同,计算回收率。
[0085]
下表4为基于crispr/cas12a系统用于血浆中检测肝素的测定结果。
[0086]
表4
[0087][0088]
从表4中可以看出在人血浆样品中进行标准回收实验,回收率保持在101.3%-104.7%范围内,六次测定的相对标准偏差均都低于2.3%,这表明了该方法的可靠性和实用性。从获得的结果可以得出结论,本方法是有效的,并且可能适合直接检测肝素的临床应用。
[0089]
实施例9
[0090]
采用本发明的实施例6的方法与现有肝素检测相比较,本发明的检测限更低、效果更好,并且简单快捷、能够直接检测肝素、优异的选择性。
[0091]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1