一种复配微生物菌剂及其制备方法与流程
1.本发明涉及微生物领域,尤其涉及一种复配微生物菌剂及其制备方法。
背景技术:
2.农作物的生长过程都会伴随着病虫害,也会遇到产量和质量的问题。
3.在20世纪,大家会使用化学药剂解决上述问题,但是慢慢的发现了化学药剂的缺点,虽然能够一时解决问题,但是长期使用导致的抗药性、农药残留和土壤问题往往很难逆转,甚至于对人们的身体健康产生了威胁。
4.近年来,人们将目光投向生物领域,利用植物、动物、细菌等天然产物去解决上述问题,取得了一些成果,让大家看到了曙光,微生物,包括细菌也就随之成为了医药和农药的重要来源。
5.大量研究和实践表明,微生物菌剂能有效的改善土壤,促进土壤生态恢复,同时提高作物的抗病虫害的能力。在这些微生物中,比较受人关注的包括枯草芽孢杆菌、胶冻样类芽孢杆菌、地衣芽孢杆菌、巨大芽孢杆菌、解淀粉芽孢杆菌、酿酒酵母、侧孢短芽孢杆菌、细黄链霉菌、植物乳杆菌,近年来,人们对一种新的细菌-伯克氏菌的研究也逐渐增多。
6.伯克氏菌目属于细菌中变形菌门的β-变形菌纲,是继放线菌后的天然产物来源的第二大类细菌。伯克氏菌能够存在于水和土壤等多种生态环境中,能够分泌包括各种具有蛋白水解活性和溶血活性的胞外酶在内的多种次级代谢产物。通过研究,人们发现伯克氏菌中的一部分为植物促生菌,可定植于植物根部和根际,与植物宿主共生结瘤,在植物微生物联合修复领域被广泛关注与应用。但因伯克氏菌的种类、试验条件以及宿主植物的不同,使用伯克氏菌所显示的效果也不相同。
7.为了追求高效、便捷的使用,人们也在探索开发复配的微生物菌剂。但是往往由于细菌的存活条件不同,所得到的菌剂中,有效菌的数量不高,因此效果并不理想。
技术实现要素:
8.本发明通过筛选配比,筛选出了存活条件类似的微生物进行复配,得到一种微生物菌剂,该菌剂能够有效改善农作物生长的土壤环境,提高作物吸收营养的能力,增强作物的抗病性,促进生长,提高产量和品质。
9.前期经发明人筛选分离,得到一株伯克氏菌(burkholderia sp.m928),该伯克氏菌分离自云南省橡胶树的根际土壤,保藏编号为gdmcc no:61156,该伯克氏菌的主要特点包括:(1)较好的防治植物病虫害,例如植物寄生线虫、立枯病等;(2)改善作物生长的土壤环境;(3)有效的促进植物根系生长,提高作物产量和品质。
10.以该伯克氏菌为基础,发明人筛选了多种微生物和处方,最后组成了一种复配微生物菌剂,该复配微生物菌剂能较好的保留各组微生物的特性,并且,相对于单独的微生物
菌剂具有更好的杀线虫和促生作用,且该复配微生物菌剂可同时针对立枯丝核菌、柑橘溃疡病菌、青枯劳尔氏菌、枯萎病病菌等多种病菌产生防治效果,具有广谱抑菌性。
11.具体的技术方案如下:一种微生物菌剂,其主要成分包括微生物发酵液、黄腐酸钾、水、磷酸二铵,其特征在于,所述微生物发酵液由伯克氏菌、短小芽孢杆菌、枯草芽孢杆菌中的两种以上菌株的发酵液复配而成。
12.所述伯克氏菌分离自云南省橡胶树的根际土壤,样本采集自云南省橡胶树的根际土壤,分离过程如下:秤取4 g土样,加入到灭过菌的36 ml浓度为0.1%(v/v)的吐温水中,涡旋振荡10 min,获得10-1浓度稀释液。用吐温水将土壤液体梯度稀释至10-4、10-5和10-6浓度,然后涂布于lb固体培养基上,于30℃恒温培养箱中培养,1天后挑取单菌落,继续接种于lb固体培养基上,于30℃恒温培养箱中倒置培养1天,然后观察菌落形态,并用光学显微镜观察菌体型态(1000
×
)。
13.lb固体培养基:胰蛋白胨10 g,酵母粉5 g,nacl 10 g,琼脂粉15 g,补水至1l,121℃高压蒸汽灭菌20分钟。
14.该菌株为革兰氏阴性菌,菌落呈不透明的乳白色,形状为圆形,向上凸起,边缘湿润。
15.已于2020年8月21日保藏于广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼五楼,保藏编号为gdmcc no:61156。
16.所述短小芽孢杆菌(bacillus pumilusm101)分离自广州市的水中,该菌株为革兰氏阳性菌,菌落呈不透明的乳白色,形状为圆形。菌株呈杆状,圆末端,单个或呈短链排列,长约2.0微米。能运动,芽孢1.0~1.2
×
1.5~2.0微米,椭圆形。已于2021年10月22日保藏于广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼五楼,保藏编号gdmcc no:61962。
17.所述枯草芽孢杆菌可以通过常规商业途径购买得到。
18.本领域技术人员可以按照本领域常规方法进行发酵获得需要的微生物发酵液。
19.所述微生物发酵液由伯克氏菌、短小芽孢杆菌、枯草芽孢杆菌发酵液,按照质量比1:1:1复配而成。
20.优选的,所述微生物发酵液由伯克氏菌、短小芽孢杆菌发酵液,按照质量比1:1复配而成。
21.所述伯克氏菌发酵液和短小芽孢杆菌发酵液中的有效活菌数皆≥90亿/ml。
22.进一步的,该微生物菌剂主要成分的配比为:微生物发酵液40-80份,黄腐酸钾40-90份,水10-50份,磷酸二铵2-5份。
23.进一步的,该微生物菌剂主要成分的配比为:微生物发酵液50份,黄腐酸钾80份,水20份,磷酸二铵3份。
24.进一步的,该微生物菌剂的主要制备方法包括以下步骤:(1)微生物发酵液的制备:分离微生物菌株,经活化、发酵后,按照比例混合。
25.(2)称取黄腐酸钾、微生物发酵液、水、磷酸二铵,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
26.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
27.上述微生物菌剂可以用于防治植物病虫害,对包括但不限于根腐病、红中柱病、柑橘溃疡病、根结线虫、黄龙病、黄瓜立枯病、土豆疮痂病、烂脖子病、灰霉病、黑星病、炭疽病、猝倒病、青枯病、枯萎病等病害都有良好的防治作用;上述微生物菌剂还有促进作物生长的作用,尤其是针对茄子、番茄、黄瓜。
28.本发明的有益效果:本发明所公开的微生物菌剂中使用的微生物以及辅料,能够满足所有微生物的生长条件,保证菌剂中有效菌的数量,从而保证菌剂的效果:有效改善土壤环境,促进植物生长,增强植物抗病虫害能力,为减少化肥、减少农药、生产绿色农产品提供了技术支持,具有大面积应用推广前景。
附图说明
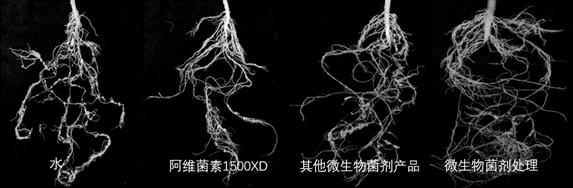
29.图1为本发明所述微生物菌剂对黄瓜根结线虫的盆栽实验防治效果-对黄瓜根系生长的影响比较。
30.图2为本发明所述微生物菌剂对黄瓜根结线虫的盆栽实验防治效果-对黄瓜植株生长的影响比较。
具体实施方式
31.需要特别说明的是,由于试验用地的限制,本发明仅优选了部分试验方案和代表性农作物开展盆栽和小区试验以验证本发明所述复配微生物菌剂的防病促生效果,但这并不能否定本发明涵盖的除优选的试验方案之外的其他试验方案的有效性。
32.实施例1 微生物菌剂的制备(1)取伯克氏菌、短小芽孢杆菌、枯草芽孢杆菌,经活化、发酵后,计数,每种发酵液中有效活菌数≥90亿/ml,按照质量比例1:1:1混合制得微生物发酵液。
33.(2)取黄腐酸钾80份、微生物发酵液50份、水20份、磷酸二铵3份,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
34.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
35.实施例2 微生物菌剂的制备(1)取伯克氏菌、短小芽孢杆菌,经活化、发酵后,计数,每种发酵液中有效活菌数≥90亿/ml,按照质量比例1:1混合制得微生物发酵液。
36.(2)取黄腐酸钾80份、微生物发酵液50份、水20份、磷酸二铵3份,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
37.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
38.实施例3 微生物菌剂的制备(1)取伯克氏菌、短小芽孢杆菌,经活化、发酵后,计数,每种发酵液中有效活菌数≥90亿/ml,按照质量比例1:1混合制得微生物发酵液。
39.(2)取黄腐酸钾40份、微生物发酵液40份、水10份、磷酸二铵2份,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
40.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
41.实施例4 微生物菌剂的制备(1)取伯克氏菌、短小芽孢杆菌,经活化、发酵后,计数,每种发酵液中有效活菌数≥90亿/ml,按照质量比例1:1混合制得微生物发酵液。
42.(2)取黄腐酸钾90份、微生物发酵液80份、水50份、磷酸二铵5份,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
43.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
44.实施例5 微生物菌剂的制备(1)取伯克氏菌、短小芽孢杆菌,经活化、发酵后,计数,每种发酵液中有效活菌数≥90亿/ml,按照质量比例1:1混合制得微生物发酵液。
45.(2)取黄腐酸钾60份、微生物发酵液60份、水25份、磷酸二铵3份,其中磷酸二铵与水加热溶解后,放至常温,加入微生物发酵液和黄腐酸钾后搅拌均匀。
46.(3)将第2步所得混合液喷雾干燥,所得粉末进行分装,即得微生物菌剂。
47.实施例6微生物菌剂对根结线虫的致死效果测试(1)分别取实施例1和2所得的微生物菌剂,加100倍量水稀释,作为微生物稀释液1和2。另取实施例1或2所用伯克氏菌发酵液和短小芽孢杆菌发酵液,分别加100倍量水稀释作为阳性对照稀释液1和2。
48.(2)分组。实验设置六个实验组,分别为处理组1组、处理组2组、阴性对照组1组、阳性对照1组、2组和3组。
49.其中,处理组1组和2组所加处理液分别为微生物稀释液1和2;阴性对照组所加处理液为无菌水;阳性对照1组和2组所加处理液分别为阳性对照稀释液1和2,阳性对照3组所加处理液为1.8%阿维菌素乳油1500倍稀释液。
50.每个实验组做5个孔(样本),每个实验重复3次。
51.(3)向24孔细胞培养板中加入450 μl处理液和50 μl线虫悬浮液(100条线虫二龄幼虫),室温下静置。24 h时,用1 mol/ml naoh溶液刺激各处理中的线虫后,僵直不动的为死虫,弯曲蠕动的为活虫。记录24h时的死虫数,并计算校正死亡率。
52.表1 各实验组杀线虫效果
各处理液对根结线虫的24h致死效果见表1。结果表明,伯克氏菌发酵液和短小芽孢杆菌发酵液处理组对根结线虫24h校正死亡率为分别为94.57%和92.50%,都高于专利cn102283253b中短小芽孢杆菌对根结线虫的24h致死率87%。另外,将两种发酵液进行复配后的微生物菌剂处理组则同阿维菌素对照组一样具有更好的杀线虫效果(24h校正死亡率都是100%)。表明复配后的微生物菌剂比未复配前具有更稳定高效的杀线虫效果。
53.实施例7微生物菌剂对黄瓜根结线虫的盆栽实验防治效果(1)基于实施例6的发现,伯克氏菌和短小芽孢杆菌的复配已具有稳定高效的杀线虫效果,本实施例直接取实施例2所得的微生物菌剂,加100倍量水稀释,作为微生物稀释液1。采购市售同类产品——新龙淡紫拟青霉,加300倍量水稀释,作为微生物稀释液2。
54.(2)分组:设置四个实验组,分别为阳性对照1组和2组、微生物菌剂处理组和空白对照组。其中,各实验组使用的处理液如下:阳性对照1组使用阿维菌素(稀释1500倍)、阳性对照2组使用微生物稀释液2,微生物菌剂处理组使用微生物稀释液1,空白对照组使用无菌水处理。
55.每个组设置10株黄瓜苗,并重复3次。
56.(3)将各组黄瓜种子(品种:粤秀3号)播种到灭菌的基质土中育苗。至第一片真叶长出时,移苗至装有灭菌基质土的塑料钵(7cm*7cm*10cm)中,待黄瓜幼苗长至两片真叶,在各实验组幼苗土壤中接种15 ml相应的处理液。1天后,接种根结线虫二龄幼虫,每株接种300条,在室温下正常管理,并在30天后检测根结数量,计算对根结线虫的防治效果。比较各组的根系情况和地上部分。
57.各实验组对黄瓜根结线虫的防治效果见表2和图1,对黄瓜苗的促生效果见图2。
58.表2不同处理根结数量及防治效果从表2和图1可以看出,在防治根结线虫方面,微生物菌剂处理组的防效为83.13%,略低于化药处理的阳性对照1组89.44%的防效,但明显高于市售同类产品处理的阳性对照2组66.86%的防效。
59.另外,从图2可以看出,阳性对照1组和2组所用的阿维菌素化药和淡紫拟青霉菌剂对黄瓜苗的生长不具备明显的促进作用,而微生物菌剂处理后的黄瓜苗生长优势极其明显(表现在株高、叶面展开度、根系发达程度等方面),这可能与化药本身对植株苗的毒性以及菌株自身的定植能力、功能特性等因素有关。因此,在杀线虫效果相当的情况下,本发明复配的微生物菌剂将具备比传统化药和/或市售同类产品更好的促生效果。
60.实施例8 微生物菌剂对番茄、茄子促生效果的小区实验
基于实施例7发现的微生物菌剂对盆栽黄瓜苗的促生作用,进一步开展小区放大实验以期验证其促生效果的可靠性和稳定性。
61.根据现有小区实验用地,选择番茄和茄子两种植物进行小区实验,其中番茄地块选用实施例1所得的微生物菌剂进行实验,茄子地块选用实施例2所得的微生物菌剂进行实验。具体实验方案和实验结果如下:一、微生物菌剂对番茄促生效果的小区实验(1)准备:取实施例1所得的微生物菌剂,加200倍量水稀释,作为微生物菌剂稀释液备用。
62.(2)分组:实验分为三组,包括微生物菌剂处理组、阳性对照组和空白对照组。各组浇灌所用浇灌液分别为:微生物菌剂处理组使用微生物菌剂稀释液,阳性对照组使用市售品牌卓润
®
微生物菌剂(解淀粉芽孢杆菌),空白对照组使用清水处理。
63.随机区组排列,1行为1个小区,每小区去头尾取 20 株进行测试,每个处理1个小区,试验重复3 次。
64.(3)育苗:将番茄种子播种于育苗盘中,待长出3片真叶后定植。待番茄幼苗移栽 2周后,进行第一次浇灌,14天后进行第二次浇灌,开花前期进行第三次浇灌。每次浇灌,微生物菌剂处理组取微生物菌剂稀释液250 ml进行浇灌,空白对照组取等量清水,阳性对照组按照推荐剂量施用。
65.(4)观察及记录:花期观察开花情况,药后20 d调查各组株高,收获时每小区随机摘取100个果实称量单果重、果实横径,并进行品质测定,记录小区总产量。实验结果见表3、表4。
66.表3不同处理对番茄株高和坐果率的影响由表3可知,与空白对照组和阳性对照组相比,施用复配微生物菌剂处理的番茄植株株高和坐果率显著增加,该促生长效果体现在植株整个生长周期,说明微生物菌剂能有效促进植株生长,植株整体长势佳。而较佳的植株长势通常意味着果实产量和品质的更理想性。
67.表4 不同处理对番茄产量及品质的影响表4可知施用复配微生物菌剂处理的番茄小区平均产量为201.10 kg,比空白对照组和阳性对照组小区的平均产量分别高出26.35kg和9.72kg,且番茄单果重量和果径的更理想。说明本发明的复配微生物菌剂可达到比市售同类型产品相当甚至是更佳的促生增产
效果,且果实品质更理想。
68.二、微生物菌剂对茄子植株促生效果的小区实验该部分实验采用同上述番茄促生效果的小区实验同样的实验方案,不同的是:(1)种子由番茄种子替换为茄子种子;(2)微生物菌剂处理组使用实施例2所得的微生物菌剂、阳性对照组使用史丹利劲素17-17-17(市售肥料,有强壮根系的作用)进行相应替换,其他一致。
69.在茄子采摘期观察、测定不同处理组的植株高度以及根系鲜重,结果比对见表5。
70.表5不同处理对茄子植株的影响与阳性对照组相比,施用复配微生物菌剂的茄子植株稳定增高(47.10cm),植株较阳性对照组(42.36cm)增高了4.74cm(11.19%)。且通过定期观察发现,该促生长的效果体现在植株开花结果的整个生长阶段,说明微生物菌剂能有效促进植株生长,植株整体长势佳。另外,待采摘期结束后称量植株根系重量发现,施用微生物菌剂的茄子植株平均根系重量为170g,与具有强壮根系作用的阳性对照组茄子植株的平均根系重量相当(168g),且显著高于空白对照组平均根系重量(103g),说明微生物菌剂具有促进根系发育的能力。
71.因此,本发明提供的微生物菌剂既能显著促进作物根系发育,又能提升植株整体生长态势和果实产量,从而达到提升植株抗倒伏能力、保证作物产量和质量的目的。
72.实施例9微生物菌剂对黄瓜立枯病的盆栽实验防治效果(1)分别取实施例1和2所得的微生物菌剂,加100倍量水稀释,作为微生物稀释液1和2。另取实施例1或2所用伯克氏菌发酵液和短小芽孢杆菌发酵液,分别加100倍量水稀释作为阳性对照稀释液1和2。
73.(2)分组。实验设置六个实验组,分别为处理组1组、处理组2组、阴性对照组1组、阳性对照1组、2组和3组。
74.各组浇灌所用浇灌液分别为:处理组1组和2组分别为微生物稀释液1和2;阴性对照组为无菌水;阳性对照1组和2组分别为阳性对照稀释液1和2,阳性对照3组为甲基托布津1000倍稀释液。每个组设置6株黄瓜苗,并重复3次。
75.(3)将粤秀3号黄瓜种子播种到装有灭菌基质土的塑料钵(7cm*7cm*10cm)中,每钵3株。至第一片真叶长出时(14天),用园艺小花铲破坏植株根系后,每钵浇灌100 ml对应组的浇灌液。24 h后,接种病原菌立枯丝核菌(rhizoctonia solani),1周后,进行第2次接种。完成第2次接种5天后,将黄瓜苗根部泥土清洗干净,观察记录植株病级并测量鲜重、叶面积及干重等生理指标。并计算病情指数及相对防效,结果见表6。
76.病级分级指标:0级:黄瓜苗茎基部无病斑1级:黄瓜苗茎基部有小病斑,所占茎围的比例小于1/42级:黄瓜苗茎基部病斑较大,约占茎围比例的1/4~1/2之间
3级:黄瓜苗基部病斑所占比例大于1/2,但未破坏整个茎围4级:黄瓜苗根茎相接处出现凹陷或断裂,腐烂变褐等症状病情指数计算公式:相对防效计算公式:表6不同处理病情指数及防治效果由表6结果可知,单独使用伯克氏菌对立枯丝核菌的防效仅为66.46%,而单独使用短小芽孢杆菌或者将伯克氏菌与短小芽孢杆菌复配后(实施例2)对立枯丝核菌的防效分别提升至76.24%和74.85%,而按实施例1的方式复配后的微生物菌剂防效提升至80.44%,与有多种作物病害防治效果的甲基托布津产品的防效相当(81.83%)。说明本发明的微生物菌剂对由立枯丝核菌引起的黄瓜立枯病有较好的防治效果。
77.实施例10微生物菌剂对柑橘溃疡病的离体防治试验(1)取实施例2所得的微生物菌剂,加100倍量水稀释,作为微生物菌剂稀释液备用。
78.(2)将供试的柑橘溃疡病菌在直径为90mm的培养皿上用培养基28℃培养48h后,用无菌接种环刮取一环菌苔置于50ml牛肉膏蛋白胨无菌液体培养基中培养24h,利用紫外可见分光光度计,测定菌液的od值,通过标准曲线换算成菌浓度,再用牛肉膏蛋白胨液体培养基将菌液稀释成约108cfu/ml的病原菌菌悬液。用无菌水将供试杀菌剂稀释500倍,备用。
79.用微量可调移液枪将1ml微生物菌剂稀释液以及1ml浓度为108cfu/ml的病原菌菌悬液依次加入装有8ml牛肉膏蛋白胨液体培养基的20ml玻璃瓶中,作为微生物菌剂处理组;以加入等量的无菌水作空白对照组;以加入等量的27.12%的碱式硫酸铜溶液500倍稀释液作阳性对照组,置于120rpm,28℃恒温振荡器培养24h,再用紫外可见分光光度计测定菌液的od值,每个处理设置3个重复。
80.杀菌剂对柑橘溃疡病菌抑制率的计算公式为:
(3)根据药剂浓度和抑制率的相关现象,先找出抑制率约为20%和90%所对应的两个药剂浓度,算出公比,在抑制率为20%-90%之间设置五个不同剂量的等比浓度做毒力测定。根据菌抑制率与其所对应的杀菌剂浓度,用dps7.05统计软件中的生物测定方法计算杀菌剂对柑橘溃疡病菌的抑制有效中浓度,即为ec50,结果见表7。
81.表7不同处理对柑橘溃疡病菌的生防结果由表7可以看出,本发明所提供的微生物菌剂对柑橘溃疡病菌的抑制率为85.13%,其对抗柑橘溃疡病菌的能力并不弱于碱式硫酸铜。
82.实施例11微生物菌剂对青枯劳尔氏菌r.s 的盆栽生防效果(1)取实施例2所得的微生物菌剂,加100倍量水稀释,作为处理组药物。
83.(2)分组。分为三组,包括处理组、阳性对照组、阴性对照组和空白对照组。其中,空白对照组和阴性对照组使用清水处理;阳性对照组使用新植霉素1000倍稀释液。
84.(3)r.s 菌悬液制备:将青枯劳尔氏菌r.s (ralstonia solanacearum)从甘油管中活化到ttc平板(配方为:葡萄糖5 g,蛋白胨10g,水解络蛋白1 g,琼脂15 g,加水至1l,121℃灭菌20min,冷却至60℃后加ttc,使终浓度为0.005%(w/v))上,培养2 d后选取活性高的青枯菌落转接至spa液体培养基(配方为:蔗糖20 g,细菌学蛋白胨5g,k2hpo
4 0. 5 g,mgso
4 0.25 g,加水至1l,调至ph为7.0~7.2,121℃灭菌20min)中,摇床上培养8-16 h后再根据od
600
的吸光度值将r.s稀释至107cfu/ml,制得r.s 菌悬液备用。
85.(4)番茄苗处理:取生长20 d的番茄苗,轻轻抖去根表面泥土,将根部浸泡于各组处理液中10 min,随即种入灭菌土中,每盆1株,6盆为1个处理,5重复。
86.将盆栽置于25-28℃环境中缓苗7 d后用园艺小铲插入根部四周土中,使番茄根部受损造成伤口。然后将阴性对照组、阳性对照组和菌剂处理组的每株苗灌入50 ml 107cfu/ml的r.s菌悬液,空白对照组灌等量清水。
87.(5)观察以及结果:在出现症状的第一个迹象(番茄苗出现青枯症状)开始(一般为灌根后第5 d开始发病),每天观测记录一次番茄苗状态(根据分级标准记录发病情况),至第10 d-13 d(视实际发病情况确定),记录各处理每个病级的植株数,并计算病情指数和防治效果,结果见表8。
88.植株病情等级分为以下5级:0级:无症状1级:一片叶萎蔫2级:2-3片叶萎蔫
3级:整株枯萎4级:植株死亡由表8可知,微生物菌剂处理后的番茄苗植株病情指数降低至25.39%,病菌防治效果达41.86%,而新植霉素稀释液处理的阳性对照组病情指数和病菌防治效果分别为27.60%和36.80%。即本发明复配的微生物菌剂同市售常用防治由青枯劳尔氏菌引起的植物病害的产品具有相当甚至是更优的病菌防治效果。产品具有相当甚至是更优的病菌防治效果。
89.表8 各处理组对青枯劳尔氏菌的生防效果实施例12 微生物菌剂对冬瓜枯萎病(fusarium oxysporum)的田间生防效果(1)按照实施例2所述方法制备微生物菌剂,加100倍量水稀释,作为微生物菌剂稀释液1备用。另取实施例1或2所用短小芽孢杆菌发酵液,加100倍量水稀释作为微生物稀释液2备用。
90.(2)分组。分为5组,包括处理1组、处理2组、阳性对照1组、阳性对照2组、阴性对照组和空白对照组。其中,空白对照组和阴性对照组使用清水处理;处理1组使用微生物菌剂处理;处理2组使用短小芽孢杆菌发酵稀释液处理;阳性对照1组使用亮盾(主要成分为咯菌腈和精甲霜灵)按照说明书要求处理;阳性对照2组使用市售微生物菌剂产品卓润
®
(解淀粉芽孢杆菌)按照说明书要求处理。
91.(3)实验方法:冬瓜品种莞研2号小冬瓜;大棚种植。每处理10棵苗,实验重复3次。冬瓜苗定植时每株浇灌250 ml处理药剂,冬瓜定植3 d 后,开始浇灌浓度为1
×
106cfu/ml的冬瓜枯萎病菌(fusarium oxysporum)孢子悬浮液,每株瓜苗浇灌50 ml。以后根据天气情况每隔10~15 d用处理药剂灌根1次,共施用3次。采用常规方法进行栽培管理。2次浇灌处理3周后,调查冬瓜枯萎病发病率。
92.(4)观察及结果:见表9。
93.表9 菌株对冬瓜枯萎病的生防效果
由表9可知,本发明所用短小芽孢杆菌稀释液比市售解淀粉芽孢杆菌产品具有更好的冬瓜枯萎病病菌生防效果(发病率分别为8.23%和14.47%),而经复配的微生物菌剂又能进一步降低冬瓜枯萎病发病率(6.15%)。且通过观察发现,经本发明的复配微生物菌剂处理的冬瓜植株长势更好,叶片展开面积、藤蔓粗壮度、开花数量等都明显优于其他处理组。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1