一种通过分子自组装技术实现非变性蛋白水凝胶的构建方法
1.本发明涉及一种通过分子自组装技术实现制备非变性蛋白水凝胶材料,制备所得的蛋白水凝胶可以通过金属离子进行可逆调控,同时具有可注射性以及自愈功能。
背景技术:
2.水凝胶是一种兼顾固液两相特性的高分子聚合物,通常是通过物理或化学交联等手段形成三维网络结构,可以在水中迅速溶胀并持有大量的水分而不溶解。水凝胶材料因具有独特的多孔结构、较好的粘弹性、以及延展性近些年来受到了科学家的重点关注。目前水凝胶在细胞支架,环境工程以及设备涂料等领域上,拥有着广阔的应用前景。一些天然的水凝胶材料,如琼脂糖,明胶和甲基纤维素等,目前已经应用于农业生产中,作为一种缓释材料将农药或化肥等物质缓慢释放,提高这类化学品的利用率并改善土壤的保水率;另外一类用聚丙烯酰胺,丙烯酸酯,聚丙烯醇等化学物质为原料的人工合成水凝胶同样在废水处理、电泳材料等方向有着重要的用途。
3.近些年来以功能活性物质为材料制备水凝胶成为领域研究的热点,并显示出巨大的应用潜力。以多糖,蛋白质/多肽和核酸为原料的水凝胶可以模拟细胞外基质环境,又具有重要的生物学功能,倍受科学家青睐。其中蛋白质水凝胶材料,因蛋白质具有良好的生物相容性或酶催化特性,使其在功能材料、药物递送、伤口愈合、组织再生等领域成为国际上热点研究领域。但是,蛋白质本身具有复杂的结构和表面不均一性,使得蛋白为原料制备凝胶具有很强的挑战性。
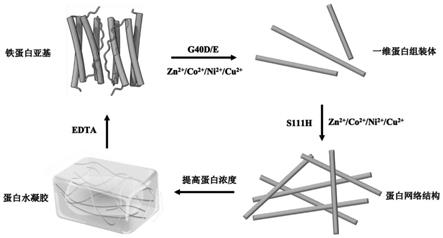
4.随着分子生物学等技术的持续发展,蛋白质自组装是近20年发展起来的新型研究领域,显示出巨大的潜力。蛋白质自组装是指以蛋白质为构建模块,通过共价或非共价作用力,使蛋白质可以自发进行定向排列的过程。科学家可以将目标蛋白进行修饰,通过在合理的作用位点引入作用力,成功构建出零维、一维、二维和三维的蛋白组装体。在构建这些不同的蛋白维度组装体中,一维方向的蛋白组装体的构建引人关注。在自然界中,蛋白质的一维组装体执行了大量的生物学功能:细胞骨架的形成、分子运输、细胞内吞等过程。除此之外,一维方向的组装也颇具挑战,需要在设计过程中对于组装体的长度、宽度和动力学过程进行精准的控制。结合目前的蛋白质组装技术,和一维蛋白组装体的设计思路,先将蛋白质进行一维组装构建形成蛋白纤维,然后再通过蛋白界面设计将形成的蛋白纤维进一步自组装形成三维蛋白网状结构,以达到构建蛋白水凝胶的目的同时保留蛋白质的天然结构与功能。
5.目前,利用自组装技术在体外制备一种非变性蛋白水凝胶结构的技术还未见报道。
技术实现要素:
6.针对上述技术问题,本发明的目的是提供一种通过分子自组装技术实现对于非变性蛋白水凝胶构建方法
7.为了实现上述目的,本发明提供了如下技术方案:
8.一种通过分子自组装技术实现对于蛋白水凝胶的构建方法,所述制备方法包括如下步骤:
9.a)蛋白突变体的设计及制备:以海栖热袍菌来源的古菌铁蛋白的序列为模板(genbank:ake30776.1),通过pcr基因扩增技术对该序列进行单点突变,在150位甘氨酸后添加一个终止密码子,命名为tmftn
△
e。随后以tmftn
△
e的序列为模板,同样通过pcr基因扩增技术对该序列进行单点突变将tmftn
△
e的40位甘氨酸突变为谷氨酸/天冬氨酸,得到命名为tmftn
△
e40d/e的铁蛋白突变体。将该突变体的质粒导入bl21(de3)感受态中,在含有终浓度为50μg/mlamp的lb培养基中进行大肠杆菌的扩增,当od600达到0.8左右时,通过添加200μm的iptg诱导获得目的蛋白。诱导5小时后将菌体离心后,通过超声破碎仪对细胞进行破碎,超声时间为3s,工作间隔为4s,功率为220w,循环90次。随后将细胞破碎液在85℃中加热15min,离心后取上清获得粗蛋白溶液。进一步通过60%的硫酸铵沉淀进一步对目标蛋白进行纯化,随后透析到25mmph8.0的tris-hcl缓冲液中。采用阴离子交换柱mono-q和凝胶过滤柱superdex 200进一步纯化,首先用缓冲液(50mmtris-hcl,ph 8.0)平衡阴离子达至少2个柱体积后,将上步所得的粗蛋白上柱。用2倍体积的缓冲液(50mmtris-hcl,ph 8.0)冲洗去除部分没有和填料结合的杂蛋白,再用含0~0.5mnaclph 8.0 50mmtris-hcl进行梯度洗脱。sds电泳进行验证后合并目的蛋白,将目标蛋白浓缩后,再进行凝胶纯化。先用缓冲液(50mmtris-hcl,ph 8.0,150mmnacl)平衡凝胶过滤柱至少两个柱体积,上样并进行洗脱,流速为0.5ml/min,最终通过sds-page电泳检验纯度;
10.b)将2mg/ml的tmftn
△e40d/e
蛋白溶液透析到含有0.5~2mm锌/钴/镍/铜离子ph=7.0~9.0的hepes/mops/tris缓冲液中,此时蛋白与金属离子的比例为1:20,在室温下透析2~24h便可以得到宽度约为5nm的一维线性组装结构。
11.c)在tmftn
△e40d/e
的序列基础上,将111位的丝氨酸突变为组氨酸,得到命名为tmftn
△e40d/e/111h
的铁蛋白突变体,分离纯化后制备0.5mg/ml以上的蛋白溶液。按照相同方式透析到含有0.5~2mm锌/钴/镍/铜离子ph=7.0~9.0的hepes/mops/tris缓冲液中,室温下透析2~24h便可以得到蛋白的三维网络结构组装体。
12.d)调整tmftn
△e40d/e/111h
蛋白的浓度至10~50mg/ml,在蛋白溶液中分十次缓慢加入锌/钴/镍/铜离子并均匀搅拌,最终锌/钴/镍/铜离子为5-20mm,此时便可以得到蛋白水凝胶材料。
13.一种根据所述的制备方法制备的蛋白水凝胶首先通过锌/钴/镍/铜离子金属配位作用首先实现了蛋白质的一维线性组装,且该一维组装体不会聚集成簇,宽度约为5nm,是设计凝胶网络的理想结构。
14.所述的蛋白水凝胶在构建时,在一维线性组装体的基础上引入第二个金属配位点后,可以将原本的一维线性组装交织成网络结构,通过提高蛋白浓度即可得到水凝胶材料。
15.所述的蛋白水凝胶的两个金属配位点互不干扰且彼此正交,且可以通过不同的金属类型对凝胶结构进行调控。
16.所述的蛋白水凝胶具有金属可逆调控的特性,蛋白可以通过金属离子的响应形成凝胶,而凝胶结构可以通过10~50mmedta或其他螯合剂的作用下变成蛋白溶液状态。
17.所述的蛋白水凝胶具有可注射性以及自愈功能,当剪切应力超过10%的时候凝胶
会变成溶液状态,恢复应力为1%凝胶结构又重新形成。
18.所制备的水凝胶在低浓度条件下,通过透射电镜观察到一种交错排列的蛋白组装体结构。利用冷冻扫描电镜直接观察其剖面结构,呈现出一种疏松多孔的网络结构,且形成的凝胶较为澄清透明,倒立放置后不会沿瓶壁流下。
19.与现有技术相比,本发明的有益效果在于:
20.采用本发明制备的利用分子自组装技术制备的蛋白水凝胶保留了蛋白本身的天然结构及功能活性,拓宽了其应用场景,且具有可注射性以及自愈功能,能够适应其在工业以及医学领域的应用需求。
附图说明
21.图1利用分子自组装构建蛋白水凝胶的示意图;
22.图2蛋白一维和网络结构组装体的透射电镜图、冷冻扫描电镜图以及水凝胶图片。
具体实施方式
23.本发明涉及一种通过分子自组装技术制备具有非变性蛋白水凝胶材料,制备所得的蛋白水凝胶可以通过金属离子进行可逆调节,同时具有可注射性以及自愈功能。
24.一种通过分子自组装技术制备具有非变性蛋白水凝胶材料,制备方法包括如下步骤:
25.(a)蛋白突变体的设计及制备:以海栖热袍菌来源的古菌铁蛋白的序列为模板(genbank:ake30776.1),通过pcr基因扩增技术对该序列进行单点突变,在150位甘氨酸后添加一个终止密码子,命名为tmftn
△
e。随后以tmftn
△
e的序列为模板,同样通过pcr基因扩增技术对该序列进行单点突变将tmftn
△
e的40位甘氨酸突变为谷氨酸/天冬氨酸,得到命名为tmftn
△
e40d/e的铁蛋白突变体。将该突变体的质粒导入bl21(de3)感受态中,在含有终浓度为50μg/mlamp的lb培养基中进行大肠杆菌的扩增,当od600达到0.8左右时,通过添加200μm的iptg诱导获得目的蛋白。诱导5小时后将菌体离心后,通过超声破碎仪对细胞进行破碎,超声时间为3s,工作间隔为4s,功率为220w,循环90次。随后将细胞破碎液在85℃中加热15min,离心后取上清获得粗蛋白溶液。进一步通过60%的硫酸铵沉淀进一步对目标蛋白进行纯化,随后透析到25mmph 8.0的tris-hcl缓冲液中。采用阴离子交换柱mono-q和凝胶过滤柱superdex 200进一步纯化,首先用缓冲液(50mmtris-hcl,ph 8.0)平衡阴离子达至少2个柱体积后,将上步所得的粗蛋白上柱。用2倍体积的缓冲液(50mm tris-hcl,ph 8.0)冲洗去除部分没有和填料结合的杂蛋白,再用含0~0.5m nacl ph 8.0 50mmtris-hcl进行梯度洗脱。sds电泳进行验证后合并目的蛋白,将目标蛋白浓缩后,再进行凝胶纯化。先用缓冲液(50mm tris-hcl,ph 8.0,150mm nacl)平衡凝胶过滤柱至少两个柱体积,上样并进行洗脱,流速为0.5ml/min,最终通过sds-page电泳检验纯度;
26.(b)将2mg/ml的tmftn
△e40d/e
蛋白溶液透析到含有0.5~2mm锌/钴/镍/铜离子ph=7.0~9.0的hepes/mops/tris缓冲液中,此时蛋白与金属离子的比例为1:20,在室温下透析2~24h便可以得到宽度约为5nm的一维线性组装结构。
27.(c)在tmftn
△e40d/e
的序列基础上,将111位的丝氨酸突变为组氨酸,得到命名为tmftn
△e40d/e/111h
的铁蛋白突变体,分离纯化后制备0.5mg/ml以上的蛋白溶液。按照相同方
式透析到含有0.5~2mm锌/钴/镍/铜离子ph=7.0~9.0的hepes/mops/tris缓冲液中,室温下透析2~24h便可以得到蛋白的三维网络结构组装体。
28.(d)调整tmftn
△e40d/e/111h
蛋白的浓度为10~50mg/ml,在蛋白溶液中分十次缓慢加入锌/钴/镍/铜离子并均匀搅拌,最终锌/钴/镍/铜离子为5~20mm,此时便可以得到蛋白水凝胶材料。
29.本发明中,序列信息包括:
30.tmftn
△e31.mmvisekvrkalndqlnreiyssylylsmatyfdaegfkgfahwmkkqaqeelthamkfyeyiyerggrveleaiekppsnwngikdafeaalkheefvtqsiynilelaseekdhatvsflkwfvdeqveeedqvreildllekang(seq id no:1)
32.tmftn
△e40d/e
33.mmvisekvrkalndqlnreiyssylylsmatyfdaegfkd(e)fahwmkkqaqeelthamkfyeyiyerggrveleaiekppsnwngikdafeaalkheefvtqsiynilelaseekdhatvsflkwfvdeqveeedqvreildllekang(seq id no:2)
34.tmftn
△e40d/e/111h
35.mmvisekvrkalndqlnreiyssylylsmatyfdaegfkd(e)fahwmkkqaqeelthamkfyeyiyerggrveleaiekppsnwngikdafeaalkheefvtqsiynilelaheekdhatvsflkwfvdeqveeedqvreildllekang(seq id no:3)
36.一种根据所述的制备方法制备的蛋白水凝胶首先通过锌/钴/镍/铜离子金属配位作用首先实现了蛋白质的一维线性组装,且该一维组装体不会聚集成簇,宽度约为5nm,是设计凝胶网络的理想结构。
37.所述的蛋白水凝胶在构建时,在一维线性组装体的基础上引入第二个金属配位点后,可以将原本的一维线性组装交织成网络结构,通过提高蛋白浓度即可得到水凝胶材料。
38.所述的蛋白水凝胶的两个金属配位点互不干扰且彼此正交,且可以通过不同的金属类型对凝胶结构进行调控。
39.所述的蛋白水凝胶具有金属可逆调控的特性,蛋白可以通过金属离子的响应形成凝胶,而凝胶结构可以通过10~50mm edta或其他螯合剂的作用下变成蛋白溶液状态。
40.所述的蛋白水凝胶具有可注射性以及自愈功能,当剪切应力超过10%的时候凝胶会变成溶液状态,恢复应力为1%凝胶结构又重新形成。
41.所制备的水凝胶在低浓度条件下,通过透射电镜观察到一种交错排列的蛋白组装体结构。利用冷冻扫描电镜直接观察其剖面结构,呈现出一种疏松多孔的网络结构,且形成的凝胶较为澄清透明,倒立放置后不会沿瓶壁流下。
42.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
43.实施例1
44.本发明中海栖热袍菌铁蛋白突变体的蛋白表达和纯化步骤的进行。
45.(1)海栖热袍菌铁蛋白突变体的质粒制备及蛋白表达
46.蛋白突变体的设计及制备:以海栖热袍菌来源的古菌铁蛋白的序列为模板(genbank:ake30776.1),通过pcr基因扩增技术对该序列进行单点突变,在150位甘氨酸后
添加一个终止密码子,命名为tmftn
△
e。随后以tmftn
△
e的序列为模板,同样通过pcr基因扩增技术对该序列进行单点突变将tmftn
△
e的40位甘氨酸突变为谷氨酸/天冬氨酸,得到命名为tmftn
△
e40d/e的铁蛋白突变体。将该突变体的质粒导入bl21(de3)感受态中,具体操作为将5μl的突变体质粒加入到100μl的感受态细胞中,在冰上静置30min后在金属浴中42℃精准热击60s,随后在冰上静置2min。随后在感受态细胞中加入500μl的lb培养基,在37℃摇床中复苏1h后均匀涂在含有amp抗性的固体培养基的平板中放置于37℃培养箱中。培养过夜后挑取单菌落在含有终浓度为50μg/mlamp的5ml小管中复苏,随后接种到500ml的锥形瓶中进行扩增培养,当od600达到0.8左右时,通过添加200μm的iptg诱导获得目的蛋白。
47.(2)海栖热袍菌铁蛋白突变体的质粒制备及蛋白表达
48.在蛋白诱导5小时后将菌体离心后,通过超声破碎仪对细胞进行破碎,超声时间为3s,工作间隔为4s,功率为220w,循环90次。随后将细胞破碎液在85℃中加热15min,10000rpm下离心10min后取上清获得粗蛋白溶液。进一步通过60%的硫酸铵对目标蛋白进行沉淀,静置4h后10000rpm下离心10min获得蛋白沉淀,随后透析到25mmph 8.0的tris-hcl缓冲液中,每次透析5h并重复三次。透析结束后10000rpm下离心10min取蛋白上清液,采用阴离子交换柱mono-q和凝胶过滤柱superdex 200进一步纯化,首先用缓冲液(50mm tris-hcl,ph 8.0)平衡阴离子达至少2个柱体积后,将上步所得的粗蛋白上柱。用2倍体积的缓冲液(50mm tris-hcl,ph8.0)冲洗去除部分没有和填料结合的杂蛋白,再用含0~0.5m nacl ph 8.0 50mm tris-hcl进行梯度洗脱。sds电泳进行验证后合并目的蛋白,将目标蛋白利用截留量为10kda的浓缩管浓缩后,再进行凝胶纯化。先用缓冲液(50mmtris-hcl,ph8.0,150mmnacl)平衡凝胶过滤柱至少两个柱体积,上样并进行洗脱,流速为0.5ml/min,最终通过sds-page电泳检验纯度;
49.实施例2
50.本发明中海栖热袍菌一维蛋白组装体的构建、蛋白网络结构的形成及蛋白水凝剂的制备各步骤的进行。
51.(1)海栖热袍菌一维及网络结构蛋白组装体的构建
52.将海栖热袍菌铁蛋白tmftn
△e40d/e
分离纯化后,先透析到含有10~50mm edta的缓冲液中(ph8.0,25mm hepes,250mm nacl)以完全除掉游离的金属离子。随后将蛋白溶液再次透析到缓冲液中(ph8.0,25mm hepes,250mmnacl)以除去edta及其形成的金属络合物。用lowery法对蛋白浓度进行测量,制备终浓度为1mg/ml的蛋白母液。用酸化水制备母液浓度为100mm的锌/钴/镍/铜离子溶液,稀释相应倍数加入到ph8.0,25mm hepes,250mm nacl的缓冲液中,使锌/钴/镍/铜离子的终浓度为0.5mm。将制备好的蛋白母液透析到含有锌/钴/镍/铜离子的缓冲液中,透析4h后即可得到一维线性组装体。
53.蛋白网络结构组装体的制备与上述方法一致,以tmftn
△
40d/e/111h
为原料重复上述操作即可制备成功。
54.(2)蛋白水凝胶的构建及其可逆调控
55.a.以tmftn
△
40d/e/111h
突变体为实验原料,用截留分子量为100kda的超滤浓缩管对蛋白进行浓缩,最终得到蛋白浓度为10mg/ml的蛋白母液。取1ml蛋白母液加入到透明的玻璃样品瓶中,内置转子缓慢搅拌。用酸化水制备母液浓度为100mm的锌/钴/镍/铜离子溶液,使用移液枪每次向样品瓶中滴加5μl,充分搅拌十分钟后继续滴加5μl的锌/钴/镍/铜离子
母液,重复滴加8次,使得样品瓶中锌/钴/镍/铜离子终浓度为4mm。此时蛋白与锌/钴/镍/铜离子的比例约为1:10,通过将小瓶倒置证明此状态下已形成凝胶结构。
56.b.取1mlph8.0,10-50mm的edta溶液与凝胶等体积比例混合,缓慢振荡约2min后凝胶逐渐溶解,成溶液状态。将此溶液透析到缓冲液中(ph8.0,25mmhepes,250mmnacl)以除去edta和其余金属离子。重新调整蛋白浓度为10mg/ml,重复步骤a的操作后凝胶结构又再次形成。
57.实施例3
58.(1)钙离子诱导海栖热袍菌一维及网络结构蛋白组装体
59.将海栖热袍菌铁蛋白tmftn
△e40d/e
分离纯化后,先透析到含有10-50mm edta的缓冲液中(ph 8.0,25mm hepes,250mm nacl)以完全除掉游离的金属离子。随后将蛋白溶液再次透析到缓冲液中(ph 8.0,25mm hepes,250mmnacl)以除去edta及其形成的金属络合物。用lowery法对蛋白浓度进行测量,制备终浓度为1mg/ml的蛋白母液。用酸化水制备母液浓度为1m的钙离子溶液,稀释相应倍数加入到ph 8.0,25mm hepes,250mm nacl的缓冲液中,使钙离子的终浓度为50mm。将制备好的蛋白母液透析到含有钙离子的缓冲液中,透析2-24h后没有一维组装体的形成。
60.钙离子诱导蛋白网络结构组装体的制备与上述方法一致,以tmftn
△
40d/e/111h
为原料重复上述操作无法制备蛋白网络结构。
61.(2)钙离子对蛋白水凝胶的构建及其可逆调控
62.以tmftn
△
40d/e/111h
突变体为实验原料,用截留分子量为100kda的超滤浓缩管对蛋白进行浓缩,最终得到蛋白浓度为10mg/ml的蛋白母液。取1ml蛋白母液加入到透明的玻璃样品瓶中,内置转子缓慢搅拌。用酸化水制备母液浓度为1m的钙离子溶液,使用移液枪每次向样品瓶中滴加5μl,充分搅拌十分钟后继续滴加5μl的钙离子母液,重复滴加10次,使得样品瓶中钙离子终浓度为50mm。通过将小瓶倒置证明此状态下无法形成凝胶结构。
63.以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1