一种水稻雌性核不育基因工程表达载体及其应用
1.本发明属于农业生物技术领域,具体涉及一种基于水稻fst和cyp81a6基因构建的用于繁殖水稻雌性核不育系的基因工程水稻表达载体及其应用于水稻雌性核不育系繁殖的方法。
技术背景
2.中国作为世界上第一个发展并推广杂交水稻的国家,从1964年开始对水稻雄性不育的研究(袁隆平.水稻的雄性不孕性.科学通报,1966,17:185
–
188),到1973年实现的水稻雄性不育系、保持系和恢复系的“三系配套”成功,并在1975年就建立了较完善的杂交水稻制种技术体系并开始推广应用(任光俊,颜龙安,谢华安.三系杂交水稻育种研究的回顾与展望.科学通报,2016,61:3748
–
3760)。“三系法”(3-line system)杂交水稻技术体系的完善打破了水稻作为自花授粉作物杂种优势利用的技术壁垒,实现了水稻杂种优势的利用。“三系法”杂交水稻技术体系是基于核质互作雄性不育系为母本、以保持系为父本来繁殖雄性不育系的种子,再用不育系为母本、以恢复系为父本大规模生产具有杂种优势的杂交种子。但是,“三系法”杂交水稻技术体系受到恢保关系的制约,不育系资源较少,优良保持系选育比较困难,对水稻丰富的种质资源利用的范围有限。
3.水稻杂种优势利用的另外一个重要技术途径就是“两系法”(2-line system)杂交水稻技术体系,是基于受自然光周期、温度调控的光温敏雄性核不育系建立起来的(牟同敏.中国两系法杂交水稻研究进展和展望.科学通报,2016,61:3761
–
3769)。水稻光温敏雄性核不育系的育性转换是受到幼穗分化期环境光温调控的孢子体隐性核基因控制的。因此,光温敏雄性核不育系可以一系两用,不仅简化了杂交种子的生产程序,而且组配自由,不受恢保关系的制约,拓宽了资源利用的范围。但是,基于光温敏雄性核不育系的两系法杂交制种和繁殖都受到了时空条件的限制,其临界不育温度会发生漂移,其制种存在不可控的潜在风险。
4.核质互作雄性不育系和光温敏雄性核不育系的利用,使得水稻杂种优势的利用在实际生产中取得了巨大成功,但是除了各自存在的缺陷以外,都面临着杂交种子制种效率低、不能大面积机械化操作的问题。因此,引入新的育种技术,开发出资源利用率高、杂交制种安全、高效的水稻杂种优势利用的育种新技术是杂交水稻发展的方向,分子设计育种为杂交水稻育种开拓出了新的途径(邓兴旺,王海洋,唐晓艳,等.杂交水稻育种将迎来新时代.中国科学:生命科学,2013,43:864
–
868)。
5.隐性雄性核不育系的不育性稳定,用于杂交制种安全可靠,有利于开展大面积的机械化的杂交制种。然而,由于隐性雄性核不育系的不育性由核基因控制,不育系种子的批量繁殖是限制其运用于育种实践中的实质问题。2006年,美国杜邦先锋公司率先在玉米中实现了基于雄性核不育突变材料的种子生产技术,并命名为seed production technology(spt)技术。该技术的基本原理是将花粉育性恢复基因、花粉失活(败育)基因和标记筛选基因作为紧密连锁的元件导入隐性雄性核不育突变体中,获得雄性核不育突变体的保持材料
用于生产制种。“智能不育杂交育种技术”,也称“第三代杂交水稻技术”证实了隐性水稻雄性核不育基因在杂交水稻育种中利用的可能性。邓兴旺等人利用一个雄性核不育基因osnp1连锁花粉失活基因和红色荧光标记基因,构建了一个水稻智能雄性核不育系。水稻智能雄性核不育系的自交种子基于连锁的转基因红色荧光进行色选,可以将含有转基因成分的雄性可育种子和不含转基因成分的纯合雄性核不育种子进行转基因红色荧光分选,并进一步用于杂交种的生产(chang z.et al.construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene.proc natl acad sci usa,2016,113,14145
–
14150)。
6.无论是基于spt技术策略利用隐性雄性核不育基因的第三代杂交育种技术和多控不育系统(multi-control sterility system,mcs)(an,x.l.,dong,z.y.,tian,y.h.,et al.zmms30 encoding a novel gdsl lipase is essential for male fertility and valuable for hybrid breeding in maize.mol.plant,2019,12,343
–
359),或是通过挖掘利用显性核不育基因的显性雄性核不育(dominant male-sterility,dms)系统的新技术策略(an,x.l.,ma,b.,duan,m.j.,dong,et al.molecular regulation of zmms7 required for maize male fertility and development of a dominant male-sterility system in multiple species.proc.natl.acad.sci.u.s.a.,2020,117,23499
–
23509),都可以将自然界广泛存在的水稻雄性核不育基因成功应用于杂种优势利用当中,也为创制新型杂交水稻技术体系提供了最广泛和最理想的花粉受体材料,为组配筛选更多的优势组合提供的更大的可能。当然,基因工程雄性核不育系创制的各种策略也为水稻雌性核不育(female sterile,fs)基因的利用提供了最直接的参考,通过借鉴遗传工程雄性核不育系创制的方法策略,遗传工程雌性核不育系也实现了雌性不育系的种子繁殖(xia,y.m.,tang,n.,hu,y.y.,et al.amethod for mechanized hybrid rice seed production using female sterile rice.rice,2019,12,39),这为突破杂交水稻制种技术体系的产业化应用的技术瓶颈,实现雌性育性基因fst(female-sterile)(雌性育性基因fst为雌性核不育基因fst的野生型基因)调控的雌性核不育系的种子繁殖提供了可行的技术思路,为“fs+ms(fm-line)”(雄性不育,male sterile,ms)杂交水稻制种技术新体系创建和应用实践的可行性提供了理论支撑(陈丽娟,李东宣,李成云,谭学林,徐学洙,朱有勇.雌性不育基因fst用于杂交水稻育种的方法[p].中国专利:cn101658129b,2012-02-01;lee,d.s.,chen,l.j.,li,c.y.,et al.the b
sister mads gene fst determines ovule patterning and development of the zygotic embryo and endosperm.plos one,2013,8(3),26-33)。本发明人报道的由一对隐性基因控制的孢子体遗传水稻雌性核不育自然突变体“g39”,由于转录因子female-sterile(fst)的mads-box区域8bp碱基的缺失造成了移码突变,导致胚珠发育异常以及合子胚和胚乳完全败育(lee,d.s.,chen,l.j.,ha,w.g.,and suh,h.s.(2002)single recessive genetic female sterility in rice.int.rice res.notes,27,22-23)。利用该水稻雌性核不育自然突变体(fst)作为父本,经多年的杂交聚合育种,选育获得了十余个具有不同遗传背景的携带有胞质雄性不育恢复基因rf-1(komori,t.,ohta,s.,murai,n.,et al.map-based cloning of a fertility restorer gene,rf-1,in rice(oryza sativa l.).plant j.,2004,37,315
–
325)的“云岭”系列水稻雌性核不育系,其具有自交和异交完全不结实,但其花粉正常可育的特性,为“fs+ms(fm-line)”杂交水稻
制种技术体系提供了不同类型的花粉供体(李伟,朱骞,郭效琼等.水稻雌性核不育系
‘
云岭319fs’分子标记辅助选择育.分子植物育种,2021,1-13[2021-12-27].http://kns.cnki.net/kcms/detail/46.1068.s.20210610.1618.012.html.)。
[0007]
然而,由于“云岭”系列水稻雌性核不育系雌性完全败育的特点,如何繁育获得大量的雌性核不育系种子或幼苗是目前面临的主要问题。因此,如何突破雌性核不育系的种子繁殖的技术瓶颈,成为了实现“fs+ms(fm-line)”杂交水稻制种技术体系产业化应用的关键所在。虽然,本发明者利用水稻的休眠芽再生或剥蘖快繁无性繁殖体系(专利号:zl201310043582.7;李仕川,刘福根,王天杰等.不同水稻雌性不育系剥蘖快繁和迭代再生力特性分析.分子植物育种,2021,1-16[2021-12-27].http://kns.cnki.net/kcms/detail/46.1068.s.20210624.1518.014.html.)解决了该特殊的雌性核不育系材料本身的繁殖问题,但也无法完全满足混播混种混收的机械化制种的要求。
[0008]
随着全球农业生物技术的蓬勃发展和创新,特别是以基因编辑技术为代表在作物分子精准育种领域开发出了多种转基因自我“中转”删除的基因编辑策略。其中利用除草剂抗性实现筛选无转基因成分转化后代植株的策略,即通过rna干扰技术(rna interference,rnai)沉默水稻内源基因cyp81a6的表达,导致转基因植株表现出对苯达松(btz)除草剂敏感的性状,功能性rnai元件(cyp81a6-hprnai)与基因转化载体紧密连锁后,可通过除草剂抗性筛选t0基因转化植株,也可以通过除草剂致死筛除携带转基因的后代,获得不含转基因成分的t1后代植株(pan,g.,zhang,x.y.,liu,k.de,et al.map-based cloning of a novel rice cytochrome p450 gene cyp81a6 that confers resistance to two different classes of herbicides.2006,plant mol.biol.,61,933
–
943;lu,h.p.,liu,s.m.,xu,s.l.,et al.crispr-s:an active interference element for a rapid and inexpensive selection of genome-edited,transgene-free rice plants.plant biotechnol.j.,2017,15,1371
–
1373)。
[0009]
本发明通过设计全新的cyp81a6基因靶标位点,构建功能性rnai元件(btz-rnai)用于筛除致死含有转基因成分的后代植株,实现利用转基因“中转”删除的技术手段通过种子来繁殖非转基因雌性核不育系种苗的目的,即将用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)与水稻cyp81a6基因的功能性rnai元件(btz-rnai)紧密连锁,通过根癌农杆菌介导的遗传转化的方法导入雌性核不育植株(fst/fst)花药诱导培养的愈伤组织中,获得转基因杂合型基因工程水稻雌性核不育系(fst
t
/fst)。基因工程水稻雌性核不育系自交结实收获种子,在t1代幼苗期通过喷晒苯达松除草剂选择性杀死转基因雌性育性恢复的植株,实现转基因在t1代幼苗植株中“中转”删除,最终存活的不含转基因成分的雌性核不育系可实现“fs+ms(fm-line)”杂交水稻制种体系的混播混栽混收的机械化杂交水稻制种操作。
技术实现要素:
[0010]
为解决水稻雌性核不育系通过种苗繁殖的技术问题,本发明提供一种用于繁殖水稻雌性核不育系的水稻基因工程表达载体及一种水稻雌性核不育系繁殖的方法。
[0011]
术语:
[0012]
fs:雌性不育,为female sterile的缩写。
[0013]
ms:雄性不育,为male sterile的缩写。
[0014]
fm-line:通过水稻雌性不育系与雄性不育系混播混栽,实现杂交水稻制种的技术模式,即fs+ms,简称为fm系法(fm-line)或fs+ms(fm-line)。
[0015]
fst:水稻中控制孢子体遗传的雌性育性的显性基因female-sterile,简称为fst,genebank登录号为dq004266。
[0016]
fst
t
:为本发明中构建的用于转基因水稻雌性育性互补的fst基因表达元件,即pfst::fst。
[0017]
fst:由于水稻雌性育性基因fst的mads-box区域8bp碱基缺失,导致雌性完全败育的隐性基因。
[0018]
fst
t
/fst
t
:表示转基因植株为转fst
t
基因型为纯合的。
[0019]
fst
t
/fst:表示转基因植株为转fst
t
基因型为杂合的。
[0020]
fst/fst:表示纯合的非转基因水稻雌性核不育系基因型。
[0021]
btz-rnai:用于rna干扰水稻cyp81a6基因表达的功能性rnai发卡结构(btz-rnai)。
[0022]
本发明所提供的一种水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai),该水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)包括用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)和用于转基因筛除的苯达松敏感致死的水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)。
[0023]
进一步,所述用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)的核苷酸序列如seq id no.1所示,所述用于转基因筛除的苯达松敏感致死的水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)的核苷酸序列如seq id no.2所示。
[0024]
进一步,所述用于转基因水稻雌性育性互补的fst基因表达元件从上游至下游依次包括fst基因的启动子、完整的fst基因编码序列和nos 3’utr序列,可以显性互补突变基因fst的功能,使雌性核不育系的雌性育性功能恢复正常。
[0025]
进一步,所述用于转基因筛除的苯达松敏感致死的水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)从上游至下游依次由35s启动子、水稻cyp81a6基因保守结构域区的短片段(304bp)构建的水稻cyp81a6基因的功能性rnai发夹结构(btz-rnai)和nos 3’utr序列构成。
[0026]
本发明提供的一种纯合的非转基因水稻雌性核不育系的繁殖方法,包括如下步骤:
[0027]
(1)将上述水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)导入纯合的雌性核不育(fst/fst)水稻植株,筛选获得杂合型转基因水稻,即基因工程水稻雌性核不育系(fst
t
/fst);
[0028]
(2)基因工程水稻雌性核不育系(fst
t
/fst)自交结实,收获t1种子;
[0029]
(3)在t1种子育苗苗期,叶面喷施苯达松溶液,转基因幼苗(fst
t
/fst
t
和fst
t
/fst)被除草剂苯达松致死筛除,分离出的纯合的非转基因水稻雌性不育幼苗(fst/fst)即为纯合的非转基因水稻雌性核不育系。
[0030]
进一步,所述一种纯合的非转基因水稻雌性核不育系繁殖的方法步骤(3)中所述的苗期为t1种子育苗至3叶期。
[0031]
进一步,所述一种纯合的非转基因水稻雌性核不育系繁殖的方法步骤(3)中所述的苯达松溶液的喷施浓度为1200mg/l,喷至叶面有水滴附着为止。
[0032]
进一步,所述一种纯合的非转基因水稻雌性核不育系繁殖的方法步骤(1)中所述的纯合的雌性核不育(fst/fst)水稻植株为云岭319fs植株。
[0033]
本发明还提供一种采用上述纯合的非转基因水稻雌性核不育系的繁殖方法在水稻杂交制种中的应用。即通过上述纯合的非转基因水稻雌性核不育系的繁殖方法获得的纯合的非转基因水稻雌性核不育系在水稻杂交制种中作为父本的应用。
[0034]
发明人前期在粳稻(oryza sativa l.ssp.japonica)中发现了一个具由细胞核遗传的隐性雌性核不育基因fst(female-sterile,fst)控制的水稻雌性核不育突变体(自然突变体)。该水稻雌性核不育突变体(fst)遗传上为孢子体不育,花器官发育正常、花粉正常,雌配子体功能分化特化异常、自交和异交均完全不结实。该水稻雌性核不育突变体基因fst位于水稻第2染色体上,野生型雌性育性基因fst为mads-box基因家族中的一员。利用该水稻雌性核不育自然突变体,经过多年的杂交聚合育种,选育获得了具有不同遗传背景的多个含有细胞质雄性不育(cytoplasmic male sterility,cms)恢复基因rf-1的“云岭”系列水稻雌性核不育系。
[0035]
本发明所述的水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)是指用于创制基因工程雌性核不育水稻的遗传转化表达载体,其含有两个功能调控元件(用于转基因水稻雌性育性互补的fst基因表达元件和用于转基因筛除的苯达松敏感致死的水稻cyp81a6基因的功能性rnai元件),这两个功能调控元件的连锁和表达,可以将雌性育性恢复的性状和苯达松敏感致死性状连锁在一起,实现杂合型的t0转化植株自交后代的转基因雌性育性恢复的植株致死筛除和不含转基因成分的雌性核不育植株繁殖的目的。
[0036]
本发明所述的纯合的非转基因水稻雌性核不育系的繁殖方法是将基因工程雌性核不育系(fst
t
/fst)自交结实获得的t1种子进行育苗至三叶期,通过喷洒苯达松除草剂杀死转基因雌性育性恢复的幼苗(fst
t
/fst
t
和fst
t
/fst),实现转基因的“中转”删除;而非转基因雌性不育幼苗(fst/fst)不受任何影响,从而达到雌性核不育系繁殖的目的,存活的非转基因雌性不育幼苗(fst/fst)可作为花粉供体父本用于杂交水稻制种。所述基因工程雌性核不育系(fst
t
/fst)是以纯合的隐性雌性核不育系(fst/fst)为转化受体材料,采用花药培养诱导产生的愈伤组织进行根癌农杆菌介导的遗传转化方法,导入了含用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)和水稻cyp81a6基因的功能性rnai元件(btz-rnai)遗传工程表达载体的转基因杂合型雌性核不育系水稻(fst
t
/fst)。
[0037]
与现有技术相比,本发明的有益效果在于:
[0038]
通过苗期的苯达松敏感致死筛除转基因雌性育性恢复的植株,最终达到不含转基因成分的水稻雌性核不育系繁殖的目的,可以实现非转基因纯合的水稻雌性核不育系种子和幼苗的繁殖,从根本上解决了杂交水稻机械化制种面临的技术短板。进一步的,通过本发明获得的纯合的非转基因水稻雌性核不育系(fst/fst)与雄性不育系(ms)的混播混种混收制种模式,最大化的实现水稻杂交制种机械化操作的目的,能够简化现行杂交水稻制种技术繁杂的程序,降低制种成本,且不受恢保关系的限制,为杂交水稻实现机械化制种提供了一种全新的技术方案。
[0039]
用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)的核苷酸序列如序列表
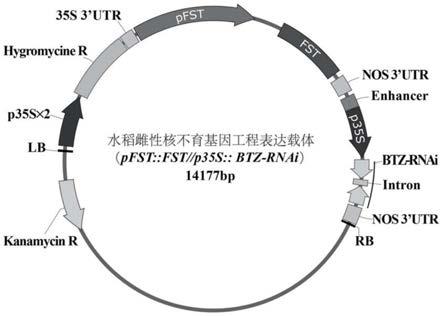
rnai)的构建结果图。图4中,a为水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)的t-dna区结构示意图,其中p35s为花椰菜花叶病毒的35s启动子;p35s
×
2为双35s启动子;hygr为潮霉素抗性基因;35s 3
′‑
utr为35s启动子的3
′
端非编码区序列;btz-rnai为cyp81a6基因的304bp片段的反向重复序列;lb和rb分别为t-dna的左边界和右边界;nos 3
′‑
utr为胭脂碱合酶基因的3
′
端非编码区序列;atg和tga分别为fst基因的起始密码子和终止密码子;b为特异性引物ft1-f/r扩增获得的大小为549bp的fst基因的片段a,如泳道1所示;c为特异性引物ft2-f/r扩增获得的大小为647bp的fst基因的片段b,如泳道1所示;d为特异性引物nos1-f/r扩增获得314bp大小的nos 3
‘‑
utr片段c,如泳道1所示;e为通过重叠延伸pcr获得的大小为1457bp的fst基因完整的编码序列片段,如泳道1所示;f为特异性引物ftp1-f/r扩增获得的fst基因起始密码子(atg)的上游大小为2289bp的片段,如泳道1所示;g为通过重叠延伸pcr获得的大小为3722bp的完整fst基因表达元件(fst
t
),如泳道1所示;h为潮霉素抗性基因特异性引物hphmmas2-f/r进行克隆pcr检测,泳道1-11为pcr扩增获得的大小为450bp的条带。m为分子标尺(thermo scientific generuler dna ladder mix)。
[0058]
图5:转基因t0植株的pcr鉴定结果图。wt为野生型对照植株“云岭319fs”,ck
+
为阳性转基因植株,plasmid为阳性对照水稻雌性核不育基因工程表达质粒载体,m为dna marker(thermo scientific generuler dna laddermix(sm0333)),1-18为独立的转基因t0株系。
[0059]
图6:转基因t0株系苯达松敏感性的鉴定结果图。图6中,a为叶面喷施浓度为1200mg/l苯达松溶液7天后,t0转基因株系对苯达松除草剂的敏感性反应;b为叶面喷施浓度为1200mg/l苯达松溶液14天后,t0转基因株系对苯达松除草剂的敏感性反应。a、b中涉及的wt为野生型对照植株“云岭319fs”,t
0-s为对苯达松敏感致死的t0株系,t
0-r为对苯达松具有抗性的t0株系。
[0060]
图7:t0转化株系at73-28的表型鉴定结果图。图7中,a为t0转化株系at73-28灌浆期穗子的表现;b为t0转化株系at73-28成熟种子的表现,其中竖直线为比例标尺,大小为2mm;c为利用潮霉素抗性基因特异性引物hphmmas2-f/r对t0转化株系at73-28的t1后代进行pcr鉴定的结果;d为对t0转化株系at73-28及其自交t1后代进行苯达松敏感性鉴定的结果。a、c和d中涉及的t
0-s为t0转化株系at73-28,ck
+
为阳性转基因植株,plasmid为阳性对照水稻雌性核不育基因工程表达质粒载体,wt为野生型对照植株“云岭319fs”,m为dna marker(thermo scientific generuler dna ladder mix(sm0333),t
1-r为t0转化株系at73-28自交获得的t1后代中分离出对苯达松具有抗性的不含基因成分的植株,t
1-s为t0转化株系at73-28自交获得的t1后代中对苯达松敏感致死的转基因植株。
[0061]
图8:非转基因雌性核不育系“319fs”的鉴定结果图。图8中,a为杂交组合“合系42a/319fs”的结实表现;b为非转基因雌性核不育系“319fs”的植株表现;c为杂交组合“合系42a/319fs”的杂种f1的整体表现。
具体实施方式
[0062]
下面根据具体的实施例并结合附图对本发明进行详细说明。以下各实施例仅仅是为了说明本发明,而不能以任何方式解释为对本发明的限制;此外,以下各实施例中所涉及
1.0μl,限制性内切酶acci 0.2μl,质粒dna 3.0μl,酶切反应为37℃ 2h),pcambia1305.2质粒(市售)经过限制性内切酶bspt104i/bsutui双酶切(酶切体系总体积为10μl,含ddh2o 5.6μl,10
×
buffer 1.0μl,限制性内切酶bspt104i和bsutui各0.2μl,质粒dna 3.0μl,酶切反应为37℃ 2h)后获得载体片段,进一步将获得的插入片段和载体片段进行连接(连接体系总体积为10μl,含ddh2o 0.8μl,10
×
t4 ligation buffer 1.0μl,载体片段2.0μl,插入片段6.0μl,t4 dna连接酶0.2μl,连接反应为22℃ 1h)(图2中a)。连接产物转化大肠杆菌dh5α感受态细胞后,挑取单克隆扩大培养后提取质粒dna,质粒dna经限制性内切酶bamhi酶切得到两个条带(酶切体系总体积为10μl,含ddh2o 5.8μl,10
×
buffer 1.0μl,限制性内切酶bamhi 0.2μl,质粒dna3.0μl,酶切反应为37℃ 2h),大小分别为10176bp和301bp(图2中图d泳道3-6),并送华大基因进行测序确认,即获得水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)的表达载体,所述水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)由35s启动子、水稻cyp81a6基因的功能性rnai发卡结构(btz-rnai)和nos 3’utr序列构成,所述水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)的核苷酸序列如seq id no.2所示(图2中a),经测序验证后通过冻融法将水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)导入根瘤农杆菌eha105感受态细胞,利用潮霉素抗性基因位点的特异性引物hphmmas2-f/r进行克隆pcr筛选,pcr扩增获得条带大小为450bp(图2中e)。
[0072]
1.2本发明水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)的构建
[0073]
水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)的质粒图谱如图3所示,其t-dna区的详细结构如图4中a所示,具体构建过程如下:
[0074]
以水稻日本晴植株开花后5d的穗子为材料,用trizol总rna提取试剂(天根)提取叶片总rna,利用revertaid first strand cdna synthesis kit(thermo scientific)进行第一链cdna的合成。以合成获得的cdna为模板,利用特异性引物ft1-f/r扩增获得fst基因的片段a(扩增体系总体积为15μl,含ddh2o 10.8μl,10
×
buffer(不含mg
2+
)1.5μl,25mm mgcl
2 0.9μl,2.5mm dntp 1.2μl,2个引物浓度均为50pmol/μl各0.12μl,5u/μl takara taq 0.16μl,模板dna100ng/μl0.2μl,扩增程序为94℃ 3min;循环内94℃ 20s、57℃ 20s、72℃ 1min,35个循环;72℃ 7min),所述fst基因的片段a包含从起始密码子(atg)开始的部分第2外显子序列以及第3、4、5和6外显子序列,长度为549bp(图4中b);以日本晴植株基因组dna为模版,利用特异性引物ft2-f/r扩增获得fst基因的片段b,所述fst基因的片段b包括终止密码子(tga)的第7外显子和部分第8外显子序列,以及第7内含子序列,长度为647bp(图4中c);以pcambia1305.2质粒(市售)为模版,利用特异性引物nos1-f/r扩增获得314bp大小的nos 3
‘‑
utr片段c(图4中d)(扩增体系总体积为15μl,含ddh2o 10.8μl,10
×
buffer(不含mg
2+
)1.5μl,25mm mgcl
2 0.9μl,2.5mm dntp 1.2μl,2个引物浓度均为50pmol/μl各0.12μl,5u/μl takara taq 0.16μl,模板dna100ng/μl0.2μl,扩增程序为94℃ 3min;循环内94℃ 20s、60℃ 20s、72℃ 30s,35个循环;72℃ 7min);再通过重叠延伸pcr(扩增体系总体积为25μl,含ddh2o 2.5μl,5
×
transstart fastpfu buffer 5.0μl,2.5mm dntp 2.0μl,fst基因的片段a、fst基因的b和nos 3
‘‑
utr片段各5.0μl,transstart fastpfu dna聚合酶0.5μl,扩增程序为95℃ 3min;循环内95℃ 30s、55℃ 30s、72℃ 90s,30个循环;72℃ 10min)将获得的fst基因的片段a和fst基因的片段b以及nos 3
‘‑
utr片段c拼接起来,获得
片段大小为1457bp的fst基因完整的蛋白编码序列(片段d)(图4中e)。另外,以日本晴植株基因组dna为模版,利用特异性引物ftp1-f/r扩增(扩增体系总体积为25μl,含ddh2o 17.0μl,5
×
transstart fastpfu buffer 5.0μl,2.5mm dntp 2.0μl,2个引物浓度均为50pmol/μl各0.2μl,transstart fastpfu dna聚合酶0.5μl,模板dna 100ng/μl 0.1μl,扩增程序为95℃ 3min;循环内95℃ 30s、48℃ 30s、72℃ 140s,2个循环;循环内95℃ 30s、60℃ 30s、72℃ 130s,35个循环;72℃ 10min)获得fst基因起始密码子(atg)的上游大小为2289bp的片段e,所述fst基因起始密码子(atg)的上游大小为2289bp的片段e,所述fst基因起始密码子(atg)的上游大小为2289bp的片段e包含启动子序列、5
’‑
utr序列、第1外显子、第1内含子和包括起始密码子的部分第2外显子序列(图4中f),再通过重叠延伸pcr(扩增体系总体积为25μl,含ddh2o 7.5μl,5
×
transstart fastpfu buffer 5.0μl,2.5mm dntp 2.0μl,片段d和片段e各5.0μl,transstart fastpfu dna聚合酶0.5μl,扩增程序为95℃ 3min;循环内95℃ 30s、61℃ 30s、72℃ 120s,30个循环;72℃ 10min)将获得的fst基因完整的编码序列(片段d)与所述fst基因起始密码子(atg)的上游大小为2289bp的片段e序列拼接后,再通过特异性引物ftp1-f/nos1-r进行扩增回收获得大小为3722bp的完整fst基因表达元件(fst
t
)(图4中g)(特异性引物ftp1-f/nos1-r进行扩增的扩增体系总体积为25μl,含ddh2o 19.7μl,10
×
la taq buffer(mg
2+
plus)2.5μl,2.5mm dntp 2.0μl,2个引物浓度均为50pmol/μl各0.2μl,la-taq 0.2μl,模板dna 0.2μl,扩增程序为94℃ 5min;循环内94℃ 30s、61℃ 30s、72℃ 4min,35个循环;72℃ 10min)。通过ta克隆将完整的fst基因表达元件(fst
t
)插入t-载体,经限制性内切酶bsmbi酶切(酶切体系总体积为10μl,含ddh2o 4.7μl,10
×
buffer 1.0μl,限制性内切酶bsmbi 0.3μl,质粒dna 4.0μl,酶切反应为37℃ 2h)获得完整的fst基因表达元件(fst
t
)序列即为用于转基因水稻雌性育性互补的的fst基因表达元件(fst
t
),其核苷酸序列如seq id no.1所示),再将完整的fst基因表达元件(fst
t
)插入到水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)的表达载体t-dna区的多克隆位点ecori和xbai之间,最终获得本发明所述的水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)。经测序验证后通过冻融法将其导入根瘤农杆菌eha105感受态细胞,挑取单克隆扩大培养,利用潮霉素抗性基因位点的特异性引物hphmmas2-f/r进行克隆pcr检测(扩增体系总体积为10μl,含ddh2o 7.34μl,10
×
buffer(不含mg
2+
)1.0μl,25mm mgcl
2 0.6μl,2.5mm dntp 0.8μl,2个引物浓度均为50pmol/μl各0.08μl,5u/μl takara taq 0.1μl,模版菌落,扩增程序为94℃ 3min;循环内94℃ 30s、58℃ 30s、72℃ 40s,35个循环;72℃ 7min),pcr扩增获得条带大小为450bp(图4中h),结果表明:本发明所述的水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)构建成功且成功导入根瘤农杆菌eha105感受态细胞。根瘤农杆菌eha105感受态细胞由本实验室用购买的transgene公司的eha05菌株按cacl2法自行制备,-80℃冰箱保存。
[0075]
实施例2根癌农杆菌介导的水稻遗传转化和转基因水稻植株的获得
[0076]
2.1水稻花药培养诱导获得愈伤组织
[0077]
在水稻雌性核不育系“云岭319fs”(即雌性核不育水稻植株)的孕穗期,剪取叶枕距1-5cm的稻苞,剪掉多余的叶子和茎节,保持整个稻苞的完整,喷洒70%v/v的酒精进行表面消毒后,用锡箔纸包裹避光,置于冰盒后带回实验室,置于10℃培养箱避光低温培养10天。低温预处理完成后,用70%v/v的酒精棉球擦拭稻苞表面,在超净工作台中用手术刀划
开稻苞,并用镊子小心取出幼穗置于无菌的培养皿中后,再将小穗从底部剪下后,用镊子夹住小穗顶端,将小穗中的花药均匀撒落于cm6培养基(n6+70g/l sucrose,1g/l yeast extract,0.2mg/l 2,4-d,1mg/l naa,和10g/l agar,ph 5.7)上,置于28℃恒温培养箱,避光培养3~4周,即可获得愈伤组织。挑选圆形或椭圆形颗粒状的愈伤组织于n6d培养基(n6+30g/l sucrose,2mg/l 2,4-d和2.4g/l phytagel,ph 5.7)上,28℃培养箱中避光培养3天后,用于下一步的遗传转化。
[0078]
2.2根癌农杆菌介导的水稻遗传转化
[0079]
通过根癌农杆菌介导的方法,将实施例1构建的水稻雌性核不育基因工程表达载体(pfst::fst//p35s::btz-rnai)转化至实施例2步骤2.1中水稻雌性核不育系“云岭319fs”花药培养诱导获得的愈伤组织中,通过潮霉素抗性筛选获得抗性愈伤组织,进一步通过分化培养基(ms+50g/l sucrose,20g/l sorbitol,0.10g/l myo-inositol,0.10mg/l naa,2.10mg/l kin和16g/l agar,ph 5.8)的潮霉素抗性筛选进行愈伤分化并再生获得转基因植株。利用潮霉素抗性基因位点的特异性引物(hphmmas2-f/r)对获得的转基因植株进行pcr检测(扩增体系总体积为10μl,含ddh2o 7.14μl,10
×
buffer(不含mg
2+
)1.0μl,25mm mgcl
2 0.6μl,2.5mm dntp 0.8μl,2个引物浓度均为50pmol/μl各0.08μl,5u/μl takara taq 0.1μl,模板dna100ng/μl 0.2μl,扩增程序为94℃ 3min;循环内94℃ 30s、58℃ 30s、72℃ 40s,35个循环;72℃ 7min),pcr扩增结果均获得大小为450bp的条带(图5),结果表明所获得的转基因植株均为阳性转基因植株。
[0080]
实施例3基因工程雌性核不育系(fst
t
/fst)的筛选
[0081]
3.1转基因t0株系的雌性育性特性的鉴定和苯达松敏感性鉴定
[0082]
以转基因t0株系成熟期是否能够正常发育获得种子为标准,筛选获得雌性育性恢复正常的11个转基因候选株系。
[0083]
以野生型水稻雌性核不育系“云岭319fs”植株为对照,通过剥蘖繁殖的方式剥取对照植株和11个转基因t0植株的新生分蘖进行正常幼苗的温室培养,待植株成活并长出新叶至3叶期(苗期),用手持小喷雾器叶面喷施苯达松溶液,喷施浓度为1200mg/l,喷至叶面可见有水滴附着为止。所用苯达松除草剂为灭草松(有效成分含量:480g/l),产于巴斯夫植物保护(江苏)有限公司。7天后,对照植株“云岭319fs”正常生长,11个转基因候选株系中有5个转基因t0株系丧失了对苯达松除草剂的抗性,表现出敏感致死(t
0-s),植株干枯;其余6个转基因t0株系对苯达松依然表现出抗性(t
0-r),植株正常(图6中a)。喷施苯达松14天后,对苯达松表现出敏感致死性状的t0株系(t
0-s)已完全干枯,而对照植株“云岭319fs”继续正常生长,对苯达松表现出抗性的转基因t0株系(t
0-r)生长正常(图6中b)。以上结果表明,表现出对苯达松敏感致死的5个独立的转化株系(at73-06、at73-11、at73-12、at73-25和at73-28)中,水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)正常表达并成功靶标干扰了目标基因cyp8a6的功能,fst基因表达元件(fst
t
)可以互补雌性不育突变基因fst的功能,使水稻雌性核不育系“云岭319fs”雌性育性恢复正常。
[0084]
3.2转基因t0株系的花粉育性鉴定和结实率统计
[0085]
在开花期,对表现出对苯达松敏感致死的5个独立的转化株系(at73-06、at73-11、at73-12、at73-25和at73-28)的花粉育性进行鉴定,具体地,随机选取三个主穗上3朵部位一致的未开颖花于卡诺氏固定液固定两小时后,置换75%v/v乙醇保存于4℃。观察时用1%i2-ki溶液染色后,在光学显微镜下观察拍照,统计花粉育性。结果表明,表现出对苯达松敏感致死的这5个独立的转化株系的花粉可育率均在94%以上(表1)。在成熟期,对表现出对苯达松敏感致死的5个独立的转化株系(at73-06、at73-11、at73-12、at73-25和at73-28)的结实率进行统计,具体地,随机选取各个转化株系的3个主穗,统计每穗总粒数和结实粒数并计算结实率,最后取平均值。结果表明,表现出对苯达松敏感致死的这5个独立的转化株系的结实率均大于52%,其中转化株系at73-28的结实率最高,为71.16
±
4.00%(表1),种子发育正常(图7中a;图7中b),说明用于转基因水稻雌性育性互补的fst基因表达元件(fst
t
)可以成功互补转基因水稻雌性育性,而且用于转基因筛除的苯达松敏感致死的水稻cyp81a6基因的功能性rnai元件(p35s::btz-rnai)与fst
t
紧密连锁。
[0086]
表1基转基因t0株系的花粉育性鉴定和结实率统计
[0087][0088]
3.3转化株系at73-28的遗传分析
[0089]
以野生型水稻雌性核不育系“云岭319fs”植株为对照,通过剥蘖繁殖的方式剥取对照植株和转化株系at73-28自交结实获得的后代t1植株的新生分蘖进行正常幼苗的温室培养,待植株成活并长出新叶至3叶期(苗期),用手持小喷雾器叶面喷施苯达松溶液,喷施浓度为1200mg/l(所述的苯达松除草剂与实施例3中3.1所述的苯达松除草剂相同),喷至叶面可见有水滴附着为止。7天后,对照植株正常生长,t1群体中部分植株表现出对苯达松的抗性(t
1-r),部分植株对苯达松敏感性致死(t
1-s)(图7中d);利用特异性引物hphmmas2-f/r对t1群体植株中表现出对苯达松的抗性的t
1-r植株进行pcr(扩增体系总体积为10μl,含ddh2o 7.14μl,10
×
buffer(不含mg
2+
)1.0μl,25mm mgcl
2 0.6μl,2.5mm dntp 0.8μl,2个引物浓度均为50pmol/μl各0.08μl,5u/μl takara taq 0.1μl,模板dna100ng/μl 0.2μl,扩增程序为94℃ 3min;循环内94℃ 30s、58℃ 30s、72℃ 40s,35个循环;72℃ 7min)鉴定表明:所有t
1-r植株均不能扩增得到目标条带,而所有t
1-s植株均可扩增获得目标片段大小为450bp的条带(图7中c)。因此,转化株系at73-28为杂合型转基因(fst
t
/fst)株系,确定为基因工程水稻雌性核不育系(fst
t
/fst),暂命名为“319fs”,可以和预期一样分离出不含转基因成分的t1植株,其自交结实产生的t1后代中分离出的不含转基因成分的雌性不育植株,作为非转基因雌性核不育系可用于杂交水稻的制种。
[0090]
实施例4基因工程水稻雌性核不育系“319fs”的鉴定
[0091]
为了鉴定来自于基因工程水稻雌性核不育系“319fs”自交后代中分离获得的t1代非转基因雌性核不育植株的花粉活性及杂种优势表现,以其t1代非转基因雌性核不育植株为父本,滇型细胞质雄性不育系“合系42a”植株为母本进行人工去雄杂交,结果表明:“合系42a”人工去雄后用“319fs”自交后代中分离获得的非转基因雌性核不育植株的花粉授粉的稻穗结实正常(8中a)。另外,来自“319fs”自交后代的非转基因雌性核不育植株和预期的一
样,完全不结实(8中b)。收获杂交f1的种子(“合系42a/319fs”),正常种植管理,其f1植株结实正常,整体表现优异(8中c)。
[0092]
因此,本发明获得的基因工程水稻雌性核不育系(fst
t
/fst),其自交后代分离群体可以通过喷施苯达松除草剂的方法筛选出纯合的非转基因的雌性核不育植株,实现水稻雌性核不育系非转基因种苗繁殖的目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1