白细胞介素2调节肿瘤巨噬细胞生成的外泌体分泌成分抑制肝细胞癌的生长和转移方法与流程
1.本发明涉及外泌体基因治疗技术领域,尤其涉及一种白细胞介素 2调节肿瘤巨噬细胞生成的外泌体分泌成分抑制肝细胞癌的生长和转移方法。
背景技术:
2.原发性肝细胞癌(hcc)是一种常见的恶性肿瘤,在癌症死亡率中排第三位。hcc的治疗主要是手术切除和肝移植。由于其恶性程度高,五年生存率仍不足50%,复发率高。复发转移已成为提高肝癌治疗效果和生存率的最大障碍。肿瘤的发生、发展、侵袭和转移不仅由恶性肿瘤细胞本身决定,还与肿瘤微环境密切相关。肿瘤微环境中存在大量的肿瘤相关巨噬细胞(tams)。肿瘤细胞与其微环境之间的相互作用早已被确立为肿瘤发生和转移的主要标志。为此,已对肿瘤相关巨噬细胞(tams)进行了广泛研究,并发现它们通常与各种癌症的不良预后相关。最近的研究证实,tams主要是m2型巨噬细胞,可以通过影响血管生成、免疫抑制、侵袭和转移来促进肿瘤生长。外泌体是直径为30-150nm的膜囊泡。外泌体可以分泌并广泛存在于各种体液中。外泌体携带亲代细胞的rna和蛋白质成分,参与肿瘤的信号转导和免疫逃逸以及一些疾病的诊断和治疗。据报道,源自tams的外泌体促进hcc细胞增殖和转移。白细胞介素2(il-2)是免疫系统中的一种多功能细胞因子,可有效激活和增强巨噬细胞的吞噬和杀伤能力。il-2已在许多临床试验中用于治疗hcc。然而,il-2是否调节从tams释放的外泌体成分从而抑制hcc仍然未知。鉴于il-2 在hcc中的新兴作用和调节巨噬细胞的功能,本发明旨在探索来自 il-2处理的tams的外泌体对hcc发生发展的一种方法。
技术实现要素:
3.针对传统技术的上述不足,本发明为il-2抑制肝细胞癌的机制提供了新的视角和方法,并暗示了tams释放的外泌体成分的潜在临床价值。
4.本发明提出的白细胞介素2调节肿瘤巨噬细胞生成的外泌体分泌成分抑制肝细胞癌的生长和转移方法,具体调节方法包括以下步骤:
5.s1、原发性肝癌标本收集和肿瘤相关巨噬细胞分离,用剪刀将人新鲜肿瘤样品切碎,分离和培养巨噬细胞;
6.s2、外泌体分离和纯化,用试剂盒提取外泌体,用红色荧光接头 pkh26标记纯化的外泌体;
7.s3、透射电子显微镜观察的外泌体和tams细胞;
8.s4、rna分离和qpcr,使用trizol试剂从细胞或小鼠组织中分离总rna,然后使用实时qpcr和实时荧光定量pcr试剂盒分析 rna;
9.s5、western blot蛋白分析,外泌体或细胞在含有蛋白酶抑制剂的ripa中裂解,总共20μg的外泌体通过sds-page分离并转移到pvdf膜,然后将膜与抗体cd63、calnexin、pcna、细胞周期蛋白d1、e-cadherin、n-cadherin、微管蛋白、bax、bcl-2、mmp-2 和mmp-9孵
育过夜;
10.s6、cck-8和edu测定增殖
11.s7、通过流式细胞术定量细胞凋亡;
12.s8、迁移测定和滑痕分析;
13.s9、实验动物异种移植小鼠模型,将处于对数生长期的qjy-7703 细胞制备成细胞悬液,腋窝皮下注射细胞(5
×
105)balb/c裸鼠, 4-6周龄,每组n=6,每2天尾静脉注射外泌体40ug/ml,共7次,5 天后每10天测量一次肿瘤体积,直到30天后处死小鼠;
14.s10、肝肺转移实验;
15.s11、tunel染色;
16.s12、生物信息学分析和结果。
17.作为优选,所述步骤s1的具体步骤为:
18.s1-1、准备无菌饭盒,内放置盛有无血清dmem液的培养皿;
19.s1-2、用剪刀和手术刀片剔除可见的大血管和单管结构以去除内皮细胞的污染,剔除坏死组织、结缔组织和血液等杂物,用pbs洗涤三次;
20.s1-3、在10cm培养皿中用剪刀和手术刀片将组织切碎后,组织块浸入含0.1%1v型胶原酶的无钙无镁hank’s平衡盐溶液中,放入 37℃的二氧化碳培养箱中消化40分钟,每隔5分钟用吸管捶打一次使细胞分离:
21.s1-4、利用钝器机械研磨组织以剔除内皮细胞;
22.s1-5、得到的细胞悬液经75pm尼龙薄纱滤网:
23.s1-6、滤液4℃下70g转速下离心3分钟两次以去除肝实质细胞,得到肝非实质细胞;
24.s1-7、pbs清洗上清液中的肝非实质细胞,4℃下650g转速离心 7分钟;
25.s1-8、细胞沉淀pbs重悬,在25%和50%percoll细胞分离液中离心15分钟,温度为4℃,转速为1800rpm;
26.s1-9、收集最上层细胞组分,加入红细胞裂解液,经pbs清洗两次,得到巨噬细胞;
27.s1-10、巨噬细胞纯度经流式细胞术检测cd68阳性率,肝癌细胞为huh7,hepg2 and qjy-7703,肿瘤细胞系外购,在收集上清液之前,接着用20ng/mlil-2孵育处理tam 24小时。
28.作为优选,所述步骤s1-10中,孵育处理具体步骤为:
29.s1-10-1、明确il-2对tams表型的影响,
30.s1-10-1-1、分离hcc组织中的tams,利用cd68免疫荧光实验检测其纯度;
31.s1-10-1-2、20ng/ml il-2对tams处理不同时间点,制备样品,通过透射电镜观察其形态变化;
32.s1-10-2、确定il-2对tams外泌体分泌的影响以及外泌体是否可以在tams和肝癌细胞之间传递,
33.s1-10-2-1、提取tams来源外泌体,采用sbi公司外泌体提取试剂盒分离tams培养上清液中的外泌体,利用电子显微镜观察分离物的形态,通过nanosight检测分离物的直径分布情况;
34.s1-10-2-2、利用western blot检测marker cd63,以及阴参 calaexin对外泌体进行鉴定;
7703(5
×
105)单独或与exo
tam
(40ug/ml) 或与exo
il2-tam
(40ug/ml)100ul,通过尾静脉注射到小鼠体内,细胞注射后30天,将小鼠安乐死并进行尸检以评估转移,通过h&e染色进一步检查小鼠的肝和肺组织。
49.作为优选,所述步骤s11中,根据标准程序通过tunel法检测肿瘤组织中的凋亡细胞,在4%多聚甲醛中固定后,将组织用50μltunel反应混合物在37℃染色60分钟,细胞核用dapi染色并通过olympus显微镜观察。
50.本发明的有益效果:
51.1,il-2处理的肿瘤相关巨噬细胞来源的外泌体改变了tam外泌体分泌的成分。未用il-2处理,tam微环境能促进hcc细胞增殖和转移,il-2处理的肿瘤相关巨噬细胞改变了tam分泌外泌体的成分,逆转了hcc发生发展。
52.2,il-2可以作为工程化外泌体包裹的药物递送内容物,治疗 hcc,il-2处理的tam外泌体可以治疗hcc,改善患者生存和预后情况。il-2(exo
il2-tam
)或未用(exo
tam
)处理的tam的外泌体,取得了两种不同的效果,并用于治疗hcc细胞,exo
il2-tam
治疗观察到细胞增殖和转移的减少以及细胞凋亡的增加,显示il-2处理的肿瘤相关巨噬细胞来源的外泌体成分有改变,可以改善hcc情况。
附图说明
53.图1为hcc细胞吸收了外泌体和不同处理对细胞存活的影响图;
54.图2为外泌体对hcc细胞增殖和凋亡的影响图;
55.图3为外泌体对体内hcc进展的影响图。
具体实施方式
56.下面结合具体实施例对本发明作进一步解说。
57.本发明的方法在实施时,征得患者同意,从接受肝切除术的患者中收集原代人类hcc标本,经过医院伦理委员会批准。
58.本发明提出的白细胞介素2调节肿瘤巨噬细胞生成的外泌体分泌成分抑制肝细胞癌的生长和转移方法,具体调节方法包括以下步骤:
59.s1、原发性肝癌标本收集和肿瘤相关巨噬细胞分离,用剪刀将人新鲜肿瘤样品切碎,分离和培养巨噬细胞,具体包括:
60.s1-1、准备无菌饭盒,内放置盛有无血清dmem液的培养皿;
61.s1-2、用剪刀和手术刀片剔除可见的大血管和单管结构以去除内皮细胞的污染,剔除坏死组织、结缔组织和血液等杂物,用pbs洗涤三次;
62.s1-3、在10cm培养皿中用剪刀和手术刀片将组织切碎后,组织块浸入37℃含0.1%1v型胶原酶的无钙无镁hank’s平衡盐溶液中放入37℃的二氧化碳培养箱中消化40分钟,每隔5分钟用吸管捶打一次使细胞分离:
63.s1-4、利用钝器机械研磨组织以剔除内皮细胞;
64.s1-5、得到的细胞悬液经75pm尼龙薄纱滤网:
65.s1-6、滤液4℃下70g转速下离心3分钟两次以去除肝实质细胞 (细胞沉淀),得到肝非实质细胞;
66.s1-7、pbs清洗上清液中的肝非实质细胞,4℃下650g转速离心 7分钟;
67.s1-8、细胞沉淀pbs重悬,在25%和50%percoll细胞分离液中离心15分钟(4℃,1800g转速)。
68.s1-9、收集最上层细胞组分,加入红细胞裂解液,经pbs清洗两次。得到巨噬细胞;
69.s1-10、巨噬细胞纯度经流式细胞术检测cd68阳性率肝癌细胞系 huh7,hepg2 and qjy-7703肿瘤细胞系外购,在收集上清液之前,接着用20ng/mlil-2敷育处理tam 24小时。
70.s2、外泌体分离和纯化,外泌体提取用试剂盒,用红色荧光接头pkh26(umibio)标记纯化的外泌体;
71.s3、透射电子显微镜观察的外泌体和tams细胞。将样品用2%戊二醛和2%多聚甲醛在0.1mol/l二甲胂酸钠缓冲液中在ph 7.3下在室温下固定3小时。空气干燥后,将样品安装在样品桩上并使用透射电子显微镜进行观察。
72.s4、rna分离和qpcr。按照制造商的说明,使用trizol试剂 (invitrogen)从细胞或小鼠组织中分离总rna。然后使用实时qpcr 和sybr green pcr master mix(roche applied science,mannheim, germany)分析rna。
73.s5、western blot蛋白分析。外泌体或细胞在含有蛋白酶抑制剂的ripa中裂解。总共20μg的外泌体通过sds-page分离并转移到pvdf膜(millipore,bedford,ma,usa)。然后将膜与抗体cd63 (1:1000;abcam,cambridge,ma,usa)、calnexin(1:1000;cst,usa)、 pcna(1:1000;cst,usa)、细胞周期蛋白d1(1:1000;cst,usa) e-cadherin(1:1000;cst,usa),n-cadherin(1:1000;cst,usa), 微管蛋白(1:5000,abcam,cambridge,uk),bax(1:1000; cst,usa)、bcl-2(1:1000;cst,usa)、mmp-2(1:1000,proteintech, chicago,illinois,usa)和mmp-9(1:1000,proteintech, chicago,illinois,美国)。
74.s6、cck-8和edu测定增殖。将hepg2细胞加入96孔板并培养24、48、72、96、120或144小时。然后,将cck-8试剂加入无血清培养基中的细胞中2小时,然后在450nm处测量吸光度。对于edu 分析,将hepg2细胞加入24孔板,在与外泌体孵育24小时后,根据协议进行edu(sigma-aldrich)染色。
75.s7、通过流式细胞术定量细胞凋亡。使用膜联蛋白v-fitc/pi细胞凋亡检测试剂盒(ebioscience,美国)测定细胞凋亡。通过流式细胞术评估细胞。
76.s8、迁移测定和滑痕分析。细胞迁移测定在24孔transwell细胞培养室上进行,孔大小为8μm,没有预涂matrigel(康宁,美国)。 hepg2细胞悬浮在500μl培养基中并添加到上部插入物中。孵育24 小时后,去除上室残留的细胞,将上室下表面的细胞用4%多聚甲醛固定染色含有0.5%的结晶紫。进行划痕试验以评估体外细胞迁移。首先,将hepg2细胞接种在6孔板中,直到形成融合的单层。然后,在汇合后,用10μl无菌移液器吸头刮擦细胞。然后在显微镜下对不同时间点的划痕进行拍照。细胞迁移率计算为(0小时宽度-24小时宽度)/0小时宽度。
77.s9、实验动物异种移植小鼠模型。所有动物实验均按照右江民族医科大学动物伦理委员会的批准进行。将处于对数生长期的qjy-7703 细胞制备成细胞悬液。腋窝皮下注射细胞(5
×
105)balb/c裸鼠(4-6 周龄,每组n=6),每2天尾静脉注射外泌体(40ug/ml),共7次。5 天后每10天测量一次肿瘤体积,直到30天后处死小鼠。
78.s10、肝肺转移实验。将6-8周龄裸鼠随机分成三个随机组(每组n=12),qjy-7703
(5
×
105)单独或与exo
tam
(40ug/ml)或与exo
il2-tam
(40ug/ml)100μl,通过尾静脉注射到小鼠体内,细胞注射后30天,将小鼠安乐死并进行尸检以评估转移,通过h&e染色进一步检查小鼠肝和肺组织。
79.s11、tunel染色。根据标准程序通过tunel法检测肿瘤组织中的凋亡细胞。在4%多聚甲醛中固定后,将组织用50μltunel反应混合物(roche)在37℃染色60分钟。细胞核用dapi染色并通过olympus显微镜观察。
80.s12、生物信息学分析和结果
81.其中,步骤s1-10中,孵育处理具体步骤为:
82.s1-10-1、明确il-2对tams表型的影响,
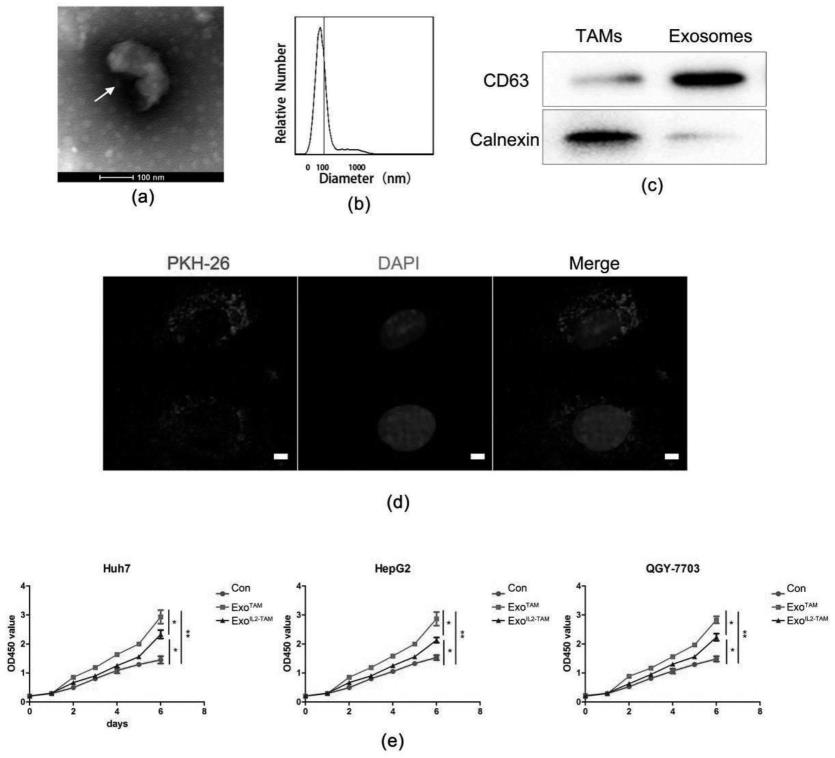
83.s1-10-1-1、分离hcc组织中的tams,利用cd68免疫荧光实验检测其纯度;
84.s1-10-1-2、20ng/mlil-2对tams处理不同时间点,制备样品,通过透射电镜观察其形态变化;
85.s1-10-2、确定il-2对tams外泌体分泌的影响以及外泌体是否可以在tams和肝癌细胞之间传递,
86.s1-10-2-1、提取tams来源外泌体,采用sbi公司外泌体提取试剂盒分离tams培养上清液中的外泌体,利用电子显微镜观察分离物的形态,通过nanosight检测分离物的直径分布情况;
87.s1-10-2-2、利用westernblot检测markercd63,以及阴参calaexin对外泌体进行鉴定;
88.s1-10-2-3、用荧光染料pkh26标记tams来源外泌体,在细胞水平,利用外泌体刺激hcc细胞24h,荧光显微镜检测其是否被标记上红色荧光;
89.s1-10-3阐明il-2诱导的tams外泌体对离体肝癌细胞的生长、迁移的影响,
90.s1-10-3-1、先从离体水平检测il-2处理的tams来源的外泌体对hcc细胞增殖的影响,分为pbs对照组、exo
il2-tam
和exo
il2-tam
三组,分别处理hcc细胞不同时间点,通过mtt实验以及edu免疫荧光实验检测其对hcc细胞增殖的影响,用westenblot检测其对增殖相关蛋白pcna和cyclind1的影响;
91.s1-10-3-2、利用annexinv和pi相关蛋白在流式细胞仪测定待测样品凋亡相关比例,并用westerrnblot测定bax和bcl2相关凋亡蛋白含量以反映对凋亡的影响程度;
92.s1-10-3-3、transwell和划痕实验测定细胞的侵袭转移能力,用westernblot分别测定hcc细胞emt相关蛋白mmp-2、mmp-9、e-cadherin、n-cadherin的表达,通过以上步骤来共同检测il-2处理过的tams分泌的外泌体对hcc细胞侵袭和迁移的影响;
93.s1-10-4、阐明il-2诱导的tams外泌体对在体肝癌的生长与转移的影响,
94.s1-10-4-1、其次从在体水平研究il-2能否对hcc的生长和转移产生影响,分为pbs对照组、exo
il2-tam
和exo
il2-tam
三组,将小鼠进行皮下注射hcc细胞数目为5
×
105,建立异体移植肿瘤模型,同时尾静脉注射外泌体,通过分别检测瘤体的质量和体积,以及利用westernblot对pcna和cyclind1相关增殖因子检测来测定增殖情况;
95.s1-10-4-2、同以上皮下注射建立的异体移植肿瘤模型,利用tunnel免疫荧光和westernblot对bax和bcl2相关凋亡蛋白进行检测以测定其凋亡情况;
96.s1-10-4-3、同皮下注射实验,分为pbs组、exo
il2-tam
和exo
il2-tam
三组,将小鼠进行尾
静脉注射hcc细胞数目为5
×
105,建立异体移植肿瘤模型,同时尾静脉注射外泌体,通过对比分析肺、肝转移照片等测定转移情况;
97.s1-10-4-4、western blot检测emt相关蛋白mmp-2、mmp-9、 e-cadherin、n-cadherin分别测定emt相关蛋白的表达,通过以上步骤来共同检测外泌体能否促进hcc的转移作用。
98.如图1所示,hcc细胞吸收了外泌体和不同处理对细胞存活的影响。图中,a,外泌体典型的特征;b,外泌体直径在30到150nm;c,蛋白免疫印记;d,外泌体被hcc细胞吸收内化;e,外泌体在体外对 hcc发生和进展的影响。评估外泌体对hcc细胞的影响,huh7、hepg2 和qjy-7703细胞分别用pbs、exo
il2-tam
和exo
il2-tam
处理。
99.如图2所示,外泌体对hcc细胞增殖和凋亡的影响。图中,(a) 体外edu细胞的代表性免疫染色图像;(b)edu原子核占原子核总 数的百分比;(c-e)pcna的蛋白质印迹分析和cyclind1表达;(f-g) 外泌体处理24小时的细胞中膜联蛋白v-apc和碘化丙啶(pi)染色的 流式细胞术。显示了代表性的图(f)和量化(g)。(h-j)bax和bcl2 表达的蛋白质印迹分析。
100.如图3所示,外泌体对体内hcc进展的影响。(a-c)肿瘤异种移植物的形态特征、肿瘤大小和肿瘤重量。(每组n=6)。(d)来自不同组的tunel染色癌症切片的代表性照片。通过tunel染色(绿色)确定凋亡细胞核,通过dapi(蓝色)确定总细胞核。比例尺: 50毫米。(e)tunel阳性细胞核占细胞核总数的百分比(n 4到5)。 (f-h)蛋白质印bax和bcl2表达的分析。(i-k)pcna和cyclind1表达的蛋白质印迹分析。
101.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1