与分拣蛋白结合并抑制颗粒蛋白前体的结合的抗体的制作方法
与分拣蛋白结合并抑制颗粒蛋白前体的结合的抗体
1.本技术是申请号为2016800404765,申请日为2016年7月12日,发明名称为“与分拣蛋白结合并抑制颗粒蛋白前体的结合的抗体”的中国专利申请的分案申请。
发明领域
2.本发明涉及单克隆抗分拣蛋白抗体,它们在校正缺陷水平的颗粒蛋白前体(pgrn)中是有用的。具体而言,这些抗体可以用于治疗额颞痴呆(ftd)和肌萎缩性侧索硬化症(als)。此外,预期这些单克隆抗体还可以有用于治疗神经退行性障碍(如阿尔茨海默病(ad))。
3.对序列表的引用
4.本技术包括一个或多个序列表(依照37c.f.r.1.821等等),其是以计算机可读介质形式披露的(文件名:0993_st25.txt,创建于2016年6月22日,并且大小为144kb),将该文件通过引用以其全部内容结合在此。
5.发明背景
6.分拣蛋白是一种已经被报道介导前神经营养因子的促凋亡效应并且介导神经营养因子受体的运输和分拣的受体(尼科扎尔等人,2012,神经科学趋势(trends neurosci.)2012;35(4):261-70;格莱拉普(glerup)等人,实验药理学手册(handb exp pharmacol),2014;220:165-89;卡洛(carlo)等人,分子医学杂志(柏林)(j mol med(berl)).2014年9月;92(9):905-11)。已经鉴定了多种分拣蛋白配体,包括通过x射线晶体学将其高亲和力结合位点定位到分拣蛋白分子的β螺旋桨通道内的神经降压素(奎斯特加德(quistgaard)等人,自然结构与分子生物学(nat struct mol biol.)2009年1月;16(1):96-8;奎斯特加德等人,蛋白质科学(protein sci.)2014年9月;23(9):1291-300)。最近,显示分拣蛋白作为生长因子颗粒蛋白前体(pgrn)的高亲和力受体起作用(胡(hu)等人,神经元(neuron.)2010年11月18日;68(4):654-67)。
7.pgrn((前上皮因子,颗粒体蛋白-上皮因子前体,pc细胞衍生的生长因子,acrogranin))是一种具有抗炎和神经营养样作用的分泌型糖基化蛋白(关于最新综述,参见阮(nguyen),内分泌与代谢趋势(trends endocrinol metab.)2013年12月;24(12):597-606)。pgrn被蛋白水解地切割为颗粒体蛋白,但是关于pgrn和颗粒体蛋白的生理作用以及其受体的身份还有许多需要了解。pgrn已经被牵涉于若干细胞功能中,包括细胞周期调节和细胞运动(何,z.(he,z.)&贝特曼,a.(bateman,a.),分子医学杂志(j.moi.med.)57:600-612(2003);慕那美,g.(monami,g.)等人,癌症研究(cancer res.)(5(5:7103-7110(2006))、创面修复、炎症(朱,j.(zhu,j.)等人,细胞(cell)777:867-878(2002))、生长因子(如血管内皮生长因子(vegf))的诱导(唐康辛辛,w.(tangkeangsiπsin,w.)&塞莱罗,g(serrero,g),致癌作用(carcinogenesis)25.1587-1592(2004))以及肿瘤发生(何,z.&贝特曼,a.,分子医学杂志81:600-612(2003);慕那美,g.等人,癌症研究(5(5:7103-7110(2006);塞莱罗,g,生物化学和生物物理研究通讯(biochem biophys.res.commun.)505-409-413(2003);陆,r(lu,r)&塞莱罗,g,美国国家科学院院刊(proc.natl acad sci u.sa)
98 142-147(2001);廖,l m.(liau,l m.)等人,癌症研究60:1353-1360(2000))。已经报道pgrn结合tnf受体(唐w(tang w)等人,科学(science)2011,332(6028):478-84),但是这种观察已经受到了别人的质疑(陈(chen)等人,神经科学杂志(j neurosci.)2013,33(21):9202-9213)。
8.pgrn与分拣蛋白的结合已经被映射到神经降压素位点并且被报道按与神经降压素类似的方式仅由pgrn c末端结构域介导(郑(zheng)等人,plos one.2011;6(6):e21023;李(lee)等人,人分子遗传学(hum mol genet.)2013),并且与其一致,已经显示神经降压素阻断分拣蛋白与pgrn以及其他配体的相互作用。结合后,分拣蛋白介导pgrn的溶酶体清除并且由此调节细胞外pgrn水平(胡(hu)等人,2010)。因此,已经显示分拣蛋白的敲减或过表达调节细胞培养物中的细胞外pgrn水平(卡拉斯基罗(carrasquillo)等人,美国人遗传学杂志(am j hum genet.)2010年12月10日;87(6):890-7),并且在小鼠中,报道分拣蛋白缺陷增加pgrn水平并且恢复pgrn+/-小鼠中的血浆和脑pgrn水平(胡(hu)等人,2010)。有趣的是,分拣蛋白附近的单核苷酸多态性(snp)与降低的血浆pgrn水平和增加的分拣蛋白mrna水平相关(卡拉斯基罗(carrasquillo)等人,美国人遗传学杂志(am j hum genet.)2010年12月10日;87(6):890-7)。这些观察表明分拣蛋白是一种关键的细胞外pgrn调节剂。
9.pgrn已经与额颞痴呆(ftd,一种由行为和语义改变表征的进行性痴呆)以及额颞叶退化(ftld)和含有tar dna结合蛋白-43(tdp-43)的神经元包涵体或τ包涵体联系(贝克(baker)等人,2006,自然(nature).2006年8月24日;442(7105):916-9;克鲁特斯(cruts)等人,自然442:920-924(2006);美国人遗传学杂志(am j hum genet.)2010年12月10日;87(6):890-7;m等人,遗传学趋势(trends in genetics)24:186-194(2008))。大部分的散发性和家族性ftd病例显示出与als类似的tdp-43病理学(约50%),并且ftd-tdp43和als被一些人认为构成疾病谱(伊藤d(ito d),神经病学(neurology).2011年10月25日;77(17):1636-43;博克瑟al(boxer al)等人,阿尔茨海默病与痴呆症(alzheimers dement.)2013年3月;9(2):176-88;拉德麦克斯(rademakers)等人,神经病学自然评论(nat rev neurol.)2012年8月;8(8):423-434),这是由于共同的病理和遗传因素以及症状学中的一些重叠。没有可供ftd用的疾病修饰治疗选择。具有tdp-43病理学的一小群额颞痴呆患者在颗粒体蛋白基因(grn)中具有功能缺失突变,从而导致pgrn单倍型不足。迄今为止,颗粒体蛋白基因中的69个不同突变(全部都导致pgrn水平和/或功能减少)已经与ftd相关联并且据信升高血浆和脑中的细胞外pgrn将阻碍疾病过程。
10.pgrn突变还已经与阿尔茨海默病(ad)联系(沈(sheng)等人,2014,基因(gene).2014年6月1日;542(2):141-5;布劳维斯(brouwers)等人,2008,神经病学(neurology).2008年8月26日;71(9):656-64),表明pgrn缺陷可能在ad发病机制中发挥重要作用。此外,已经在小鼠ad模型中观察到pgrn的神经保护作用(米娜迷(minami)等人,2014,自然医学(nat med.)2014年10月;20(10):1157-64),从而为以下观点提供支持,即增强的pgrn在ad和可能地其他神经退行性疾病中可能是有益的。
11.本技术描述了抗人分拣蛋白抗体的产生和鉴定,这些抗体可以调节细胞模型和小鼠中的pgrn。那些抗体出人意料地结合到分拣蛋白上的远离先前报道的颗粒蛋白前体结合位点(所谓的神经降压素-位点)的区域,并且仍能够抑制分拣蛋白-pgrn相互作用并且能够增加细胞外pgrn。
12.诸位发明人已经定义了六个分拣蛋白结合区并且出人意料地鉴定出最有效的抗体结合一个区域(“d区”)。因为pgrn具有神经保护和抗炎作用,诸位发明人的发现指示靶向分拣蛋白的此类抗体在一系列神经退行性障碍(包括ftd/ftld)的治疗中可能具有有益效果。一个亚组的这些患者在编码pgrn的基因中携带突变,从而导致单倍型不足。因此,分拣蛋白抗体对于罹患其他tdp-43蛋白质病以及pgrn水平可以影响tdp43-功能和病理学的疾病(包括als和ad)的患者而言可能具有类似的治疗益处。
13.发明概述
14.本发明的诸位发明人已经产生了单克隆抗体,这些抗体能够抑制pgrn与分拣蛋白的结合并且出人意料地结合到被命名为如在seq id no:170中所定义的“d-区”的新颖分拣蛋白区。由诸位发明人鉴定的若干抗体具有与d-区抗体类似的特性,并且实验证据指示它们也结合在d-区内,并且那些抗体在此被称为d+抗体。因此,在一个方面,本发明涉及此类抗体,涉及包含此类抗体的组合物和/或试剂盒,并且涉及其方法和用途。
15.本发明还涉及一种预防或治疗与患者的脑中降低的pgrn水平相关的疾病的方法,该方法包括给予有效剂量的结合到分拣蛋白的d-区的抗体或其抗原结合片段。特别地,这些疾病包括ftd、als和tdp43蛋白质病(如ad)。
16.附图简要说明
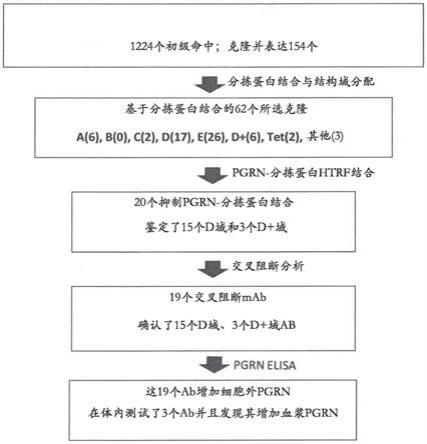
17.图1提供了基于分拣蛋白区结合的人抗体的区域分配的产生,对pgrn-结合和pgrn-水平以及抗体之间的交叉阻断的影响的概述。
18.对分拣蛋白结合抗体进行选择并且基于与改组构建体的结合将其分配给区域a-e,其中序列对应于该蛋白的所选区域内的四齿鲀属(tetraodon)分拣蛋白序列(实例1,图2)。
19.选择了20个抑制分拣蛋白-pgrn结合(如通过htrf分析测量的)的抗体(参见实例10,图5和图6)。这些抗体中的15个是d-区抗体,同时3个是d+抗体(图6)。随后的交叉阻断分析显示18个d-区和d+抗体(d+抗体具有与d-区抗体不同的结合改组构建体的模式,然而d+抗体不能被确定无疑地分配到如上概述的结合区a-e,但是具有与d-区抗体类似的功能特征(细胞测定等))全部都彼此交叉阻断,支持它们与同一分拣蛋白区相互作用(实例9,图7)。当在htrf分拣蛋白-pgrn结合测定中测试其他区域类别的分拣蛋白抗体时,41个抗体中仅有两个展现出抑制效果。这两个抗体之一与d和d+交叉阻断,但是具有非典型改组构建体结合模式(d样,除了它结合hb01-05区之外),而另一抗体并不与抑制pgrn-分拣蛋白结合的其他抗体交叉阻断,从而支持以下结论,即它结合到另一分拣蛋白区。
20.这些观察显示,结合到分拣蛋白中的由d-区定义的区域的抗体具有抑制分拣蛋白-pgrn结合的潜力。
21.19个交叉阻断抗体(其中18个是d-区和d+抗体)在细胞测定中增加细胞外pgrn(实例13,图10和图11)。在体内对这些抗体中的三个进行了测试,并且发现其增加血浆pgrn(图13a-c,实例15)。
22.图1中的框说明了抗体选择中的步骤。a-e是指基于如描述于实例1和seq id no:171-179中的改组构建体,对应的分拣蛋白结合抗体所分配的区域。“其他”是指不能被分配到一个区域并且可以结合在a-区与b-区之间的界面处的抗体。tet是指还结合四齿鲀属-分拣蛋白的抗体。
23.除所示的人抗体之外,还产生并且类似地表征了一组小鼠抗人分拣蛋白抗体。这些抗体中的两个被分配到d区并且显示与人d-区和d+抗体交叉阻断,以抑制分拣蛋白-pgrn结合并且增加细胞外pgrn(参见图4)。
24.图2示出了基于与分拣蛋白改组构建体的结合的抗体区域分配。
25.图a示出了用于抗体区域分配的如实例1中所述的改组构建体的线性说明。基于人分拣蛋白序列(seq id no:169)(以灰色描绘的区段)产生分拣蛋白改组构建体,在该序列中氨基酸残基被交换为来自四齿鲀属分拣蛋白序列(以黑色描绘)(seq id no:173)的相应氨基酸(实例1-3)。
26.图b示出了在a中线性地说明的改组构建体的预测结构。深色残基指示在改组构建体中变为相应的四齿鲀属序列的残基。
27.图c说明了分别被分配到d-区和e区类别的抗体的结合模式。“+”指示与给定的改组构建体结合,并且
“‑”
指示缺少结合。基于与不同改组构建体的结合模式,为抗体分配区域。所得抗体区域类别由a-e指示。对于说明的d和e区抗体,两者均结合如由“+”指示的人序列(全部为灰色)并且均不结合如由
“‑”
指示的四齿鲀属序列(全部为黑色),而e区抗体结合hb45678改组构建体,然而d区抗体并不结合,从而产生如图a中说明的结合定位。对于d区抗体,观察到与以下改组区域结合:hsort、hb06-10、b12390。这些抗体不与hb01-05、b45678、tet结合。对于d+抗体,观察到与以下改组区域结合:hsort、b12390。这些抗体不与hb01-05、hb06-10、b45678、tet结合。f结合模式与d结合模式类似,除了没有观察到d+抗体与hb06-10结合之外。
28.这些抗体并不与完全四齿鲀属的分拣蛋白结合,两个除外。这两个能够结合四齿鲀属序列的抗体被表示为“tet”。“其他”是指不能被分配到一个区域的抗体。
29.图3示出了人d-区和d+抗体的结合亲和力。使用octet 384red,通过生物膜层干涉技术如实例8中描述的确定与分拣蛋白改组构建体的结合亲和力(ec50,ng/ml)。没有阴影指示0.1-10ng/ml的ec50,浅灰色阴影指示ec50》10ng/ml并且灰色阴影指示没有结合(nb)。基于结合模式的区域分配在图2中说明。改组构建体在图2中说明并且序列以seq id no:171-179给出。mab=单克隆抗体。
30.图4示出了如使用octet 384red通过生物膜层干涉技术如实例8中描述的获得的小鼠抗人抗体与分拣蛋白改组构建体的结合亲和力(ec50,ng/ml)。没有阴影指示结合并且灰色阴影指示没有结合(nb)。在图2中说明基于结合模式的区域分配。
31.图5示出了分拣蛋白抗体对分拣蛋白pgrn结合的影响。d区分拣蛋白人单克隆(humab)抗体45(实心圆)阻止pgrn与分拣蛋白结合,与不干扰结合的对照分拣蛋白e区抗体(实心三角形)和igg对照igg1-b12(空心三角形)相反。通过使用均相时间分辨荧光(htrf)测量结合到分拣蛋白的pgrn的位移来确定抗体的结合(实例10)。用涵盖50pm至1μm的十个浓度在3倍稀释曲线中进行抗体的剂量应答评估。通过在xlfit 4(idbs,英国)中使用s形浓度应答(可变斜率)进行非线性回归来计算半最大抑制浓度(ic50)值。
32.图6如图5中所示的,通过均相时间分辨荧光(htrf)分析确定的抗体对分拣蛋白-pgrn结合的影响的概述。总计对62个抗体进行了测试-发现15个d-区抗体和3个d+抗体抑制分拣蛋白-pgrn结合并且确定了ic50值。对于两个另外的抗体(e和其他区域),观察到抑制效应。剩余的所有抗体在测试中都是阴性的。*抗体太弱以至于不能拟合剂量应答曲线在1μ
m下6%的抑制。**对照(ctrl)抗体太弱以至于不能拟合剂量应答曲线在1μm下37%的抑制。
33.这些观察显示由其d-区或d+分配表征的分拣蛋白抗体直接抑制分拣蛋白与pgrn的结合并且能够抑制分拣蛋白-pgrn结合。
34.图7示出了抗体之间的交叉阻断。人抗体和小鼠抗体都在单次实验中进行了测试,在该单次实验中每个抗体都结合到人野生型(wt)分拣蛋白(图7)。随后,针对与预成型的分拣蛋白:抗体复合物的结合对所有其他抗体进行测试(实例9)。所选的15个d-区和3个d+人抗体(基于其在htrf pgrn-分拣蛋白测定中的作用(图5和图6)和两个小鼠d区抗体全部抑制彼此与人wt分拣蛋白的结合。
35.这些抗体不与被指定为其他区域类别的抗体(如针对识别a-区、e-区和四齿鲀属的抗体所说明的,其在表中分别被编号为aba1-x、abe1-x和abtet)交叉阻断,除了一个交叉阻断a区抗体(一个具有未知区域分配(“其他”)并且对d+抗体548部分阻断的抗体)之外。这些数据支持在htrf测定中能够抑制分拣蛋白-pgrn结合的d-区和d+抗体全部与分拣蛋白中的同一区域相互作用。
36.通过分析对抗体-分拣蛋白结合的干扰来确定来自相同或不同区域(基于如图2中说明的与改组构建体结合的区域)的分拣蛋白抗体之间的交叉阻断。使用octet 384red通过生物膜层干涉技术测量抗体与分拣蛋白-ecd-his的结合(实例9)。左栏指示一级(固定)抗体并且顶行指示二级抗体(针对固定抗体进行测试的抗体)。一级和二级抗体与分拣蛋白-ecd-his的结合都将产生高于0.1的应答值并且指示两种抗体都结合到该蛋白的不同区域。小于0.1的应答值显示缺少二级抗体的结合和被固定(一级)抗体有效的交叉阻断,这表明两种抗体结合到分拣蛋白的同一区域。
37.图8示出了d-区和d+分拣蛋白抗体对选择性小分子配体af38469与分拣蛋白的结合的影响。已经显示af38469结合位点与神经降压素的结合位点类似并且通过x射线晶体学对其进行了表征(施罗德等人,生物有机化学与药物化学快报(bioorg med chem lett.)2014年1月1日;24(1):177-80)。已经报道pgrn结合到同一位点(李(lee)等人,人分子遗传学(hum mol genet.)2013),分别结合到d-区和d+的抗体45和68不抑制af38469与分拣蛋白的结合。这个数据表明这些抗体具有与af38469结合位点不同的分拣蛋白结合位点。因此,抗体45和68通过与迄今推测的分拣蛋白中的pgrn结合位点不同的结合位点抑制pgrn-分拣蛋白结合。
38.图9抗体45和68对pgrn的细胞结合和内吞的影响(实例12)。抗体45和68抑制过表达分拣蛋白的细胞对pgrn的结合和/或内吞。神经降压素(nt,10um)的添加类似地减少pgrn的结合或内吞,如在如预期的减少的荧光中所反映的,而同种型对照抗体b12并不影响pgrn荧光水平。
39.在添加重组pgrn持续4hr之前30min,将有待测试的抗体(100nm)添加至s18细胞中。然后将细胞固定,针对pgrn进行染色并且通过cellomics进行分析。将pgrn荧光测量为平均荧光/细胞。数据呈现为平均值
±
sd。通过单因素方差分析,随后是邓尼特分析(dunnett’s analysis)对数据进行分析,将所有组群与pgrn进行比较。*p《0.05;**p《0.01
40.图10在来自过表达分拣蛋白的hek细胞(s18)的培养物的培养基中通过elisa估计的细胞外pgrn水平。分拣蛋白d-区(45,811)和d+(68)抗体增加pgrn水平并且观察到分拣蛋白配体神经降压素的类似效果,而对照抗体b12没有影响。这些观察指示d-区和d+分拣蛋白
抗体能够抑制分拣蛋白介导的pgrn清除,由此增加细胞外pgrn。在100nm下对所有抗体进行测试。在10um下对神经降压素进行测试。pgrn水平已经用对照进行归一化。数据呈现为平均值
±
sd。通过单因素方差分析,随后是邓尼特分析对数据进行分析,将所有组群与ctrl进行比较*p《0.05;**p《0.01。(实例13)。
41.图11示出了如在实例13中描述的通过elisa测量的抗体对过表达人分拣蛋白的hek细胞中的细胞外pgrn的影响。全部所选d-区抗体和三个所选d+抗体增加细胞外pgrn。与上述相同的分析pgrn水平。将pgrn水平用未处理的对照进行归一化并且以%给出。两个抗体在小鼠抗人分拣蛋白中是升高的(1f2f4&5e1f6)),并且其余是人抗体。ab=单克隆抗体。
42.图12(上下图)示出了分拣蛋白抗体对神经元分化的ipsc细胞中的细胞外pgrn的影响(实例14)。分拣蛋白d-区抗体45和d+抗体68增加pgrn水平,而对照抗体b12和抗hel没有影响。
43.将神经元分化的ipsc细胞铺在96孔板中。一周后,将抗体添加至细胞中。在48hr或96hr时收集来自细胞的培养基并且通过人pgrn elisa(恩佐生命科学公司(enzo life sciences))进行分析并且按照制造商的说明书对样品进行分析。分拣蛋白人抗体45和68在两个时间点均增加培养基中的pgrn水平。对照同种型抗体b12和抗hel(阴性对照)并不改变细胞外pgrn。数据呈现为平均值
±
sd。通过单因素方差分析,随后是邓尼特分析对数据进行分析*p《0.05;**p《0.01(实例14)
44.图13a-c示出了用分拣蛋白人抗体处理的表达人分拣蛋白的敲入(ki)小鼠中的血浆pgrn水平(实例15)。分拣蛋白抗体45增加血浆pgrn水平,而对照抗体没有影响。
45.a时程研究:在抗体45(d区)注射后观察到增加的血浆pgrn水平。以10mg/kg的剂量为小鼠皮下注射45(n=5)或对照(n=3)抗体。在不同时间点将各组处死。在用对照抗体(抗hel)处理的小鼠中血浆pgrn没有变化,而在用45处理的小鼠中pgrn水平逐渐增加。效果似乎在24与48hr之间达到峰值并且在第4-7天逐渐降低。
46.b亚慢性研究:将小鼠用10mg/kg的45和对照抗体(抗hel)一周处理两次。每周从颊血收集样品。与用对照抗体处理的动物(n=20)相比,血浆pgrn在第1周升高并且贯穿整个研究保持大致相同的水平。
47.c剂量应答研究:注射不同剂量(4个剂量:0.1、0.4、2和10mg/kg)的分拣蛋白(45)和对照抗体(抗hel)并且在第2天将小鼠处死。在用45(10和2mg/kg)处理的小鼠中血浆pgrn是升高的。更低的剂量(0.4和0.1mg/kg)对血浆pgrn没有影响。数据呈现为平均值
±
sd。通过双因素方差分析,随后是邦费罗尼分析(bonferroni’s analysis)对数据进行分析*p《0.05;**p《0.01;***p《0.001(实例15)。
48.图14提供了基于加到预测的分拣蛋白结构上的分拣蛋白改组构建体的分拣蛋白区域说明。这些区域构成分拣蛋白的区段,在这些区段中所选氨基酸残基从人序列向四齿鲀属序列的改变抑制对那一区域类别的抗体的结合。箭头指示报道的神经降压素和pgrn的高亲和力结合位点(奎斯特加德(quistgaard),自然结构与分子生物学(nat struct mol biol.)2009年1月;16(1):96-8;李(lee)等人,人分子遗传学(hum mol genet.)2013)。
49.图15a(小图1-6)和15b(小图1-3)示出了涵盖抗体45、68和811的构象表位的代表肽。示出的所有肽都显示出受保护免于交换大于0.5d,肽115-125除外。肽115-125是不受抗体45、68或811的存在影响,并且由此不是构象结合表位的一部分的肽的实例(实例16)。
50.图16a(小图1-6)和16b(小图1-3)示出了涵盖抗体30的构象表位的代表肽。示出的所有肽都显示出受保护免于交换大于0.5d,肽563-572、肽646-656和肽704-714除外。这三种肽是不受抗体30的存在影响,并且由此不是构象结合的一部分的肽的实例(实例16)。
51.图17示出了微透析程序的说明。
52.图18a示出了时程:在微透析实验之前24h抗体45或pbs(50mg/kg,10ml/kg,皮下(s.c.))的全身性给予随时间(24h)对自由活动的hsort1小鼠的海马体中的prgn水平的影响。(实例17)
53.图18b示出了合并的24h透析的结果:自由活动的hsort1小鼠的海马体中的基础prgn,在用mab#45和pbs处理的小鼠中分别为3.3
±
0.3ng/ml和1.1
±
0.1ng/ml,如通过推拉式微透析所评估的(实例17)。
54.图18c呈现了一个表,示出了将动物用mab#45(n=10)或pbs(n=8)处理之后1d,在24h期间每2h测量的自由活动的hsort1小鼠的海马体中的prgn水平(平均值
±
sem)(实例17)。
55.发明详细说明
56.如在此使用的,术语“分拣蛋白(sortilin)”与“分拣蛋白(sortilin protein)”是同义的(在例如uniprot中鉴定为q99523,1和2)。分拣蛋白的氨基酸编号相对于seq id no:169如下所示的给出,met是氨基酸1:
[0057][0058][0059]
如在此使用的,术语“d区”旨在是指分拣蛋白上的由如下所示的seq id no:170中的氨基酸组成的区域(对应于seq id no:169的残基523-610):
[0060][0061]
对于d区抗体,观察到与以下改组区域结合:hsort、hb06-10、b12390。这些抗体不与hb01-05、b45678、tet结合。对于d+抗体,观察到与以下改组区域结合:hsort、b12390。这些抗体不与hb01-05、hb06-10、b45678、tet结合。对于命名为“d+”的抗体,观察到与“d”区抗体类似的结合模式,除了没有观察到d+抗体与hb06-10结合之外。尽管与改组构建体的结合模式不同,d+抗体与d-区抗体共享功能特征(细胞测定等)。
[0062]
某些d和d+结合抗体尤其结合如在seq id no:185、186或187中定义的区域。因此,本发明在某些实施例中涉及结合到seq id 170的,并且在区域seq id no:185、186或187内的d区序列的抗体或其抗原结合片段。通过结合,这些抗体或抗原结合片段影响pgrn水平并且因此可以用于治疗与pgrn相关的疾病,如ftd、als和ad。
[0063]
通过进一步分析本发明的d和d+的抗体的结合,鉴定到一些抗体与邻区(a区)的部分结合。这个区域对应于seq id no:169的氨基酸78-254,如在seq id no:180中和以下所示的:
[0064][0065]
这个区域已经被给予术语“a区”。
[0066]
因此,在某些实施例中,本发明涉及以下抗体或其抗原结合片段,其结合如上所定义的并且在seq id no 170、185、186或187中的d区,并且对在seq id no180中鉴定的a区进一步具有亲和力。在a区内,某些抗体或其抗原结合片段对在seq id no 181、182、183或184中鉴定的a区氨基酸具有亲和力。
[0067]
pgrn(前上皮因子,颗粒体蛋白-上皮因子前体,pc细胞衍生的生长因子,acrogranin)编码68.5kda的分泌型糖蛋白,该糖蛋白具有较小的颗粒体蛋白基序(范围从6-25kda)的7.5倍重复,该重复可以从前体pgrn中蛋白水解地切割下来(何,z.(he,z.)&贝特曼,a.(bateman,a.),分子医学杂志(j.moi.med.)81:600-6x2(2003))。在非神经元细胞中,pgrn已经与多个事件相关联,如细胞周期调节和细胞运动(何,z.(he,z.)&贝特曼,a.(bateman,a.),分子医学杂志(j.moi.med.)57:600-612(2003);慕那美,g.(monami,g.)等人,癌症研究(cancer res.)(5(5:7103-7110(2006))、创面修复、炎症(朱,j.(zhu,j.)等人,细胞(cell)777:867-878(2002))、生长因子(如血管内皮生长因子(vegf))的诱导(唐康辛辛,w.(tangkeangsiπsin,w.)&塞莱罗,g(serrero,g),致癌作用(carcinogenesis)25.1587-1592(2004))以及肿瘤发生(何,z.&贝特曼,a.,分子医学杂志81:600-612(2003);慕那美,g.等人,癌症研究(5(5:7103-7110(2006);塞莱罗,g,生物化学和生物物理研究通讯(biochem biophys.res.commun.)505-409-413(2003);陆,r(lu,r)&塞莱罗,g,美国国家科学院院刊(proc.natl acad sci u.sa)98 142-147(2001);廖,l m.(liau,l m.)等人,癌症研究60:1353-1360(2000))。
[0068]
pgrn突变导致单倍型不足(贝克,m.(baker,m.)等人,自然(nature)442:916-919
(2006);克鲁特斯,m.(cruts,m.)等人,自然442:920-924(2006))并且已知存在于将近50%的家族性ftd病例中,使得pgrn突变成为ftd的主要遗传促成因素(克鲁特斯,m.&范布洛克霍芬,c(van broeckhoven,c),遗传学趋势(trends genet.)24:186-194(2008);乐贝,i.(le ber,i.)等人,脑(brain)129:3051-3065(2006))。pgrn突变的功能缺失杂合性状意味着在健康个体中,pgrn表达在保护健康个体免于患上ftd中发挥剂量依赖性的关键作用。
[0069]
在本发明的背景下,术语“抗体”(ab)是指免疫球蛋白分子或根据本发明的一些实施例,免疫球蛋白分子的具有结合到分子(“抗原”)的表位上的能力的片段。天然存在的抗体典型地包含四聚体,该四聚体通常由至少两条重(h)链和至少两条轻(l)链构成。每条重链由重链可变域(在此缩写为vh)和重链恒定域构成,重链恒定域通常由3个结构域(ch1、ch2和ch3)构成。重链可以具有任何同种型,包括igg(igg1、igg2、igg3和igg4亚型)、iga(iga1和iga2亚型)、igm以及ige。每条轻链由轻链可变域(在此缩写为vl)和轻链恒定域(cl)构成。轻链包括κ链和λ链。重链和轻链可变域典型地负责抗原识别,而重链和轻链恒定域可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q))的结合。vh和vl域还可以被进一步细分成称作“互补性决定区”的超变区,它们中间穿插着更保守的称为“构架区”(fr)的区域。每个vh和vl由三个cdr域和四个fr域构成,按以下顺序从氨基末端排到羧基末端:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。重链和轻链可变域含有与抗原相互作用的结合域。特别相关的是已经“被分离”以便存在于与它可以在自然界中存在的不同于物理环境中的或者已经被修饰以便在氨基酸序列上不同于天然存在的抗体的抗体及其抗原结合片段。
[0070]
术语“表位”意指能够特异性结合抗体的抗原决定簇。表位通常由如氨基酸或糖侧链分子的表面基团组成,并且通常具有特定的三维结构特征以及特定的电荷特征。构象表位和线性表位的区别在于,在变性溶剂的存在下常常丧失与前者而非后者的结合。表位可以包含直接牵涉在结合中的氨基酸残基以及其他没有直接牵涉在结合中的氨基酸残基,如被特异性抗原结合肽有效阻断的氨基酸残基(换言之,氨基酸残基在特异性抗原结合肽的影响范围之内)。
[0071]
如在此使用的,术语“抗体的抗原结合片段”意指能够与表位结合的抗体的片段、部分、区域或结构域(无论它是如何产生的(例如,经由切割、重组、合成等)),并且因此术语“抗原结合”旨在意指与“表位结合”是相同的,这样使得例如,“抗体的抗原结合片段”旨在是与“抗体的表位结合片段”是相同的。抗原结合片段可以含有这样的抗体的1、2、3、4、5或所有6个cdr域,并且尽管能够结合到这样的表位,仍可以展现出对不同于这样的抗体的表位的这样的表位的特异性、亲和力或选择性。然而,优选地,抗原结合片段含有这样的抗体的所有6个cdr域。抗体的抗原结合片段可以是单条多肽链(例如,scfv)的一部分或包含单条多肽链,或者可以是两条或更多条多肽链(各自具有氨基末端和羧基末端)(例如,双抗体、fab片段、fab2片段等)的一部分或包含两条或更多条多肽链。可以例如通过完整抗体的蛋白酶切割来获得展现出抗原结合能力的抗体片段。更优选地,尽管fv片段的两个结构域vl和vh由单独基因或编码这样的基因序列的多核苷酸(例如,其编码cdna)天然地编码,但是可以将这两个结构域使用重组方法通过柔性接头连接,该柔性接头使得这两个结构域能够成为单条蛋白链,在该单条蛋白链中vl区和vh区缔合以形成单价抗原结合分子(称为单链fv(scfv);参见例如,伯德(bird)等人,(1988)科学(science)242:423-426;和休斯顿
(huston)等人,(1988)美国国家科学院院刊(proc.natl.acad.sci.(u.s.a.))85:5879-5883)。可替代地,通过采用太短(例如,小于约9个残基)以使得单条多肽链的vl域和vh域不能缔合在一起的柔性接头,可以形成双特异性抗体、双抗体或类似分子(其中两条这样的多肽链缔合在一起以形成二价抗原结合分子)(关于双抗体的描述,参见例如pnas usa 90(14),6444-8(1993))。本发明所包括的抗原结合片段的实例包括(i)fab'或fab片段,由vl、vh、cl和ch1域组成的单价片段,或如描述于wo 2007059782中的单价抗体;(ii)f(ab')2片段,包含两个由二硫键在铰链结构域连接的fab片段的二价片段;(iii)基本上由vh域和chl域组成的fd片段;(iv)基本上由vl域和vh域组成的fv片段;(v)dab片段(沃德(ward)等人,自然(nature)341,544-546(1989)),其基本上由vh域组成并且也称为结构域抗体(奥尔特(holt)等人,生物技术趋势(trends biotechnol.)2003年11月;2i(ll):484-90);(vi)骆驼或纳米抗体(雷维特斯(revets)等人,生物疗法的专家意见(expert opin biol ther.)2005年1月;5_(l):l ll-24)以及(vii)分离的互补决定区(cdr)。此外,尽管fv片段的两个结构域vl和vh由分离基因编码,但是可以使用重组方法通过合成接头将它们连接,该合成接头使得它们能够成为单条蛋白链,在该单条蛋白链中vl域和vh域配对以形成单价分子(称为单链抗体或单链fv(scfv);参见例如,伯德(bird)等人,科学(science)242,423-426(1988)和休斯顿(huston)等人,pnas usa 85,5879-5883(1988))。在此进一步讨论在本发明的背景下的这些和其他有用抗体片段。还应理解的是,除非另外指明,否则术语抗体还包括抗体样多肽,如通过任何已知技术(如酶促切割、肽合成和重组技术)提供的嵌合抗体和人源化抗体以及保留与抗原结合能力的抗体片段(抗原结合片段)。这样产生的抗体可以具有任何同种型。如在此使用的,“同种型”是指由重链恒定域基因编码的免疫球蛋白类别(例如igg1、igg2、igg3或igg4)。使用本领域的普通技术人员已知的常规技术获得这类抗体片段;可以按与完整抗体相同的方式针对实用性容易地对能够与希望的表位结合的适合片段进行筛选。
[0072]
术语“双特异性抗体”是指含有各自靶向独立靶标的两个独立抗原结合片段的抗体。这些靶标可以是存在于不同蛋白质上的表位或存在于相同靶标上的不同表位。可以使用亲本单特异性二价抗体分子的hc的恒定域中的补偿氨基酸变化制备双特异性抗体分子。所得异源二聚体抗体含有一个由两个不同亲本单特异性抗体贡献的fab。fc域中的氨基酸变化导致具有随时间稳定的双特异性的异源二聚体抗体的稳定性增加。(里奇韦(ridgway)等人,蛋白质工程(protein engineering)9,617-621(1996);古纳塞克兰(gunasekaran)等人,jbc 285,19637-1(2010);摩尔(moore)等人,mabs 3:6 546-557(2011);施特罗普(strop)等人,jmb 420,204-219(2012);梅茨(metz)等人,蛋白质工程25:10 571-580(2012);拉布赖恩(labrijn)等人,pnas110:113,5145-5150(2013);斯普雷特冯克鲁德恩斯坦(spreter von kreudenstein)等人,mabs 5:5 646-654(2013))。双特异性抗体还可以包括使用scfv融合物产生的分子。然后将两个单特异性scfv独立地连接至能够形成稳定异源二聚体的fc域,以产生单个双特异性分子(马布里(mabry)等人,peds 23:3 115-127(2010))。双特异性分子具有双重结合能力。
[0073]“抗分拣蛋白抗体”或“分拣蛋白抗体”(取决于书写它的背景,在此可互换地使用)是特异性地结合到分拣蛋白,并且尤其是结合到分拣蛋白d区seq id no:170的抗体其抗原结合片段。结合到分拣蛋白d区的抗分拣蛋白抗体通常将以或低于22nm(如在22nm与1nm之
间、在10nm与1nm之间或在5nm与1nm之间)的亲和力(ic50)结合到d-区(例如seq id no:185、186或187)内的3、4、5、6或7个连续氨基酸的构象表位或线性表位。根据一些实施例,抗分拣蛋白抗体还可以结合到a区(seq id no:180、181、182、183或184),尽管强调的是据信它们的主要生物功能是通过结合到d区实现的。
[0074]
鉴定的结合位点是相当独特的,如通过例如选择性小分子配体af38469与分拣蛋白的结合所显示的。已经显示af38469结合位点与神经降压素的结合位点类似并且通过x射线晶体学对其进行了表征(施罗德等人,生物有机化学与药物化学快报(bioorg med chem lett.)2014年1月1日;24(1):177-80)。已经报道pgrn结合到同一位点(李(lee)等人,人分子遗传学(hum mol genet.)2013)。分别结合到d-区和d+的抗体45和68不抑制af38469与分拣蛋白的结合。这个数据表明这些抗体具有与af38469和神经降压素结合位点不同的分拣蛋白结合位点。因此,在某些实施例中,本发明涉及能够特异性结合到分拣蛋白并且抑制pgrn与分拣蛋白的结合的抗体或其抗原结合片段,但是该结合不抑制或基本上不抑制神经降压素或af38469与分拣蛋白的结合。这可以使用闪烁亲近测定法(spa),使用例如结合到分拣蛋白的位移来示出(实例11)。解释这个发现的一种方式可以是抗体或其抗原结合片段结合到分拣蛋白的表面区域,而小分子样神经降压素结合在结合口袋内。
[0075]
如在此使用的,术语“人抗体”(其可以缩写为“humab”或“humab”)旨在包括具有衍生自人种系免疫球蛋白序列的可变域和恒定域的抗体。本发明的人抗体可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,在体外通过随机或位点特异性诱变或在基因重排期间或在体内通过体细胞突变引入的突变)。
[0076]
如在此使用的术语“单克隆抗体”或“单克隆抗体组合物”是指单分子组合物的抗体分子制剂。常规的单克隆抗体组合物表现出对特定表位的单一结合特异性和亲和力。在某些实施例中,单克隆抗体可以由多于一种fab域构成,由此增加对多于一种靶标的特异性。术语“单克隆抗体”或“单克隆抗体组合物”并不旨在受限于任何具体产生方法(例如,重组的、转基因的、杂交瘤等)。
[0077]
本发明的抗体及其分拣蛋白抗原结合片段优选是人的,例如对于小鼠抗体(表示为1f2、5e1)而言,是“人源化的”,特别是如果用于治疗目的的话。术语“人源化的”是指通常使用重组技术制备的具有衍生自来自非人物种的免疫球蛋白的抗原结合位点和基于人免疫球蛋白的结构和/或序列的剩余免疫球蛋白结构的分子。抗原结合位点可以包含融合至人恒定域的完全非人抗体可变域或仅包含接枝到人可变域的适当人构架区的此类可变域的互补决定区(cdr)。此类人源化分子的构架残基可以是野生型的(例如,全人的)或者它们可以被修饰成包含一种或多种未在其序列已经充当人源化的基础的人抗体中发现的氨基酸取代。人源化减小或消除该分子的恒定域充当人个体中的免疫原的可能性,但是仍存在对外源可变域做出免疫应答的可能性(洛布格利奥,a.f.(lobuglio,a.f.)等人(1989)“人体内的小鼠/人嵌合单克隆抗体:动力学与免疫应答(mouse/human chimeric monoclonal antibody in man:kinetics and immune response)”,美国国家科学院院刊(proc.natl.acad.sci.(u.s.a.))86:4220-4224)。另一种方法不仅集中于提供人衍生的恒定域,还集中于修饰可变域以便将它们改造地尽可能接近人形式。已知的是,重链和轻链两者的可变域都含有三个互补决定区(cdr),它们响应于所讨论的抗原而改变并且决定结合能力,其侧翼为四个构架区(fr),这些构架区在给定物种中是相对保守的并且推定为cdr提
供支架。当相对于特定抗原制备非人抗体时,可以通过在有待修饰的人抗体中存在的fr上接枝衍生自非人抗体的cdr来“改造”或“人源化”可变域。已经由萨托,k.(sato,k.)等人(1993)癌症研究(cancer res)53:851-856;莱克曼妮,l.(riechmann,l.)等人(1988)“改造治疗用的人抗体(reshaping human antibodies for therapy)”,自然(nature)332:323-327;费尔霍恩,m.(verhoeyen,m.)等人(1988)“改造人抗体:接枝抗溶菌酶活性(reshaping human antibodies:grafting an antilysozyme activity)”,科学(science)239:1534-1536;凯特伯勒,c.a.(kettleborough,c.a.)等人(1991)“通过cdr-接枝人源化小鼠单克隆抗体:构架残基在环构象中的重要性(humanization of a mouse monoclonal antibody by cdr-grafting:the importance of framework residues on loop conformation)”,蛋白质工程(protein engineering)4:773-3783;马埃达,h.(maeda,h.)等人(1991)“具有hiv中和活性的经改造的人抗体的构建(construction of reshaped human antibodies with hiv-neutralizing activity)”,人抗体杂交瘤(human antibodies hybridoma)2:124-134;戈尔曼,s.d.(gorman,s.d.)等人(1991)“改造治疗用cd4抗体(reshaping a therapeutic cd4 antibody)”,美国国家科学院院刊(proc.natl.acad.sci.(u.s.a.))88:4181-4185;坦皮斯特,p.r.(tempest,p.r.)等人(1991)“改造人单克隆抗体以抑制体内人呼吸道合胞病毒感染(reshaping a human monoclonal antibody to inhibit human respiratory syncytial virus infection in vivo)”,生物/技术(bio/technology)9:266-271;科,m.s.(co,m.s.)等人(1991)“抗病毒治疗用的人源化抗体(humanized antibodies for antiviral therapy)”,美国国家科学院院刊88:2869-2873;卡特,p.(carter,p.)等人(1992)“人癌症治疗用的抗p185her2抗体的人源化(humanization of an anti-p185her2 antibody for human cancer therapy)”,美国国家科学院院刊89:4285-4289;以及科,m.s.等人(1992)“对cd33抗原具有特异性的嵌合和人源化抗体(chimeric and humanized antibodies with specificity for the cd33 antigen)”,(j.immunol.)148:1149-1154报道了这种方法在各种抗体中的应用。在一些实施例中,人源化抗体保留所有cdr序列(例如,含有来自小鼠抗体的所有六个cdr的人源化小鼠抗体)。在其他实施例中,人源化抗体具有一个或多个cdr(一个、两个、三个、四个、五个、六个),它们相对于原始抗体是改变的,它们还被称为一个或多个“衍生自”来自原始抗体的一个或多个cdr的cdr。人源化抗原的能力是众所周知的(参见例如,美国专利号5,225,539;5,530,101;5,585,089;5,859,205;6,407,213;6,881,557)。
[0078]
术语“抗体“xx”旨在表示以下抗体或其抗原结合片段(例如抗体“5e1”),其包含如由其对应seq id no定义的轻链、轻链可变域或轻链可变域cdr1-3和如由其对应seq id no定义的重链、重链可变域或重链可变域cdr1-3或者由其组成。在某些实施例中,抗体或其抗原结合片段通过包含如由其seq id no定义的其整个重链可变域和如由其seq id no定义的其轻链可变域定义。
[0079]
这个区域中的氨基酸残基的编号是根据这个区域中的氨基酸残基的编号是根据(the international immunogenetics information)或卡巴特(kabat,e.a.),吴(wu,t.t.),佩里(perry,h.m.),格兹曼(gottesmann,k.s.)&富勒(foeller,c.)(1991),免疫学关注的蛋白质序列(sequences of proteins of immunological interest),第5版,nih公开号91-3242,美国卫生与公众服务部;乔西亚,c.(chothia,c.)&莱斯克(lesk,a.m.)
(1987).免疫球蛋白的超变区的典型结构(canonical structures for the hypervariable domains of immunoglobulins.)分子生物学(j.mol.biol.)196,901-917进行的。
[0080]
如在此使用的,抗体或其抗原结合片段被说成“特异性地”结合另一分子的区域(即,表位),如果它相对于替代表位与该表位更加频繁地、更加快速地、以更长的持续时间和/或以更大的亲和力或亲合力反应或缔合的话。在一个实施例中,本发明的抗体或其抗原结合片段相对于另一分子至少强10倍地与其靶标(分拣蛋白)结合;优选地强至少50倍并且更优选地强至少100倍。优选地,抗体或其抗原结合片段在生理条件下(例如,在体内)结合。因此,所谓“特异性地结合到分拣蛋白”,我们包括该抗体或其抗原结合片段以这样的特异性和/或在这样的条件下结合到分拣蛋白上的能力。适合于确定这样的结合的方法是本领域的普通技术人员已知的,并且示例性方法描述在所附实例中。如在此使用的,在抗体与预定抗原结合的背景下,术语“结合”典型地是指以对应于约10-7
m或更小(如约10-8
m或更小、如约10-9
m或更小)的kd的亲和力结合,当用抗原作为配体并且抗体作为分析物在3000或t200仪器中通过例如表面等离子体共振(spr)技术确定时,并且以对应于以下kd的亲和力结合到预定抗原,该kd比该抗体对与除预定抗原或紧密相关抗原之外的非特异性抗原(例如,bsa、酪蛋白)结合的亲和力低至少十倍,如低至少100倍、例如低至少1,000倍、如低至少10,000倍、例如低至少100,000倍。亲和力低的量依赖于抗体的kd,这样使得当抗体的kd非常低(即,该抗体具高度特异性)时,低于对非特异性抗原的亲和力的对抗原的亲和力的量可以是至少10,000倍。具体而言,本发明涉及抗分拣蛋白抗体,当使用octet 384red通过例如生物膜层干涉技术确定时(实例8),其展现出对应于或低于22nm(如在22nm与1nm之间、在10nm与1nm之间或在5nm与1nm之间)的结合亲和力。
[0081]
在本发明的某些实施例中,本发明涉及能够与humab抗体45或humab抗体68竞争与分拣蛋白结合的抗体或其抗原结合片段。在另一个实施例中,本发明涉及能够与抗体45竞争与如在seq id no:170中定义的分拣蛋白的d区结合的抗体或其抗原结合片段。这种竞争性结合抑制可以使用本领域熟知的测定和方法确定,例如使用固定有人分拣蛋白的芯片并且与参考抗体(如抗体“45”或“68”),与和不与有待测试的抗体多肽孵育。可替代地,可以使用成对映射方法,其中参考抗体(如抗体“45”或“68”)被固定到芯片的表面,人分拣蛋白抗原被结合到固定的抗体,并且然后测试第二抗体同时结合人分拣蛋白的能力(参见
‘
测定手册(assay handbook)’,ge医疗集团生命科学部(ge healthcare life sciences),29-0194-00aa 05/2012;将其披露通过引用结合在此)。
[0082]
如在此使用的,术语“kd”(sec-1或1/s)是指特定抗体-抗原相互作用的解离速率常数。所述值又称为koff值。
[0083]
如在此使用的,术语“ka”(m-1x sec-1或1/msec)是指特定抗体-抗原相互作用的缔合速率常数。
[0084]
如在此使用的,术语“kd”(m)是指特定抗体-抗原相互作用的解离平衡常数并且通过kd除以ka获得。
[0085]
如在此使用的,术语“ka”(m-1或1/m)是指特定抗体-抗原相互作用的缔合平衡常数并且通过ka除以kd获得。
[0086]
在一个实施例中,本发明涉及展现出以下特性中的一种或多种的抗体或其抗原结合片段:
[0087]
(i)在0.5-10nm(如1-5nm或1-2nm)之间的对分拣蛋白的结合亲和力(kd);
[0088]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0089]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0090]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0091]
(v)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力。
[0092]
术语“减少和/或抑制pgrn与分拣蛋白结合的能力”包括使用实例10中所披露的时间分辨荧光测定(htfr),具有以小于50nm但优选在10nm与0.2nm之间的ic50抑制与pgrn结合的能力的抗体。
[0093]
术语“减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力”包括将培养基中的pgrn浓度增加至少25%(如在25%与500%之间、在25%与400%之间或在25%与200%之间)的能力,如通过elisa测定如实例13中所披露的测量的。
[0094]“减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力”包括将pgrn的细胞内浓度减少至少10%但优选在20%与100%之间的能力,如通过基于细胞组学的测定如实例12中所披露的测量的。
[0095]“增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力”包括将血浆中的pgrn浓度增加至少25%但优选在50%与500%之间的能力,如通过elisa测定如实例15中所披露的测量的。
[0096]
设想的是,增加脑中的pgrn的能力还可以通过例如微透析进行测定。因此,“增加脑中的pgrn量和/或浓度的能力”包括将脑中的pgrn浓度增加至少25%但优选在50%与500%之间的能力,如通过微透析所测量的。
[0097]
在一些抗体中,仅需cdr的一部分(即结合所需的cdr残基亚群,称为sdr)在人源化抗体中保持结合。可以通过分子建模和/或凭经验或者如在冈萨雷斯,n.r.(gonzales,n.r.)等人,(2004)“使用多个人种系模板对鼠类抗体进行sdr接枝以最小化其免疫原性(sdr grafting of a murine antibody using multiple human germline templates to minimize its immunogenicity)”,分子免疫学(mol.immunol.)41:863-872中所述的,基于先前研究(例如cdr h2中的残基h60-h65通常是不需要的)从位于乔西亚(chothia)超变环外的卡巴特cdr区域(参见,卡巴特(kabat)等人,(1992)免疫学关注的蛋白质序列(sequences of proteins of immunological interest),美国国立卫生研究院(national institutes of health),公开号91-3242;乔西亚,c.(chothia,c.)等人,(1987)“免疫球蛋白的超变区的典型结构(canonical structures for the hypervariable regions of immunoglobulins)”,分子生物学杂志(j.mol.biol.)196:901-917)中鉴定不接触相关表位并且不在sdr中的cdr残基。在此类人源化抗体中,在一个或多个供体cdr残基不存在或整个供体cdr被省略的位置处,占据该位置的氨基酸可以是在受体抗体序列中占据相应位置(通过卡巴特编号)的氨基酸。在包含在内的cdr中受体对供体氨基酸的这样的取代的数目反映了竞争考虑的平衡。这样的取代在降低人源化抗体中的小鼠氨基酸的数目方面并且因此在降低潜在的免疫原性方面是潜在有利的。然而,取代还可以引起亲和力变化,并且优选避免亲和力的显著减少。还可以凭经验选择cdr内的取代位置和待取代的氨基酸。
[0098]
cdr残基的单个氨基酸改变可以导致失去功能性结合的事实(鲁迪科夫,s.(rudikoff,s.)等人(1982)“单个氨基酸取代改变抗原结合特异性(single amino acid substitution altering antigen-binding specificity)”,美国国家科学院院刊(proc.natl.acad.sci.(usa))79(6):1979-1983)提供了用于系统性鉴定可替代的功能性cdr序列的手段。在一种用于获得此类变体cdr的优选方法中,将编码cdr的多核苷酸诱变(例如经由随机诱变或通过位点定向方法(例如,用编码突变座位的引物进行聚合酶链式介导的扩增))以产生具有取代的氨基酸残基的cdr。通过比较原始(功能性)cdr序列中的相关残基的身份与取代的(非功能性)变体cdr序列的身份,可以鉴定出该取代的blosum62.iij取代得分。blosum系统提供了通过分析序列数据库创建的氨基酸取代矩阵,用于可信比对(埃迪,s.r.(eddy,s.r.)(2004)“blosum62比对得分矩阵来自哪里?(where did the blosum62 alignment score matrix come from?)”,自然生物技术(nature biotech.)22(8):1035-1036;赫尼科夫,j.g.(henikoff,j.g.)(1992)“来自蛋白质嵌段的氨基酸取代矩阵(amino acid substitution matrices from protein blocks)”,美国国家科学院院刊(proc.natl.acad.sci.(usa))89:10915-10919;卡林,s.(karlin,s.)等人,(1990)“通过使用通用评分方案评估分子序列特征的统计显著性的方法(methods for assessing the statistical significance of molecular sequence features by using general scoring schemes)”,美国国家科学院院刊87:2264-2268;阿尔丘尔,s.f.(altschul,s.f.)(1991)“来自信息理论视角的氨基酸取代矩阵(amino acid substitution matrices from an information theoretic perspective)”,分子生物学杂志(j.mol.biol.)219,555-565。目前,最先进的blosum数据库是blosum62数据库(blosum62.iij)。表1呈现了blosum62.iij取代得分(得分越高取代越保守,并且因此更加可能地,该取代将不会影响功能)。如果包含所得cdr的抗原结合片段不能结合到分拣蛋白,例如,则blosum62.iij取代得分被认为是不充分保守的,并且选择且产生新的具有更高取代得分的候选取代。因此,例如,如果原始残基是谷氨酸(e)并且非功能性取代残基是组氨酸(h),则blosum62.iij取代得分将为0,并且更保守的变化(如到天冬氨酸、天冬酰胺、谷氨酰胺或赖氨酸)是优选的。
[0099]
[0100][0101]
本发明因此考虑了随机诱变用于鉴定改进的cdr的用途。在本发明的背景下,保守取代可以由反映在以下三个表中的一个或多个中的氨基酸类别内的取代定义:
[0102]
保守取代的氨基酸残基类别:
[0103][0104]
替代性保守氨基酸残基取代类别:
[0105][0106]
氨基酸残基的替代性物理和功能分类:
[0107][0108][0109]
更保守的取代分组包括:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精
inside and outside the complementarity-determining regions)”,分子生物学(j.mol.biol.)388(3):541-558;波斯特朗,j.(bostrom,j.)等人(2009)“改进抗体结合亲和力以及特异性用于治疗性开发(improving antibody binding affinity and specificity for therapeutic development)”,分子生物学方法(methods mol.biol.)525:353-376;史泰德,s.(steidl,s.)等人(2008)“通过定向cdr多样化进行人gm-csf抗体的体外亲和力成熟(in vitro affinity maturation of human gm-csf antibodies by targeted cdr-diversification)”,分子免疫学(mol.immunol.)46(1):135-144;以及巴尔代雷斯,r.(barderas,r.)等人(2008)“通过计算机建模辅助的抗体亲和力成熟(affinity maturation of antibodies assisted by in silico modeling)”,美国国家科学院院刊(proc.natl.acad.sci.(usa))105(26):9029-9034。
[0113]
因此,所包含的抗体或其抗原结合片段的cdr变体的序列可以通过取代而不同于亲本抗体的cdr的序列;例如取代的4个氨基酸残基、3个氨基酸残基、2个氨基酸残基或氨基酸残基中的1个。根据本发明的实施例,此外设想的是,cdr区中的氨基酸可以用保守取代进行取代,如在以下3个表中所定义的。
[0114]
术语“转基因非人动物”是指具有包含一个或多个人重链和/或轻链转基因或转染色体(整合或未整合进动物的天然基因组dna)的基因组并且能够表达全人抗体的非人动物。例如,转基因小鼠可以具有人轻链转基因和人重链转基因或人重链转染色体,这样使得当用分拣蛋白抗原和/或表达分拣蛋白的细胞免疫时,该小鼠产生人抗分拣蛋白抗体。人重链转基因可以被整合进小鼠的染色体dna中,转基因小鼠就是这样,例如humab小鼠,如hco7或hco12小鼠,或者人重链转基因可以被维持在染色体外,如描述于wo 02/43478中的转染色体km小鼠就是这样。这样的转基因和转染色体小鼠(在此统称为“转基因小鼠”)通过经历v-d-j重组和同种型转换能够产生多种针对给定抗原的人单克隆抗体同种型(如igg、iga、igm、igd和/或ige)。
[0115]
转基因非人动物还可以通过引入编码这样的特异性抗体的基因(例如通过将这些基因可操作地连接至在该动物的乳中表达的基因)而用于产生针对特定抗原的抗体。
[0116]
如在此使用的术语“治疗(treatment)”或“治疗(treating)”意指改善、减缓、减弱或逆转疾病或障碍的进展或严重性,或者改善、减缓、减弱或逆转这种疾病或障碍的一种或多种症状或副作用。出于本发明的目的,“治疗(treatment)”或“治疗(treating)”另外意指用于获得有益的或希望的临床结果的方法,其中“有益的或希望的临床结果”包括但不限于症状的缓解、障碍或疾病程度的减小、稳定化的(即没有恶化的)疾病或障碍状态、疾病或障碍状态进展的延缓或减缓、疾病或障碍状态的改善或减轻以及疾病或障碍的缓解,不论是部分地或全部地、可检出的或不可检出的。
[0117]
当应用于本发明的抗体或其抗原结合片段时,“有效量”是指以所需剂量并且持续所需时间段足以达到预期生物效应或希望的治疗结果(包括但不限于临床结果)的量。当应用于本发明的抗体或其抗原结合片段时,短语“治疗有效量”旨在表示足以改善、减轻、稳定、逆转、减缓、减弱或延缓障碍或疾病状态的进展,或者该障碍或疾病的症状的进展的抗体或其抗原结合片段的量。在实施例中,本发明的方法提供了抗体或其抗原结合片段与其他化合物组合的给药。在此类情况下,“有效量”是足以引起预期的生物效应的该组合的量。
[0118]
本发明的抗分拣蛋白抗体或其抗原结合片段的治疗有效量可以根据以下因素而
变化,如个体的疾病状态、年龄、性别和体重,以及抗分拣蛋白抗体或其抗原结合片段在个体中引起希望的应答的能力。治疗有效量还是抗体或抗体部分的有益治疗效果超过其任何毒性或有害效果的量。
[0119]
抗体优选是人或人源化抗体。
[0120]
这个区域中的氨基酸残基的编号是根据这个区域中的氨基酸残基的编号是根据这个区域中的氨基酸残基的编号是根据(the international immunogenetics information)或卡巴特(kabat,e.a.),吴(wu,t.t.),佩里(perry,h.m.),格兹曼(gottesmann,k.s.)&富勒(foeller,c.)(1991),免疫学关注的蛋白质序列(sequences of proteins of immunological interest),第5版,nih公开号91-3242,美国卫生与公众服务部;乔西亚,c.(chothia,c.)&莱斯克(lesk,a.m.)(1987).免疫球蛋白的超变区的典型结构(canonical structures for the hypervariable domains of immunoglobulins.)分子生物学(j.mol.biol.)196,901-917进行的。
[0121]
抗体5e1:
[0122]
因此,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0123]
(a)具有seq id no:1的氨基酸序列的轻链cdr1;
[0124]
(b)具有seq id no:2的氨基酸序列的轻链cdr2;
[0125]
(c)具有seq id no:3的氨基酸序列的轻链cdr3;
[0126]
(d)具有seq id no:4的氨基酸序列的重链cdr1;
[0127]
(e)具有seq id no:5的氨基酸序列的重链cdr2;以及
[0128]
(f)具有seq id no:6的氨基酸序列的重链cdr3。
[0129]
优选地,单克隆抗体可以包含seq id no:8的重链可变域和seq id no:7的轻链可变域或者由其组成。
[0130]
抗体1f2:
[0131]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0132]
(a)具有seq id no:9的氨基酸序列的轻链cdr1;
[0133]
(b)具有seq id no:10的氨基酸序列的轻链cdr2;
[0134]
(c)具有seq id no:11的氨基酸序列的轻链cdr3;
[0135]
(d)具有seq id no:12的氨基酸序列的重链cdr1;
[0136]
(e)具有seq id no:13的氨基酸序列的重链cdr2;以及
[0137]
(f)具有seq id no:14的氨基酸序列的重链cdr3。
[0138]
优选地,单克隆抗体可以包含seq id no:16的重链可变域和seq id no:15的轻链可变域或者由其组成。
[0139]
抗体068:
[0140]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0141]
(a)具有seq id no:17的氨基酸序列的轻链cdr1;
[0142]
(b)具有seq id no:18的氨基酸序列的轻链cdr2;
[0143]
(c)具有seq id no:19的氨基酸序列的轻链cdr3;
[0144]
(d)具有seq id no:20的氨基酸序列的重链cdr1;
[0145]
(e)具有seq id no:21的氨基酸序列的重链cdr2;以及
[0146]
(f)具有seq id no:22的氨基酸序列的重链cdr3。
[0147]
优选地,单克隆抗体可以包含seq id no:24的重链可变域和seq id no:23的轻链可变域或者由其组成。
[0148]
抗体1320:
[0149]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0150]
(a)具有seq id no:25的氨基酸序列的轻链cdr1;
[0151]
(b)具有seq id no:26的氨基酸序列的轻链cdr2;
[0152]
(c)具有seq id no:27的氨基酸序列的轻链cdr3;
[0153]
(d)具有seq id no:28的氨基酸序列的重链cdr1;
[0154]
(e)具有seq id no:29的氨基酸序列的重链cdr2;以及
[0155]
(f)具有seq id no:30的氨基酸序列的重链cdr3。
[0156]
优选地,单克隆抗体可以包含seq id no:32的重链可变域和seq id no:31的轻链可变域或者由其组成。
[0157]
抗体93-05:
[0158]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0159]
(a)具有seq id no:33的氨基酸序列的轻链cdr1;
[0160]
(b)具有seq id no:34的氨基酸序列的轻链cdr2;
[0161]
(c)具有seq id no:35的氨基酸序列的轻链cdr3;
[0162]
(d)具有seq id no:36的氨基酸序列的重链cdr1;
[0163]
(e)具有seq id no:37的氨基酸序列的重链cdr2;以及
[0164]
(f)具有seq id no:38的氨基酸序列的重链cdr3。
[0165]
优选地,单克隆抗体可以包含seq id no:40的重链可变域和seq id no:39的轻链可变域或者由其组成。
[0166]
抗体93-01:
[0167]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0168]
(a)具有seq id no:41的氨基酸序列的轻链cdr1;
[0169]
(b)具有seq id no:42的氨基酸序列的轻链cdr2;
[0170]
(c)具有seq id no:43的氨基酸序列的轻链cdr3;
[0171]
(d)具有seq id no:44的氨基酸序列的重链cdr1;
[0172]
(e)具有seq id no:45的氨基酸序列的重链cdr2;以及
[0173]
(f)具有seq id no:46的氨基酸序列的重链cdr3。
[0174]
优选地,单克隆抗体可以包含seq id no:48的重链可变域和seq id no:47的轻链可变域或者由其组成。
[0175]
抗体924:
[0176]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0177]
(a)具有seq id no:49的氨基酸序列的轻链cdr1;
[0178]
(b)具有seq id no:50的氨基酸序列的轻链cdr2;
[0179]
(c)具有seq id no:51的氨基酸序列的轻链cdr3;
[0180]
(d)具有seq id no:52的氨基酸序列的重链cdr1;
[0181]
(e)具有seq id no:53的氨基酸序列的重链cdr2;以及
[0182]
(f)具有seq id no:54的氨基酸序列的重链cdr3。
[0183]
优选地,单克隆抗体可以包含seq id no:56的重链可变域和seq id no:55的轻链可变域或者由其组成。
[0184]
抗体1276:
[0185]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0186]
(a)具有seq id no:57的氨基酸序列的轻链cdr1;
[0187]
(b)具有seq id no:58的氨基酸序列的轻链cdr2;
[0188]
(c)具有seq id no:59的氨基酸序列的轻链cdr3;
[0189]
(d)具有seq id no:60的氨基酸序列的重链cdr1;
[0190]
(e)具有seq id no:61的氨基酸序列的重链cdr2;以及
[0191]
(f)具有seq id no:62的氨基酸序列的重链cdr3。
[0192]
优选地,单克隆抗体可以包含seq id no:64的重链可变域和seq id no:63的轻链可变域或者由其组成。
[0193]
抗体849:
[0194]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0195]
(a)具有seq id no:65的氨基酸序列的轻链cdr1;
[0196]
(b)具有seq id no:66的氨基酸序列的轻链cdr2;
[0197]
(c)具有seq id no:67的氨基酸序列的轻链cdr3;
[0198]
(d)具有seq id no:68的氨基酸序列的重链cdr1;
[0199]
(e)具有seq id no:69的氨基酸序列的重链cdr2;以及
[0200]
(f)具有seq id no:70的氨基酸序列的重链cdr3。
[0201]
优选地,单克隆抗体可以包含seq id no:72的重链可变域和seq id no:71的轻链可变域或者由其组成。
[0202]
抗体531-02:
[0203]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0204]
(a)具有seq id no:73的氨基酸序列的轻链cdr1;
[0205]
(b)具有seq id no:74的氨基酸序列的轻链cdr2;
[0206]
(c)具有seq id no:75的氨基酸序列的轻链cdr3;
[0207]
(d)具有seq id no:76的氨基酸序列的重链cdr1;
[0208]
(e)具有seq id no:77的氨基酸序列的重链cdr2;以及
[0209]
(f)具有seq id no:78的氨基酸序列的重链cdr3。
[0210]
优选地,单克隆抗体可以包含seq id no:80的重链可变域和seq id no:79的轻链可变域或者由其组成。
[0211]
抗体548-01:
[0212]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0213]
(a)具有seq id no:81的氨基酸序列的轻链cdr1;
[0214]
(b)具有seq id no:82的氨基酸序列的轻链cdr2;
[0215]
(c)具有seq id no:83的氨基酸序列的轻链cdr3;
[0216]
(d)具有seq id no:84的氨基酸序列的重链cdr1;
[0217]
(e)具有seq id no:85的氨基酸序列的重链cdr2;以及
[0218]
(f)具有seq id no:86的氨基酸序列的重链cdr3。
[0219]
优选地,单克隆抗体可以包含seq id no:88的重链可变域和seq id no:87的轻链可变域或者由其组成。
[0220]
抗体548-02:
[0221]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0222]
(a)具有seq id no:89的氨基酸序列的轻链cdr1;
[0223]
(b)具有seq id no:90的氨基酸序列的轻链cdr2;
[0224]
(c)具有seq id no:91的氨基酸序列的轻链cdr3;
[0225]
(d)具有seq id no:92的氨基酸序列的重链cdr1;
[0226]
(e)具有seq id no:93的氨基酸序列的重链cdr2;以及
[0227]
(f)具有seq id no:94的氨基酸序列的重链cdr3。
[0228]
优选地,单克隆抗体可以包含seq id no:96的重链可变域和seq id no:95的轻链可变域或者由其组成。
[0229]
抗体1289-02:
[0230]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0231]
(a)具有seq id no:97的氨基酸序列的轻链cdr1;
[0232]
(b)具有seq id no:98的氨基酸序列的轻链cdr2;
[0233]
(c)具有seq id no:99的氨基酸序列的轻链cdr3;
[0234]
(d)具有seq id no:100的氨基酸序列的重链cdr1;
[0235]
(e)具有seq id no:101的氨基酸序列的重链cdr2;以及
[0236]
(f)具有seq id no:102的氨基酸序列的重链cdr3。
[0237]
优选地,单克隆抗体可以包含seq id no:104的重链可变域和seq id no:103的轻链可变域或者由其组成。
[0238]
抗体811-02:
[0239]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片
段:
[0240]
(a)具有seq id no:105的氨基酸序列的轻链cdr1;
[0241]
(b)具有seq id no:106的氨基酸序列的轻链cdr2;
[0242]
(c)具有seq id no:107的氨基酸序列的轻链cdr3;
[0243]
(d)具有seq id no:108的氨基酸序列的重链cdr1;
[0244]
(e)具有seq id no:109的氨基酸序列的重链cdr2;以及
[0245]
(f)具有seq id no:110的氨基酸序列的重链cdr3。
[0246]
优选地,单克隆抗体可以包含seq id no:112的重链可变域和seq id no:111的轻链可变域或者由其组成。
[0247]
抗体566-01:
[0248]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0249]
(a)具有seq id no:113的氨基酸序列的轻链cdr1;
[0250]
(b)具有seq id no:114的氨基酸序列的轻链cdr2;
[0251]
(c)具有seq id no:115的氨基酸序列的轻链cdr3;
[0252]
(d)具有seq id no:116的氨基酸序列的重链cdr1;
[0253]
(e)具有seq id no:117的氨基酸序列的重链cdr2;以及
[0254]
(f)具有seq id no:118的氨基酸序列的重链cdr3。
[0255]
优选地,单克隆抗体可以包含seq id no:120的重链可变域和seq id no:119的轻链可变域或者由其组成。
[0256]
抗体562:
[0257]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0258]
(a)具有seq id no:121的氨基酸序列的轻链cdr1;
[0259]
(b)具有seq id no:122的氨基酸序列的轻链cdr2;
[0260]
(c)具有seq id no:123的氨基酸序列的轻链cdr3;
[0261]
(d)具有seq id no:124的氨基酸序列的重链cdr1;
[0262]
(e)具有seq id no:125的氨基酸序列的重链cdr2;以及
[0263]
(f)具有seq id no:126的氨基酸序列的重链cdr3。
[0264]
优选地,单克隆抗体可以包含seq id no:128的重链可变域和seq id no:127的轻链可变域或者由其组成。
[0265]
抗体193:
[0266]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0267]
(a)具有seq id no:129的氨基酸序列的轻链cdr1;
[0268]
(b)具有seq id no:130的氨基酸序列的轻链cdr2;
[0269]
(c)具有seq id no:131的氨基酸序列的轻链cdr3;
[0270]
(d)具有seq id no:132的氨基酸序列的重链cdr1;
[0271]
(e)具有seq id no:133的氨基酸序列的重链cdr2;以及
[0272]
(f)具有seq id no:134的氨基酸序列的重链cdr3。
[0273]
优选地,单克隆抗体可以包含seq id no:136的重链可变域和seq id no:135的轻链可变域或者由其组成。
[0274]
抗体88:
[0275]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0276]
(a)具有seq id no:137的氨基酸序列的轻链cdr1;
[0277]
(b)具有seq id no:138的氨基酸序列的轻链cdr2;
[0278]
(c)具有seq id no:139的氨基酸序列的轻链cdr3;
[0279]
(d)具有seq id no:140的氨基酸序列的重链cdr1;
[0280]
(e)具有seq id no:141的氨基酸序列的重链cdr2;以及
[0281]
(f)具有seq id no:142的氨基酸序列的重链cdr3。
[0282]
优选地,单克隆抗体可以包含seq id no:144的重链可变域和seq id no:143的轻链可变域或者由其组成。
[0283]
抗体045:
[0284]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0285]
(a)具有seq id no:145的氨基酸序列的轻链cdr1;
[0286]
(b)具有seq id no:146的氨基酸序列的轻链cdr2;
[0287]
(c)具有seq id no:147的氨基酸序列的轻链cdr3;
[0288]
(d)具有seq id no:148的氨基酸序列的重链cdr1;
[0289]
(e)具有seq id no:149的氨基酸序列的重链cdr2;以及
[0290]
(f)具有seq id no:150的氨基酸序列的重链cdr3。
[0291]
优选地,单克隆抗体可以包含seq id no:152的重链可变域和seq id no:151的轻链可变域或者由其组成。
[0292]
抗体044:
[0293]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0294]
(a)具有seq id no:153的氨基酸序列的轻链cdr1;
[0295]
(b)具有seq id no:154的氨基酸序列的轻链cdr2;
[0296]
(c)具有seq id no:155的氨基酸序列的轻链cdr3;
[0297]
(d)具有seq id no:156的氨基酸序列的重链cdr1;
[0298]
(e)具有seq id no:157的氨基酸序列的重链cdr2;以及
[0299]
(f)具有seq id no:158的氨基酸序列的重链cdr3。
[0300]
优选地,单克隆抗体可以包含seq id no:160的重链可变域和seq id no:159的轻链可变域或者由其组成。
[0301]
抗体002:
[0302]
根据另一个实施例,本发明涉及包含以下各项或由其组成的抗体或其抗原结合片段:
[0303]
(a)具有seq id no:161的氨基酸序列的轻链cdr1;
[0304]
(b)具有seq id no:162的氨基酸序列的轻链cdr2;
[0305]
(c)具有seq id no:163的氨基酸序列的轻链cdr3;
[0306]
(d)具有seq id no:164的氨基酸序列的重链cdr1;
[0307]
(e)具有seq id no:165的氨基酸序列的重链cdr2;以及
[0308]
(f)具有seq id no:166的氨基酸序列的重链cdr3。
[0309]
优选地,单克隆抗体可以包含seq id no:168的重链可变域和seq id no:167的轻链可变域或者由其组成。
[0310]
根据一个实施例,以上所提及的抗体可以进一步包括与所述cdr1、cdr2和/或cdr3(vh和/或vl)序列具有不超过4个氨基酸差异、或不超过3个氨基酸差异、或不超过2个氨基酸差异或不超过1个氨基酸差异的变体。
[0311]
此外,抗体可以与药学上可接受的载体一起处于组合物中。本发明的抗体可以在治疗中使用。具体而言,本发明的抗体可以用于治疗ftd或als或tdp43蛋白质病(如阿尔茨海默病(ad))。
[0312]
通过本发明所设想的治疗可以是长期的并且患者可以接受至少2周(如至少持续1个月、6个月、1年或更久)治疗。
[0313]
本发明的抗体可以例如是通过杂交瘤方法产生的单克隆抗体,该方法首次由科勒(kohler)等人,自然(nature)256,495(1975)进行描述,或者可以是通过重组dna或其他方法产生的单克隆抗体。还可以使用在例如克拉克森(clackson)等人,自然(nature)352,624-628(1991)和马克思(marks)等人,分子生物学杂志(j.mol.biol.)222,581-597(1991)中描述的技术从噬菌体抗体文库分离单克隆抗体。单克隆抗体可以从任何适合的来源获得。因此,例如,单克隆抗体可以从制备自鼠类脾脏b淋巴细胞的杂交瘤获得,这些淋巴细胞获得自用感兴趣的抗原或编码感兴趣的抗原的核酸免疫的小鼠,例如,这些淋巴细胞处于在表面表达该抗原的细胞的形式。单克隆抗体还可以从来源于免疫的人的或来自非人哺乳动物(如大鼠、兔、狗、绵羊、山羊、灵长类动物等)的表达抗体的细胞的杂交瘤获得。
[0314]
在一个实施例中,本发明的抗体是人抗体。可以使用携带部分人免疫系统而非小鼠系统的转基因或转染色体小鼠产生针对分拣蛋白的人单克隆抗体。这样的转基因和转染色体小鼠包括在此分别称为humab小鼠和km小鼠的小鼠。
[0315]
humab小鼠含有人免疫球蛋白基因微座位连同定向突变,该微座位编码非重排人重链可变和恒定(μ和y)以及轻链可变和恒定(κ)免疫球蛋白序列,这些定向突变使内源μ和k链座位失活(朗伯格,n.(lonberg,n.)等人,自然(nature)368,856-859(1994))。因此,小鼠展现出减少的小鼠igm或k表达,并且响应于免疫,所引入的人重链和轻链转基因经历类别转换和体细胞突变以产生高亲和力人igg,κ单克隆抗体(朗伯格,n.(lonberg,n.)等人(1994),见上文;综述于朗伯格,n.,实验药物学手册(handbook of experimental pharmacology)113,49-101(1994);朗伯格,n.和胡萨尔,d.(huszar,d.),国际免疫学评论(intern.rev.immunol.)第13卷65-93(1995)和哈丁,f.(harding,f.)和朗伯格,n.,纽约科学院年刊(ann.n.y.acad.sci)764 536-546(1995))。humab小鼠的制备详细描述于泰勒,l.(taylor,l.)等人,核酸研究(nucleic acids research)20,6287-6295(1992);陈,j.(chen,j.)等人,国际免疫学(international immunology)5,647-656(1993);图爱隆
(tuaillon)等人,免疫学杂志(j.immunol.)152,2912-2920(1994);泰勒,l.等人,国际免疫学6,579-591(1994);菲施维尔德,d.(fishwild,d.)等人,自然生物技术(nature biotechnology)14,845-851(1996)。还参见us 5,545,806、us 5,569,825、us 5,625,126、us 5,633,425、us 5,789,650、us 5,877,397、us 5,661,016、us 5,814,318、us 5,874,299、us 5,770,429、us 5,545,807、wo 98/24884、wo 94/25585、wo 93/1227、wo 92/22645、wo 92/03918以及wo 01/09187。
[0316]
hco7、hco12、hco17和hco20小鼠在其内源轻链(κ)基因中具有jkd破坏(如描述于陈(chen)等人,欧洲分子生物学学会杂志(embo j.)12,811-820(1993)),在其内源重链基因中具有种cmd破坏(如描述于wo 01/14424的实例1)以及kco5人κ轻链转基因(如描述于菲施维尔德(fishwild)等人,自然生物技术(nature biotechnology)14,845-851(1996))。此外,hco7小鼠具有hco7人重链转基因(如描述于us 5,770,429),hco12小鼠具有hco12人重链转基因(如描述于wo 01/14424的实例2),hco17小鼠具有hco17人重链转基因(如描述于wo 01/09187的实例2)并且hco20小鼠具有hco20人重链转基因。所得小鼠在对内源小鼠重链和κ轻链座位破坏纯合的背景下表达人免疫球蛋白重链和κ轻链转基因。
[0317]
在km小鼠品系中,内源小鼠κ轻链基因已经被同型结合地破坏,如描述于陈(chen)等人,欧洲分子生物学学会杂志(embo j.)12,811-820(1993),并且内源小鼠重链基因已经被同型结合地破坏,如描述于wo 01/09187的实例1。这个小鼠品系携带人κ轻链转基因kco5,如描述于菲施维尔德(fishwild)等人,自然生物技术(nature biotechnology)14,845-851(1996)中。这个小鼠品系还携带由染色体14片段hcf(sc20)构成的人重链转染色体,如描述于wo 02/43478中。hco12-balb/c、hco17-balb/c和hco20-balb/c小鼠可以通过将hco12、hco17和hco20与kco5[j/k](balb)杂交来产生,如描述于wo 09/097006中。
[0318]
在km小鼠品系中,内源小鼠κ轻链基因已经被同型结合地破坏,如描述于陈(chen)等人,欧洲分子生物学学会杂志(embo j.)12,811-820(1993),并且内源小鼠重链基因已经被同型结合地破坏,如描述于wo 01/09187的实例1。这个小鼠品系携带人κ轻链转基因kco5,如描述于菲施维尔德(fishwild)等人,自然生物技术(nature biotechnology)14,845-851(1996)中。这个小鼠品系还携带由染色体14抗原结合片段hcf(sc20)构成的人重链转染色体,如描述于wo 02/43478中。
[0319]
来自这些转基因小鼠的脾细胞可以用于根据熟知的技术产生分泌人单克隆抗体的杂交瘤。本发明的人单克隆抗体或多克隆抗体或者源于其他物种的本发明的抗体还可以通过产生对于感兴趣的免疫球蛋白重链和轻链序列而言转基因的另一非人哺乳动物或植物并且从其中产生可回收形式的抗体而转基因地产生。与哺乳动物中的转基因生产相结合,抗体可以从山羊、奶牛或其他哺乳动物的乳中产生和回收。参见例如us 5,827,690、us 5,756,687、us 5,750,172和us 5,741,957。
[0320]
本发明的抗体可以具有任何同种型。同种型的选择典型地将由希望的效应子功能(如adcc诱导)来指导。示例性同种型是igg1、igg2、igg3和igg4。可以使用人轻链恒定域κ或λ中任一者。如果希望的话,可以通过已知方法转换本发明的抗分拣蛋白抗体的类别。例如,最初是igm的本发明抗体可以类别转换为本发明的igg抗体。此外,类别转换技术可以用来将一个igg亚类转化成另一亚类,例如从iggl到igg2。因此,本发明的抗体的效应子功能可以通过同种型切换变为例如igg1、igg2、igg3、igg4、igd、iga、ige或igm抗体,用于各种治疗
用途。在一个实施例中,本发明的抗体是igg1抗体,例如igg1,κ。抗体被说成属于特定同种型,如果其氨基酸序列相对于其他同种型与该同种型大部分同源的话。
[0321]
在一个实施例中,本发明的抗体是全长抗体,优选igg抗体,特别是igg1,κ抗体。在另一个实施例中,本发明的抗体是抗体抗原结合片段或单链抗体。
[0322]
抗体及其抗原结合片段可以例如使用常规技术通过抗原结合片段化来获得,并且按与如在此针对完整抗体描述的相同方式针对实用性对抗原结合片段进行筛选。例如,f(ab')2抗原结合片段可以通过用胃蛋白酶处理抗体而产生。可以处理所得f(ab')2抗原结合片段,以减少二硫键,从而产生fab'抗原结合片段。fab抗原结合片段可以通过用木瓜蛋白酶处理igg抗体而获得;fab'抗原结合片段可以用胃蛋白酶消化igg抗体而获得。f(ab')抗原结合片段还可以经由硫醚键或二硫键通过结合以下描述的fab’而产生。fab'抗原结合片段是通过切割f(ab')2的铰链域的二硫键获得的抗体抗原结合片段。fab'-抗原结合片段可以通过用还原剂(如二硫苏糖醇)处理f(ab')2抗原结合片段而获得。抗体抗原结合片段还可以通过在重组细胞中表达编码此类抗原结合片段的核酸而产生(参见例如埃文斯(evans)等人,免疫学方法杂志(j.immunol.meth.)184,123-38(1995))。例如,编码f(ab')2抗原结合片段的一部分的嵌合基因可以包括编码h链的ch1域和铰链域的dna序列,随后是翻译终止密码子,以产生这样一种截短的抗体抗原结合片段分子。
[0323]
在一个实施例中,抗分拣蛋白抗体是单价抗体,优选如在wo 2007059782(将其通过引用以其全部内容结合在此)中描述的具有铰链区缺失的单价抗体。因此,在一个实施例中,抗体是单价抗体,其中所述抗分拣蛋白抗体通过以下方法构建,该方法包括:i)提供编码所述单价抗体的轻链的核酸构建体,所述构建体包含编码所选抗原特异性抗分拣蛋白抗体的vl区的核苷酸序列和编码ig的恒定cl区的核苷酸序列,其中编码所选抗原特异性抗体的vl区的所述核苷酸序列和编码ig的cl区的所述核苷酸序列被可操作地连接在一起,并且其中,在igg1亚型的情况下,编码cl区的核苷酸序列已经被修饰,这样使得在多克隆人igg的存在下或当给予给动物或人时,该cl区不含有能够与包含该cl区的一致氨基酸序列的其他肽形成二硫键或共价键的任何氨基酸;ii)提供编码所述单价抗体的重链的核酸构建体,所述构建体包含编码所选抗原特异性抗体的vh区的核苷酸序列和编码人ig的恒定ch区的核苷酸序列,其中编码ch区的核苷酸序列已经被修饰,这样使得在多克隆人igg的存在下或当给予给动物人时,对应于铰链区和(如由ig亚型所要求的)ch区的其他区域(如ch3区)的区域不包含参与和包含人ig的ch区的一致氨基酸序列的其他肽形成二硫键或共价或稳定的非共价重链间键的任何氨基酸残基,其中编码所选抗原特异性抗体的vh区的所述核苷酸序列和编码所述ig的ch区的所述核苷酸序列被可操作地连接在一起;iii)提供用于产生所述单价抗体的细胞表达系统;iv)通过在(iii)的细胞表达系统的细胞中共表达(i)和(ii)的核酸构建体来产生所述单价抗体。
[0324]
类似地,在一个实施例中,抗分拣蛋白抗体是单价抗体,其包含:
[0325]
(i)如在此描述的本发明抗体的可变域或所述结构域的抗原结合部分,以及
[0326]
(ii)免疫球蛋白的ch域或其包含ch2和ch3域的结构域,其中该ch域或其结构域已经被修饰,这样使得对应于铰链域和(如果该免疫球蛋白不是igg4亚型的话)ch域的其他结构域(如ch3域)的结构域不包含任何氨基酸残基,这些任何氨基酸残基能够与相同ch域形成二硫键或在多克隆人igg的存在下与相同ch域形成其他共价或稳定的非共价重链间键。
[0327]
在一个另外的实施例中,单价抗体的重链已经被修饰,这样使得已经缺失整个铰链区。
[0328]
在另一个另外的实施例中,单价抗体的序列已经被修饰,这样使得它不包含用于n-连接的糖基化的任何受体位点。
[0329]
本发明还包括“双特异性抗体”,其中抗分拣蛋白结合区(例如,抗分拣蛋白单克隆抗体的分拣蛋白结合区)是靶向一种以上表位的二价或多价双特异性支架的一部分(例如第二表位可以包含主动转运受体的表位,这样使得该双特异性抗体将展现出跨生物屏障(如血脑屏障)的改进的胞转作用)。因此,在另一个另外的实施例中,抗分拣蛋白抗体的单价fab可以连接到另外的靶向不同蛋白的fab或scfv,以产生双特异性抗体。双特异性抗体可以具有双重功能,例如由抗分拣蛋白结合域赋予的治疗功能和可以结合到受体分子以增强跨生物屏障(如血脑屏障)转移的转运功能。
[0330]
本发明的抗体及其抗原结合片段还包括单链抗体。单链抗体是重链和轻链fv域被连接的肽。在一个实施例中,本发明提供了单链fv(scfv),其中本发明的抗分拣蛋白抗体的fv中的重链和轻链由柔性肽接头(典型地为约10、12、15或更多个氨基酸残基)连接成单条肽链。产生此类抗体的方法描述于例如us 4,946,778;普拉克图恩(pluckthun),在单克隆抗体药理学(the pharmacology of monoclonal antibodies),第113卷,罗森伯格(rosenburg)和摩尔(moore)编辑,施普林格出版公司(springer-verlag),纽约,第269-315页(1994);伯德(bird)等人,科学(science)242,423-426(1988);休斯顿(huston)等人,pnas usa 85,5879-5883(1988)和麦卡弗蒂(mccafferty)等人,自然(nature)348,552-554(1990)。单链抗体可以是单价的,如果仅使用单个vh和vl的话;可以是二价的,如果使用两个vh和vl的话;或可以是多价的,如果使用两个以上vh和vl的话。
[0331]
可以通过包含任何适合数目的经修饰的氨基酸和/或与此类偶联取代基缔合来修饰在此描述的抗体及其抗原结合片段。在此背景下适合性通常由至少基本上保留与非衍生化亲本抗分拣蛋白抗体相关的分拣蛋白选择性和/或分拣蛋白特异性的能力决定。一个或多个经修饰的氨基酸的包含在例如增加多肽血清半衰期、降低多肽抗原性或增加多肽储存稳定性中可以是有利的。对一种或多种氨基酸进行修饰,例如,在重组产生的过程中与翻译同时进行或在翻译之后进行(例如,在哺乳动物细胞中表达过程中在n-x-s/t基序上的n-连接的糖基化作用),或通过合成手段进行修饰。经修饰的氨基酸的非限制性实例包括糖基化的氨基酸、硫酸化的氨基酸、异戊二烯化(例如,法尼基化、香叶基-香叶基化(geranyl-geranylated))的氨基酸、乙酰化的氨基酸、酰化的氨基酸、聚乙二醇化的氨基酸、生物素酰化的氨基酸、羧基化的氨基酸、磷酸化的氨基酸等。足够指导本领域中的普通技术人员进行氨基酸修饰的参考文献在文献中相当充分。示例性方案见于沃克(walker)(1998)只读型光盘蛋白质指南(protein protocols on cd-rom),胡马纳出版社(humana press),托托华(totowa),新泽西州。经修饰的氨基酸可以例如选自糖基化的氨基酸、聚乙二醇化的氨基酸、法尼基化的氨基酸、乙酰化的氨基酸、生物素酰化的氨基酸、偶联到脂质部分的氨基酸或偶联到有机衍化剂的氨基酸。
[0332]
本发明的抗体及其抗原结合片段还可以通过共价偶联到聚合物而化学地修饰,以例如增加其循环半衰期。示例性聚合物以及将它们附接到肽的方法说明于例如us 4,766,106;us 4,179,337;us 4,495,285和us 4,609,546中。另外的说明性聚合物包括聚氧乙基
化的多元醇和聚乙二醇(peg)(例如,分子量在约1,000与约40,000之间,如在约2,000与约20,000之间,例如约3,000-12,000g/mol的peg)。
[0333]
本发明的抗体及其抗原结合片段可以进一步用在诊断方法中或用作诊断成像配体。
[0334]
在一个实施例中,提供了本发明的包含一个或多个放射性标记的氨基酸的抗体及其抗原结合片段。放射性标记的抗分拣蛋白抗体可以用于诊断和治疗两种目的(偶联到放射性标记的分子是另一可能特征)。此类标记的非限制性实例包括但不限于铋(
213
bi)、碳(
11
c、
13
c、
14
c)、铬(
51
cr)、钴(
57
co、
60
co)、铜(
64
cu)、镝(
165
dy)、铒(
169
er)、氟(
18
f)、钆(
153
gd、
159
gd)、镓(
68
ga、
67
ga)、锗(
68
ge)、金(
198
au)、钬(
166
ho)、氢(3h)、铟(
111
in、
112
in、
113
in、
115
in)、碘(
121
i、
123
i、
125
i、
131
i)、铱(
192
ir)、铁(
59
fe)、氪(
81m
kr)、镧(
140
la)、镥(
177
lu)、锰(
54
mn)、钼(
99
mo)、氮(
13
n、
15
n)、氧(
15
o)、钯(
103
pd)、磷(
32
p)、钾(
42
k)、镨(
142
pr)、钷(
149
pm)、铼(
186
re、
188
re)、铑(
105
rh)、铷(
81
rb、
82
rb)、钌(
82
ru、
97
ru)、钐(
153
sm)、钪(
47
sc)、硒(
75
se)、钠(
24
na)、锶(
85
sr、
89
sr、
92
sr)、硫(
35
s)、锝(
99
tc)、铊(
201
tl)、锡(
113
sn、
117
sn)、氙(
133
xe)、镱(
169
yb、
175
yb、
177
yb)、钇(
90
y)以及锌(
65
zn)。用于制备放射性标记的氨基酸和相关肽衍生物的方法在本领域是已知的(参见例如,荣汉斯(junghans)等人,在癌症化疗和生物疗法(cancer chemotherapy and biotherapy)655-686(第2版,查弗尼尔(chafner)和)隆哥(longo)编辑,利平科特瑞文公司(lippincott raven)(1996))以及us 4,681,581、us 4,735,210、us 5,101,827、us 5,102,990(us re35,500)、us 5,648,471和us 5,697,902)。例如,放射性同位素可以氯胺t方法进行偶联(林德格伦,s.(lindegren,s.)等人(1998)“使用n-琥珀酰亚胺基-3-(三甲基锡烷基)苯甲酸酯作为中间体的抗体的高比活放射性碘化中的氯胺-t(chloramine-t in high-specific-activity radioiodination of antibodies using n-succinimidyl-3-(trimethylstannyl)benzoate as an intermediate)”,核医学与生物学(nucl.med.biol.)25(7):659-665;库尔特,m.(kurth,m.)等人(1993)“放射性碘化的苯乙胺衍生物至单克隆抗体的位点特异性偶联在肿瘤中产生增加的放射性(site-specific conjugation of a radioiodinated phenethylamine derivative to a monoclonal antibody results in increased radioactivity localization in tumor)”,药物化学杂志(j.med.chem.)36(9):1255-1261;雷亚,d.w.(rea,d.w.)等人(1990)“用于靶向肿瘤的位点特异性放射性碘化的抗体(site-specifically radioiodinated antibody for targeting tumors)”,癌症研究(cancer res.)50(3增刊):857s-861s)。
[0335]
本发明还提供了使用以下项可检测地标记的抗分拣蛋白抗体及其抗原结合片段:荧光标记(如稀土螯合物(例如,铕螯合物))、荧光素型标记(例如,荧光素、荧光素异硫氰酸酯、5-羧基荧光素、6-羧基荧光素、二氯三嗪基胺荧光素)、罗丹明型标记(例如,568(英杰公司(invitrogen))、或丹磺酰氯)、vivotag 680 xl fluorochrome
tm
(珀金埃尔默公司(perkin elmer))、藻红蛋白;伞形酮、丽丝胺;花菁;藻红蛋白、德克萨斯红、bodipy(英杰公司)或其类似物,所有这些都适用于光学检测。可以采用化学发光标记(例如,鲁米诺、荧光素酶、荧光素和水母蛋白)。这种诊断和检测还可以通过将本发明的诊断分子偶合至可检测物质(包括但不限于各种酶,酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶)或者偶合至辅基复合体(如但不限于链霉亲和素/生物素和亲和素/生物素)来完成。
[0336]
可以采用化学发光标记(例如,鲁米诺、荧光素酶、荧光素和水母蛋白)。这种诊断和检测还可以通过将本发明的诊断分子偶合至可检测物质(包括但不限于各种酶,酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶)或者偶合至辅基复合体(如但不限于链霉亲和素/生物素和亲和素/生物素)来完成。还可以采用顺磁性标记,并且优选地使用正电子发射断层术(pet)或单光子发射计算机断层术(spect)进行检测。这样的顺磁性标记包括但不限于含有铝(al)、钡(ba)、钙(ca)、铈(ce)、镝(dy)、铒(er)、铕(eu)、钆(gd)、钬(ho)、铱(ir)、锂(li)、镁(mg)、锰(mn)、钼(m)、钕(nd)、锇(os)、氧(o)、钯(pd)、铂(pt)、铑(rh)、钌(ru)、钐(sm)、钠(na)、锶(sr)、铽(tb)、铥(tm)、锡(sn)、钛(ti)、钨(w)和锆(zi)并且特别是co
+2
、cr
+2
、cr
+3
、cu
+2
、fe
+2
、fe
+3
、ga
+3
、mn
+3
、ni
+2
、ti
+3
、v
+3
和v
+4
的顺磁离子的化合物,使用各种正电子发射断层术的正电子发射金属以及非放射性顺磁金属离子。
[0337]
因此,在一个实施例中,可以用荧光标记、化学发光标记、顺磁性标记、放射性同位素标记或酶标记来标记本发明的抗分拣蛋白抗体或其分拣蛋白结合片段。可以使用经标记的抗体的片段检测或测量所述分拣蛋白在受试者的脑中的存在或量。这种方法可以包括结合到所述分拣蛋白的抗分拣蛋白抗体或分拣蛋白结合片段的体内成像的检测或测量并且可以包括结合到这样的分拣蛋白的所述抗分拣蛋白抗体或分拣蛋白结合片段的离体成像。
[0338]
在另外的方面,本发明涉及编码本发明的抗体或其抗原结合域的一条或多条多肽链的表达载体。此类表达载体可以用于重组产生本发明的抗体和抗原结合片段。
[0339]
在本发明的背景下,表达载体可以是任何适合的dna或rna载体,包括染色体载体、非染色体载体和合成核酸载体(包含一组适合的表达控制元件的核酸序列)。此类载体的实例包括sv40的衍生物、细菌质粒、噬菌体dna、杆状病毒、酵母质粒、衍生自质粒与噬菌体dna的组合的载体以及病毒核酸(rna或dna)载体。在一个实施例中,编码抗分拣蛋白抗体的核酸被包含在裸dna或rna载体中,包括例如线性表达元件(如描述于例如赛克斯(sykes)和约翰斯顿(johnston),自然生物技术(nat biotech)12,355-59(1997))、紧凑型核酸载体(如描述于例如us 6,077,835和/或wo 00/70087)、质粒载体(如pbr322、puc 19/18或puc 118/119)、“侏儒(midge)”最小尺寸的核酸载体(如描述于例如斯查考斯基(schakowski)等人,分子治疗学(moi ther)3,793-800(2001)),或作为沉淀型核酸载体构建体,如capo4沉淀型构建体(如描述于例如wo 00/46147;本威尼斯提(benvenisty)和雷瑟夫(reshef),pnas usa 83,9551-55(1986);威格尔(wigler)等人,细胞(cell)14,725(1978)以及科拉科(coraro)和皮尔森(pearson),体细胞遗传学(somatic cell genetics)2,603(1981))。此类核酸载体及其使用在本领域是熟知的(参见例如us 5,589,466和us 5,973,972)。
[0340]
在一个实施例中,载体适用于在细菌细胞中表达抗分拣蛋白抗体或其抗原结合片段。此类载体的实例包括以下表达载体,如bluescript(stratagene公司)、pin载体(范黑克(van heeke)&舒斯特(schuster),生物化学杂志(j biol chem)264,5503-5509(1989))、pet载体(novagen公司,麦迪逊,威斯康星州)等。
[0341]
表达载体还可以是或可替代地是适用于在酵母系统中进行表达的载体。可以采用任何适用于在酵母系统中进行表达的载体。适合的载体包括例如包含组成型或诱导型启动子(如α因子、醇氧化酶和pgh)的载体(综述于:f.奥苏贝尔(f.ausubel)等人编辑分子生物学实验指南(current protocols in molecular biology),格林出版和威利国际科学
(greene publishing and wiley interscience)纽约(1987);格朗(grant)等人,酶学方法(methods in enzymol)153,516-544(1987);玛塔诺维奇,d.(mattanovich,d.)等人分子生物学方法(methods mol.biol.)824,329-358(2012);塞利克,e.(celik,e.)等人生物技术进展(biotechnol.adv.)30(5),1108-1118(2012);李,p.(li,p.)等人应用生物化学与生物技术(appl.biochem.biotechnol.)142(2),105-124(2007);波尔,e.(e.)等人应用微生物学与生物技术(appl.microbiol.biotechnol.)77(3),513-523(2007);范德法特,j.m.(van der vaart,j.m.)分子生物学方法178,359-366(2002)和霍利格,p.(holliger,p.)分子生物学方法178,349-357(2002))。
[0342]
在本发明的表达载体中,编码抗分拣蛋白抗体的核酸可以包含任何适合的启动子、增强子和其他有助于表达的元件或者与其缔合。此类元件的实例包括强表达型启动子(例如,人cmv ie启动子/增强子连同rsv、sv40、sl3-3、mmtv和hiv ltr启动子)、有效的聚(a)终止序列、用于在大肠杆菌中产生质粒的复制起点、作为选择性标记的抗生素抗性基因和/或便利的克隆位点(例如,多聚接头)。核酸还可以包含与组成型启动子(如cmv ie)相对的诱导型启动子(本领域的技术人员应认识到此类术语实际上是在某些条件下的基因表达程度的描述语)。
[0343]
在甚至另外的方面,本发明涉及重组真核或原核宿主细胞(如转染瘤),其产生如在此定义的本发明的抗体或其抗原结合片段或如在此定义的本发明的双特异性分子。宿主细胞的实例包括酵母、细菌和哺乳动物细胞(如cho或hek细胞)。例如,在一个实施例中,本发明提供了包含稳定地整合进细胞基因组中的核酸的细胞,该基因组包含编码本发明的抗分拣蛋白抗体或其抗原结合片段的表达的序列。在另一个实施例中,本发明提供了包含非整合型核酸(如质粒、粘粒、噬菌粒或线性表达元件)的细胞,该核酸包含编码本发明的抗分拣蛋白抗体或其抗原结合片段的表达的序列。
[0344]
在另外的方面,本发明涉及用于产生本发明的抗分拣蛋白抗体的方法,所述方法包括以下步骤:a)培养如在上文描述的本发明的杂交瘤或宿主细胞,并且b)从培养基中纯化本发明的抗体。
[0345]
在一个实施例中,本发明涉及一种制剂,如此术语在此使用的,该制剂包含如在此定义的抗分拣蛋白抗体,并且基本上不含天然产生的不能结合到分拣蛋白或不实质性地改变该制剂的抗分拣蛋白功能性的抗体。因此,这样一种制剂不包括天然产生的血清或这样的血清的经纯化的衍生物,该制剂包含抗分拣蛋白抗体和另一种抗体的混合物,所述另一种抗体不改变该制剂的抗分拣蛋白抗体的功能性,其中这样的功能性是:
[0346]
(i)对分拣蛋白的结合亲和力(kd);
[0347]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0348]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0349]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0350]
(v)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力;增加脑中的pgrn量和/或浓度的能力和/或
[0351]
(vi)当长期给予时,提供额颞痴呆(ftd)和/或肌萎缩性侧索硬化症(als)的治疗的能力。
[0352]
本发明具体涉及在其氨基酸序列中(在任何其cdr、可变域、构架残基和/或恒定域
中)相对于天然存在的抗分拣蛋白抗体的结构具有结构改变的这样一种抗分拣蛋白抗体的制剂,其中所述结构改变使得抗分拣蛋白抗体单克隆抗体相对于由所述天然存在的抗分拣蛋白抗体展现出的功能性展现出显著改变的功能性(即,在功能性方面,差异超过20%、差异超过40%、差异超过60%、差异超过80%、差异超过100%、差异超过150%、差异超过2倍、差异超过4倍、差异超过5倍或差异超过10倍);其中这样的功能性是:
[0353]
(i)对分拣蛋白的结合亲和力(kd);
[0354]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0355]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0356]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0357]
(vi)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力;
[0358]
(vii)增加脑中的pgrn量和/或浓度的能力和/或
[0359]
(vi)当长期给予时,提供额颞痴呆(ftd)、肌萎缩性侧索硬化症(als)和/或阿尔茨海默病(ad)的治疗的能力。
[0360]
尤其是其中这样改变的功能性是结构改变的结果并且因此与它不可分。
[0361]
术语“基本不含”天然产生的抗体是指在此类制剂中完全不存在此类天然产生的抗体,或在此类制剂中包含不实质上影响这些制剂的分拣蛋白结合特性的浓度的此类天然产生的抗体。抗体被说成是“分离的”,如果它具有非天然产生的对应物或已经从天然伴随它的组分中分离或纯化出来的话。
[0362]
当它涉及此类制剂时,术语“天然产生的抗体”是指作为活的人或其他动物的免疫系统发挥功能的自然结果在活的人或其他动物体内诱出的抗体(包括天然产生的自身抗体)。
[0363]
因此,本发明的制剂不排除并且的确明确地包括含有抗分拣蛋白抗体和有意添加的另外的抗体的此类制剂,该另外的抗体能够结合到不为分拣蛋白所具有的表位。此类制剂具体包括制剂在治疗额颞痴呆(ftd)和/或肌萎缩性侧索硬化症(als)中展现出增强的功效的其实施例。
[0364]
本发明的抗体的其抗原结合片段可以在不同细胞系中产生,如人细胞系、非人哺乳动物细胞系和昆虫细胞系,例如cho细胞系、hek细胞系、bhk-21细胞系、鼠类细胞系(如骨髓瘤细胞系)、纤维肉瘤细胞系、per.c6细胞系、hkb-11细胞系、cap细胞系和huh-7人细胞系(杜蒙特(dumont)等人,2015,生物技术评论性综述(crit rev biotechnol.)9月18日:1-13.,将其内容通过引用包括在此)。
[0365]
在甚至另外的方面,本发明涉及药物组合物,其包含:
[0366]
(i)抗分拣蛋白抗体或其抗原结合片段,两者均如在此定义的,或包含这样一种抗分拣蛋白抗体或其抗原结合片段的制剂,如此术语在此定义的;以及
[0367]
(ii)药学上可接受的载体。
[0368]
药物组合物可以用药学上可接受的载体或稀释剂连同任何其他已知的佐剂和赋形剂根据常规技术配制,这些常规技术是如以下披露的那些:雷明顿:药学科学与实践(remington:the science and practice of pharmacy),第22版,热纳罗(gennaro)编辑,马克出版公司(mack publishing co.),伊斯顿,宾夕法尼亚州,2013。
[0369]
药学上可接受的载体或稀释剂连同任何其他已知的佐剂和赋形剂应该适合于本
发明的所选化合物和所选给药方式。基于就表位结合而言对本发明的所选化合物或药物组合物的所希望的生物特性的显著不利影响的缺少(例如,小于实质性影响(10%或更少相对抑制、5%或更少相对抑制等))来确定药物组合物的载体和其他组分的适合性。
[0370]
本发明的药物组合物还可以包含稀释剂、填充剂、盐、缓冲剂、洗涤剂(例如,非离子型洗涤剂,如tween-20或tween-80)、稳定剂(例如,糖或无蛋白氨基酸)、防腐剂、组织固定剂、增溶剂和/或适于包含在药物组合物中的其他材料。将稀释剂选择为不影响组合的生物活性。此类稀释剂的实例为蒸馏水、生理磷酸盐缓冲盐水、林格氏溶液、右旋糖溶液和汉克氏溶液。此外,药物组合物或配制品还可以包含其他载体,或无毒的、非治疗性的、非免疫原性的稳定剂等。组合物还可以包含大的、缓慢代谢的大分子,如蛋白质、多糖(像壳聚糖)、聚乳酸、聚乙醇酸和共聚物(例如,乳胶功能化的交联琼脂糖、琼脂糖、纤维素等)、聚合氨基酸、氨基酸共聚物以及脂质聚集体(例如,油滴或脂质体)。
[0371]
本发明药物组合物中活性成分的实际剂量水平可以变化,以获得对于特定患者、组合物和给药方式而言有效实现所希望的治疗应答的活性成分量。所选的剂量水平将取决于多种药代动力学因素,包括所采用的本发明具体组合物或其酰胺的活性,给药路径,给药时间,所采用的具体化合物的排泄速率,治疗持续时间,与所采用的具体组合物组合使用的其他药物、化合物和/或材料,所治疗患者的年龄、性别、体重、病情、一般健康状况和既往病史以及医学领域熟知的类似因素。
[0372]
药物组合物可以通过任何适合的途径和方式给予,包括:用于预防性和/或治疗性治疗的胃肠外、局部、口服或鼻内手段。在一个实施例中,胃肠外地给予本发明的药物组合物。如在此使用的短语“胃肠外给药(parenteral administration)”和“胃肠外地给药(administered parenterally)”意指除肠内和局部给药之外的给药方式,通常是通过注射,并且包括表皮、静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心内、真皮内、腹膜内、腱内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、椎管内、颅内、胸腔内、硬膜外以及胸骨内注射和输注。另外的适合的在体内和在体外给予本发明化合物的途径在本领域是熟知的并且可以由本领域的普通技术人员进行选择。在一个实施例中,通过静脉内或皮下注射或输注给予该药物组合物。
[0373]
药学上可接受的载体包括任何和所有适合的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂、抗氧化剂和吸收延迟剂以及可与本发明的化合物生理上兼容的类似物。
[0374]
可以在本发明药物组合物中采用的适合的水性和非水性载体的实例包括水、盐水、磷酸盐缓冲盐水、乙醇、右旋糖、多元醇(如甘油、丙二醇、聚乙二醇等)及其适合的混合物、植物油(如橄榄油、玉米油、花生油、棉籽油和芝麻油)、羧甲基纤维素胶体溶液、黄蓍胶和可注射有机酯(如油酸乙酯)和/或各种缓冲剂。其他载体在制药领域是熟知的。
[0375]
药学上可接受的载体包括无菌水溶液或分散体和用于临时制备无菌注射液或分散体的无菌粉剂。使用此类介质和试剂用于药物活性物质在本领域是已知的。除了在任何常规介质或试剂与活性化合物不兼容的情况下,考虑了其在本发明药物组合物中的使用。
[0376]
可以例如通过使用包衣材料(如卵磷脂),通过维持所需的粒度(在分散体的情况下)和通过使用表面活性剂来维持适当的流动性。
[0377]
本发明的药物组合物还可以包含药学上可接受的抗氧化剂,例如(1)水溶性抗氧化剂,如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等;(2)油溶性抗氧化
剂,如抗坏血酸棕榈酸酯、丁基羟基茴香醚(bha)、丁基羟基甲苯(bht)、卵磷脂、没食子酸丙酯、α-生育酚等;以及(3)金属螯合剂,如柠檬酸、乙二胺四乙酸(edta)、山梨醇、酒石酸、磷酸等。
[0378]
本发明的药物组合物还可以在组合物中包含等渗剂,如糖、多元醇(如甘露醇、山梨醇、甘油)或氯化钠。
[0379]
本发明的药物组合物还可以含有一种或多种适用于所选给药途径的佐剂,如防腐剂、润湿剂、乳化剂、分散剂、防腐剂或缓冲剂,这些试剂可以增强药物组合物的保质期或有效性。本发明的化合物可以与载体一起制备,这些载体可以保护化合物免于被快速释放,如控释配制品,包括植入物、透皮贴剂和微囊化递送系统。此类载体可以包括明胶、单硬脂酸甘油酯、二硬脂酸甘油酯、可生物降解的生物兼容聚合物(如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸)(单独的或与蜡一起)或本领域熟知的其他材料。用于制备此类配制品的方法通常是本领域普通技术人员已知的。参见例如,缓释和控释递药系统(sustained and controlled release drug delivery systems),j.r.罗宾逊(j.r.robinson)编辑,马歇尔德克公司(marcel dekker,inc.),纽约,1978。
[0380]
在一个实施例中,可以将本发明的化合物配制成确保在体内恰当分布。用于胃肠外给药的药学上可接受的载体包括无菌水溶液或分散体和用于临时制备无菌注射液或分散体的无菌粉剂。使用此类介质和试剂用于药物活性物质在本领域是已知的。除了在任何常规介质或试剂与活性化合物不兼容的情况下,考虑了其在本发明药物组合物中的使用。还可以将补充活性化合物掺入组合物中。
[0381]
注射用药物组合物通常在生产和保存条件下典型地必须是无菌且稳定的。可以将组合物配制为溶液、微乳液、脂质体或适于高药物浓度的其他有序结构。载体可以是含有例如水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)及其适合的混合物、植物油(如橄榄油)和可注射有机酯(如油酸乙酯)的水性或非水性溶剂或分散介质。可以例如通过使用包衣材料(如卵磷脂),通过维持所需的粒度(在分散体的情况下)和通过使用表面活性剂来维持适当的流动性。在许多情况下,优选的是在组合物中包括等渗剂,例如糖、多元醇(如甘油、甘露醇、山梨醇)或氯化钠。可注射组合物的延长吸收可以通过在组合物中包括延迟抗体吸收的试剂(例如单硬脂酸盐和明胶)来实现。无菌可注射溶液可以通过按需要将所需量的活性化合物与一种例如像上文列举的成分或成分的组合掺在适当溶剂中,随后无菌微孔过滤来制备。通常,通过将活性化合物掺入无菌载体中来制备分散体,该无菌载体含有基础分散介质和例如来自上文列举的那些的其他所需成分。在用于制备无菌可注射溶液的无菌粉剂的情况下,制备方法的实例是真空干燥和冷冻干燥(冻干),这从其之前的无菌过滤溶液得到活性成分和任何另外的所希望成分的粉剂。
[0382]
无菌可注射溶液可以通过按需要将所需量的活性化合物与一种上文列举的成分或成分的组合掺在适当溶剂中,随后无菌微孔过滤来制备。通常,通过将活性化合物掺入无菌载体中来制备分散体,该无菌载体含有基础分散介质和来自上文列举的那些的其他所需成分。在用于制备无菌可注射溶液的无菌粉剂的情况下,制备方法的实例是真空干燥和冷冻干燥(冻干),这从其之前的无菌过滤溶液得到活性成分和任何另外的所希望成分的粉剂。
[0383]
调整在以上治疗方法和在此描述的使用中的剂量方案,以提供最佳期望应答(例
如,治疗应答)。例如,可以给予单次推注,可以随时间给予若干分次剂量或者可以由治疗情况的紧迫性所指示的按比例减少或增加剂量。为了便于给药和剂量统一,胃肠外组合物可以被配制为剂量单位形式。如在此使用的剂量单位形式是指作为针对待治疗受试者的单一剂量适合的物理上离散的单位;每个单位含有经计算产生与所需药物载体相关的所希望的治疗效果的活性化合物的预定量。针对本发明的剂量单位形式的描述受指示于并且直接取决于(a)活性化合物的独特特征和待达到的具体治疗效果,以及(b)在复合这样的活性化合物以在个体中获得灵敏治疗的领域中固有的限制。
[0384]
抗分拣蛋白抗体的有效剂量和剂量方案取决于待治疗的疾病或病症并且可以由本领域的普通技术人员确定。本发明抗体的治疗有效量的示例性、非限制性范围是约0.1-10mg/kg体重,如约0.1-5mg/kg体重,例如约0.1-2mg/kg体重,如约0.1-1mg/kg体重,例如约0.15、约0.2、约0.5、约1、约1.5或约2mg/kg体重。
[0385]
具有本领域普通技术的医师或兽医可以容易地确定并且开出所需药物组合物的有效量。例如,医师或兽医可以按低于为了达到所希望的治疗效果所需的水平开始给予药物组合物中采用的抗分拣蛋白抗体,并且逐步增加剂量直至达到所希望的效果。通常,本发明组合物的适合日剂量将是有效产生治疗效果的最低剂量的化合物量。这样一个有效剂量通常将取决于上述因素。给药可以例如是静脉内的、肌内的、腹膜内的或皮下的,或者例如临近靶标位点给予。如果希望的话,药物组合物的有效日剂量可以在一整天以适当的时间间隔分开为两个、三个、四个、五个、六个或更多个子剂量来给予,任选地以单位剂型给予。虽然本发明的化合物可以单独给予,但是优选的是作为如上描述的药物组合物给予该化合物。
[0386]
本发明的标记抗体或其抗原结合片段可以用于诊断目的,以检测、诊断或监测疾病或障碍。本发明提供了神经退行性或认知疾病或障碍的检测或诊断,所述神经退行性或认知疾病或障碍包括但不限于ftd、als或tdp43蛋白质病(如阿尔茨海默病(ad)),该检测或诊断包括:(a)使用一种或多种特异性结合到分拣蛋白上的抗体测定受试者的细胞或组织样品中的焦谷氨酸化aβ片段的存在;并且(b)将抗原的水平与对照水平(例如,正常组织样品中的水平)进行比较,由此相比于抗原的对照水平该抗原的测定水平的增加指示疾病或障碍,或指示疾病或障碍的严重性。
[0387]
使用本领域熟知的免疫组织化学方法,本发明的抗体或其抗原结合片段可以用于测定生物样品中的分拣蛋白或分拣蛋白抗原结合片段。有用于检测蛋白质的其他基于抗体的方法包括免疫测定(如酶联免疫测定(elisa)和放射免疫测定(ria))以及基于中型发现平台(mesoscale discovery platform)的测定(msd)。适合的抗体标记可以用在此类试剂盒和方法中,并且本领域已知的标记包括酶标记,如碱性磷酸酶和葡萄糖氧化酶;放射性同位素标记,如碘(
125
i、
131
i)、碳(
14
c)、硫(
35
s)、氚(3h)、铟(
121
in)和锝(
99m
tc);和发光标记,如鲁米诺和荧光素酶;以及荧光标志,如荧光素和罗丹明。
[0388]
可以在体内检测标记的抗分拣蛋白抗体或其分拣蛋白结合片段的存在,用于诊断目的。在一个实施例中,诊断包括:a)向受试者给予有效量的这样的标记分子;b)在给药后等待一定时间间隔,以允许标记的分子在aβ沉积位点(如果有的话)聚集并且以允许未结合的标记分子被清除至背景水平;c)测定背景水平;并且d)检测受试者中的标记分子,这样使得在背景水平之上的标记分子的检测指示该受试者患有该疾病或障碍,或指示该疾病或障
碍的严重性。根据这样的实施例,用成像部分标记分子,该成像部分适于使用本领域的普通技术人员已知的具体成像系统进行检测。背景水平可以通过本领域已知的多种方法测定,包括将检测到的标记抗体的量与先前针对具体成像系统测定的标准值进行比较。可以用于本发明诊断方法的方法和系统包括但不限于计算机断层术(ct)、全身扫描如正电子发射断层术(pet)、磁共振成像(mri)以及超声检查。
[0389]
在另外的方面,本发明涉及用于在医学中使用的抗体或其抗原结合片段。
[0390]
在另外的方面,本发明涉及用于在治疗与患者的脑中降低的pgrn水平相关的疾病中使用的本发明的抗体或其抗原结合片段。
[0391]
在另外的方面,本发明涉及本发明的抗体或其抗原结合片段在生产用于治疗与患者的脑中降低的pgrn水平相关的疾病的药物中的用途。
[0392]
在另外的方面,本发明涉及预防或治疗与患者的脑中降低的pgrn水平相关的疾病的方法,该方法包括给予有效剂量的本发明的抗体或其抗原结合片段。
[0393]
优选的是在本发明的那些方面的用途和方法中,该疾病是:ftd;als;或tdp43蛋白质病,如ad。
[0394]
优选地,在本发明的那些方面的用途和方法中,治疗是长期的,并且优选持续至少2周,如至少持续1个月、6个月、1年或更久。
[0395]
在另外的方面,本发明提供了包含本发明的抗体或其抗原结合片段的试剂盒。
[0396]
表5-抗体序列
[0397]
[0398]
[0399]
[0400]
[0401]
[0402][0403]
在明显在先公开的文献的说明书中的清单或讨论并不一定要视为承认该文献是现有技术的一部分或是公知常识。
[0404]
实施方式
[0405]
如应从文本和实例显而易见的,本发明进一步涉及以下实施例:
[0406]
1.一种抗体或其抗原结合片段,能够特异性地结合到分拣蛋白并且抑制pgrn与分拣蛋白的结合。
[0407]
2.根据实施例1所述的抗体或其抗原结合片段,其中该抗体包含完整抗体或由其
组成。
[0408]
3.根据实施例1或2所述的抗体或其抗原结合片段,其中该抗原结合片段包含选自下组的抗原结合片段或由其组成,该组由以下各项组成:fv片段(例如单链fv或二硫化物键合的fv);fab样片段(例如fab片段或f(ab’)2片段);以及结构域抗体(例如单个vh可变域或v
l
可变域)。
[0409]
4.根据任何前述实施例所述的抗体或其抗原结合片段,其中该抗体选自下组,该组由以下各项组成:亚型igg1、igg2、igg3或igg4的抗体。
[0410]
5.根据任何前述实施例所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段特异性地结合到如在seq id no:170中定义的分拣蛋白的d区。
[0411]
6.根据任何前述实施例所述的抗体或其抗原结合片段,其中所述抗体或其片段特异性地结合到如在seq id no:170中定义的分拣蛋白的d区的至少3个连续氨基酸,如4、5、6或7个连续氨基酸。
[0412]
7.根据任何前述实施例所述的抗体或其抗原结合片段,其中该抗体或抗原结合片段展现出以下特性中的一种或多种:
[0413]
(i)在0.5-10nm(如1-5nm或1-2nm)之间的对分拣蛋白的结合亲和力(kd)
[0414]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0415]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0416]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0417]
(v)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力。
[0418]
8.根据实施例7所述的抗体或其抗原结合片段,其中该抗体或其片段减少pgrn与分拣蛋白的结合的能力包括将pgrn与分拣蛋白的结合减少10%或更多;例如,20%或更多;或30%或更多。
[0419]
9.根据实施例7或8所述的抗体或其抗原结合片段,其中所述抗体或其片段该抗体或其片段减少和/或抑制pgrn与分拣蛋白的结合的能力包括以或低于22nm,如在22nm与1nm之间、或在10nm与1nm之间、或在5nm与1nm之间的ic50减少和/或抑制pgrn与分拣蛋白的结合。
[0420]
10.根据任何以上实施例所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段是人的或是人源化的。
[0421]
11.根据任何前述实施例所述的抗体或其抗原结合片段,包含轻链可变域,该轻链可变域包含如针对表5中所定义的抗体中的每者列出的cdr 1-3轻链中的一条或多条,或具有不超过4个氨基酸差异、或不超过3个氨基酸差异、或不超过2个氨基酸差异、或不超过1个氨基酸差异的氨基酸序列。
[0422]
12.根据实施例11所述的抗体或其抗原结合片段,包含轻链可变域,该轻链可变域包含如针对表5中所定义的抗体中的每者列出的cdr 1-3轻链。
[0423]
13.根据实施例11或12所述的抗体或其抗原结合片段,包含轻链可变域,该轻链可变域包含如针对表5中所定义的抗体中的每者列出的氨基酸序列vl或由其组成。
[0424]
14.根据实施例11至13中任一项所述的抗体或其抗原结合片段,包含轻链,该轻链包含如针对表5中所定义的抗体中的每者列出的vl的氨基酸序列或由其组成。
[0425]
15.根据任何前述实施例所述的抗体或其抗原结合片段,包含重链可变域,该重链
可变域包含如针对表5中所定义的抗体中的每者列出的一条或多条cdr 1-3重链,或具有不超过4个氨基酸差异、或不超过3个氨基酸差异、或不超过2个氨基酸差异、或不超过1个氨基酸差异的氨基酸序列。
[0426]
16.根据实施例15所述的抗体或其抗原结合片段,包含重链可变域,该重链可变域包含如针对表5中所定义的抗体中的每者列出的cdr 1-3重链。
[0427]
17.根据实施例15或16所述的抗体或其抗原结合片段,包含重链可变域,该重链可变域包含如针对表5中所定义的抗体中的每者列出的vh的氨基酸序列或由其组成。
[0428]
18.根据实施例15至17中任一项所述的抗体或其抗原结合片段,包含重链,该重链包含如针对表5中所定义的抗体中的每者列出的氨基酸序列vl或由其组成。
[0429]
19.根据任何前述实施例所述的抗体或其抗原结合片段,包含轻链可变域以及重链可变域,该轻链可变域包含如针对表5中所定义的抗体中的每者列出的vl的氨基酸序列或由其组成,该重链可变域包含如针对表5中所定义的抗体中的每者列出的vh的氨基酸序列或由其组成。
[0430]
20.根据任何前述实施例所述的抗体或其抗原结合片段,包含轻链以及重链,该轻链包含如针对表5中所定义的抗体中的每者列出的vl的氨基酸序列或由其组成,该重链包含如针对表5中所定义的抗体中的每者列出的vh的氨基酸序列或由其组成。
[0431]
21.根据任何前述实施例所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段与在实施例20中所定义的抗体或其抗原结合片段竞争与分拣蛋白的结合。
[0432]
22.根据任何前述实施例所述的抗体或其抗原结合片段,其中该抗体或抗原结合片段包含fc区。
[0433]
23.根据任何前述实施例所述的抗体或其抗原结合片段,其中该抗体或抗原结合片段进一步包含用于增加体内半衰期的部分。
[0434]
24.根据实施例22所述的抗体或其抗原结合片段,其中用于增加体内半衰期的该部分选自下组,该组由以下各项组成:聚乙二醇(peg)、人血清白蛋白、糖基化基团、脂肪酸以及葡聚糖。
[0435]
25.根据任何前述实施例所述的抗体或其抗原结合片段,其中该抗体或抗原结合片段进一步包含可检测部分。
[0436]
26.根据实施例25所述的抗体或其抗原结合片段,其中该可检测部分选自下组,该组由以下各项组成:荧光标记;化学发光标记;顺磁性标记;放射性同位素标记;或酶标记。
[0437]
27.根据实施例25或26所述的抗体或其抗原结合片段,其中该可检测部分包含放射性同位素或由其组成。
[0438]
28.根据实施例26或27所述的抗体或其抗原结合片段,其中该放射性同位素选自下组,该组由以下各项组成:
99m
tc、
111
in、
67
ga、
68
ga、
72
as、
89
zr、
123
i以及
201
tl。
[0439]
29.根据实施例25所述的抗体或其抗原结合片段,其中该可检测部分包含顺磁性同位素或由其组成。
[0440]
30.根据实施例29所述的抗体或其抗原结合片段,其中该顺磁性同位素选自下组,该组由以下各项组成:
157
gd、
55
mn、
162
dy、
52
cr以及
56
fe。
[0441]
31.根据实施例25至30中任一项所述的抗体或其抗原结合片段,其中该可检测部分可通过成像技术如spect、pet、mri、光学或超声成像检测到。
40中任一项所述的制剂,用于在医学中使用。
[0465]
43.如在实施例1-33的任一项中所定义的抗体或其抗原结合片段,或如实施例39-40中任一项所述的制剂,用于在预防和/或治疗与患者的脑中降低的pgrn水平相关的疾病中使用。
[0466]
44.如在实施例1-33的任一项中所定义的抗体或其抗原结合片段,或如实施例39-40中任一项所述的制剂在生产用于预防和/或治疗与患者的脑中降低的pgrn水平相关的疾病的药物中的用途。
[0467]
45.根据实施例43所述供使用的抗体或其抗原结合片段,或根据实施例44所述的用途,其中该疾病选自下组,该组由以下各项组成:ftd;als;tdp43蛋白质病,如ad。
[0468]
46.一种预防或治疗与患者的脑中降低的pgrn水平相关的疾病的方法,该方法包括给予有效剂量的如在实施例1-33的任一项中所定义的抗体或其片段、如实施例39-40中任一项所述的制剂、或如实施例41所述的药物组合物。
[0469]
47.根据实施例43所述供使用的抗体或其抗原结合片段,或根据实施例44所述的用途,或根据实施例46所述的方法,其中该疾病选自下组,该组由以下各项组成:ftd;als;或tdp43蛋白质病,如ad。
[0470]
48.根据实施例46或47所述的供使用的抗体或其抗原结合片段;或用途;或方法,其中该治疗是长期的。
[0471]
49.根据实施例48所述的供使用的抗体或其抗原结合片段;或用途;或方法,其中该长期治疗持续至少2周,如至少持续1个月、6个月、1年或更久。
[0472]
50.如在实施例1-33的任一项中所定义的抗体或其抗原结合片段,如实施例39-40中任一项所述的制剂,或如实施例41所述的药物组合物,其能够特异性地结合到分拣蛋白并且抑制pgrn与分拣蛋白的结合,但是不抑制或基本上不抑制神经降压素或af38469与分拣蛋白的结合。
[0473]
51.一种试剂盒,包含如在实施例1-33的任一项中所定义的抗体或其抗原结合片段、如在实施例39-40的任一项中所定义的制剂、或如在实施例41中所定义的药物组合物。
[0474]
如应从文本和实例显而易见的,本发明进一步涉及以下段落:
[0475]
段落1.一种抗体或其抗原结合片段,能够特异性地结合到分拣蛋白并且抑制或减少pgrn与分拣蛋白的结合。
[0476]
段落2.根据段落1所述的抗体或其抗原结合片段,其中该抗原结合片段选自下组,该组由以下各项组成:fv片段(例如单链fv或二硫化物键合的fv);fab样片段(例如fab片段、fab’片段或f(ab)2片段);以及结构域抗体(例如单个vh可变域或vl可变域)。
[0477]
段落3.根据任何前述段落所述的抗体,其中该抗体由完整抗体组成。
[0478]
段落4.根据任何前述段落所述的抗体或其抗原结合片段,其中该抗体选自下组,该组由以下各项组成:亚型igg1、igg2、igg3或igg4的抗体。
[0479]
段落5.根据任何前述段落所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段结合到如由seq id no:170定义的分拣蛋白的d区。
[0480]
段落6.根据任何前述段落所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段结合到如由seq id no:185、186或187的任一项定义的分拣蛋白的d区。
[0481]
段落7.根据段落5或6所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合
片段另外结合到如由seq id no:180定义的分拣蛋白的a区。
[0482]
段落8.根据段落5或6所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段另外结合到如由seq id no 181、182、183或184的任一项定义的分拣蛋白的a区。
[0483]
段落9.根据任何前述段落所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段结合到如在seq id no:170中定义的分拣蛋白的d区内的至少3个连续氨基酸,如4、5、6或7个连续氨基酸。
[0484]
段落10.根据任何前述段落所述的抗体或其抗原结合片段,其中该抗体或抗原结合片段展现出以下特性中的一种或多种:
[0485]
a.在0.5-10nm,如1-5nm或1-2nm之间的对分拣蛋白的结合亲和力(kd);
[0486]
b.减少和/或抑制pgrn与分拣蛋白结合的能力;
[0487]
c.减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0488]
d.减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0489]
e.增加脑中的pgrn量和/或浓度的能力,和/或
[0490]
f.增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力。
[0491]
段落11.根据任何前述段落1-9所述的抗体或其抗原结合片段,其中使用时间分辨荧光测定(htfr),该抗体或其抗原结合片段减少和/或抑制pgrn与分拣蛋白的结合的能力的ic50小于50nm,但是优选在10nm与0.2nm之间。
[0492]
段落12.根据任何前述段落1-9所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段减少和/或抑制pgrn与分拣蛋白的结合的能力包括以或低于22nm,如在22nm与1nm之间、或在10nm与1nm之间、或在5nm与1nm之间的ic50减少和/或抑制pgrn与分拣蛋白的结合。
[0493]
段落13.根据任何前述段落所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段是人抗体、人源化抗体、重组抗体或嵌合抗体。
[0494]
段落14.根据任何前述段落所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0495]
a.包含seq id no:1的轻链可变域l-cdr1;
[0496]
b.包含seq id no:2的轻链可变域l-cdr 2;
[0497]
c.包含seq id no:3的轻链可变域l-cdr 3;
[0498]
d.包含seq id no:4的重链可变域h-cdr 1;
[0499]
e.包含seq id no:5的重链可变域h-cdr 2;以及
[0500]
f.包含seq id no:6的重链可变域h-cdr 3。
[0501]
段落15.根据段落14所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:8。
[0502]
段落16.根据段落14所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:7。
[0503]
段落17.根据段落14所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含如在段落15和16中所定义的重链可变域和轻链可变域两者。
[0504]
段落18.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0505]
a.包含seq id no:9的轻链可变域l-cdr 1;
[0506]
b.包含seq id no:10的轻链可变域l-cdr 2;
[0507]
c.包含seq id no:11的轻链可变域l-cdr 3;
[0508]
d.包含seq id no:12的重链可变域h-cdr 1;
[0509]
e.包含seq id no:13的重链可变域h-cdr 2;以及
[0510]
f.包含seq id no:14的重链可变域h-cdr 3。
[0511]
段落19.根据段落18所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:16。
[0512]
段落20.根据段落18所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:15。
[0513]
段落21.根据段落18所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含如在段落19和20中所定义的重链可变域和轻链可变域两者。
[0514]
段落22.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0515]
a.包含seq id no:17的轻链可变域l-cdr 1;
[0516]
b.包含seq id no:18的轻链可变域l-cdr 2;
[0517]
c.包含seq id no:19的轻链可变域l-cdr 3;
[0518]
d.包含seq id no:20的重链可变域h-cdr 1;
[0519]
e.包含seq id no:21的重链可变域h-cdr 2;以及
[0520]
f.包含seq id no:22的重链可变域h-cdr 3。
[0521]
段落23.根据段落22所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:24。
[0522]
段落24.根据段落22所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:23。
[0523]
段落25.根据段落22所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落23和24中所定义的重链可变域和轻链可变域两者。
[0524]
段落26.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0525]
a.包含seq id no:25的轻链可变域l-cdr 1;
[0526]
b.包含seq id no:26的轻链可变域l-cdr 2;
[0527]
c.包含seq id no:27的轻链可变域l-cdr 3;
[0528]
d.包含seq id no:28的重链可变域h-cdr 1;
[0529]
e.包含seq id no:29的重链可变域h-cdr 2;以及
[0530]
f.包含seq id no:30的重链可变域h-cdr 3。
[0531]
段落27.根据段落26所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:32。
[0532]
段落28.根据段落26所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:31。
[0533]
段落29.根据段落26所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片
段包含如在段落27和28中所定义的重链可变域和轻链可变域两者。
[0534]
段落30.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0535]
a.包含seq id no:33的轻链可变域l-cdr 1;
[0536]
b.包含seq id no:34的轻链可变域l-cdr 2;
[0537]
c.包含seq id no:35的轻链可变域l-cdr 3;
[0538]
d.包含seq id no:36的重链可变域h-cdr 1;
[0539]
e.包含seq id no:37的重链可变域h-cdr 2;以及
[0540]
f.包含seq id no:38的重链可变域h-cdr 3。
[0541]
段落31.根据段落30所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:40。
[0542]
段落32.根据段落30所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:39。
[0543]
段落33.根据段落30所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落31和32中所定义的重链可变域和轻链可变域两者。
[0544]
段落34.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0545]
a.包含seq id no:41的轻链可变域l-cdr 1;
[0546]
b.包含seq id no:42的轻链可变域l-cdr 2;
[0547]
c.包含seq id no:43的轻链可变域l-cdr 3;
[0548]
d.包含seq id no:44的重链可变域h-cdr 1;
[0549]
e.包含seq id no:45的重链可变域h-cdr 2;以及
[0550]
f.包含seq id no:46的重链可变域h-cdr 3。
[0551]
段落35.根据段落34所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:48。
[0552]
段落36.根据段落34所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:47。
[0553]
段落37.根据段落34所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落35和36中所定义的重链可变域和轻链可变域两者。
[0554]
段落38.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0555]
a.包含seq id no:49的轻链可变域l-cdr 1;
[0556]
b.包含seq id no:50的轻链可变域l-cdr 2;
[0557]
c.包含seq id no:51的轻链可变域l-cdr 3;
[0558]
d.包含seq id no:52的重链可变域h-cdr 1;
[0559]
e.包含seq id no:53的重链可变域h-cdr 2;以及
[0560]
f.包含seq id no:54的重链可变域h-cdr 3。
[0561]
段落39.根据段落38所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:56。
[0562]
段落40.根据段落38所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:55。
[0563]
段落41.根据段落38所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落39和40中所定义的重链可变域和轻链可变域两者。
[0564]
段落42.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0565]
a.包含seq id no:57的轻链可变域l-cdr 1;
[0566]
b.包含seq id no:58的轻链可变域l-cdr 2;
[0567]
c.包含seq id no:59的轻链可变域l-cdr 3;
[0568]
d.包含seq id no:60的重链可变域h-cdr 1;
[0569]
e.包含seq id no:61的重链可变域h-cdr 2;以及
[0570]
f.包含seq id no:62的重链可变域h-cdr 3。
[0571]
段落43.根据段落42所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:64。
[0572]
段落44.根据段落42所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:63。
[0573]
段落45.根据段落42所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落43和44中所定义的重链可变域和轻链可变域两者。
[0574]
段落46.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0575]
a.包含seq id no:65的轻链可变域l-cdr 1;
[0576]
b.包含seq id no:66的轻链可变域l-cdr 2;
[0577]
c.包含seq id no:67的轻链可变域l-cdr 3;
[0578]
d.包含seq id no:68的重链可变域h-cdr 1;
[0579]
e.包含seq id no:69的重链可变域h-cdr 2;以及
[0580]
f.包含seq id no:70的重链可变域h-cdr 3。
[0581]
段落47.根据段落46所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:72。
[0582]
段落48.根据段落46所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:71。
[0583]
段落49.根据段落46所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落47和48中所定义的重链可变域和轻链可变域两者。
[0584]
段落50.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0585]
a.包含seq id no:73的轻链可变域l-cdr 1;
[0586]
b.包含seq id no:74的轻链可变域l-cdr 2;
[0587]
c.包含seq id no:75的轻链可变域l-cdr 3;
[0588]
d.包含seq id no:76的重链可变域h-cdr 1;
[0589]
e.包含seq id no:77的重链可变域h-cdr 2;以及
[0590]
f.包含seq id no:78的重链可变域h-cdr 3。
[0591]
段落51.根据段落50所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:80。
[0592]
段落52.根据段落50所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:79。
[0593]
段落53.根据段落50所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落51和52中所定义的重链可变域和轻链可变域两者。
[0594]
段落54.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0595]
a.包含seq id no:81的轻链可变域l-cdr 1;
[0596]
b.包含seq id no:82的轻链可变域l-cdr 2;
[0597]
c.包含seq id no:83的轻链可变域l-cdr 3;
[0598]
d.包含seq id no:84的重链可变域h-cdr 1;
[0599]
e.包含seq id no:85的重链可变域h-cdr 2;以及
[0600]
f.包含seq id no:86的重链可变域h-cdr 3。
[0601]
段落55.根据段落54所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:88。
[0602]
段落56.根据段落54所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:87。
[0603]
段落57.根据段落54所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落55和56中所定义的重链可变域和轻链可变域两者。
[0604]
段落58.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0605]
a.包含seq id no:89的轻链可变域l-cdr 1;
[0606]
b.包含seq id no:90的轻链可变域l-cdr 2;
[0607]
c.包含seq id no:91的轻链可变域l-cdr 3;
[0608]
d.包含seq id no:92的重链可变域h-cdr 1;
[0609]
e.包含seq id no:93的重链可变域h-cdr 2;以及
[0610]
f.包含seq id no:94的重链可变域h-cdr 3。
[0611]
段落59.根据段落58所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:96。
[0612]
段落60.根据段落58所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:95。
[0613]
段落61.根据段落58所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落59和60中所定义的重链可变域和轻链可变域两者。
[0614]
段落62.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0615]
a.包含seq id no:97的轻链可变域l-cdr 1;
[0616]
b.包含seq id no:98的轻链可变域l-cdr 2;
[0617]
c.包含seq id no:99的轻链可变域l-cdr 3;
[0618]
d.包含seq id no:100的重链可变域h-cdr 1;
[0619]
e.包含seq id no:101的重链可变域h-cdr 2;以及
[0620]
f.包含seq id no:102的重链可变域h-cdr 3。
[0621]
段落63.根据段落62所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:104。
[0622]
段落64.根据段落62所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:103。
[0623]
段落65.根据段落62所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落63和64中所定义的重链可变域和轻链可变域两者。
[0624]
段落66.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0625]
a.包含seq id no:105的轻链可变域l-cdr 1;
[0626]
b.包含seq id no:106的轻链可变域l-cdr 2;
[0627]
c.包含seq id no:107的轻链可变域l-cdr 3;
[0628]
d.包含seq id no:108的重链可变域h-cdr 1;
[0629]
e.包含seq id no:109的重链可变域h-cdr 2;以及
[0630]
f.包含seq id no:110的重链可变域h-cdr 3。
[0631]
段落67.根据段落66所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:112。
[0632]
段落68.根据段落66所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:111。
[0633]
段落69.根据段落66所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落67和68中所定义的重链可变域和轻链可变域两者。
[0634]
段落70.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0635]
a.包含seq id no:113的轻链可变域l-cdr 1;
[0636]
b.包含seq id no:114的轻链可变域l-cdr 2;
[0637]
c.包含seq id no:115的轻链可变域l-cdr 3;
[0638]
d.包含seq id no:116的重链可变域h-cdr 1;
[0639]
e.包含seq id no:117的重链可变域h-cdr 2;以及
[0640]
f.包含seq id no:118的重链可变域h-cdr 3。
[0641]
段落71.根据段落70所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:120。
[0642]
段落72.根据段落70所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:119。
[0643]
段落73.根据段落70所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落71和72中所定义的重链可变域和轻链可变域两者。
[0644]
段落74.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其
抗原结合片段包含:
[0645]
a.包含seq id no:121的轻链可变域l-cdr 1;
[0646]
b.包含seq id no:122的轻链可变域l-cdr 2;
[0647]
c.包含seq id no:123的轻链可变域l-cdr 3;
[0648]
d.包含seq id no:124的重链可变域h-cdr 1;
[0649]
e.包含seq id no:125的重链可变域h-cdr 2;以及
[0650]
f.包含seq id no:126的重链可变域h-cdr 3。
[0651]
段落75.根据段落74所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:128。
[0652]
段落76.根据段落74所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:127。
[0653]
段落77.根据段落74所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落75和76中所定义的重链可变域和轻链可变域两者。
[0654]
段落78.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0655]
a.包含seq id no:129的轻链可变域l-cdr 1;
[0656]
b.包含seq id no:130的轻链可变域l-cdr 2;
[0657]
c.包含seq id no:131的轻链可变域l-cdr 3;
[0658]
d.包含seq id no:132的重链可变域h-cdr 1;
[0659]
e.包含seq id no:133的重链可变域h-cdr 2;以及
[0660]
f.包含seq id no:134的重链可变域h-cdr 3。
[0661]
段落79.根据段落78所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:136。
[0662]
段落80.根据段落78所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:135。
[0663]
段落81.根据段落78所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落79和80中所定义的重链可变域和轻链可变域两者。
[0664]
段落82.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0665]
a.包含seq id no:137的轻链可变域l-cdr 1;
[0666]
b.包含seq id no:138的轻链可变域l-cdr 2;
[0667]
c.包含seq id no:139的轻链可变域l-cdr 3;
[0668]
d.包含seq id no:140的重链可变域h-cdr 1;
[0669]
e.包含seq id no:141的重链可变域h-cdr 2;以及
[0670]
f.包含seq id no:142的重链可变域h-cdr 3。
[0671]
段落83.根据段落82所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:144。
[0672]
段落84.根据段落82所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:143。
[0673]
段落85.根据段落82所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落83和84中所定义的重链可变域和轻链可变域两者。
[0674]
段落86.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0675]
a.包含seq id no:145的轻链可变域l-cdr 1;
[0676]
b.包含seq id no:146的轻链可变域l-cdr 2;
[0677]
c.包含seq id no:147的轻链可变域l-cdr 3;
[0678]
d.包含seq id no:148的重链可变域h-cdr 1;
[0679]
e.包含seq id no:149的重链可变域h-cdr 2;以及
[0680]
f.包含seq id no:150的重链可变域h-cdr 3。
[0681]
段落87.根据段落86所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:152。
[0682]
段落88.根据段落86所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:151。
[0683]
段落89.根据段落86所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落87和88中所定义的重链可变域和轻链可变域两者。
[0684]
段落90.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0685]
a.包含seq id no:153的轻链可变域l-cdr 1;
[0686]
b.包含seq id no:154的轻链可变域l-cdr 2;
[0687]
c.包含seq id no:155的轻链可变域l-cdr 3;
[0688]
d.包含seq id no:156的重链可变域h-cdr 1;
[0689]
e.包含seq id no:157的重链可变域h-cdr 2;以及
[0690]
f.包含seq id no:158的重链可变域h-cdr 3。
[0691]
段落91.根据段落90所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含重链可变域,该重链可变域包含seq id no:160。
[0692]
段落92.根据段落90所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:159。
[0693]
段落93.根据段落90所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落91和92中所定义的重链可变域和轻链可变域两者。
[0694]
段落94.根据段落1至13中任一项所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:
[0695]
a.包含seq id no:161的轻链可变域l-cdr 1;
[0696]
b.包含seq id no:162的轻链可变域l-cdr 2;
[0697]
c.包含seq id no:163的轻链可变域l-cdr 3;
[0698]
d.包含seq id no:164的重链可变域h-cdr 1;
[0699]
e.包含seq id no:165的重链可变域h-cdr 2;以及
[0700]
f.包含seq id no:166的重链可变域h-cdr 3。
[0701]
段落95.根据段落94所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合
片段包含重链可变域,该重链可变域包含seq id no:168。
[0702]
段落96.根据段落94所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含seq id no:167。
[0703]
段落97.根据段落94所述的抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含如在段落95和96中所定义的重链可变域和轻链可变域两者。
[0704]
段落98.一种包含根据以上段落中任一项所述的抗体或其抗原结合片段的制剂,其中所述制剂基本上不含天然产生的抗体,这些抗体不能结合到分拣蛋白或不实质上改变该制剂的抗分拣蛋白功能性,所述功能性选自下组,该组由以下各项组成:
[0705]
(i)对分拣蛋白的结合亲和力(kd);
[0706]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0707]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0708]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0709]
(v)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力;
[0710]
(vi)增加脑中的pgrn量和/或浓度的能力和/或
[0711]
(vii)当长期给予时,提供额颞痴呆(ftd)、肌萎缩性侧索硬化症(als)或阿尔茨海默病(ad)的治疗的能力。
[0712]
段落99.一种包含根据以上段落中任一项所述的单克隆抗体或其抗原结合片段的制剂,其中所述单克隆抗体在其氨基酸序列中相对于天然存在的抗分拣蛋白抗体的结构具有结构改变,其中所述结构改变使得所述单克隆抗体相对于由所述天然存在的抗分拣蛋白抗体展现出的功能性展现出改变的功能性,其中所述功能性选自下组,该组由以下各项组成:
[0713]
(i)对分拣蛋白的结合亲和力(kd);
[0714]
(ii)减少和/或抑制pgrn与分拣蛋白结合的能力;
[0715]
(iii)减少和/或抑制表达分拣蛋白的细胞清除pgrn的能力;
[0716]
(iv)减少和/或抑制表达分拣蛋白的细胞对pgrn的内吞的能力;
[0717]
(v)增加表达人分拣蛋白的敲入小鼠的血浆中的pgrn量和/或浓度的能力;
[0718]
(vi)增加脑中的pgrn量和/或浓度的能力,或
[0719]
(vii)当长期给予时,提供额颞痴呆(ftd)、肌萎缩性侧索硬化症(als)和/或阿尔茨海默病(ad)的治疗的能力。
[0720]
段落100.一种药物组合物,包含如在段落1至97的任一项中所定义的抗体或其抗原结合片段,或如段落98-99中任一项所述的制剂,以及药学上可接受的载体。
[0721]
段落101.如在段落1至97的任一项中所定义的抗体或其抗原结合片段,或如段落98-99中任一项所述的制剂,或如段落100所述的药物组合物,用于医学。
[0722]
段落102.如在段落1至97的任一项中所定义的抗体或其抗原结合片段,或如段落98-99中任一项所述的制剂,或如段落100所述的药物组合物,用于治疗与患者的脑中降低的pgrn水平相关的疾病。
[0723]
段落103.如在段落1至97的任一项中所定义的抗体或其抗原结合片段、或如段落98-99中任一项所述的制剂、或如段落100所述的药物组合物在制备用于治疗与患者的脑中降低的pgrn水平相关的疾病的药物中的用途。
[0724]
段落104.一种预防或治疗与患者的脑中降低的pgrn水平相关的疾病的方法,该方法包括给予有效剂量的如在段落1-97的任一项中所定义的抗体或其抗原结合片段、或如段落98-99中任一项所述的制剂、或如段落100所述的药物组合物。
[0725]
段落105.根据段落102所述的抗体或其抗原结合片段,或根据段落103所述的用途,或根据段落104所述的方法,其中该疾病是:ftd;als;或tdp43蛋白质病,如ad。
[0726]
段落106.根据段落102所述的抗体或其抗原结合片段,或根据段落103所述的用途,或根据段落104所述的方法,其中该治疗是长期的,并且优选持续至少2周,如至少持续1个月、或至少持续6个月、或至少持续1年。
[0727]
段落107.一种试剂盒,包含如在段落1-97的任一项中所定义的抗体或其抗原结合片段、或如段落98-99中任一项所述的制剂、或如段落100所述的药物组合物。
[0728]
段落108.如在段落1-97的任一项中所定义的抗体或其抗原结合片段,该抗体或其抗原结合片段已经在细胞系中生产或制备,该细胞系是如人细胞系、非人哺乳动物细胞系、昆虫细胞系、酵母细胞系或细菌细胞系。
[0729]
段落109.根据段落108所述的抗体或其抗原结合片段,其在cho细胞系、hek细胞系、bhk-21细胞系、鼠类细胞系(如骨髓瘤细胞系)、纤维肉瘤细胞系、per.c6细胞系、hkb-11细胞系、cap细胞系以及huh-7人细胞系中产生。
[0730]
现在将参照附图描述采用本发明的某些方面的优选的、非限制性实例。
[0731]
实例
[0732]
实例1-3描述了分拣蛋白构建体的产生
[0733]
实例1披露了改组构建体。实例2披露了分拣蛋白构建体的表达。实例3披露了分拣蛋白构建体的纯化。
[0734]
实例4-7描述了分拣蛋白抗体的产生
[0735]
实例4披露了免疫和杂交瘤。实例5披露了序列分析。实例6披露了抗体的纯化。实例7披露了小鼠抗体的产生。
[0736]
实例8-17描述了分拣蛋白抗体的表征
[0737]
实例8披露了与分拣蛋白的结合。实例9披露了分拣蛋白抗体的交叉阻断能力。实例10披露了htrf pgrn-分拣蛋白结合。实例11披露了nts结合。实例12披露了细胞pgrn结合和内吞。实例13披露了细胞外pgrn水平。实例14披露了ipsc pgrn水平。实例15披露了血浆pgrn水平。实例16披露了由hdx进行的表位作图。实例17披露了脑中pgrn的微透析。
[0738]
实例1
[0739]
用于在杂交瘤筛选过程中使用和用作抗体组的多样化两者,设计、构建并且产生了所谓的“改组构建体”,从而制备一组含有来源于人分拣蛋白和具有显著降低的序列同源性的远亲物种(四齿鲀属)两者的氨基酸序列的嵌合分拣蛋白分子。基本原理是这些嵌合构建体的整体分拣蛋白结构和功能性将被保留,但是抗体与某些嵌合构建体的结合损失将指示在结合中涉及特定交换区域。将可溶性胞外区(ecd,aa1-755)构建体用bap标签(生物素受体肽)(使得能够通过共表达生物素连接酶而进行蛋白质的“体外”生物素酰化)或his标签(使得能够容易地纯化)进行标记。制备编码以下蛋白质的表达载体:sort-ecdbap、sort-ecdbap-hb01-05、sort-ecdbap-hb06-10、sort-ecdbap-hb12390、sort-ecdbap-hb45678、sort-ecdbap-tetra、sort、sort-tetra。
[0740]
分拣蛋白序列可以发现于seq id no:169-180中并且图2示出了基于与分拣蛋白改组构建体的结合的抗体区域分配的示意性展示。
[0741]
实例2
[0742]
在抗体表达的情况下,在hek-293f细胞中共表达适当的重链和轻链载体,如在实例4、5和6中描述的。
[0743]
实例3:his标记的分拣蛋白的纯化
[0744]
在hek-293f细胞中表达sortecdhis。蛋白质中的his-标签使得能够通过固定化金属亲和层析进行纯化。在这种方法中,将ninta超流柱体(ninta superflow cartridge)(凯杰公司(qiagen))用50mm nah2po4、300mm nacl和10mm咪唑(ph 8.0)平衡。柱装载有his标记的蛋白,其中停留时间为1分钟。将柱用50mm nah2po4、300mm nacl和20mm咪唑(ph 8.0)洗涤。将蛋白质用50mm nah2po4、300mm nacl和250mm咪唑(ph 8.0)洗脱。随后,将蛋白质使用截留为10.000mwco的slide-a-lyzer(赛默科技公司(thermo scientific))用pbs透析。透析后,将蛋白质使用0.2微米sfca过滤器(赛默科技公司)无菌过滤。
[0745]
通过用人野生型(wt)分拣蛋白表达载体转染hek293细胞来产生s18-hek细胞系。在选择剂的存在下传代后得到稳定转染的细胞。通过稀释克隆选择单独的克隆。使用qpcr针对分拣蛋白mrna表达对克隆进行表征。然后使用抗分拣蛋白多克隆抗体(多克隆山羊分拣蛋白生物素酰化的ab,目录号:baf2934_(r&d系统公司(r&d systems)))通过facs(guava,密理博公司(millipore))分析最高的表达克隆,以确定分拣蛋白的表面表达水平。
[0746]
实例4
[0747]
a-转基因小鼠的免疫程序
[0748]
抗体humab分拣蛋白来源于humab小鼠品系hco12、hco17、hco20、hco12-balb/c、hco17-balb/c和hco20-balb/c(人单克隆抗体;梅达瑞克斯公司(medarex inc.),圣何塞,加利福尼亚州,美国)的免疫。这些小鼠被双敲除了小鼠免疫球蛋白(ig)重链和小鼠κ轻链,这基本上使完全鼠类的抗体表达失活。通过插入人ig重链和人igκ轻链座位使得不同小鼠品系成为转基因的并且区别在于人vh(重链的可变域)和vl(轻链的可变域)基因的数目。通过用kco5-balb/c(κ轻链转基因的)小鼠杂交繁育得到hco12-balb/c小鼠。
[0749]
将48只小鼠用20μg sortecdhis(seq id no:179)腹膜内地(ip)并且用相同蛋白皮下地(sc,在尾根处)交替免疫,间隔为14天。进行最多八次免疫,4次ip和4次sc。
[0750]
在一个方案中,用完全弗氏佐剂(cfa;difco实验室(difco laboratories),底特律,密歇根州,美国)中的sortecdhis进行第一次免疫,之后的免疫在不完全弗氏佐剂(ifa)中进行。第二方案在所有免疫步骤中使用sas作为佐剂。当发现血清滴度足够(针对至少两个连续的、双周的、筛选事件,在抗原特异性筛选测定中,发现1/50或更低的血清稀释度呈阳性)时,在融合之前四天和三天,将小鼠另外用100μl pbs中的10μg sortecdhis蛋白静脉内地(iv)强化两次。
[0751]
b-humab杂交瘤-产生
[0752]
将具有如上定义的足够抗原特异性滴度发生的humab小鼠处死并且收集腹主动脉与腔静脉两侧的脾脏和淋巴结。基本上根据制造商的说明书,使用ceef 50电融合系统(细胞脉冲科学(cyto pulse sciences),格伦伯尼,马里兰州,美国)通过电融合进行脾细胞和淋巴结细胞与小鼠骨髓瘤细胞系的融合。将融合的细胞接种在融合培养基中,该培养基含
有10%fetal clone i牛血清(普达生物公司(perbio))、1mm丙酮酸钠(康伯司公司(cambrex))、0.5u/ml青霉素、0.5u/ml链霉素(康伯司公司)、50μm 2-巯基乙醇(英杰公司)、600ng/ml白介素6(il-6)(施特拉特曼公司(strathmann))、1x hat(西格玛公司(sigma))和0.5mg/ml卡那霉素(英杰公司),在hyq madcf-mab(普达生物公司)中。十天之后,收获上清液并且将细胞培养基更换为收获培养基,该收获培养基含有10%fetal clone i牛血清、0.5u/ml青霉素、0.5u/ml链霉素、600ng/ml il-6和1x proht(康伯司公司),在hyq madcf-mab中。通过初级筛选测定和偶合到sortecdbap(seq id no 171)、sortecdbaphb06-10(seq id no 176)、sortecdbaphb12390(seq id no 177)上的链霉亲和素珠对杂交瘤培养物上清液进行筛选,以检测产生人(或嵌合)抗分拣蛋白抗体的杂交瘤。将来自最佳初级孔的杂种瘤细胞接种于半固体培养基中,该培养基由40%克隆培养基(clonemedia)(基因有限公司(genetix),汉普郡,英国)和60%hyq 2x完全培养基(hyclone公司,沃尔瑟姆,美国)制成。对于每个初级孔,接种genetix黑色6孔板的孔。使用clonepix系统(基因有限公司)从每个孔中挑取25个亚克隆。将亚克隆挑取在收获培养基中。七天之后,针对分拣蛋白特异性人igg结合再次对亚克隆上清液进行筛选并且使用octet 384red(fortebio公司,门洛帕克,美国)测量人igg浓度。从每个初级孔选择最佳亚克隆并且在仅含有600ng/ml il-6、0.5u/ml青霉素、0.5u/ml链霉素和1 x proht的扩增培养基中进行扩增。将亚克隆从一个96孔板孔扩增到一个24孔板孔,到四个24孔板孔,到六个6孔板孔。通过这种方法得到的克隆被指定为初级克隆(pc)。
[0753]
对本发明的抗分拣蛋白humab抗体进行鉴定并且使其经受序列分析。
[0754]
实例5:分拣蛋白特异性humab可变域的序列分析与表达载体中的克隆
[0755]
从0.2至5x106个杂交瘤细胞制备总rna并且根据制造商的说明书,使用smart race cdna扩增试剂盒(克罗泰克公司(clontech))从100ng总rna制备5
’‑
race-互补dna(cdna)。通过pcr扩增vh和vl编码区并且框内地直接在p33g1f和p33κ表达载体(含有人igg1./κ恒定域编码序列)中通过连接独立克隆进行克隆(阿斯拉尼迪斯,c.(aslanidis,c.)和p.j.德容(p.j.de jong),核酸研究(nucleic acids res)1990;18(20):6069-74)。对于每个抗体,对16个vl克隆和16个vh克隆进行测序。选择具有正确开放阅读框(orf)的克隆进行进一步研究和表达。使用293fectin在freestyletm 293-f细胞中瞬时共表达重链和轻链的所有组合的载体。
[0756]
所得序列示于在此的序列表(seq id no:1-168)中。根据公开的指南定义cdr序列。
[0757]
实例6:抗体的纯化
[0758]
将培养物上清液经0.2μm死端过滤器进行过滤,装载在5ml蛋白a柱(rprotein a ff,阿莫仙生物科学公司(amersham bioscience))上并且用0.1m柠檬酸-naoh(ph 3)洗脱。将洗脱物立即用2m tris-hcl(ph 9)中和并且用12.6mm nah2po4、140mm nacl,ph 7.4(贝朗公司(b.braun)),o/n(过夜)透析。透析之后,将样品经0.2μm死端过滤器进行无菌过滤。通过sds-page确定纯度并且通过比浊法和280nm处的吸光度测量浓度。将纯化的抗体等分并且储存在-80℃下。一旦解冻,便将纯化的抗体等分部分保持在4℃下。进行质谱法,以鉴定由杂交瘤表达的抗体重链和轻链的分子量。
[0759]
实例7:小鼠抗体(1f2和5e1)的产生
[0760]
免疫原
[0761]
使用来自英杰公司的freestyle系统将编码嵌合免疫原hsortilin-fc(来自seq id no:169的人分拣蛋白aa(78-756))和来自seq id no:169的人igg1-fc aa(104-330)的合成基因克隆进pcdna3.1中并且用于表达。使用如上针对人抗体描述的抗体纯化标准程序通过蛋白-a亲和层析从细胞培养上清液中纯化抗原。
[0762]
杂交瘤产生
[0763]
将hsortilin-fc用作免疫原并且免疫5只balb/c小鼠。选择具有令人满意的免疫应答的小鼠进行细胞融合和杂交瘤产生。使用hsortilin-ecd作为包被抗原通过elisa筛选杂交瘤上清液。产生了来源于九个亲本克隆的总共十八个杂交瘤细胞系。
[0764]
表达
[0765]
使杂交瘤首先在完全生长培养基(具有10%fbs+抗生素的dmem)中生长,并且随后变为cdhybridoma培养基(英杰公司)用于表达实验。
[0766]
纯化
[0767]
根据供应商(ge医疗公司(ge healthcare))推荐的标准程序通过蛋白-g交联琼脂糖从杂交瘤细胞培养上清液中纯化小鼠单克隆抗体。
[0768]
实例8:分拣蛋白特异性humab和小鼠抗体对分拣蛋白的重组胞外区的亲和力
[0769]
使用octet 384red(fortebio公司,门洛帕克,美国)确定抗分拣蛋白humab抗体对分拣蛋白的结合动力学。通过稀释于样品稀释剂(fortebio公司,品号18-5028)中制备2μg/ml的humab溶液。将prot a传感蛋白(fortebio公司,品号18-0004)用动力学缓冲液(pbs中的1:10样品稀释液)预湿至少600秒。随后,将传感蛋白用humab溶液固定600秒。通过在动力学缓冲液中浸渍120秒获得基线应答。在1000秒孵育期间进行sortecd构建体的缔合。这之后在动力学缓冲液中解离100秒。解离之后,使传感蛋白再生(10mm甘氨酸ph 1.0)并且中和(动力学缓冲液)3次,每次持续5秒。使用四个浓度的sortecd构建体(10、5、2.5和1.25μg/ml)分析所有humab。将76.8kda的分子量用于sortecdhis。将数据使用全球全拟合(global full fit)用fortebio分析6.4软件进行拟合。结果示于图3和图4中。
[0770]
实例9:抗分拣蛋白humab的抗体交叉阻断
[0771]
使用octet 384red(fortebio公司,门洛帕克,美国)进行抗体交叉阻断研究。通过稀释于样品稀释剂(fortebio公司,品号18-5028)中制备2μg/ml的humab抗体溶液。将胺反应性传感蛋白(fortebio公司,品号18-0008)用于humab的固定。在偶合至胺反应性传感蛋白之前,将humab稀释在mes ph 6.0缓冲液(18-5027)中。如下在30℃和1000rpm下进行偶合:将胺反应性传感蛋白在pbs中预湿并且随后用edc/nhs(fortebio公司,品号18-1033/18-1034)活化溶液(根据制造商的说明书)活化300秒。在600秒期间用humab固定活化的传感蛋白。由于剩余的胺与乙醇胺(fortebio公司,目录号18-1039)的反应性,将固定的传感蛋白淬灭。淬灭之后,将传感蛋白置于pbs中直到使用。在30℃和1000rpm下通过建立基线应答开始交叉阻断分析。通过在样品稀释液中浸渍120秒获得基线应答。在300秒期间进行sortecdhis的缔合,随后直接进行humab的缔合持续300秒。humab的缔合之后,使传感蛋白再生(10mm甘氨酸ph 1.0)并且中和(样品稀释液)3次,每次持续5秒。使用fortebio分析6.4软件处理数据。
[0772]
基于它们在不同分拣蛋白改组构建体上的结合谱将抗体分组(图2,图3和图4)。为
了证实来自区d(和区f)的所有抗体都结合到人野生型分拣蛋白ecd的同一区域,使用octet384 red在交叉阻断研究中表征它们阻断彼此与野生型人分拣蛋白ecd的结合的能力。例如,当测试来自同一区域的抗体时,一级抗体将阻断二级抗体的结合,反之亦然。然而,当测试来自从不同区域的抗体时,将不会存在交叉阻断,因为仅有一个区域被该一级抗体阻断并且其余的区域可供二级抗体结合使用。图7显示所有d-区和d+抗体都交叉阻断彼此,这证实了将抗体基于改组构建体分类到区d和d+。另外,这些数据还证实嵌合分拣蛋白构建体保留与天然人野生型分拣蛋白ecd的相似性。
[0773]
实例10:在抗分拣蛋白抗体的存在下分拣蛋白-pgrn配体结合的表征。
[0774]
通过使用均相时间分辨荧光(htrf,cisbio公司)测定测量结合到分拣蛋白的pgrn的位移来确定抗体的ic50值,参见图5和图6。
[0775]
在葛莱娜(greiner)384孔、白色、低体积微量滴定板(784075,葛莱娜公司)中,在总体积为20μl的测定缓冲液(50mm磷酸盐(ph 7.0)、0.1%bsa)中进行实验。
[0776]
在添加稀释于偶联缓冲液(50mm磷酸盐(ph 7.0)、0.8mm kf,0.1%bsa)中的7nm抗6his-d2和0.7nm抗pgrn-eu穴合物(cisbio公司)之前,将抗体在室温下与50nm his标记的分拣蛋白ecd和4nm pgrn(sulu20110924)预孵育15min。将20μm神经降压素用作阳性对照并且将缓冲液中的dmso用作阴性对照。
[0777]
在将板在envision读取器(珀金埃尔默公司)中读取之前,将测定板在室温下孵育60min并且在4℃下孵育过夜。
[0778]
将未标记的神经降压素和dmso空白分别用作测定建立的阳性对照和阴性对照。用在1μm与50pm之间的十个浓度在3倍稀释曲线中进行抗体的剂量应答评估。
[0779]
通过在xlfit 4(idbs,英国)中使用s形浓度应答(可变斜率)进行非线性回归来计算半最大抑制浓度(ic50)。(图5和图6)。
[0780]
实例11:在抗分拣蛋白抗体的存在下分拣蛋白-神经降压素结合的表征
[0781]
使用闪烁亲近测定法(spa)通过测量结合到分拣蛋白的3h-神经降压素的位移确定分拣蛋白特异性化合物af38469(施罗德等人,生物有机化学与药物化学快报(bioorg med chem lett.)2014年1月1日;24(1):177-80,2014)的ic50。
[0782]
在384孔白色不透明optiplate(6007299,珀金埃尔默公司)中,在总体积为40μl的测定缓冲液(50mm hepes(ph 7.4)、100mm nacl、2mm cacl2、0.1%bsa、0.1%tween-20)中进行实验。
[0783]
在将蛋白溶液添加至含有浓度系列50μm至2.5nm的af38469的孔中之前,将150nm his标记的分拣蛋白在室温下与或不与1μm分拣蛋白特异性抗体(igg1-6003-045或igg1-6003-068)或与人igg1同种型对照预孵育15min。在添加5nm3h-神经降压素和ni-螯合物成像珠(rpnq0266,珀金埃尔默公司)之前,将混合物在摇床上在室温下孵育15min。将测定在相同条件下再孵育60min。
[0784]
6h之后,将板在viewlux(360s曝光时间)上读取。将未标记的神经降压素和dmso空白分别用作阳性对照和阴性对照。
[0785]
用在50μm与2.5nm之间的十个浓度在3倍稀释曲线中进行af38469的剂量应答评估。通过在xlfit 4(idbs,英国)中使用s形浓度应答(可变斜率)进行非线性回归来计算半最大抑制浓度(ic50)。结果可以见于图8中。
[0786]
实例12:在抗分拣蛋白抗体的存在下分拣蛋白-pgrn配体在细胞表面上的结合的表征。
[0787]
在这个测定中使用分拣蛋白瞬时转染的细胞和稳定细胞系s18-hek细胞(过表达人分拣蛋白的hek细胞)两者。将细胞胰酶消化并且以每孔42,000个细胞的密度在96孔板中铺板。在瞬时转染的细胞的情况下,在转染后将细胞在96孔板中铺板24hr。第二天,完全换掉培养基并且将稀释于培养基中的测试化合物添加至细胞中持续30min,随后添加pgrn持续4hr。在研究结束时(4.5hr后),将细胞固定并且针对pgrn进行染色。通过cellomics阵列扫描(赛默飞世尔公司(thermo fischer))分析所有染色板并且将pgrn/细胞/孔的平均染色强度用于分析。
[0788]
在hek 293细胞中瞬间转染pgrn表达质粒之后,从培养基中收获在测定中使用的pgrn。使用pgrn elisa试剂盒(r&d)测量pgrn水平。
[0789]
添加至细胞中的pgrn被容易地结合并且内吞,这使得分拣蛋白转染的孔中的荧光信号增加。神经降压素的添加阻止分拣蛋白与pgrn结合,并且pgrn荧光强度类似于对照水平,指示pgrn在神经降压素的存在下未被结合和内吞。
[0790]
两种分拣蛋白humab(45和68)以类似于神经降压素的效力阻断pgrn的吸收。同种型对照抗体b12对pgrn内吞或结合没有任何影响。结果可以见于图9中。
[0791]
实例13:抗体对细胞外pgrn水平的影响
[0792]
发现hek293细胞和s18-hek细胞在没有任何刺激的情况下将pgrn连续地分泌进培养基中。
[0793]
将抗体和对照剂添加至s18-hek细胞中,以评估对pgrn的影响。向s18-hek细胞中添加神经降压素(一种已知肽分拣蛋白配体)或人抗体45、68和811使得细胞培养基中的pgrn增加。两种分拣蛋白人抗体(45和68)具有与神经降压素类似的影响,将pgrn水平分别提高到202%和201%。与对照b12相比,抗体811将培养基中的pgrn增加到146%,将同种型对照抗体在我们所有的研究中用作阴性对照并且对pgrn水平没有显示出任何影响。这些观察指示测试的分拣蛋白抗体抑制分拣蛋白介导的pgrn内化,由此增加细胞外pgrn。
[0794]
在第1天,将s18-hek细胞接种在96孔板中。24hr之后,将培养基完全换为单独的培养基(对照)或补充有测试化合物的培养基。除非另外指明,否则在10um下测试所有化合物并且在100nm下测试抗体。在第3天收集培养基并且使用pgrn elisa(r&d)进行分析。通过cell titerglo(普洛麦格公司(pro mega))评估细胞活力,以评价化合物的细胞毒效应。通过elisa分析培养基中的pgrn水平并且将值用对照孔进行归一化。结果可以见于图10中。
[0795]
实例14:ipsc中的细胞外pgrn的elisa测定
[0796]
如在其他地方描述的(拉斯马森(rasmussen)等人,干细胞报告(stem cell reports).2014年9月9日;3(3):404-13),通过人成纤维细胞(正常的人真皮成纤维细胞,18岁男性;龙沙公司(lonza))的非整合重编程产生诱导多能干细胞(ipsc)。将nhdf k1_shp53系用于这些研究。首先在mtesr培养基中产生ipsc并且随后在pluripro(细胞指导系统公司(cell guidance system))中以单层进行培养。通过将细胞在聚-l-鸟氨酸/层粘连蛋白包衣的培养皿中重新铺板并且在具有500ng/ml头发生素和10μm sb431542的n3培养基(补充有0.5%n2、具有ra的1%b27、0,5mm glutamax、0,5&nea、50μm 2-巯基乙醇和2.5mg/ml胰岛素的50%dmem/f12+50%neurobasal培养基)中培养它们而在第0天启动神经元分化。每天
更换培养基。头发生素/sb431542诱导11天之后,将细胞用分散酶分散并且在n3培养基中的聚-l-鸟氨酸/层粘连蛋白中重新铺板。从此今后,每2-3天更换n3培养基并且大约每10-14天使用accutase分散细胞。
[0797]
将神经元分化的ipsc细胞铺在96孔板中。一周后,将抗体添加至细胞中。在48hr或96hr时收集来自细胞的培养基并且通过人pgrn elisa(恩佐生命科学公司)进行分析并且按照制造商的说明书对样品进行分析。
[0798]
测试的分拣蛋白人抗体(45和68)在第48hr和96hr时以不同的水平增加pgrn水平。b12和抗hel是对照同种型抗体(阴性对照)。数据呈现为平均值
±
sd。通过单因素方差分析,随后是邓尼特分析对数据进行分析*p《0.05;**p《0.01。结果可以见于图12中。
[0799]
实例15
[0800]
为了分析抗体对血浆中pgrn水平的影响,通过皮下注射向人源化分拣蛋白ki小鼠给予单次或多次分拣蛋白抗体或同种型对照注射(10mg/kg)。在给药后不同时间点将动物麻醉并且处死,并且通过elisa确定血浆pgrn水平。
[0801]
a.时程研究:将小鼠用抗体(分拣蛋白humab或对照ab)处理并且在不同时间点将其处死。用对照抗体(抗hel)处理的小鼠没有显示出血浆pgrn变化,而在用分拣蛋白humab 45处理的小鼠中,pgrn水平是增加的,它似乎在24与48hr之间达到峰值并且然后从第4天左右逐渐降低。pgrn水平在第7天仍是升高的。
[0802]
b.亚慢性研究:基于来自时程研究的数据,向分拣蛋白ki小鼠每周皮下地给予两次10mg/kg的分拣蛋白人抗体45或同种型对照抗体,以便维持稳定的抗体水平持续亚慢性研究(4周)。在研究开始时并且每周收集血液样品,以密切注意血浆pgrn变化。在两组动物中研究开始时的血浆pgrn水平是相似的。从第1周在用分拣蛋白抗体45处理的小鼠中看到较高水平的血浆pgrn并且在整个研究中仍然是升高的。用对照ab处理的小鼠没有显示出任何血浆pgrn增加并且保持在基线水平(第0周)。
[0803]
c.剂量应答研究:注射不同剂量(4个剂量:10、2、0.4和0.1mg/kg)的分拣蛋白(45)和对照抗体(抗hel)并且在第2天将小鼠处死。在用分拣蛋白humab处理的小鼠中在10mg/kg和2mg/kg情况下血浆pgrn是升高的,并且更低的剂量对血浆pgrn没有影响,这清楚地显示了分拣蛋白抗体对血浆pgrn水平的剂量依赖性效应。用对照抗体处理的小鼠没有显示出任何pgrn水平变化。
[0804]
将小鼠用0,4ml阿佛丁腹膜内地麻醉,并且收集心脏血并且转移到500ul kedta小瓶中。将样品保持在冰上,直到在4c以3600g离心15min。将血浆移液到micronic小瓶中并且冷冻于-20c下。按照制造商的说明书使用pgrn elisa试剂盒(adipogen公司)测量样品中的pgrn。结果可以见于图13a-c中。
[0805]
实例16:通过氢/氘交换随后通过质谱法对靶向颗粒蛋白前体-分拣蛋白相互作用的抗体进行表位作图
[0806]
在氢/氘交换,随后是质谱法(hdx-ms)中,测量蛋白质中的骨架酰胺氢的交换速率。由此,有可能探测到整个蛋白质骨架的构象动力学,除了在脯氨酸残基处之外。交换反应的速率由骨架酰胺的氢键合状态并且在较小程度上由其溶剂可及性决定。可以观察到作为氘掺入变化的例如由配体的存在引起的这两个参数的微妙变化。
[0807]
为了对氘掺入变化进行亚定位,将蛋白质用酸稳定蛋白酶(例如胃蛋白酶)处理,
这产生典型地为十至十五个氨基酸的局部区域。在配体的存在下显示出扰动的区域直接牵涉在结合界面中或者别构性地受结合事件的影响。
[0808]
抗体的表位作图
[0809]
在不存在和存在mab45、mab68、mab811和命名为mab30的抗体(其不结合到d区)的情况下测量分拣蛋白的胞外区(seq id no:188)的氘掺入。为了保证在稳态条件下进行测量,在启动交换反应之前,使复合物在25℃下平衡15min。通过将蛋白样品1:9(v/v)地稀释到氘化的缓冲液(99%d2o、20mm tris、150mm nacl,pdread=7.6)中启动交换反应。在不同时间点(15s、1min、10min、1h和8h)之后,通过用冰冷的淬灭缓冲液(2m甘氨酸、0.8m三-(2-羧乙基)膦(tcep),ph=2.3)1:1(v/v)地稀释将交换反应淬灭,由此使ph降至2.46。立即将淬灭的样品置于-80
°
冷冻箱中并且储存直到分析。通过将分拣蛋白样品1:9(v/v)地稀释到氘化的变性缓冲液(6m盐酸胍、99%d2o、20mm tris、150mm nacl,pdread=7.6)中,随后在25℃下孵育16h来制备完全氘化的对照样品,之后如上所述的将它们淬灭并处理。
[0810]
将淬灭的样品解冻并且注入配备有家庭装胃蛋白酶柱(60μl的内体积,获得自赛默科技公司(thermo scientific inc.)的胃蛋白酶珠)的冷却(0℃)反相uplc-hdx系统(沃特斯公司(waters inc.),美国)中。这里,使氘化的蛋白样品在20℃下经受在线胃蛋白酶消化,并且通过反相uplc分离所得胃酶解肽。在最终的质量测定之前,将肽通过电喷射离子化电离到质谱仪(synapt g2质谱仪,沃特斯公司,英国)中,在该质谱仪中肽通过离子迁移被进一步分离。
[0811]
使用数据独立(mse)和数据依赖采集的组合通过串联质谱法在完全还原且非氘化的样品上进行肽的鉴定。
[0812]
数据分析
[0813]
肽的鉴定
[0814]
将采集的质谱针对gfp进行锁定质量校正并且在plgs 3.0中进行分析,其将前体和片段离子匹配到本地蛋白质数据库中。手动地谨慎评估所有肽鉴定。
[0815]
氘掺入的确定:将采集的质谱针对gfp进行锁定质量校正并且使用软件dynamx 3.0(沃特斯公司,美国)来确定在不存在或存在抗体的情况下分拣蛋白的所有肽的氘掺入。
[0816]
肽被认为是结合表位的一部分,如果在抗体的存在下观察到保护免于交换大于0.5d的话。
[0817]
表1-通过hdx-ms鉴定的构象表位表。
[0818][0819]
实例17:用于评估清醒的自由活动动物的脑中颗粒蛋白前体水平的微透析
[0820]
使用推拉式微透析方法评估来自清醒且自由活动的小鼠的脑isf颗粒蛋白前体(prgn)。将小鼠在受控的温度(22℃
±
1.5℃)和湿度条件(55%-65%)下单独饲养并且保持12:12小时光/暗循环(在06:00h时开灯)。食物和水可随意获得。在人分拣蛋白敲入(hsort1)小鼠(22周龄)的海马体中进行本研究。为了使得能够在海马体中进行微透析,将
小鼠用异氟烷麻醉并且将脑内引导套管(cma)立体定向地植入脑中,从而根据小鼠脑立体定位图谱集(the atlas of paxinos and franklin 2001)将微透析探针定位在海马体中(探针尖的坐标:前囟后面3.1mm并且前囟侧面2.8mm,并且相对于硬脑膜1.3mm)。将丙烯酸粘固剂用于固定引导套管。植入套管之后,在透析之前允许小鼠从手术中恢复7天。在前5天(包括手术当天),动物具有痛感并且接受抗生素处理(力莫敌(rimadyl)和noromox prolongatum)。在微透析实验开始之前24h,还将泵连接到出口管,以便防止通过拉动流体穿过管时灌注液从探针中丢失。作为灌注缓冲液,在使用当天将25%牛白蛋白馏分v(西格玛公司)用人工csf(acsf;以mm计:147nacl、2.7kcl、1.2cacl2、0.85mgcl2)稀释至0.2%并且通过0.1-μm膜过滤。在不连接探针的情况下确定泵的实际流速。在取样前后对样品管进行称重持续给定时间段并且计算流速。然后将泵设置为具有1μl/min的恒流。贯穿实验期使用120-min取样方案并且收集12个样品(收集12h)(图17,关于程序)。在实验结束时,从动物取血,灌注动物并且收集脑。将透析液、血浆和脑储存在-80℃下,直到通过elisa测定prgn。
[0821]
在24h期间每2h的prgn水平测量值描绘于图17中。在每个时间段,除了开始收集二透析液之后24h,当与来自用pbs处理的动物的prgn水平相比时,在用增加的mab#45处理的动物中prgn水平是显著增加的(图18a)。从将探针插入海马体之后4h直到16h,prgn水平随时间是稳定的。在第一透析液中,prgn是升高的,可能是由于将探针插入了海马体。据推测在探针插入后≥18h/20h,prgn水平正在降低,可能是由于探针膜的堵塞,因为它发生在两组中(并且先前已经在其他推拉式研究观察到)。
[0822]
将针对每个动物并且然后是合并的所有动物的在抗体或载体处理之后24h的12个透析样品的平均值
±
sem视为基线(图18b)。通过非配对t检验分析用mab#45和pbs处理的动物之间的差异。当与来自用pbs处理的动物的prgn基础水平相比时,在用mab#45处理的动物中prgn基础水平是显著增加的(p《0.001,f10.0,dfn,9dfd 7;3.3
±
0.3ng/ml,n=10对比1.1
±
0.1ng/ml,n=8)(图18c)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1