细胞周期蛋白依赖性激酶7(CDK7)的抑制剂的制作方法
细胞周期蛋白依赖性激酶7(cdk7)的抑制剂
1.本发明要求2021年2月10日向中国国家知识产权局提交的,专利申请号为202110187112.2,发明名称为“细胞周期蛋白依赖性激酶7(cdk7)的抑制剂”的在先申请的优先权。上述在先申请的全文通过引用的方式结合于本发明中。
技术领域
2.本发明属于医药技术领域,涉及cdk7抑制剂化合物或其光学异构体、药学上可接受的盐,含有它们的药物组合物以及作为cdk7抑制剂的用途。
背景技术:
3.细胞周期蛋白依赖性激酶(cyclin-dependent kinases,cdks)是一组丝氨酸/苏氨酸蛋白激酶,cdk通过对丝氨酸/苏氨酸蛋白的化学作用驱动细胞周期,和周期蛋白协同作用,是细胞周期调控中的重要因子。
4.cdk7是cdks家族的重要成员,在胞质溶胶中,cdk7作为异源三聚体复合物存在并且被认为起cdk1/2激活激酶(cak)的作用,由此cdk7对cdk1/2中的保守残基的磷酸化是完全催化性cdk活性和细胞周期进程所必需的。在细胞核中,cdk7形成rna聚合酶(rnap)ii一般转录因子复合物的激酶核心,并且负责磷酸化rnap ii的c-末端结构域(ctd),这是基因转录起始的必要步骤。由于cdk7具备cak和ctd磷酸化的双重功能,使其在细胞增殖,细胞周期和转录过程都发挥重要的作用。
5.根据已有研究,cdk7在肝癌、宫颈癌、胆管癌、卵巢癌、胰腺癌、肺鳞状细胞癌、胃癌和胶质母细胞瘤等多种肿瘤中活性异常,抑制cdk7的活性可以有效的抑制肿瘤细胞的增殖、转移、促进肿瘤细胞的凋亡。更为重要的是,在一些具有极高遗传复杂性的肿瘤如三阴性乳腺癌和成人t细胞白血病中,抑制cdk7的活性可以显著诱导肿瘤细胞的凋亡,提示cdk7抑制剂在肿瘤治疗中的巨大潜力。
6.虽然现有文献中也报道了一些cdk7小分子抑制剂用于治疗癌症(如专利文献wo2018013867a1,wo202093011a1,wo2019143719a1,wo2019143730a1),但仍有大量的患者无法得到满意的临床治疗效果,因此目前仍然需要更优、更有效的临床治疗和解决方案。鉴于此,本发明在现有技术基础上创造性地设计了系列化合物,提供一系列结构新颖、药效优良、生物利用度高、成药性好的cdk7抑制剂,并用于有效治疗cdk7相关的疾病,包括但不限于肿瘤等。
技术实现要素:
7.本发明的目的在于提供对cdk7具有高抑制性和高抗肿瘤活性的cdk7小分子抑制剂的化合物及其用途。
8.为了实现上述目的,本发明采用如下技术方案:
9.一种式(i)所示化合物或其药学上可接受的盐,
[0010][0011]
其中,选自c=ch-nh、n-ch=ch或n-ch=n;
[0012]
x选自化学键或者nh;
[0013]
r1选自cn、-o-c
1-c6烷基、-s(=o)
2-c
1-c6烷基、c
1-c6卤代烷基、c
6-c
10
芳基、5-10元杂芳基、3-10元杂环基或c
3-c8环烷基,所述c
6-c
10
芳基、5-10元杂芳基、3-10元杂环基或c
3-c8环烷基任选地被ra取代;ra选自卤素、oh、nh2或c
1-c3烷基;
[0014]
r2选自5-10元杂芳基、c
3-c8环烷基或3-10元杂环基,所述5-10元杂芳基、c
3-c8环烷基或3-10元杂环基任选地被rb取代;rb选自卤素、cn、oh、nh2、-nh(c
1-c3烷基)、-n(c
1-c3烷基)2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rc取代;rc选自卤素、nh2、cn或oh;
[0015]
r3选自h、卤素、c
1-c6烷基、-p(=o)(c
1-c6烷基)2或-s(=o)
2-c
1-c6烷基;
[0016]
r4选自h、cn、卤素或c
1-c6烷基;
[0017]
条件是,当r2选自时,选自n-ch=ch或n-ch=n;或者当r2选自时,选自c=ch-nh且r1选自-s(o)
2-c
1-c6烷基、c
1-c6卤代烷基或5-10元杂芳基,所述5-10元杂芳基任选地被ra取代;ra选自卤素、oh、nh2或c
1-c3烷基。
[0018]
在一些实施方案中,选自c=ch-nh。
[0019]
在一些实施方案中,r1选自cn、-s(=o)
2-c
1-c6烷基、c
1-c6卤代烷基、5-10元杂芳基或3-10元杂环基,所述5-10元杂芳基或3-10元杂环基任选地被ra取代。
[0020]
在一些实施方案中,r1选自-s(=o)
2-c
1-c6烷基、c
1-c6卤代烷基或5-10元杂芳基,所述5-10元杂芳基任选地被ra取代。
[0021]
在一些实施方案中,r1选自-s(=o)
2-c
1-c6烷基或5-10元杂芳基,所述5-10元杂芳基任选地被ra取代。
[0022]
在一些实施方案中,r1选自-s(=o)
2-c
1-c3烷基、c
1-c3卤代烷基或吡唑基,所述吡唑基任选地被ra取代。
[0023]
在一些实施方案中,r1选自-s(=o)
2-ch3、cf3、
[0024]
在一些实施方案中,ra选自卤素或c
1-c3烷基。
[0025]
在一些实施方案中,ra选自c
1-c3烷基。
[0026]
在一些实施方案中,r2选自5-10元杂芳基,所述5-10元杂芳基任选地被rb取代;或
者
[0027]
r2选自以下基团:
[0028]
所述所述任选地被rb取代。
[0029]
在一些实施方案中,r2选自以下基团:选自以下基团:所述所述任选地被rb取代。
[0030]
在一些实施方案中,当r2选自任选地被rb取代的时,选自n-ch=ch或n-ch=n;或者当r2选自任选地被rb取代的时,选自c=ch-nh且r1选自-s(o)
2-c
1-c6烷基或5-10元杂芳基,所述5-10元杂芳基任选地被ra取代;ra选自卤素、oh、nh2或c
1-c3烷基
[0031]
在一些实施方案中,当r2选自任选地被rb取代的时,选自c=ch-nh且r1选自5-10元杂芳基,所述5-10元杂芳基任选地被ra取代;ra选自卤素、oh、nh2或c
1-c3烷基。
[0032]
在一些实施方案中,r2选自5-10元杂芳基,所述5-10元杂芳基任选地被rb取代。
[0033]
在一些实施方案中,r2选自吡唑基、呋喃基、吡咯基、咪唑基、吡啶基、嘧啶基或吡嗪基,所述吡唑基、呋喃基、吡咯基、咪唑基、吡啶基、嘧啶基或吡嗪基任选地被rb取代。
[0034]
在一些实施方案中,r2选自吡啶基或吡唑基,所述吡啶基或吡唑基任选地被rb取代。
[0035]
在一些实施方案中,所述rb选自卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选地被rc取代。
[0036]
在一些实施方案中,所述rb选自卤素、cn、oh、nh2、c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0037]
在一些实施方案中,所述rb选自nh2或c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0038]
在一些实施方案中,所述rb选自c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0039]
在一些实施方案中,所述rc选自卤素或oh。
[0040]
在一些实施方案中,r2选自以下基团:选自以下基团:
[0041]
rd选自h、卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rf取代;rf选自卤素、nh2、cn或oh。
[0042]
在一些实施方案中,r2选自以下基团:选自以下基团:
[0043]
rd选自h、卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rf取代;rf选自卤素、nh2、cn或oh。
[0044]
在一些实施方案中,r2选自以下基团:选自以下基团:
[0045]
rd选自h、卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rf取代;rf选自卤素、nh2、cn或oh。
[0046]
在一些实施方案中,所述rd选自h、nh2、c
1-c6烷基,所述c
1-c6烷基任选地被rf取代。
[0047]
在一些实施方案中,所述rf选自卤素或oh。
[0048]
在一些实施方案中,r2选自以下基团:
[0049]
在一些实施方案中,当r2选自时,选自n-ch=ch或n-ch=n;或者当r2选自时,选自c=ch-nh且r1选自-s(o)
2-c
1-c6烷基或5-10元杂芳基,所述5-10元杂芳基任选地被ra取代;ra选自卤素、oh、nh2或c
1-c3烷基。
[0050]
在一些实施方案中,r3选自h或-p(=o)(c
1-c6烷基)2。
[0051]
在一些实施方案中,r3选自h或-p(=o)(c
1-c3烷基)2。
[0052]
在一些实施方案中,r4选自h或cn。
[0053]
在一些实施方案中,r4选自cn。
[0054]
在一些实施方案中,所述式(i)所示化合物选自式(ii)所示化合物或其药学上可接受的盐,
[0055][0056]
其中,r1、r3、r4、x如上文的定义;
[0057]
r2选自5-10元杂芳基,所述杂芳基任选地被rb取代;rb选自卤素、cn、oh、nh2、-nh(c
1-c3烷基)、-n(c
1-c3烷基)2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rc取代;rc选自卤素、nh2、cn或oh;
[0058]
或者r2选自以下基团:选自以下基团:
[0059]
rd选自h、卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rf取代;rf选自卤素、nh2、cn或oh。
[0060]
在一些实施方案中,r2选自吡啶基或吡唑基,所述吡啶基或吡唑基任选地被rb取代。
[0061]
在一些实施方案中,所述rb选自卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选地被rc取代。
[0062]
在一些实施方案中,所述rb选自卤素、cn、oh、nh2、c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0063]
在一些实施方案中,所述rb选自c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0064]
在一些实施方案中,所述式(i)所示化合物选自式(iii)所示化合物或其药学上可接受的盐,
[0065][0066]
其中,r1、r3、r4、x如上文的定义;
[0067]
r2选自5-10元杂芳基、c
3-c8环烷基或3-10元杂环基,所述5-10元杂芳基、c
3-c8环烷基或3-10元杂环基任选地被rb取代;rb选自卤素、cn、oh、nh2、-nh(c
1-c3烷基)、-n(c
1-c3烷基)2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选被rc取代;rc选自卤素、nh2、cn或oh,但r2不包括以下基团:
[0068]
在一些实施方案中,r2选自3-10元杂环基,所述3-10元杂环基任选地被rb取代。
[0069]
在一些实施方案中,r2选自6-10元杂环基,所述6-10元杂环基任选地被rb取代。
[0070]
在一些实施方案中,rb选自卤素、cn、oh、nh2、c
1-c6烷基或c
3-c8环烷基,所述c
1-c6烷基或c
3-c8环烷基任选地被rc取代。
[0071]
在一些实施方案中,所述rb选自卤素、cn、oh、nh2、c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0072]
在一些实施方案中,所述rb选自c
1-c6烷基,所述c
1-c6烷基任选地被rc取代。
[0073]
在一些实施方案中,x选自nh。
[0074]
在一些实施方案中,所述式(i)所示化合物选自式(ⅳ)所示化合物或其药学上可接受的盐,
[0075][0076]
其中,r4选自cn、卤素或c
1-c6烷基;r1、r2、r3、x如上文定义。
[0077]
在一些实施方案中,x选自nh。
[0078]
在一些实施方案中,式(i)所示化合物或其药学上可接受的盐选自以下化合物或其药学上可接受的盐,
[0079][0080]
进一步,本发明还提供了一种药物组合物,所述组合物包含式(i)所示化合物或其药学上可接受的盐,以及药学上可接受的辅料。
[0081]
进一步,本发明涉及的式(i)所示化合物或其药学上可接受的盐,或其药物组合物在制备预防或者治疗与cdk7相关疾病的药物中的用途。
[0082]
进一步,本发明涉及的式(i)所示化合物或其药学上可接受的盐,或其药物组合物在预防或者治疗与cdk7相关疾病中的用途。
[0083]
进一步,本发明涉及预防或者治疗cdk7相关疾病的式(i)化合物或其药学上可接受的盐,或其药物组合物。
[0084]
本发明还涉及治疗cdk7相关疾病的方法,该方法包括给以患者治疗上有效剂量的
包含本发明所述的式(i)化合物或其药学上可接受的盐的药物制剂。
[0085]
进一步,本发明所述的cdk7相关疾病包括但不限于增殖性疾病、炎性疾病、自身免疫性疾病。
[0086]
进一步,所述增殖性疾病选自癌症。
[0087]
术语定义和说明
[0088]
除非另有说明,本发明说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当属于本发明说明书记载的范围内。
[0089]
术语“药学上可接受的盐”是指药学上可接受的由本技术所述的化合物与无毒酸或碱的盐,包括由本技术所述的化合物与无机酸和碱、有机酸和碱的盐。
[0090]
本发明的化合物可以具有不对称碳原子(光学中心)或双键。外消旋体、对映异构体、非对映异构体、几何异构体和单个的异构体都包括在本发明的范围之内。
[0091]
本文中消旋体或者对映体纯的化合物的图示法来自maehr,j.chem.ed.1985,62:114-120。除非另有说明,用楔形键和虚线键表示一个立体中心的绝对构型。当本文所述化合物含有烯属双键或其它几何不对称中心,除非另有规定,它们包括e、z几何异构体。同样地,所有的互变异构形式均包括在本发明的范围之内。
[0092]
本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本发明的范围之内。
[0093]
术语“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体、非对应异构体和构象异构体。
[0094]
术语“互变异构体”是指因分子中某一原子在两个位置迅速移动而产生的官能团异构体。本发明化合物可表现出互变异构现象。互变异构的化合物可以存在两种或多种可相互转化的种类。质子移变互变异构体来自两个原子之间共价键合的氢原子的迁移。互变异构体一般以平衡形式存在,尝试分离单一互变异构体时通常产生一种混合物,其理化性质与化合物的混合物是一致的。平衡的位置取决于分子内的化学特性。例如,在很多脂族醛和酮,如乙醛中,酮型占优势;而在酚中,烯醇型占优势。本发明包含化合物的所有互变异构形式。
[0095]
术语“药物组合物”表示一种或多种文本所述化合物或其生理学/药学上可接受的盐或前体药物与其它化学组分的混合物,其它组分例如生理学/药学上可接受的载体和赋形剂。药物组合物的目的是促进化合物对生物体的给药。
[0096]
术语“被取代”是指特定原子上的任意一个或多个氢原子被取代基取代,只要特定原子的价态是正常的并且取代后的化合物是稳定的。当取代基为氧代(即=o)时,意味着两个氢原子被取代,氧代不会发生在芳香基上。
[0097]
术语“任选”或“任选地”是指随后描述的事件或情况可以发生或不发生,该描述包括发生所述事件或情况和不发生所述事件或情况。例如,乙基“任选”被卤素取代,指乙基可
以是未被取代的(ch2ch3)、单取代的(如ch2ch2f)、多取代的(如chfch2f、ch2chf2等)或完全被取代的(cf2cf3)。本领域技术人员可理解,对于包含一个或多个取代基的任何基团,不会引入任何在空间上不可能存在和/或不能合成的取代或取代模式。
[0098]
术语“c
1-c
10
烷基”应理解为表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链或支链饱和一价烃基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等。术语“c
1-c6烷基”应理解为表示具有1、2、3、4、5、6个碳原子的直链或支链饱和一价烃基。术语“c
1-c3烷基”应理解为表示具有1、2、3个碳原子的直链或支链饱和一价烃基。
[0099]
术语“卤素”指氟、氯、溴或碘,优选为氟、氯或溴。
[0100]
术语“c
6-c
10
芳基”应理解为具有6、7、8、9、10个碳原子的一价芳香性或部分芳香性的单环、双环或三环烃环,特别是具有6个碳原子的环(“c6芳基”),例如苯基;或者具有9个碳原子的环(“c9芳基”),例如茚满基或茚基,或者具有10个碳原子的环(“c
10
芳基”),例如四氢化萘基、二氢萘基或萘基。
[0101]
术语“c
3-c8环烷基”应理解为表示饱和的一价单环或双环烃环,其具有3~8个碳原子。环烷基的例子如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基或环癸基,或者是双环烃基如十氢化萘环。根据本发明,所述双环烃环包括桥环、螺环或并环结构。
[0102]
术语“3-10元杂环基”应理解为具有3-10个环原子的饱和的或部分不饱和的一价单环或双环,其包含1-5个,优选1-3个选自n、o和s的杂原子。所述双环烃环包括桥环、螺环或并环结构。4元环,如氮杂环丁烷基、氧杂环丁烷基;5元环,如四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基;或6元环,如四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基或三噻烷基;或部分饱和的6元环如四氢吡啶基;或7元环,如二氮杂环庚烷基。任选地,所述杂环基可以是苯并稠合的。所述杂环基可以是双环的,例如但不限于5,5元环,如六氢环戊并[c]吡咯-2(1h)-基环,或者5,6元双环,如六氢吡咯并[1,2-a]吡嗪-2(1h)-基或含氮原子的环可以是部分不饱和的,即它可以包含一个或多个双键,例如但不限于吡唑基、2,5-二氢-1h-吡咯基、4h-[1,3,,4]噻二嗪基、4,5-二氢噁唑基或4h-[1,4]噻嗪基;或者,它可以是苯并稠合的,例如但不限于二氢异喹啉基。
[0103]
术语“5-10元杂芳基”应理解为包括这样的一价单环、双环或三环芳族环系,特别是5或6或9或10个环原子,且其包含1-5个,优选1-3各独立选自n、o和s的杂原子并且,另外在每一种情况下可为苯并稠合的。特别地,杂芳基选自噻吩基、呋喃基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、噻二唑基等以及它们的苯并衍生物,例如苯并呋喃基、苯并噻吩基、苯并噻唑基、苯并噁唑基、苯并异噁唑基、苯并咪唑基、苯并三唑基、吲唑基、吲哚基、异吲哚基等;或吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基等,以及它们的苯并衍生物,例如喹啉基、喹唑啉基、异喹啉基等;或吖辛因基、吲嗪基、嘌呤基等以及它们的苯并衍生物;或噌啉基、酞嗪基、喹唑啉基、喹喔啉基、萘啶基、蝶啶基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基等。
[0104]
术语“治疗”意为将本技术所述化合物或制剂进行给药以预防、改善或消除疾病或与所述疾病相关的一个或多个症状,且包括:
[0105]
(i)预防疾病或疾病状态在哺乳动物中出现,特别是当这类哺乳动物易患有该疾病状态,但尚未被诊断为已患有该疾病状态时;
[0106]
(ii)抑制疾病或疾病状态,即遏制其发展;
[0107]
(iii)缓解疾病或疾病状态,即使该疾病或疾病状态消退。
[0108]
术语“治疗有效量”意指(i)治疗或预防特定疾病、病况或障碍,(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状,或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的本发明化合物的用量。构成“治疗有效量”的本发明化合物的量取决于该化合物、疾病状态及其严重性、给药方式以及待被治疗的哺乳动物的年龄而改变,但可例行性地由本领域技术人员根据其自身的知识及本发明公开内容而确定。
[0109]
术语“辅料”是指可药用惰性成分。术语“赋形剂”的种类实例非限制性地包括粘合剂、崩解剂、润滑剂、助流剂、稳定剂、填充剂和稀释剂等。赋形剂能增强药物制剂的操作特性,即通过增加流动性和/或粘着性使制剂更适于直接压缩。适用于上述制剂的典型的“药学上可接受的载体”的实例为:糖类,淀粉类,纤维素及其衍生物等在药物制剂中常用到的辅料。
[0110]
术语“药学上可接受的辅料”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的那些辅料。合适的辅料是本领域技术人员熟知的,例如碳水化合物、蜡、水溶性和/或水可膨胀的聚合物、亲水性或疏水性材料、明胶、油、溶剂、水等。
[0111]
词语“包括(comprise)”、“含有(comprise)”或“包含(comprise)”及其英文变体例如comprises或comprising应理解为开放的、非排他性的意义,即“包括但不限于”。
[0112]
本技术的药物组合物可以采用本领域众所周知的方法制造,如常规的混合法、溶解法、制粒法、制糖衣药丸法、磨细法、乳化法、冷冻干燥法等。在一些实施方案中,药物组合物是口服形式。对于口服给药,可以通过将活性化合物与本领域熟知的药学上可接受的辅料混合,来配制该药物组合物。这些辅料能使本技术的化合物被配制成片剂、丸剂、锭剂、糖衣剂、胶囊剂、凝胶剂、浆剂、悬浮剂等,用于对患者的口服给药。
[0113]
可以通过常规的混合、填充或压片方法来制备固体口服组合物。例如,可通过下述方法获得:将所述的活性化合物与固体辅料混合,任选地碾磨所得的混合物,如果需要则加入其它合适的辅料,然后将该混合物加工成颗粒,得到了片剂或糖衣剂的核心。适合的辅料包括但不限于:粘合剂、稀释剂、崩解剂、润滑剂、助流剂、甜味剂或矫味剂等。
[0114]
药物组合物还可适用于肠胃外给药,如合适的单位剂型的无菌溶液剂、混悬剂或冻干产品。
[0115]
本文所述的化合物的所有施用方法中,每天给药的剂量为0.01mg/kg体重到200mg/kg体重。
[0116]
本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
[0117]
本发明具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于
1h-吲哚-6-甲腈(112mg,0.51mmol),80℃继续反应12个小时。反应结束后加冰水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0130]
步骤3:(s)-7-溴-3-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(甲基磺酰基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0131][0132]
将7-溴-3-(2-氯-5-(甲基磺酰基)嘧啶-4-基)-1h-吲哚-6-甲腈(64mg,0.16mmol),(s)-6,6-二甲基哌啶-3-胺(31mg,0.24mmol),n,n-二异丙基乙胺(62mg,0.48mmol)溶于2ml n-甲基吡咯烷酮,130℃下反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0133]
步骤4:(s)-7-(二甲基磷酰基)-3-(2-((6,6-二甲基哌啶-3-基)氨基)-5-(甲基磺酰基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0134][0135]
将(s)-7-溴-3-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(甲基磺酰基)嘧啶-4-基)-1h-吲哚-6-甲腈(30mg,0.06mmol),二甲基氧化膦(6mg,0.07mmol),醋酸钯(1.4mg,0.006mmol),磷酸钾(19mg,0.09mmol),4,5-双二苯基膦-9,9-二甲基氧杂蒽(3.5mg,0.006mmol)溶于1.5ml n,n-二甲基甲酰胺,氩气氛围下,于150℃下反应2个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0136]
dmso-d6δ
h 12.15(s,1h),8.79-8.71(m,1.5h),8.68-8.62(m,1h),8.46-8.40(m,0.5h),8.07(s,1h),7.73-7.65(m,1h),3.92-3.77(m,1h),2.99(d,j=6.1hz,3h),2.92-2.85(m,1h),2.72-2.63(m,1h),2.05(s,3h),2.02(s,3h),1.87-1.75(m,1h),1.74-1.62(m,1h),1.56-1.46(m,1h),1.39-1.25(m,1h),1.10-1.02(m,6h).
[0137]
lc/ms(m/z,mh
+
):501.1
[0138]
实施例2:(s)-1-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-5-甲腈
[0139][0140]
步骤1:1-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-5-甲腈
[0141][0142]
将2,4-二氯-5-(三氟甲基)嘧啶(216mg,1mmol)溶于1.5ml n,n-二甲基甲酰胺,冰浴下冷却,随后将5-氰基吲哚(142mg,1mmol)溶于1.5ml n,n-二甲基甲酰胺中,冰浴下冷却至0℃,将氢化钠(36mg,1.2mmol)缓慢加入其中,所得溶液滴加至2,4-二氯-5-(三氟甲基)嘧啶的n,n-二甲基甲酰胺溶液中,滴加结束室温反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0143]
步骤2:(s)-1-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-5-甲腈
[0144][0145]
将1-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-5-甲腈(85mg,0.264mmol),(s)-6,6-二甲基哌啶-3-胺(51mg,0.396mmol),n,n-二异丙基乙胺(102mg,0.792mmol)溶于2ml n-甲基吡咯烷酮,130℃反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0146]
dmso-d6δ
h 8.86-8.80(m,1h),8.58(s,1h),8.45-8.41(m,1h),8.25-8.19(m,1h),7.78-7.71(m,1h),6.97-6.91(m,1h),4.32-4.24(m,1h),2.98-2.90(m,1h),2.87-2.78(m,1h),2.04-1.95(m,1h),1.95-1.87(m,1h),1.86-1.75(m,1h),1.56-1.45(m,1h),1.45-1.35(m,1h),1.13(s,3h),1.11(s,3h).
[0147]
lc/ms(m/z,mh
+
):415.1
[0148]
实施例3:(s)-3-(2-(((5-氮杂螺[2.4]庚基-7-基]氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈
[0149][0150]
步骤1:(s)-5-苄基-5-氮杂螺[2.4]庚烷-7胺盐酸盐
[0151][0152]
将(s)-(5-苄基-5-氮杂螺[2.4]庚烷-7-基)氨基甲酸叔丁酯(160mg,0.53mmol)加入1ml二氯甲烷中,再向其中加入2ml 1,4-二氧六环,室温反应2个小时。反应结束旋干反应液,直接投用下一步。
[0153]
步骤2:(s)-3-(2-(((5-苄基-5-氮杂螺[2.4]庚烷-7-基]氨基]-5-(三氟甲基)嘧啶-4-基)-7-溴-1h-吲哚-6-甲腈
[0154][0155]
将(s)-5-苄基-5-氮杂螺[2.4]庚烷-7胺盐酸盐(91mg,0.45mmol),7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(120mg,0.3mmol),n,n-二异丙基乙胺(116mg,0.9mmol)溶于2ml n-甲基吡咯烷酮,130℃下反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0156]
步骤3:(s)-3-(2-(((5-苄基-5-氮杂螺[2.4]庚烷-7-基]氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈
[0157][0158]
将(s)-3-(2-(((5-苄基-5-氮杂螺[2.4]庚烷-7-基]氨基]-5-(三氟甲基)嘧啶-4-基)-7-溴-1h-吲哚-6-甲腈(98mg,0.17mmol),二甲基氧化膦(15mg,0.19mmol),醋酸钯(4mg,0.017mmol),磷酸钾(54mg,0.26mmol),4,5-双二苯基膦-9,9-二甲基氧杂蒽(10mg,0.017mmol)溶于1.5ml n,n-二甲基甲酰胺,氩气氛围下150℃反应2个小时。反应结束后加
水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0159]
步骤4:(s)-3-(2-(((5-氮杂螺[2.4]庚烷-7-基]氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈
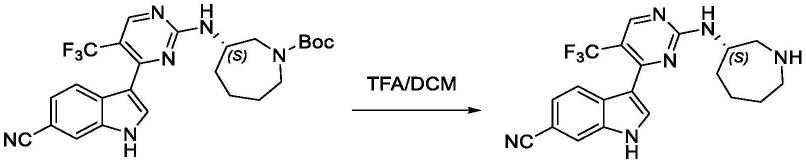
[0160][0161]
将(s)-3-(2-(((5-苄基-5-氮杂螺[2.4]庚烷-7-基]氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈(47mg,0.083mmol),二碳酸二叔丁酯(20mg,0.09mmol),钯/碳(4.7mg)置于2ml甲醇中,氢气置换气三次,室温反应12个小时。反应结束后抽滤,滤液旋干,将旋干得到的残余液溶于1ml二氯甲烷,随后向其中加入1ml三氟乙酸,室温反应2个小时。反应结束后向其中加入碳酸氢钠溶液调至中性,用乙酸乙酯萃取,合并有机相,旋干制备得标题化合物。
[0162]
dmso-d6δ
h 8.80-8.73(m,0.5h),8.63-8.53(m,1h),8.45-8.39(m,0.5h),8.23-8.12(m,1h),8.06-7.94(m,0.5h),7.75-7.64(m,1h),7.25-7.17(m,0.5h),4.29-4.17(m,1h),3.75-3.57(m,1h),3.24-3.17(m,1h),3.04-2.96(m,1h),2.94-2.87(m,1h),2.69-2.56(m,1h),2.05(s,3h),2.02(s,3h),0.76-0.69(m,1h),0.68-0.58(m,1h),0.57-0.43(m,2h).
[0163]
lc/ms(m/z,mh
+
):475.1
[0164]
实施例4:3-(5-(三氟甲基)-2-(3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7(8h)-基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0165][0166]
步骤1:3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0167][0168]
先将2,4-二氯-5-(三氟甲基)嘧啶(2.27g,10.5mmol)溶于10ml1,2-二氯乙烷,再
向其中加入三氯化铝(4.67g,35mmol),85℃下搅拌一小时,随后冷却至室温,再向其中加入6-氰基吲哚(1g,7mmol),85℃下反应5个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相旋干,二氯甲烷洗涤,抽滤,得到的滤饼为标题化合物。
[0169]
步骤2:3-(5-(三氟甲基)-2-(3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7(8h)-基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0170][0171]
将3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(40mg,0.12mmol),3-(三氟甲基)-5,6,7,8-四氢-[1,2,4]三唑并[4,3-a]吡嗪盐酸盐(32mg,0.132mmol),n,n-二异丙基乙胺(32mg,0.24mmol)溶于2ml n-甲基吡咯烷酮,130℃反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0172]
dmso-d6δ
h 8.83(s,1h),8.32-8.27(m,1h),8.12-8.09(m,1h),8.07-8.04(m,1h),7.56-7.51(m,1h),5.31(s,2h),4.44-4.31(m,4h).
[0173]
lc/ms(m/z,mh
+
):479.1
[0174]
实施例5:3-(2-(((1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0175][0176]
步骤1:4-硝基-1h-吡唑-1-甲酸叔丁酯
[0177][0178]
先将4-硝基吡唑(565mg,5mmol),三乙胺(1.01g,10mmol),4-二甲氨基吡啶(73mg,0.6mmol)溶于5ml二氯甲烷,冰浴下缓慢滴加二碳酸二叔丁酯(1.417mg,6.5mmol)。滴加结束,移至室温反应2个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相旋干,经柱层析分离纯化得标题化合物。
[0179]
步骤2:4-氨基-1h-吡唑-1-甲酸叔丁酯
[0180]
[0181]
将4-硝基-1h-吡唑-1-甲酸叔丁酯(200mg,0.94mmol),钯/碳(40mg),置于3ml甲醇中,氢气氛围下反应6个小时。反应结束后抽滤,取滤液旋干直接投用下一步。
[0182]
步骤3:3-(2-(((1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0183][0184]
将3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(80mg,0.25mmol),4-氨基-1h-吡唑-1-甲酸叔丁酯(64mg,0.35mmol),n,n-二异丙基乙胺(97mg,0.75mmol)溶于2ml n-甲基吡咯烷酮,130℃下反应3个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0185]
dmso-d6δ
h 12.61(s,1h),10.11(s,1h),8.81-8.72(m,1h),8.64-8.56(m,0.5h),8.21-8.02(m,2.5h),7.80(brs,2h),7.56
–
7.41(m,1h).
[0186]
lc/ms(m/z,mh
+
):370.1
[0187]
实施例6:3-(2-((((1s,3r)-3-氨基环己基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-腈
[0188][0189]
步骤1:3-(2-((((1s,3r)-3-氨基环己基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0190][0191]
先将(1r,3s)-环己烷-1,3-二胺二盐酸盐(89mg,0.475mmol)溶于2.5ml乙腈,加入dbu(1,8-二氮杂双环[5.4.0]十一碳-7-烯400mg),80℃下搅拌半小时,再向其中加入3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(60mg,0.19mmol)反应一个小时。反应结束后旋干溶剂,经柱层析分离纯化得标题化合物。
[0192]
dmso-d6δh 8.63-8.53(m,1h),8.53-8.47(m,0.5h),8.40-8.36(m,0.5h),8.11-8.06(m,1h),8.03-7.95(m,2h),7.51-7.43(m,1h),3.92-3.83(m,1h),2.71-2.61(m,1h),2.09-1.99(m,1h),1.92-1.84(m,1h),1.77-1.70(m,2h),1.33-1.09(m,5h),1.01-0.90(m,
1h).
[0193]
lc/ms(m/z,mh
+
):401.1
[0194]
实施例7:7-(二甲基磷酰基)-3-(2-((1-(2-羟基-2-甲基丙基)-1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0195][0196]
步骤1:7-溴-3-(2-(((1-(2-羟基-2-甲基丙基)-1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0197][0198]
参照wo2018013867中compound258步骤3的合成方法,制备7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈。
[0199]
将7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(100mg,0.25mmol),1-(4-氨基-1h-吡唑-1-基)-2-甲基丙烷-2-醇(58mg,0.375mmol),n,n-二异丙基乙胺(97mg,0.75mmol)溶于2ml n-甲基吡咯烷酮,150℃下反应1个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物经柱层析分离纯化得标题化合物。
[0200]
步骤2:(7-(二甲基磷酰基)-3-(2-((1-(2-羟基-2-甲基丙基)-1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0201][0202]
将7-溴-3-(2-(((1-(2-羟基-2-甲基丙基)-1h-吡唑-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(105mg,0.2mmol),二甲基氧化膦(17mg,0.22mmol),醋酸钯(4.5mg,0.02mmol),磷酸钾(64mg,0.3mmol),4,5-双二苯基膦-9,9-二甲基氧杂蒽(11.6mg,0.02mmol)溶于3ml n,n-二甲基甲酰胺,氩气氛围下,于150℃下反应2个小时。反应结束后加水淬灭,乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,浓缩,所得残余物柱层析分离纯化得标题化合物。
[0203]
dmso-d6δ
h 12.20(s,1h),10.25-10.09(m,1h),8.88-8.73(m,1.5h),8.40-8.32(m,0.5h),8.29-8.12(m,1h),8.02(s,0.5h),7.79(s,0.5h),7.77-7.65(m,1h),7.65-7.56(m,1h),4.74(s,0.5h),4.69(s,0.5h),4.02(s,1h),3.92(s,1h),2.08(s,3h),2.05(s,3h),1.08(s,3h),1.04(s,3h).
[0204]
lc/ms(m/z,mh
+
):518.1
[0205]
实施例8:(s)-3-(2-(氮杂-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈
[0206][0207]
步骤1:(s)-3-((3-(7-溴-6-氰基-1h-吲哚-3-基)-4-(三氟甲基)苯基)氨基)氮杂环庚烷-1-羧酸叔丁酯
[0208][0209]
将7-溴-3-(5-氯-2-(三氟甲基)苯基)-1h-吲哚-6-甲腈(100mg,0.25mmol)加入到2.5ml n-甲基吡咯烷酮中,加入n,n-二异丙基乙胺(100mg,0.75mmol),(s)-3-氨基氮杂环庚烷-1-羧酸叔丁酯(64.2mg,0.3mmol),加热至100℃搅拌2小时后反应完毕。降到室温后,向反应液中加20ml纯化水,然后用乙酸乙酯萃取两次,合并有机相,有机相用饱和食盐水洗涤后,无水硫酸钠干燥,过滤,减压浓缩,经乙酸乙酯和石油醚柱层析分离得到标题化合物。
[0210]
步骤2:(s)-3-((4-(6-氰基-7-(二甲基磷酰基)-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯和(s)-3-((4-(6-氰基-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯
[0211][0212]
将(s)-3-((3-(7-溴-6-氰基-1h-吲哚-3-基)-4-(三氟甲基)苯基)氨基)氮杂环庚烷-1-羧酸叔丁酯(115.6mg,0.2mmol)加入到16ml超干n,n-二甲基甲酰胺中,加入二甲基氧化膦(78mg,1.0mmol),醋酸钯(4.5mg,0.02mmol),4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(23mg,0.04mmol),磷酸钾(23mg,0.022mmol),氩气置换三次,并在氩气保护下150℃搅拌6小时。降温后,向反应液加入纯化水50ml,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,过
滤,浓缩,经乙酸乙酯和石油醚柱层析得到目标化合物(s)-3-((4-(6-氰基-7-(二甲基磷酰基)-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯,和(s)-3-((4-(6-氰基-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯。
[0213]
步骤3:(s)-3-(2-(氮杂环庚烷-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-7-(二甲基磷酰基)-1h-吲哚-6-甲腈的合成
[0214][0215]
将(s)-3-((4-(6-氰基-7-(二甲基磷酰基)-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯(70mg,0.12mmol)加入到3ml二氯甲烷中,磁子搅拌下冰水浴降温到0℃后滴入1ml三氟乙酸,滴加完毕后升至室温25℃反应2小时。待反应完毕,向反应液加入饱和碳酸氢钠水溶液调至ph在7到8之间,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩干燥得到粗品。向粗品中加入5ml乙腈搅拌30min,有白色固体不溶,抽滤,滤饼用1ml乙腈洗涤,烘干后得到标题化合物。
[0216]
dmso-d6δ
h 8.79-8.73(m,0.5h),8.65-8.56(m,1h),8.55-8.50(m,0.5h),8.23-8.15(m,1h),7.89-7.78(m,1h),7.75-7.65(m,1h),4.15-3.99(m,1h),3.09-2.97(m,1h),2.84-2.64(m,3h),2.06(s,3h),2.02(s,3h),1.96-1.85(m,1h),1.74-1.60(m,3h),1.60-1.43(m,2h).
[0217]
lc/ms(m/z,mh
+
):477.1
[0218]
实施例9:(s)-3-(2-(氮杂-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0219][0220]
步骤1:(s)-3-(2-(氮杂环庚烷-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0221][0222]
将(s)-3-((4-(6-氰基-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)氮杂环庚烷-1-羧酸叔丁酯(30mg,0.06mmol)加入到2ml二氯甲烷中,磁子搅拌,冰水浴降温到0℃附近滴入0.7ml三氟乙酸,滴加完毕后升至室温25℃反应2小时。待反应完毕,向反应液加入饱
和碳酸氢钠水溶液调至ph在7到8之间,乙酸乙酯萃取,合并有机相,有机相经饱和食盐水洗涤后,无水硫酸钠干燥,过滤,减压浓缩得到粗品。粗品经制备hplc(triart c18exrs,乙腈/水梯度洗脱)分离,冻干后得到目标产物,白色固体。
[0223]
dmso-d6δ
h 8.65-8.54(m,1h),8.53-8.48(m,0.5h),8.36-8.31(m,0.5h),8.07(s,1h),8.04-7.98(m,1h),7.84-7.74(m,1h),7.52-7.44(m,1h),4.13-4.01(m,1h),3.08-2.99(m,1h),2.85-2.60(m,3h),1.97-1.82(m,3h),1.76-1.60(m,3h),1.60-1.45(m,2h).
[0224]
lc/ms(m/z,mh
+
):401.1
[0225]
实施例10:7-(二甲基磷酰基)-3-(2-((1-异丙基哌啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0226][0227]
步骤1:7-溴-3-(5-(((1-异丙基哌啶-4-基)氨基)-2-(三氟甲基)苯基)-1h-吲哚-6-甲腈的合成
[0228][0229]
将7-溴-3-(5-氯-2-(三氟甲基)苯基)-1h-吲哚-6-甲腈(100mg,0.25mmol)加入到2.5ml n-甲基吡咯烷酮中,加入n,n-二异丙基乙胺(100mg,0.75mmol),4-氨基-1-异丙基哌啶(43mg,0.3mmol),加热至100℃搅拌2小时后反应完毕。降到室温后,向将反应液中加20ml纯化水,然后用乙酸乙酯萃取,合并有机相,有机相用饱和食盐水洗涤后,无水硫酸钠干燥,过滤,减压浓缩,经柱层析(石油醚/乙酸乙酯梯度洗脱)分离得到标题化合物。
[0230]
步骤2:(7-(二甲基磷酰基)-3-(2-((1-异丙基哌啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0231][0232]
将(7-溴-3-(5-(((1-异丙基哌啶-4-基)氨基)-2-(三氟甲基)苯基)-1h-吲哚-6-甲腈(110mg,0.2mmol)加入到16ml超干n,n-二甲基甲酰胺中,加入二甲基氧化膦(78mg,1.0mmol),醋酸钯(4.5mg 0.02mmol),4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(23mg,0.04mmol),磷酸钾(23mg,0.022mmol),氩气置换三次,并在氩气保护下,于150℃下搅拌6小
时后反应完毕。反应完毕后减压浓缩将反应液除去大部分溶剂,然后用乙腈/水体系过反向柱纯化得到粗品,粗品再经制备hplc(triart c18 exrs,乙腈/水梯度洗脱)分离,冻干得到标题化合物。
[0233]
dmso-d6δ
h 12.13(s,1h),8.78-8.72(m,0.5h),8.66-8.56(m,1h),8.55-8.48(m,0.5h),8.25-8.15(m,1h),8.05-7.93(m,1h),7.74-7.63(m,1h),3.85-3.73(m,1h),2.87-2.75(m,2h),2.74-2.63(m,1h),2.23-2.10(m,2h),2.05(s,3h),2.02(s,3h),1.94-1.86(m,2h),1.60-1.47(m,2h),0.98(s,3h),0.96(s,3h).
[0234]
lc/ms(m/z,mh
+
):505.2
[0235]
实施例11:(s)-3-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(1-甲基-1h-吡唑-4-基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0236][0237]
步骤1:3-(5-溴-2-氯嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0238][0239]
将5-溴-2,4-二氯嘧啶(4.80g,21mmol)和无水三氯化铝(3.75g,28mmol)加入到90ml1,2-二氯乙烷中,加热至80℃搅拌30分钟,然后加入6-氰基吲哚(2.00g,14mmol),继续在80℃下反应2小时。将反应液冷却至室温,加入100ml水和100ml乙酸乙酯,充分搅拌,析出大量黄色固体,抽滤,滤饼用乙酸乙酯洗涤,干燥得标题化合物。
[0240]
步骤2:(s)-3-(5-溴-2-((6,6-二甲基哌啶-3-基)氨基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0241][0242]
将3-(5-溴-2-氯嘧啶-4-基)-1h-吲哚-6-甲腈(500mg,1.50mmol)和(s)-6,6-二甲基哌啶-3-胺二盐酸盐(392mg,1.95mmol)加入到5ml n-甲基吡咯烷酮中,然后加入n,n-二异丙基乙胺(0.87ml,5.25mmol),加热至130℃反应3小时。将反应液冷却至室温,然后倒入
50ml水中,用乙酸乙酯萃取,合并有机层,水洗,饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩后,所得残余物经柱层析纯化得到标题化合物。
[0243]
步骤3:((s)-3-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(1-甲基-1h-吡唑-4-基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0244][0245]
将(s)-3-(5-溴-2-((6,6-二甲基哌啶-3-基)氨基)嘧啶-4-基)-1h-吲哚-6-甲腈(80mg,0.19mmol),1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑(47mg,0.22mmol),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(14mg,0.02mmol)和碳酸钾(52mg,0.38mmol)加入到3ml 1,4-二氧六环/水(v/v=10:1)混合溶剂中,惰性气体置换三次,气体保护下升温至100℃反应3小时。将反应液冷却后,过滤,滤液经制备hplc(triart c18 exrs,乙腈/水梯度洗脱)纯化得标题化合物。
[0246]
dmso-d6δ
h 8.50(s,1h),8.06(s,1h),7.98-7.93(m,1h),7.69(s,1h),7.43-7.31(m,2h),7.32(s,1h),7.00-6.90(m,1h),6.05-5.86(m,1h),3.85(s,3h),2.98-2.87(m,2h),2.70-2.58(m,2h),1.89-1.77(m,1h),1.71-1.62(m,1h),1.56-1.47(m,1h),1.38-1.30(m,1h),1.08(s,3h),1.05(s,3h).
[0247]
lc/ms(m/z,mh
+
):427.2
[0248]
实施例12:(s)-3-(2-(((6,6-二甲基哌啶-3-基)氨基)-5-(1h-吡唑-4-基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0249][0250]
将(s)-3-(5-溴-2-((6,6-二甲基哌啶-3-基)氨基)嘧啶-4-基)-1h-吲哚-6-甲腈(80mg,0.19mmol),4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1h-吡唑-1-羧酸叔丁酯(47mg,0.22mmol),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(14mg,0.02mmol)和碳酸钾(52mg,0.38mmol)加入到3ml 1,4-二氧六环/水(v/v=10:1)混合溶剂中,惰性气体置换三次,气体保护下升温至100℃反应3小时。将反应液冷却后,过滤,滤液经制备hplc(triart c18 exrs,乙腈/水梯度洗脱)纯化得标题化合物。
[0251]
dmso-d6δ
h 12.95(s,1h),11.85(s,1h),8.48(s,1h),8.08(s,1h),7.92(s,1h),7.66
–
7.47(m,2h),7.44
–
7.36(m,1h),7.29(s,1h),7.00
–
6.87(m,1h),3.89
–
3.67(m,1h),
3.00
–
2.84(m,1h),2.72
–
2.59(m,1h),1.92
–
1.73(m,2h),1.73
–
1.60(m,1h),1.54
–
1.47(m,1h),1.40
–
1.29(m,1h),1.08(s,3h),1.06(s,3h).
[0252]
lc/ms(m/z,mh
+
):413.2
[0253]
实施例13:7-(二甲基磷酰基)-3-(2-((四氢-2h-吡喃-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0254][0255]
步骤1:7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0256][0257]
将2,4-二氯-5-(三氟甲基)嘧啶(1.47g,6.79mmol)和无水三氯化铝(1.20g,9.05mmol)加入到18ml 1,2-二氯乙烷中,加热至80℃搅拌30分钟,然后加入7-溴-1h-吲哚-6-甲腈(1.00g,4.52mmol),继续在80℃下反应4小时。将反应液冷却至室温,加入120ml水,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩后加少量乙酸乙酯打浆,抽滤,干燥得标题化合物。
[0258]
步骤2:7-溴-3-(2-(((四氢-2h-吡喃-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0259][0260]
将7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(200mg,0.50mmol)和4-氨基四氢吡喃(65.7mg,0.65mmol)加入到4ml n-甲基吡咯烷酮中,然后加入n,n-二异丙基乙胺(226mg,1.75mmol),加热至130℃反应3小时。将反应液冷却至室温,然后倒入50ml水中,用乙酸乙酯萃取,合并有机层,水洗,饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩后,所得残余物经柱层析纯化得到标题化合物。
[0261]
步骤3:7-(二甲基磷酰基)-3-(2-((四氢-2h-吡喃-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0262][0263]
将7-溴-3-(2-(((四氢-2h-吡喃-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(70mg,0.15mmol),二甲基氧化膦(27mg,0.35mmol),醋酸钯(6.9mg,0.0075mmol),4,5-双二苯基膦-9,9-二甲基氧杂蒽(8.7mg,0.015mmol)和磷酸钾(64mg,0.30mmol)加入到2ml无水n,n-二甲基甲酰胺中,加热至150℃反应2小时。将反应液冷却后倒入水中,用乙酸乙酯萃取,合并有机层,饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩,经制备hplc(triart c18 exrs,乙腈/水梯度洗脱)纯化得到标题化合物。
[0264]
dmso-d6δ
h 12.15(s,1h),8.80-8.72(m,0.5h),8.67-8.58(m,1h),8.57-8.51(m,0.5h),8.24-8.16(m,1h),8.14-8.02(m,1h),7.80-7.66(m,1h),4.13-4.01(m,1h),3.95-3.85(m,2h),3.46-3.36(m,2h),2.06(s,3h),2.02(s,3h),1.93-1.81(m,2h),1.66-1.52(m,2h).
[0265]
lc/ms(m/z,mh
+
):464.2
[0266]
实施例14:(s)-7-(二甲基磷酰基)-3-(2-(吡咯烷-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-腈
[0267][0268]
步骤1:(s)-3-((4-(7-溴-6-氰基-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-羧酸叔丁酯的合成
[0269][0270]
将7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(131mg,0.33mmol),3-氨基吡咯烷-1-羧酸叔丁酯(73mg,0.39mmol),n,n-二异丙基乙胺(126mg,0.98mmol)加入到n-甲基吡咯烷酮(6ml)中,130℃搅拌2小时后反应完毕。将反应液水洗,萃取得有机相,浓缩经柱层析后得标题化合物。
[0271]
步骤2:(s)-3-((4-(6-氰基-7-(二甲基磷酰基)-1h-吲哚-3-基)-5(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸叔丁酯的合成
[0272][0273]
将(s)-3-((4-(7-溴-6-氰基-1h-吲哚-3-基)-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-羧酸叔丁酯(55mg,0.1mmol),二甲基氧化膦(7.8mg,0.1mmol),磷酸钾(32mg,0.15mmol),醋酸钯(2.24mg,0.01mg),4,5-双二苯基膦-9,9-二甲基氧杂蒽(5.8mg,0.01mmol)加入到n,n-二甲基甲酰胺(6ml)中,150℃搅拌2小时后反应完毕。将反应液水洗,萃取得有机相,浓缩后经柱层析后得标题化合物。
[0274]
步骤3:(s)-7-(二甲基磷酰基)-3-(2-(吡咯烷-3-基氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0275][0276]
将(s)-3-((4-(6-氰基-7-(二甲基磷酰基)-1h-吲哚-3-基)-5(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸叔丁酯(40mg,0.07mmol)溶于二氯甲烷/三氟乙酸=4/1体系中,室温下搅拌2小时后反应完毕。浓缩,经柱层析后得标题化合物。
[0277]
dmso-d6δ
h 8.82-8.72(m,0.5h),8.70-8.50(m,1.5h),8.29-8.14(m,1.5h),8.11-8.00(m,0.5h),7.73-7.60(m,1h),4.53-4.31(m,1h),3.66-3.56(m,1h),3.52-3.45(m,1h)3.05-2.88(m,1h),2.84-2.70(m,1h),2.21-2.11(m,1h),2.05(s,3h),2.01(s,3h),1.79-1.67(m,1h).
[0278]
lc/ms(m/z,mh
+
):449.1
[0279]
实施例15:7-(二甲基磷酰基)-3-(2-((2-(2-羟基丙烷-2-基)吡啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈
[0280][0281]
步骤1:2-(4-溴吡啶-2-基)丙烷-2-醇的合成
[0282]
[0283]
将1m甲基溴化镁的四氢呋喃溶液(11.6ml,11.57mmol),置于三口瓶中,氩气保护,降温至-20℃。向其中滴加4-溴吡啶甲酸甲酯(1g,4.63mmol)的四氢呋喃(7.5ml)溶液,保持温度不超过-15℃。继续搅拌两小时后反应完毕。将反应液用饱和氯化铵溶液淬灭,乙酸乙酯萃取三次,合并滤液后,经柱层析得标题化合物。
[0284]
步骤2:(2-(2-羟基丙烷-2-基)吡啶-4-基)氨基甲酸叔丁酯的合成
[0285][0286]
将2-(4-溴吡啶-2-基)丙烷-2-醇(295mg,1.37mmol),氨基甲酸叔丁酯(161mg,1.37mmol),碳酸铯(895mg,2.74mmol),2-二环己基磷-2,4,6-三异丙基联苯(65mg,0.14mmol),三[二亚苄基丙酮]二钯(126mg,0.14mmol)加入到5ml1,4-二氧六环中,置换氩气,90℃搅拌2小时后反应完毕。将反应液浓缩,经柱层析后得标题化合物。
[0287]
步骤3:2-(4-氨基吡啶-2-基)丙烷-2-醇的合成
[0288][0289]
将(2-(2-羟基丙烷-2-基)吡啶-4-基)氨基甲酸叔丁酯(100mg,0.4mmol)溶于甲醇(1ml),加入盐酸的1,4-二氧六环溶液(2ml),室温搅拌三小时后反应完毕。用饱和碳酸氢钠水洗萃取后,有机相浓缩得标题化合物。
[0290]
步骤4:7-溴-3-(2-((2-(2-羟基丙烷-2-基)吡啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0291][0292]
将7-溴-3-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(60mg,0.15mmol),2-(4-氨基吡啶-2-基)丙烷-2-醇(28mg,0.18mmol),n,n-二异丙基乙胺(58mg,0.45mmol)加入到2ml n-甲基吡咯烷酮中,130℃搅拌2小时后反应完毕。将反应液水洗,萃取得有机相,浓缩经柱层析后得标题化合物。
[0293]
步骤5:7-(二甲基磷酰基)-3-(2-((2-(2-羟基丙烷-2-基)吡啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈的合成
[0294][0295]
将7-溴-3-(2-((2-(2-羟基丙烷-2-基)吡啶-4-基)氨基)-5-(三氟甲基)嘧啶-4-基)-1h-吲哚-6-甲腈(40mg,0.08mmol),二甲基氧化膦(6mg,0.08mmol),磷酸钾(24mg,0.12mmol),醋酸钯(1.7mg,0.01mg),4,5-双二苯基膦-9,9-二甲基氧杂蒽(4.4mg,0.01mmol)加入到n,n-二甲基甲酰胺(2ml)中,150℃搅拌2小时后反应完毕。将反应液水洗,萃取得有机相,浓缩后经柱层析后得标题化合物。
[0296]
dmso-d6δ
h 10.61(s,1h),12.25(s,1h),10.57(s,1h),8.93(s,1h),8.73(m,1h),8.40-8.24(m,2h),8.02-7.85(m,2h),7.74(s,1h),5.16(s,1h),1.43(s,5h),1.23(s,2h),0.00(s,3h).
[0297]
lc/ms(m/z,mh
+
):515.1
[0298]
实施例16:(s)-4-(1h-苯并[d]咪唑-1-基)-n-(6,6-二甲基哌啶-3-基)-5-(三氟甲基)嘧啶-2-胺
[0299][0300]
步骤1:1-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-苯并[d]咪唑的合成
[0301][0302]
将苯并咪唑(236mg,2.0mmol)加入到2ml无水n,n-二甲基甲酰胺中,加入氢化钠(96mg,2.4mmol),搅拌10分钟,然后加入2,4-二氯-5-(三氟甲基)嘧啶(434mg,2.0mmol)的n,n-二甲基甲酰胺溶液(2ml),室温反应4小时。加水将反应淬灭,用乙酸乙酯萃取,合并有机层,水洗,饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩后经柱层析纯化得到标题化合物。
[0303]
步骤2:(s)-4-(1h-苯并[d]咪唑-1-基)-n-(6,6-二甲基哌啶-3-基)-5-(三氟甲基)嘧啶-2-胺的合成
[0304]
[0305]
将1-(2-氯-5-(三氟甲基)嘧啶-4-基)-1h-苯并[d]咪唑(50mg,0.17mmol)和(s)-6,6-二甲基哌啶-3-胺二盐酸盐(44mg,0.22mmol)加入到2ml n-甲基吡咯烷酮中,然后加入n,n-二异丙基乙胺(76mg,0.59mmol),加热至130℃反应2小时。将反应液冷却至室温,然后倒入20ml水中,用乙酸乙酯萃取,合并有机层,水洗,饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩后经制备hplc(triart c18 exrs,乙腈/水梯度洗脱)纯化得到标题化合物。
[0306]
dmso-d6δ
h 9.13(s,1h),8.65-8.58(m,1h),8.55-8.47(m,1h),7.84-7.76(m,1h),7.50-7.35(m,2h),7.31-7.20(m,1h),4.40-4.27(m,1h),3.00-2.89(m,1h),2.87-2.76(m,1h),2.02-1.88(m,1h),1.86-1.73(m,1h),1.58-1.48(m,1h),1.46-1.34(m,1h),1.13(s,3h),1.12(s,3h).
[0307]
lc/ms(m/z,mh+):391.2
[0308]
实验例1 cdk激酶活性抑制实验
[0309]
采用caliper mobility shift assay的方法检测化合物对cdk2,cdk7,cdk6,cdk12激酶的活性抑制作用。化合物测试终浓度为10μm起始,3倍稀释10个浓度,复孔。使用分液器echo 550向目的板3573转移250nl的100倍终浓度化合物。
[0310]
在激酶cdk2/cyca2上,加入10μl终浓度为2.5nm cdk2/cyca2的激酶溶液,室温下孵育10分钟,加入15μl终浓度为17μm的atp和3μm底物peptide18混合溶液反应30分钟;
[0311]
在激酶cdk7/cych/mat1上,加入10μl终浓度为10nm cdk7/cych/mat1的激酶溶液,室温下孵育10分钟,加入15μl终浓度为19.6μm的atp和3μm底物peptide ctd3混合溶液反应120分钟;
[0312]
在激酶cdk6/cyct1上,加入10μl终浓度为10nm cdk6/cyct1的激酶溶液,室温下孵育10分钟,加入15μl终浓度为6.5μm的atp和3μm底物peptide ctd3混合溶液反应30分钟;
[0313]
在激酶cdk12 wt/cyck上,加入10μl终浓度为10nm cdk12 wt/cyck的激酶溶液,室温下孵育10分钟,加入15μl终浓度为11.5μm的atp和3μm底物peptide c混合溶液反应24小时。
[0314]
(阴性对照孔含10μl激酶缓冲液和250nl 100%dmso;阳性对照孔含10μl的激酶溶液和250nl 100%dmso)。
[0315]
加入30μl含edta的终止检测液停止激酶反应。用caliper ez reader读取转化率。换算抑制率%=(阳性对照转化率均值%-样品转化率%/(阳性对照转化率均值%-阴性对照转化率均值%)。其中:阴性对照孔,代表没有酶活孔的转化率读数;阳性对照孔,代表没有化合物抑制孔的转化率读数。以浓度的log值作为x轴,百分比抑制率为y轴,采用分析软件graphpad prism 5的log(inhibitor)vs.response-variable slope拟合量效曲线,从而得出各个化合物对酶活性的ic
50
值。计算公式:y=bottom+(top-bottom)/(1+10^((logic
50-x)*hillslope))。
[0316]
试验结果:在本实验条件下,测试化合物对cdk7均具有良好的抑制活性。相比于cdk2和/或cdk6和/或cdk12,本技术实施例化合物对cdk7具有更高的选择性抑制活性,测试化合物相应的活性测试结果具体见表1。
[0317]
表1化合物对cdk7,cdk2,cdk6,cdk12的激酶活性
[0318][0319]
“‑”
表示未进行测试
[0320]
实验例2本发明化合物的药代动力学性质检测
[0321]
试验动物:
[0322]
健康成年balb/c小鼠3只,雌性,每组3只,小鼠购自北京维通利华实验动物技术有限公司,动物生产许可证号:scxk(浙)2019-0001。
[0323]
药物配制:
[0324]
称取一定量药物,溶于dmso 5%+pg 20%+无水乙醇5%+solutol 10%+水60%,配制成10mg/ml,用于灌胃。
[0325]
给药方式:
[0326]
灌胃组:balb/c小鼠禁食过夜后灌胃给药,给药剂量均为10mg/kg,给药体积均为1ml/kg。
[0327]
操作方法:
[0328]
小鼠灌胃给药后,于给药后5min,15min,30min,1h,2h,4h,24h由眼眶采血40μl,5μledta-k2抗凝,12000rpm,4℃,5分钟离心分离血浆,于-20℃保存。
[0329]
测定不同浓度的药物灌胃给药后小鼠血浆中待测化合物含量:取样品室温融解,涡旋1min;定量转移15μl至2ml 96孔板中,加入150μl内标沉淀剂,振荡(1200rpm*3min);离心(4000rpm*15min),转移上清100μl至1ml 96孔板中;氮气吹干,加入100μl复溶液(乙腈水1:9),振荡摇匀(900rpm*3min),20μl进样分析。lc/ms/ms条件:流动相a:0.1%甲酸水溶液,流动相b:0.1%(v/v)甲酸的乙腈溶液,色谱柱:ace c
18 5μm(3.0mm*50mm),柱温:35℃,流速0.5ml/min。
[0330]
试验结果:
[0331]
在本实验条件下,测试化合物表现出较好的药代动力学性质,结果具体见表2。
[0332]
表2小鼠单次灌胃给予本发明化合物后药代动力学参数
[0333]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1