喹喔啉类衍生物及其制备方法和应用与流程
1.本发明涉及药物化学技术领域,特别是涉及一种喹喔啉类衍生物及其制备方法和应用。
背景技术:
2.c-met,也被称为酪氨酸蛋白激酶的met或肝细胞生长因子受体(hgfr),是一种蛋白质,由met基因编码。该蛋白质具有酪氨酸激酶活性,初级单链前体蛋白在翻译后被切割以产生α和β亚基,它们被二硫键连接形成成熟受体。met是对胚胎发育、器官发生和伤口愈合必不可少的单程酪氨酸激酶受体。肝细胞生长因子/分散因子(hgf/sf)及其剪接同工型(nk1,nk2)是met受体的唯一已知配体。met通常由上皮来源的细胞表达,而hgf/sf的表达仅限于间充质来源的细胞。当hgf/sf结合其同源受体met时,它会通过尚未完全了解的机制诱导其激活而诱导其二聚化。
3.met在许多类型的人类恶性肿瘤中被发现,包括肾癌、肝癌、胃癌、乳腺癌和脑癌。通常,仅干细胞和祖细胞表达met,这使这些细胞能够侵入性生长,以便在胚胎中产生新的组织或在成年后再生受损的组织。但是,癌症干细胞被认为会劫持正常干细胞表达met的能力,从而成为癌症持久性的原因并扩散到体内其他部位。met/hgfr的过表达及其通过共表达其肝细胞生长因子配体的自分泌激活均与肿瘤发生有关。癌症中异常的met激活与不良预后相关,异常激活的met会触发肿瘤生长,形成向肿瘤提供营养的新血管(血管生成),以及使癌症扩散到其他器官(转移)。具体地,met途径通过以下途径在癌症的发展中发挥重要作用:(1)激活关键的致癌途径(ras,pi3k,stat3,β-catenin);(2)血管生成(将新血管从已有的血管中萌发,为肿瘤提供营养);(3)分散(由于金属蛋白酶的产生而使细胞解离),通常会导致转移。研究表明,mir-199a*对met及其下游效应器细胞外信号调节激酶2(erk2)的协同下调不仅可抑制细胞增殖,而且抑制肿瘤细胞的运动性和侵袭能力。
4.axl是一种细胞表面受体酪氨酸激酶,从属于tam激酶家族,参与刺激细胞增殖和存活。近年来发现axl是癌细胞免疫逃逸和耐药性的关键因素之一,会导致侵袭性和转移性癌症。axl在肿瘤细胞以及邻近的免疫细胞(包括树突细胞、巨噬细胞和nk细胞)上有过度表达;在各种动物模型中,axl已被证明是对靶点疗法、免疫疗法和化学疗法产生耐药性的关键驱动因素。抑制过度活化的axl受体激酶,可以降低肿瘤细胞增长水平、阻滞肿瘤的侵袭,增强其他靶向药物的治疗效果,提高放疗、化疗的敏感度。
技术实现要素:
5.基于此,本发明提供一种喹喔啉类衍生物,该喹喔啉类化合物具有axl和c-met双效激酶抑制活性,能够发挥较好的抗肿瘤功效。
6.本发明的第一方面,提供一种具有如通式(i)所示结构的喹喔啉类衍生物、或其盐、或其药学上可接受的载体:
[0007][0008]
其中,
[0009]
w1、w2各自独立地选自:cr1或n;
[0010]
r0、r1各自独立地选自:h或卤素;m、n各自独立地选自:0、1、2、3或4;
[0011]
r2、r3各自独立地选自:h、c6~c10芳基、c3~c10环烷基、5~10元杂芳基、4~10元杂环烷基、8~20元螺杂环、-cn、-c(o)ra、-c(o)nrara、-c(o)ora、-ora、-oc(o)nrara或-nrara;其中,所述5~10元杂芳基、4~10元杂环烷基各自独立地被1、2或3个独立选择的rb取代基取代;rb选自:h、c1~c5烷基、c1~c5烷氧基取代的c1~c5烷基、羟基取代的c1~c5烷基、c3~c10环烷基、4~10元杂环烷基、c1~c3烷基取代的4~10元杂环烷基、-s(o)2r
b1
或-nr
b2rb3
,r
b1
选自:c3~c5环烷基或c6~c10芳基,r
b2
、r
b3
各自独立地选自:h、c1~c5烷基或c1~c5烷氧基取代的c1~c5烷基;
[0012]
ra各自独立地选自:h、c1~c10烷基、-nrcrc、-s(o)2rc、c3~c10环烷基、4~10元杂环烷基或-c(o)rc;其中,所述c1~c10烷基、c3~c10环烷基、4~10元杂环烷基各自独立地被1、2或3个独立选择的rc取代基取代;
[0013]
rc各自独立地选自:h、c1~c5烷基、c6~c10芳基、c3~c10环烷基、4~10元杂环烷基、-ord或-nrdrd;
[0014]
rd各自独立地选自:h或c1~c5烷基。
[0015]
在其中一个实施例中,r2、r3各自独立地选自:h、5~7元杂芳基、4~7元杂环烷基、9~12元螺杂环、-ora或-nrara;其中,所述5~7元杂芳基、4~7元杂环烷基各自独立地被1个独立选择的rb取代基取代;rb选自:h、c1~c3烷基、c1~c3烷氧基取代的c1~c5烷基、羟基取代的c1~c3烷基、c3~c5环烷基、4~7元杂环烷基、c1~c3烷基取代的4~7元杂环烷基、-s(o)2r
b1
或-nr
b2rb3
,r
b1
选自:c3~c5环烷基或c6~c8芳基,r
b2
、r
b3
各自独立地选自:h、c1~c3烷基或c1~c3烷氧基取代的c1~c3烷基;
[0016]
ra各自独立地选自:h、c1~c3烷基或-c(o)rc;其中,所述c1~c3烷基被1个rc取代基取代;
[0017]
rc各自独立地选自:c3~c10环烷基或4~10元杂环烷基。
[0018]
在其中一个实施例中,r2和r3有且只有一个为h。
[0019]
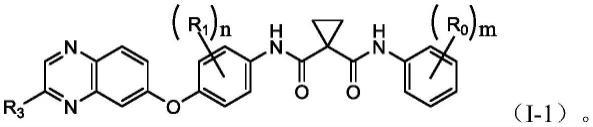
在其中一个实施例中,通式(i)具有如通式(i-1)所示结构:
[0020][0021]
在其中一个实施例中,通式(i-1)中,r3选自:h、
[0022]
在其中一个实施例中,通式(i)具有如通式(i-2)所示结构:
[0023][0024]
在其中一个实施例中,通式(i-2)中,rb选自:h、甲基、选自:h、甲基、
[0025]
在其中一个实施例中,选自:选自:
[0026]
在其中一个实施例中,所述喹喔啉类衍生物选自如下任一化合物:
[0027]
[0028][0029]
本发明的第二方面,提供所述的喹喔啉类衍生物的制备方法,所述制备方法包括如下步骤:
[0030]
将化合物1和化合物2进行取代反应;
[0031]
化合物1的结构通式如下:
[0032]
其中,x选自卤素;
[0033]
化合物2的结构通式如下:
[0034][0035]
本发明的第三方面,提供所述的喹喔啉类衍生物、或其盐、或其药学上可接受的载体在制备axl和c-met激酶抑制剂中的应用。
[0036]
本发明的第四方面,提供所述的喹喔啉类衍生物、或其盐、或其药学上可接受的载体在制备抗肿瘤药物中的应用。
[0037]
上述喹喔啉类衍生物在体外活性筛选表现出优异的axl和c-met双效激酶抑制活
性,在动物模型上能够发挥优异的抗肿瘤效果,能为癌症的治疗提供新的药物选择,同时还具有良好的安全性和耐受性。
附图说明
[0038]
图1为测试例2中化合物组、溶剂对照组和阳性对照组小鼠肿瘤体积的生长变化图;
[0039]
图2为测试例2中化合物组、溶剂对照组和阳性对照组小鼠体重随治疗时间的变化图。
具体实施方式
[0040]
以下结合具体实施例对本发明的喹喔啉类衍生物及其制备方法和应用作进一步详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
[0041]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
[0042]
本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
[0043]
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
[0044]
本发明中,涉及到数值区间,如无特别说明,上述数值区间内视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
[0045]
本发明中涉及的百分比含量,如无特别说明,对于固液混合和固相-固相混合均指质量百分比,对于液相-液相混合指体积百分比。
[0046]
本发明中涉及的百分比浓度,如无特别说明,均指终浓度。所述终浓度,指添加成分在添加该成分后的体系中的占比。
[0047]
本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内进行处理。所述的恒温处理允许温度在仪器控制的精度范围内进行波动。
[0048]
术语“烷基”是指包含伯(正)碳原子、或仲碳原子、或叔碳原子、或季碳原子、或其组合的饱和烃。包含该术语的短语,例如,“c1~c6烷基”是指包含1~6个碳原子的烷基,每次出现时,可以互相独立地为c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基。合适的实例包括但不限于:甲基(me、-ch3)、乙基(et、-ch2ch3)、1-丙基(n-pr、n-丙基、-ch2ch2ch3)、2-丙基(i-pr、i-丙基、-ch(ch3)2)、1-丁基(n-bu、n-丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、i-丁基、-ch2ch(ch3)2)、2-丁基(s-bu、s-丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、t-丁
基、-c(ch3)3)、1-戊基(n-戊基、-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3。
[0049]“烷氧基”是指具有-o-烷基的基团,即如上所定义的烷基经由氧原子连接至母核结构。包含该术语的短语,例如,“c1~c5烷基”是指烷基部分包含1~5个碳原子,每次出现时,可以互相独立地为c1烷氧基、c2烷氧基、c3烷氧基、c4烷氧基、c5烷氧基。合适的实例包括但不限于:甲氧基(-o-ch3或-ome)、乙氧基(-o-ch2ch3或-oet)和叔丁氧基(-o-c(ch3)3或-otbu)。
[0050]“芳基”是指在芳香环化合物的基础上除去一个氢原子衍生的芳族烃基,可以为单环芳基、或稠环芳基、或多环芳基,对于多环的环种,至少一个是芳族环系。例如,“c6~c10芳基”是指包含6~10个碳原子的芳基,每次出现时,可以互相独立地为c6芳基、c7芳基、c8芳基、c9基、c10芳基。
[0051]“芳杂环”是指在芳基的基础上至少一个碳原子被非碳原子所替代,非碳原子可以为n原子、o原子、s原子等。例如,“5~10元芳杂环”是指包含5~10个环原子的芳杂基,每次出现时,可以互相独立地为5元芳杂环、6元芳杂环、7元芳杂环、8元芳杂环、9元芳杂环、10元芳杂环。合适的实例包括但不限于:呋喃、苯并呋喃、噻吩、苯并噻吩、吡咯、吡唑、三唑、咪唑、噁唑、噁二唑、噻唑、四唑、吲哚、咔唑、吡咯并咪唑、吡咯并吡咯、噻吩并吡咯、噻吩并噻吩、呋喃并吡咯、呋喃并呋喃、噻吩并呋喃、苯并异噁唑、苯并异噻唑、苯并咪唑、吡啶、吡嗪、哒嗪、嘧啶、三嗪、喹啉、异喹啉、邻二氮萘、喹喔啉、菲啶、伯啶、喹唑啉和喹唑啉酮。
[0052]“螺环”是指脂环分子中两个碳环共用一个碳原子,“螺杂环”是指在螺环的基础上至少一个碳原子被非碳原子所替代,非碳原子可以为n原子、o原子、s原子等。例如,“8~20元螺杂环”是指共含8~20个环原子的螺杂环,8~20个环原子可以在两个环中以任意数量分配,如12元螺杂环可以为[6-6]-螺杂环或[4-8]-螺杂环等。
[0053]“单杂环”是指脂环分子的基础上至少一个碳原子被非碳原子所替代,非碳原子可以为n原子、o原子、s原子等。例如,“4~10元单杂环”是指共含4~10个环原子的单杂环。
[0054]“卤素”是指f、cl、br或i。
[0055]
本发明提供一种具有如通式(i)所示结构的喹喔啉类衍生物、或其盐、或其药学上可接受的载体:
[0056][0057]
其中,
[0058]
w1、w2各自独立地选自:cr1或n;
[0059]
r0、r1各自独立地选自:h或卤素;m、n各自独立地选自:0、1、2、3或4;
[0060]
r2、r3各自独立地选自:h、c6~c10芳基、c3~c10环烷基、5~10元杂芳基、4~10元杂环烷基、8~20元螺杂环、-cn、-c(o)ra、-c(o)nrara、-c(o)ora、-ora、-oc(o)nrara或-nrara;其中,所述5~10元杂芳基、4~10元杂环烷基各自独立地被1、2或3个独立选择的rb取代基取代;rb选自:h、c1~c5烷基、c1~c5烷氧基取代的c1~c5烷基、羟基取代的c1~c5烷基、c3~c10环烷基、4~10元杂环烷基、c1~c3烷基取代的4~10元杂环烷基、-s(o)2r
b1
或-nr
b2rb3
,r
b1
选自:c3~c5环烷基或c6~c10芳基,r
b2
、r
b3
各自独立地选自:h、c1~c5烷基或c1~c5烷氧基取代的c1~c5烷基;
[0061]
ra各自独立地选自:h、c1~c10烷基、-nrcrc、-s(o)2rc、c3~c10环烷基、4~10元杂环烷基或-c(o)rc;其中,所述c1~c10烷基、c3~c10环烷基、4~10元杂环烷基各自独立地被1、2或3个独立选择的rc取代基取代;
[0062]
rc各自独立地选自:h、c1~c5烷基、c6~c10芳基、c3~c10环烷基、4~10元杂环烷基、-ord或-nrdrd;
[0063]
rd各自独立地选自:h或c1~c5烷基。
[0064]
在其中一个示例中,w1、w2选自如下组:
[0065]
w1为cr1,且w2为cr1;
[0066]
w1为n,且w2为cr1;
[0067]
w1为cr1,且w2为n。
[0068]
在其中一个示例中,r1选自:h或f。
[0069]
在其中一个示例中,选自:选自:可以理解地,上述基团中,左端与通式(i)中的
“‑o‑”
相连,右端与通式(i)中的
“‑
nh
‑”
相连。
[0070]
在其中一个示例中,r0选自:h或f。进一步地,r0选自:f。
[0071]
在其中一个示例中,r2、r3各自独立地选自:h、5~7元杂芳基、4~7元杂环烷基、9~12元螺杂环、-ora或-nrara;其中,所述5~7元杂芳基、4~7元杂环烷基各自独立地被1个独立选择的rb取代基取代;rb选自:h、c1~c3烷基、c1~c3烷氧基取代的c1~c5烷基、羟基取代的c1~c3烷基、c3~c5环烷基、4~7元杂环烷基、c1~c3烷基取代的4~7元杂环烷基、-s(o)2r
b1
或-nr
b2rb3
,r
b1
选自:c3~c5环烷基或c6~c8芳基,r
b2
、r
b3
各自独立地选自:h、c1~c3烷基或c1~c3烷氧基取代的c1~c3烷基;
[0072]
ra各自独立地选自:h、c1~c3烷基或-c(o)rc;其中,所述c1~c3烷基被1个rc取代基取代;
[0073]
rc各自独立地选自:c3~c10环烷基或4~10元杂环烷基。
[0074]
在其中一个示例中,r2和r3有且只有一个为h。
[0075]
在其中一个示例中,通式(i)具有如通式(i-1)所示结构:
[0076][0077]
在其中一个示例中,通式(i-1)中,r3选自:h、选自:h、
[0078]
在其中一个示例中,通式(i)具有如通式(i-2)所示结构:
[0079][0080]
在其中一个示例中,通式(i-2)中,rb选自:h、甲基、选自:h、甲基、
[0081]
在其中一个示例中,所述喹喔啉类衍生物选自如下任一化合物:
[0082]
[0083][0084]
本发明还提供所述的喹喔啉类衍生物的制备方法,所述制备方法包括如下步骤:
[0085]
将化合物1和化合物2进行取代反应;
[0086]
化合物1的结构通式如下:
[0087]
其中,x选自卤素;
[0088]
化合物2的结构通式如下:
[0089][0090]
本发明还提供所述的喹喔啉类衍生物、或其盐、或其药学上可接受的载体在制备axl和c-met激酶抑制剂中的应用。
[0091]
本发明还提供所述的喹喔啉类衍生物、或其盐、或其药学上可接受的载体在制备抗肿瘤药物中的应用。具体地,肿瘤为胃癌、肝癌、肾癌、肺癌、食管癌、乳腺癌、胆管癌、白血病、前列腺癌、结直肠癌、骨癌、大肠癌、黑色素瘤、淋巴瘤、血癌、脑瘤、卵巢癌、胰腺癌或皮肤癌中的至少一种。
[0092]
以下为具体的实施例。
[0093]
实施例1~18中化合物的合成总路线如下所示:
[0094][0095]
实施例1化合物1合成方法:
[0096][0097]
7-溴-2-氯喹喔啉(2000mg,8.21mmol,1.0eq),1-(1-乙氧基乙基)-4-吡唑硼酸频哪醇酯(2300mg,4.16mmol,1.05eq),pd(pph3)4(84.88mg,0.8mmol,0.01eq)和碳酸钠水溶液(2m,4ml)常温加入到反应瓶中,用1,4-dioxane(20ml)溶成悬浮液,换氮气3次,移入100℃油浴锅中搅拌12小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,无水硫酸钠干燥后,40℃下减压浓缩,柱层析得1.30g白色固体。
[0098]
lcms(esi):m/z 349[m+h]
+
。
[0099][0100]
7-溴-2-(1-(1-乙氧基乙基)-1h-4-吡唑基)喹喔啉(500mg,1.44mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1-二羧酰胺(508mg,1.61mmol,1.1eq),碳酸铯(1.41g,4.33mmol,3.0eq)和cui(27.99mg)常温加入到反应瓶中,用dmf(5ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌3小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,无水硫酸钠干燥后,40℃下减压浓缩,柱层析得217mg类白色固体。
[0101]
lcms(esi):m/z 581[m+h]
+
。
[0102]1h nmr(500mhz,dmso-d6)δ10.14(s,1h),10.04(s,1h),9.23(d,j=2.4hz,1h),
8.81(d,j=2.5hz,1h),8.30(d,j=2.4hz,1h),8.05(dd,j=9.1,2.4hz,1h),7.77
–
7.71(m,2h),7.64(ddd,j=9.5,5.0,2.5hz,2h),7.53(dt,j=9.2,2.6hz,1h),7.20(dt,j=9.0,2.3hz,2h),7.18
–
7.09(m,3h),5.62(dd,j=5.9,2.5hz,1h),3.47(ddt,j=14.0,9.4,4.6hz,2h),1.65(dd,j=6.0,2.4hz,3h),1.48(d,j=2.5hz,4h),1.05(td,j=6.9,2.3hz,3h)。
[0103]
实施例2化合物2的合成
[0104][0105]
7-溴-2-氯喹喔啉(920mg,3.78mmol,1.00eq),1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)-1h-吡唑(586mg,3.78mmol,1.00eq),碳酸钾(783mg,5.68mmol,1.50eq)四(三苯基膦)钯(218mg,0.19mmol,0.05eq)常温加入到反应瓶中,用1,4-二氧六环(12ml)和水(3ml)溶成悬浮液,置换氮气3次,移入100℃油浴锅中搅拌6小时。反应结束后,反应液冷却至室温,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得1.30g类白色固体。
[0106]
lcms(esi):m/z 289/291[m+h]
+
。
[0107][0108]
7-溴-2-(1-甲基-1h-吡唑-4-基)喹喔啉(600mg,2.08mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(719mg,2.29mmol,1.10eq),碳酸铯(2.03g,6.25mmol,3.0eq),碘化亚铜(39mg,0.21mmol,0.1eq)常温加入到反应瓶中,用dmf(6ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,加200~300目硅胶拌样,以洗脱剂(二氯甲烷/甲醇=20/1)洗脱,得284mg类白色固体。
[0109]
lcms(esi):m/z 523[m+h]
+
。
[0110]1h nmr(500mhz,dmso)δ10.14(s,1h),10.05(s,1h),9.16(s,1h),8.58(s,1h),8.23(s,1h),8.03(d,j=9.1hz,1h),7.73(d,j=8.9hz,2h),7.64(dd,j=9.1,5.1hz,2h),7.51(dd,j=9.1,2.8hz,1h),7.19(d,j=9.0hz,2h),7.15(t,j=8.9hz,2h),7.11(d,j=2.7hz,1h),3.92(s,3h),1.48(s,4h)。
[0111]
实施例3化合物3的合成
[0112][0113]
7-溴-2-(1-甲基-1h-吡唑-4-基)喹喔啉(300mg,1.04mmol,1.0eq),n-(2-氟-4-羟基苯基)-n-(3-氟苯基)环丙烷-1,1-二甲酰胺(380mg,1.14mmol,1.10eq),碳酸铯(1.02g,3.13mmol,3.0eq),碘化亚铜(20mg,0.10mmol,0.1eq)常温加入到反应瓶中,用dmf(3ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得26mg类白色固体。
[0114]
lcms(esi):m/z 541[m+h]
+
。
[0115]1h nmr(500mhz,dmso)δ10.13(s,1h),10.04(s,1h),9.15(s,1h),8.57(s,1h),8.23(s,1h),8.02(d,j=9.1hz,1h),7.74(d,j=8.9hz,2h),7.65(dd,j=9.1,5.1hz,2h),7.52(dd,j=9.1,2.8hz,1h),7.17(d,j=9.0hz,2h),7.13(s,1h),7.12(d,j=2.7hz,1h),3.92(s,3h),1.48(s,4h)。
[0116]
实施例4化合物4的合成
[0117][0118]
7-溴-2-(1-甲基-1h-吡唑-4-基)喹喔啉(300mg,1.04mmol,1.0eq),n-(2-氟-4-羟基苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(378mg,1.14mmol,1.10eq),碳酸铯(1.02g,3.13mmol,3.0eq),碘化亚铜(19mg,0.10mmol,0.1eq)常温加入到反应瓶中,用dmf(3ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得70mg类白色固体。
[0119]
lcms(esi):m/z 541[m+h]
+
。1h nmr(500mhz,dmso)δ10.16(s,1h),10.05(s,1h),9.16(s,1h),8.57(s,1h),8.24(s,1h),8.02(d,j=9.1hz,1h),7.75(s,1h),7.65(dd,j=9.1,5.1hz,2h),7.52(dd,j=9.1,2.8hz,1h),7.18(d,j=9.0hz,2h),7.14(t,j=8.9hz,2h),7.12(d,j=2.7hz,1h),3.94(s,3h),1.48(s,4h)。
[0120]
实施例5化合物5的合成
[0121]
[0122]
7-溴-2-氯喹喔啉(460mg,1.41mmol,1.00eq),1-环丙基-4-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)-1h-吡唑(329mg,1.41mmol,1.00eq),碳酸钾(583mg,2.11mmol,1.50eq)四(三苯基膦)钯(81mg,0.07mmol,0.05eq)常温加入到反应瓶中,用1,4-二氧六环(6ml)和水(1.5ml)溶成悬浮液,置换氮气3次,移入100℃油浴锅中搅拌6小时。反应结束后,反应液冷却至室温,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得500mg类白色固体。
[0123]
lcms(esi):m/z 315/317[m+h]
+
。
[0124][0125]
7-溴-2-(1-环丙基-1h-吡唑-4-基)喹喔啉(500mg,1.59mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(550mg,1.75mmol,1.10eq),碳酸铯(1.80g,4.77mmol,3.0eq),碘化亚铜(30mg,0.16mmol,0.1eq)常温加入到反应瓶中,用dmf(6ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得180mg类白色固体。
[0126]
lcms(esi):m/z 523[m+h]
+
。
[0127]1h nmr(500mhz,dmso)δ10.15(s,1h),10.05(s,1h),9.17(s,1h),8.68(s,1h),8.21(s,1h),8.03(d,j=9.1hz,1h),7.75(s,1h),7.73(s,1h),7.65(dd,j=9.1,5.1hz,2h),7.52(dd,j=9.1,2.7hz,1h),7.20(d,j=8.9hz,2h),7.14(dd,j=15.1,6.2hz,2h),7.09(d,j=2.7hz,1h),3.82(tt,j=7.5,3.9hz,1h),1.48(s,4h).1.16
–
1.10(m,2h),1.05
–
0.99(m,2h)。
[0128]
实施例6化合物6合成方法:
[0129][0130]
7-溴-2-氯喹喔啉(1.00g,4.10mmol,1.0eq),1-异丙基-4-吡唑硼酸频哪醇酯(0.97g,7.80mmol,1.0eq),四(三苯基膦)钯(0.05g,0.04mmol,0.01eq)常温加入到反应瓶中,2m碳酸钠水溶液(0.44g,4.10mmol,1.0eq),用1,4-二氧六环(10ml)溶成悬浮液,换氮气3次,移入100℃油浴锅中搅拌9小时。反应结束后,反应液冷却至室温,减压浓缩,加ea溶解,转移至分液漏斗,水洗3遍,饱和食盐水洗涤有机相,无水硫酸钠干燥后,40℃下减压浓缩,得1.20g浅黄色固体。
[0131]
lcms(esi):m/z:317[m]。
[0132][0133]
7-溴-2-(1-(1-异丙基-1h-吡唑-4-基)-1h-吡唑-4-基)喹喔啉(0.30g,0.95mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二羧酰胺(0.33g,1.04mmol,1.1eq),碳酸铯(0.93g,2.85mmol,3.0eq),碘化亚铜(0.02g,0.10mmol,0.1eq)常温加入到反应瓶中,用无水dmf(6ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌4.0小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,搅拌析出固体,抽滤得到滤饼,加二氯甲烷溶清,饱和食盐水洗涤有机相,硫酸钠干燥后,30℃下减压浓缩,柱层析得120mg黄色固体。
[0134]
lcms(esi):m/z 551[m+h]
+
。
[0135]1h nmr(500mhz,dmso)δ10.14(s,1h),10.05(s,1h),9.19(s,1h),8.66(s,1h),8.24(s,1h),8.03(d,j=9.1hz,1h),7.74(d,j=8.4hz,2h),7.65(dd,j=8.9,5.0hz,2h),7.51(dd,j=9.1,2.8hz,1h),7.20(d,j=8.5hz,2h),7.15(t,j=8.6hz,2h),7.10(d,j=2.7hz,1h),4.57(p,j=6.7hz,1h),1.48(d,j=7.0hz,10h)。
[0136]
实施例7化合物7的合成
[0137][0138]
7-溴-2-氯喹喔啉(2.00g,8.21mmol,1.0eq),1-thp-4-吡唑硼酸频哪醇酯(2.17g,7.80mmol,0.95eq),四(三苯基膦)钯(0.10g,0.09mmol,0.01eq)常温加入到反应瓶中,2m碳酸钠水溶液(0.87g,8.21mmol,1.0eq),用1,4-二氧六环(20ml)溶成悬浮液,换氮气3次,移入100℃油浴锅中搅拌6小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,搅拌析出固体,抽滤,滤饼用二氯甲烷溶清,饱和食盐水洗涤有机相,无水硫酸钠干燥后,40℃下减压浓缩,柱层析得1.90g白色固体。
[0139]
lcms(esi):m/z:359[m]。
[0140][0141]
7-溴-2-(1-(四氢-2h-吡喃-2-基)-1h-吡唑-4-基)喹喔啉(1.90g,5.29mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二羧酰胺(1.83g,5.82mmol,1.1eq),碳酸铯(5.17g,15.87mmol,3.0eq),碘化亚铜(0.10g,0.53mmol,0.1eq)常温加入到反应瓶中,用无水dmf(20ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8.0小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,搅拌析出固体,抽滤得到滤饼,加乙
酸乙酯溶清,饱和食盐水洗涤有机相,硫酸钠干燥后,45℃下减压浓缩,柱层析得1.20g黄色固体。
[0142]
lcms(esi):m/z 615[m+na]
+
。
[0143]1h nmr(500mhz,dmso)δ10.15(s,1h),10.05(s,1h),9.24(s,1h),8.80(s,1h),8.28(s,1h),8.05(d,j=9.1hz,1h),7.75(d,j=8.4hz,2h),7.65(dd,j=8.8,5.1hz,2h),7.53(dd,j=9.1,2.8hz,1h),7.20(d,j=8.5hz,2h),7.18
–
7.11(m,3h),5.49(d,j=9.4hz,1h),3.96(d,j=11.5hz,1h),3.67(dt,j=12.2,6.8hz,1h),2.20
–
2.08(m,1h),1.96(q,j=7.9,4.5hz,2h),1.78
–
1.67(m,1h),1.60
–
1.55(m,2h),1.48(s,4h)。
[0144]
实施例8化合物8合成方法:
[0145][0146]
n-(4-氟苯基)-n-(4-(3-(1-(四氢-2h-吡喃-2-基)-1h-吡唑-4-基)喹喔啉-6-基)氧基)苯基)环丙烷-1,1-二羧酰胺(1.20g,2.02mmol,1.0eq)常温加入到反应瓶中,用无水甲醇(6ml)溶成悬浮液,边搅拌边滴加4m氯化氢的异丙醇溶液2ml,室温搅拌反应16h。反应结束后,将反应液40℃下减压浓缩,得1.05g红色固体。
[0147]
lcms(esi):m/z 509[m+h]
+
。
[0148]1h nmr(500mhz,dmso)δ13.32(s,1h),10.14(s,1h),10.05(s,1h),9.22(s,1h),8.65(s,1h),8.28(s,1h),8.04(d,j=9.1hz,1h),7.74(d,j=8.9hz,2h),7.65(dd,j=9.0,5.0hz,2h),7.51(dd,j=9.1,2.8hz,1h),7.23
–
7.09(m,5h),1.48(s,4h)。
[0149]
实施例9化合物9合成方法:
[0150][0151]
n-(4-((3-(1h-吡唑基-4-基)喹喔啉-6-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二羧酰胺(200mg,0.39mmol,1.0eq.),吡啶(0.1ml,1.24mmol)常温加入到反应瓶中,加入dcm(4ml)溶剂,移入冰浴中搅拌,滴加环丙基磺酰氯(0.2ml,1.96mmol,5.0eq.),搅拌3小时。反应结束后,将反应液30℃下减压浓缩,柱层析得150mg固体。
[0152]
lcms(esi):m/z:613[m+h]
+
。
[0153]1h nmr(500mhz,dmso)δ10.16(s,1h),10.04(s,1h),9.39(s,1h),9.25(s,1h),8.68(s,1h),8.10(d,j=9.1hz,1h),7.75(d,j=8.6hz,2h),7.65(dd,j=8.9,5.0hz,2h),7.61(dd,j=8.9,2.8hz,1h),7.25
–
7.11(m,5h),3.24(tt,j=8.1,4.7hz,1h),1.48(s,4h),1.36(p,j=4.8hz,2h),1.26(dt,j=7.8,3.8hz,2h)。
[0154]
实施例10化合物10合成方法:
[0155][0156]
n-(4-((3-(1h-吡唑基-4-基)喹喔啉-6-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二羧酰胺(200mg,0.39mmol,1.0eq.),碳酸铯(256mg,0.78mmol,2.0eq.)常温加入到反应瓶中,用dmf(4ml)溶成悬浮液,室温搅拌20min,再加入2-(2-溴乙氧基)四氢-2h-吡喃(163mg,0.78mmol,2.0eq),移入60℃油浴锅中搅拌2小时。反应结束后,反应液冷却至20℃,倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,45℃下减压浓缩,柱层析得120mg固体。
[0157]
lcms(esi):m/z:659[m+na]
+
。
[0158][0159]
n-(4-氟苯基)-n-(4-(3-(1-(2-((四氢-2h-吡喃-2-基)氧基)乙基)-1h-吡唑-4-基)喹喔啉-6-基)氧基)苯基)环丙烷-1,1-二羧酰胺(120mg,2.02mmol,1.0eq)常温加入到反应瓶中,用无水甲醇(6ml)溶成悬浮液,边搅拌边滴加4m氯化氢的异丙醇溶液2ml,室温搅拌反应4h。反应结束后,将反应液40℃下减压浓缩,加水稀释,乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,45℃下减压浓缩,柱层析得40mg白色固体。
[0160]
lcms(esi):m/z 575[m+na]
+
。
[0161]1h nmr(500mhz,dmso)δ10.14(s,1h),10.05(s,1h),9.19(s,1h),8.59(s,1h),8.25(s,1h),8.03(d,j=9.1hz,1h),7.74(d,j=8.7hz,2h),7.65(dd,j=9.0,5.0hz,2h),7.51(dd,j=9.1,2.8hz,1h),7.20(d,j=9.0hz,2h),7.17
–
7.10(m,3h),4.94(t,j=5.2hz,1h),4.22(t,j=5.6hz,2h),3.79(q,j=5.2hz,2h),1.48(s,4h)。
[0162]
实施例11化合物11合成方法:
[0163][0164]
n-(4-((3-(1h-吡唑基-4-基)喹喔啉-6-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二羧酰胺(40mg,0.08mmol,1.0eq.),2-溴乙基甲基醚(0.2ml,2.158mmol,27eq.),碳酸铯(51mg,0.16mmol,2.0eq.)常温加入到反应瓶中,用dmf(1ml)溶成悬浮液,移入60℃油浴锅中搅拌7小时。反应结束后,反应液冷却至20℃,倒入到饱和氯化铵溶液中,搅拌析出固体,柱层析纯化得11mg近白色固体。
[0165]
lcms(esi):m/z:567[m+h]
+
。
[0166]1h nmr(500mhz,dmso)δ10.16(s,1h),10.06(s,1h),9.18(s,1h),8.58(s,1h),8.26(s,1h),8.03(d,j=9.1hz,1h),7.74(d,j=8.7hz,2h),7.64(dd,j=9.0,5.0hz,2h),7.53(dd,j=9.1,2.8hz,1h),7.22(d,j=9.0hz,2h),7.18
–
7.10(m,3h),4.94(t,j=5.2hz,1h),4.22(t,j=5.6hz,2h),3.79(q,j=5.2hz,2h),3.25(s,3h),1.48(s,4h)。
[0167]
实施例12化合物12的合成
[0168][0169]
7-溴-2-氯喹喔啉(500mg,2.06mmol,1.00eq),4-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(775mg,2.06mmol,1.00eq),碳酸钾(425mg,3.09mmol,1.50eq)四(三苯基膦)钯(75mg,0.10mmol,0.05eq)常温加入到反应瓶中,用1,4-二氧六环(10ml)和水(2ml)溶成悬浮液,置换氮气3次,移入100℃油浴锅中搅拌6小时。反应结束后,反应液冷却至室温,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得700mg类白色固体。
[0170]
lcms(esi):m/z 458/460[m+h]
+
。
[0171][0172]
4-(4-(7-溴喹喔啉-2-基)-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(600mg,1.31mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(453mg,1.44mmol,1.10eq),碳酸铯(1.27g,3.93mmol,3.0eq),碘化亚铜(25mg,0.13mmol,0.1eq)常温加入到反应瓶中,用dmf(6ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得400mg类白色固体。
[0173]
lcms(esi):m/z 690[m-h]-。
[0174][0175]
叔丁基4-(4-(7-(4-(1-((4-氟苯基)氨甲酰)环丙烷-1-甲酰胺基)苯氧基)喹喔啉-2-基)-1h-吡唑-1-基)哌啶-1-羧酸盐(400mg,0.58mmol,1.0eq),常温加入到反应瓶中,向反应滴加hcl的1,4-二氧六环溶液(0.86ml,1.74mmol,3.00eq,2m),在常温下持续搅拌2.5小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得230mg类白色固体。
[0176]
lcms(esi):m/z 592[m+h]
+
。
[0177]1h nmr(500mhz,dmso)δ10.16(s,1h),10.06(s,1h),9.21(s,1h),8.67(s,1h),8.28(s,2h),8.04(d,j=9.1hz,1h),7.82
–
7.61(m,4h),7.52(dd,j=9.1,2.8hz,1h),7.24
–
7.07(m,5h),4.47(td,j=10.9,9.0,5.3hz,1h),3.32
–
3.19(m,2h),2.93(t,j=12.5hz,2h),2.22
–
2.14(m,2h),2.08(m,2h),1.48(s,4h)。
[0178]
实施例13化合物13的合成
[0179][0180]
7-溴-2-氯喹喔啉(500mg,1.41mmol,1.00eq),氨水(10ml,25%)常温加入到耐压瓶中,用1,4-二氧六环(50ml)溶成悬浮液,移入110℃油浴锅中搅拌3小时。反应结束后,反应液冷却至室温,缓慢倒入到纯化水中,进行抽滤,收集滤饼后。用乙酸乙酯进行溶解。用无水硫酸镁进行干燥。过滤后在40℃下减压浓缩,加200~300目硅胶拌样,柱层析得300mg淡黄色固体。
[0181]
lcms(esi):m/z 224/226[m+h]
+
。
[0182][0183]
在0℃下,向反应瓶中加入7-溴-2-氨基-喹喔啉(300mg,1.34mmol,1.0eq),用dcm(6ml)溶成悬浮液,向反应加入三乙胺(270mg,2.68mmol,2.0eq),持续进行搅拌。向反应滴加溶有环丙酰氯的dcm溶液(3ml,0.98mol/l,2.0eq),滴加完毕后,将反应移至室温持续进行反应3小时。反应结束后,将反应液缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得200mg淡黄色固体。
[0184]
lcms(esi):m/z 292/294[m+h]
+
。
[0185][0186]
7-溴-2-(环丙甲酰基)喹喔啉(200mg,0.69mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(238mg,0.76mmol,1.10eq),碳酸铯(670g,2.07mmol,3.0eq),碘化亚铜(13mg,0.07mmol,0.1eq)常温加入到反应瓶中,用dmf(2ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得120mg类白色固体。
[0187]
lcms(esi):m/z 526[m+h]
+
。
[0188]1h nmr(500mhz,dmso)δ11.31(s,1h),10.08(d,j=37.6hz,2h),9.51(s,1h),8.02(d,j=9.1hz,1h),7.70(d,j=8.9hz,2h),7.63(dd,j=9.0,5.1hz,2h),7.41(dd,j=9.1,
(2-氟-4-羟基苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(222mg,0.67mmol,1.05eq),碳酸铯(630mg,1.92mmol,3.0eq),碘化亚铜(12mg,0.07mmol,0.1eq)常温加入到反应瓶中,用dmf(4ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得110mg淡黄色固体。
[0200]
lcms(esi):m/z 642[m+h]
+
。
[0201]1h nmr(500mhz,dmso)δ10.45(s,1h),9.99(s,1h),8.73(s,1h),8.15(s,1h),7.94
–
7.75(m,2h),7.61(dd,j=8.6,5.1hz,2h),7.24
–
7.06(m,5h),6.97(d,j=8.5hz,1h),6.90(d,j=2.3hz,1h),4.56(d,j=12.7hz,2h),3.09(s,1h),2.98(t,j=12.1hz,3h),2.57(s,4h),2.28(s,3h),1.87(d,j=10.5hz,2h),1.58(d,j=20.0hz,4h),1.42(dd,j=20.0,11.1hz,2h),1.23(s,1h)。
[0202]
实施例16化合物16合成方法:
[0203][0204]
7-溴-2-氯喹喔啉(0.50g,2.05mmol,1.0eq),羟乙基吗啉(0.40g,3.05mmol,1.5eq),氢化钠(0.05g,2.25mmol,1.1eq)常温加入到反应瓶中,用无水thf(5ml)溶成悬浮液,置换氮气3次,室温搅拌5小时。反应结束后,将反应液缓慢倒入到饱和水中,加碳酸氢钠饱和溶液中和,用乙酸乙酯萃取,饱和食盐水洗涤有机相,无水硫酸钠干燥后,45℃下减压浓缩,得0.60g白色固体。
[0205]
lcms(esi):m/z:338[m]。
[0206][0207]
4-(2-((7-溴喹喔啉-2-基)氧基)乙基)吗啉(300mg,0.89mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二羧酰胺(308mg,0.98mmol,1.1eq),碳酸铯(870mg,2.67mmol,3.0eq),碘化亚铜(17mg,0.09mmol,0.1eq)常温加入到反应瓶中,用无水dmf(5ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌7.0小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,45℃下减压浓缩,柱层析得30mg黄色固体。
[0208]
lcms(esi):m/z 572[m+h]
+
。
[0209]1h nmr(500mhz,dmso)δ10.13(s,1h),10.04(s,1h),8.46(s,1h),7.99(d,j=9.0hz,1h),7.75
–
7.69(m,2h),7.68
–
7.60(m,2h),7.37(dd,j=9.0,2.7hz,1h),7.19
–
7.10(m,4h),6.99(d,j=2.7hz,1h),4.49(t,j=5.7hz,2h),3.58
–
3.53(m,4h),2.72(t,j=5.7hz,2h),2.48
–
2.43(m,4h),1.48(s,4h)。
[0210]
实施例17化合物17的合成
[0211][0212]
7-溴-2-氯喹喔啉(550mg,2.26mmol,1.00eq),3,9-二氮螺环[5.5]十一碳-3-羧酸叔丁酯(862mg,3.39mmol,1.50eq),用dmf(10ml)溶成悬浮液,置换氮气3次,移入80℃油浴锅中搅拌6小时。反应结束后,反应液冷却至室温,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得650mg类白色固体。
[0213]
lcms(esi):m/z 461/463[m+h]
+
。
[0214][0215]
9-(7-溴喹喔啉-2-基)-3,9-二氮螺环[5.5]十一碳-3-羧酸叔丁酯(460mg,1.00mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(330mg,1.10mmol,1.10eq),碳酸铯(978mg,3.00mmol,3.0eq),碘化亚铜(19mg,0.10mmol,0.1eq)常温加入到反应瓶中,用dmf(5ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌8h。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得270mg淡褐色固体。
[0216]
lcms(esi):m/z 695[m+h]
+
。
[0217][0218]
9-(7-(4-(1-((4-氟苯基)氨基甲酰基)环丙烷-1-甲酰胺基)苯氧基)喹喔啉-2-基)-3,9-二氮杂螺[5.5]十一烷-3-羧酸叔丁酯(200mg,0.29mmol,1.0eq),常温加入到反应瓶中,向反应滴加hcl的1,4-二氧六环溶液(0.43ml,0.86mmol,3.00eq,2mol/l),在常温下持续搅拌2.5小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,加乙酸乙酯萃取,饱和食盐水洗涤有机相,硫酸钠干燥后,40℃下减压浓缩,柱层析得120mg淡黄色固体。
[0219]
lcms(esi):m/z 595[m+h]
+
。
[0220]1h nmr(500mhz,dmso)δ10.12(s,2h),8.68(s,1h),8.40(s,1h),7.78(d,j=8.9hz,1h),7.69(d,j=8.8hz,2h),7.64(dd,j=9.0,5.1hz,2h),7.13(dd,j=19.7,8.9hz,5h),6.77(d,j=2.6hz,1h),3.74
–
3.68(m,4h),2.93(s,4h),1.55(d,j=26.1hz,8h),1.47(s,4h)。
[0221]
实施例18化合物18合成方法:
[0222][0223]
4-(3-吖啶基)吗啉二盐酸盐(290mg,1.35mmol,1.1eq),碳酸钠(391mg,3.69mmol,3.0eq)常温加入到反应瓶中,用无水dmf(5ml)溶成悬浮液,室温搅拌30min,加入7-溴-2-氯喹喔啉(300mg,1.23mmol,1.0eq),移入60℃油浴锅中搅拌6.0小时。反应结束后,将反应液缓慢倒入到饱和氯化铵溶液中,搅拌析出固体,抽滤,干燥,得340mg白色固体。
[0224]
lcms(esi):m/z:349[m]。
[0225][0226]
4-(1-(7-溴喹喔啉-2-基)氮杂环糊精-3-基)吗啉(217mg,0.62mmol,1.0eq),n-(4-氟苯基)-n-(4-羟基苯基)环丙烷-1,1-二甲酰胺(233mg,0.74mmol,1.2eq),碳酸铯(606mg,1.86mmol,3.0eq),碘化亚铜(11mg,0.06mmol,0.1eq)常温加入到反应瓶中,用无水dmf(5ml)溶成悬浮液,换氮气3次,移入120℃油浴锅中搅拌6.0小时。反应结束后,反应液冷却至20℃,缓慢倒入到饱和氯化铵溶液中,搅拌析出固体,抽滤,干燥;加乙酸乙酯溶解,45℃下减压浓缩,柱层析得240mg黄色固体。
[0227]
lcms(esi):m/z 583[m+h]
+
。
[0228]1h nmr(500mhz,dmso)δ10.10(s,1h),10.04(s,1h),8.18(s,1h),7.81(d,j=8.9hz,1h),7.69(d,j=8.6hz,2h),7.64(dd,j=8.9,5.0hz,2h),7.19
–
7.08(m,5h),6.79(d,j=2.7hz,1h),4.19(t,j=8.0hz,2h),4.01(dd,j=9.1,5.0hz,2h),3.60(t,j=4.5hz,4h),3.35(s,1h),2.36(s,4h),1.47(s,4h)。
[0229]
测试例1:本发明化合物对激酶axl和c-met的酶活性抑制(ic
50
)的评价实验
[0230]
本实验使用mobility shift assay的方法,在axl和c-met激酶上进行化合物的筛选,起始浓度10000nm,3倍稀释,10个浓度,复孔检测。
[0231]
试剂及耗材(表1):
[0232]
表1
[0233]
试剂名称供货商货号批号axlcarna08-10716cbs-0641emetcarna08-15110cbs-1118pkinase substrate 2gl190861p200807-ys190861kinase substrate 22gl112393p200403-cl112393dmsosigmad8418-1lshbg3288v384-well platecorning357312619003
[0234]
仪器:
[0235]
离心机(生产厂家:eppendorf,型号:5430);
[0236]
酶标仪(生产厂家:perkin elmer,型号:caliper ez readerⅱ);
[0237]
echo 550(生产厂家:labcyte,型号:echo 550);
[0238]
酶标仪(生产厂家:perkin elmer,型号:envision)。
[0239]
实验步骤:
[0240]
1)配制1
×
kinase buffer。
[0241]
2)化合物浓度梯度的配制:受试化合物测试浓度为10000nm,3倍稀释,10个浓度,复孔检测;在384source板中稀释成100倍终浓度的100%dmso溶液,3倍稀释化合物,10个浓度。使用分液器echo 550向目的板384孔板转移250nl 100倍终浓度的化合物。
[0242]
3)用1
×
kinase buffer配制2.5倍终浓度的激酶溶液。
[0243]
4)在化合物孔和阳性对照孔分别加10μl的2.5倍终浓度的激酶溶液;在阴性对照孔中加10μl的1
×
kinase buffer。
[0244]
5)1000rpm离心30秒,反应板振荡混匀后室温孵育10分钟。
[0245]
6)用1
×
kinase buffer配制5/3倍终浓度的atp和kinase substrate的混合溶液。
[0246]
7)加入15μl的5/3倍终浓度的atp和底物的混合溶液,起始反应。
[0247]
8)将384孔板1000rpm离心30秒,振荡混匀后室温孵育相应的时间。
[0248]
9)加入30μl终止检测液停止激酶反应,1000rpm离心30秒,振荡混匀。
[0249]
10)用caliper ez reader读取转化率。
[0250]
11)采用分析软件graphpad prism 5的log(inhibitor)vs.response-variable slope拟合量效曲线,从而得出各个化合物对酶活性的ic50值。
[0251]
本发明化合物对激酶axl和c-met的抑制活性如下表2。
[0252]
表2
[0253]
[0254][0255]
由上表可知,本发明化合物能够有效地抑制axl和c-met激酶的活性。
[0256]
测试例2:本发明化合物在模型小鼠肿瘤细胞异位移植试验中的体内抗肿瘤活性测试
[0257]
选择18只雌性6-8周龄的nod/scid小鼠,皮下异位接种人白血病细胞系mv4-11株5
×
106个,接种肿瘤细胞18天后,待肿瘤长至90mm3~150mm3时,小鼠灌胃给予待测试样品。
[0258]
将小鼠分为阴性溶剂对照组、本发明化合物组(实施例2化合物)(20mg/kg)和阳性对照卡博替尼组(20mg/kg),每组6只。所有剂量组均采用等体积不等浓度经口每日单次灌胃给药,给药体积为10ml/kg。阴性溶剂对照组给予相同体积的空白溶媒(dmso:solutol:水=1:2:7),给药频率为每天一次,连续给药14天。
[0259]
开始给药后,每周测量两次小鼠的体重和肿瘤的大小。肿瘤大小计算公式:
[0260]
肿瘤体积(mm3)=0.5
×
(肿瘤长径
×
肿瘤短径2)。
[0261]
抗肿瘤疗效是基于治疗中肿瘤的生长曲线(即每次测量的肿瘤体积相对于其治疗天数)和相对瘤体积来评估。其中相对肿瘤抑制率(tgi)按下列公式计算:
[0262]
相对肿瘤抑制率tgi(%):tgi%=(1-t/c)
×
100%。
[0263]
t/c%为相对肿瘤增值率,即在某一时间点,治疗组和对照组相对肿瘤体积或瘤重的百分比值。t和c分别为治疗组和对照组在某一特定时间点的相对肿瘤体积(rtv)或瘤重(tw)。计算公式如下:t/c%=t
rtv
/c
rtv
×
100%(t
rtv
:治疗组平均rtv;c
rtv
:溶媒对照组平均rtv;rtv=vt-v0,v0为分组时该动物的瘤体积,vt为治疗后该动物的瘤体积)。或t/c%=ttw/ctw
×
100%(ttw:治疗组试验终结时平均瘤重;ctw:溶媒对照组试验终结时平均瘤重)。
[0264]
图1显示本发明化合物组、溶剂对照组和阳性对照组小鼠肿瘤体积的生长变化。如图所示,本发明化合物能够有效抑制肿瘤细胞在模型小鼠体内的生长,相对肿瘤抑制率(tgi)以瘤重计为106%,高于阳性对照卡博替尼的92%。
[0265]
图2显示本发明化合物组、溶剂对照组和阳性对照组小鼠体重随治疗时间的变化。如图所示,荷瘤小鼠在实验过程中体重无明显变化,显示本发明化合物具有良好的安全性和耐受性。
[0266]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0267]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书和附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1