一种烈性噬菌体PSA-Pe及其应用的制作方法
一种烈性噬菌体psa-pe及其应用
技术领域
1.本发明涉及微生物学领域,具体是一种烈性噬菌体psa-pe及其应用,是一种以丁香假单胞菌猕猴桃致病型为寄主的烈性噬菌体。
背景技术:
2.猕猴桃溃疡病在世界各猕猴桃产区均有发生。尽管各地病原菌的来源不同,但基因组序列分析表明,其病原菌均是假单胞菌属(pseudomonas)丁香假单胞菌,为革兰氏阴性细菌,病原菌发病状况与其宿主植物密切相关。因此,研究不同种植区溃疡病发病规律,开发高效抑菌制剂,尤其是生物制剂,有效控制溃疡病的发生具有现实的紧迫性和必要性。
3.植物细菌病害的防治是世界性难题,传统上,采用以化学农药为主,连同轮作及种植抗病品种,但都不能有效控制该病害。而化学农药防治以抗生素和农用链霉素为主,不仅很难达到在植物组织内部繁殖的细菌,而且长期或大量使用容易引起细菌产生抗(耐)药性,产生超级细菌,还会因为农药残留带来环境污染和食品安全性问题。因此,探索一种新型、有效的生物防治方法——“噬菌体疗法”成为近年来研究的热点。
4.噬菌体应用于细菌性疾病或病害的防治可以追溯到二十世纪初,然而伴随着高效抗生素的发现和广泛应用,噬菌体疗法在相当长的时间里被忽略。1915年英国的twort首次在葡萄球菌中发现了噬菌体。噬菌体是侵染细菌、放线菌等微生物的病毒,是迄今地球上数量最多的微生物,其数目是细菌的10倍。噬菌体通过捕获细菌来维持自然界中微生态的平衡。根据与细菌寄主的关系,噬菌体可分为烈性噬菌体及温和性噬菌体。前者又称毒性噬菌体,是细菌的天然“杀手”,能在特异性宿主菌细胞内复制增殖,产生许多子代噬菌体,并裂解细菌,其子代噬菌体可以再度侵染新的宿主菌,进一步杀灭宿主菌。由于毒性噬菌体具有自然裂菌和追踪杀菌的天然特性,且对植物没有毒性,筛选细菌性病害的相应毒性噬菌体,将可应用于作物细菌性病害的生物防治。
5.二十世纪末,细菌的耐药性使得抗生素防治细菌病变得越来越困难。据报道,目前美国75%的细菌感染对一种或多种抗生素会产生耐药性,由于抗生素的滥用导致耐药菌种的不断出现,抗生素的治疗效果日趋下降,特别是“超级细菌”的出现,而新型抗生素的研发速度远远低于细菌克服抗生素产生抗性的速度,使得噬菌体的应用重新登上历史舞台。
6.与目前普遍使用的细菌病害防控方式相比,噬菌体具有以下优势:1)特异性强:只针对目标病原菌群,不会对环境中其他微生物产生影响,具有较好的生态安全性;2)高效:在适宜条件下,噬菌体一个裂解周期可产生200个子代,噬菌体将以200n的速度进行增殖,利用噬菌体进行防治时只需少量即可;3)具有自我复制的局限性:只要环境中存在寄主细菌时它们便通过感染寄主细胞启动自我复制模式,而无寄主细菌存在时则降解;4)对真核细胞无毒;5)不受细菌多重耐药性的影响,可有效防控耐药性细菌引起病害;6)细菌很难对噬菌体产生抗性:细菌对抗生素产生的抗性突变率为10-6
,而对噬菌体的抗性突变率为10-7
,抗生素和噬菌体联合用药的突变率为10-13
,且噬菌体会产生适当的变异以适应宿主菌的变异;7)研制开发的周期短,可以在4℃下保存数月,效价也无显著降低;8)可随细菌运动到
达植物组织内部,起到其它药剂无法防治的效果。
7.一种噬菌体只能感染一种细菌,而一种细菌可以被不同噬菌体侵染。因此,可以分离、检验不同杀菌效果的噬菌体,并联合应用于目标菌群;利用噬菌体的特异性和分型,实现植物、食物及环境中病原菌的噬菌体快速检测。噬菌体在植物细菌性病害研究中被分离和利用也不乏非常成功的例子。例如,马铃薯黑胫病、棉花黑枝病、玉米细菌性枯腐病、桃细菌性穿孔病、烟草青枯病、以及苹果、梨、木莓的梨火疫病等的噬菌体分离、防治中取得良好效果。
技术实现要素:
8.本发明具有两个主要目的:一是提供一种烈性噬菌体psa-pe,二是提供一该烈性噬菌体psa-pe的具体应用,以弥补现有技术的不足。
9.一种烈性噬菌体psa-pe,该烈性噬菌体psa-pe于2020年7月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:cgmcc no.18920。保藏地址:北京市朝阳区北辰西路1号院3号。建议的分类命名:假单胞菌噬菌体phi6(pseudomonas phage phi6);
10.所述烈性噬菌体psa-pe是一株能特异地裂解丁香假单胞菌猕猴桃致病型的囊状病毒科无尾噬菌体,呈球形,且有球形的头部,无尾部结构,直径和长度为84
±
5nm;潜伏期为75分钟,裂解期为35分钟,爆发量大小为223,在感染噬菌体后90-100分钟达到稳定期;在ph7-8,4-37℃条件下,噬菌体的存活率最高,所述噬菌体在自然温度、ph值和uv-b照射条件下活性持续非常稳定。
11.所述噬菌体是一株能适应复杂果园环境的烈性噬菌体。
12.所述噬菌体能够用于裂解丁香假单胞菌猕猴桃致病型致病菌psa。
13.所述噬菌体能够用于植物、食物和环境的丁香假单胞菌猕猴桃致病型快速检测和鉴定。
14.所述的烈性噬菌体psa-pe的制备方法,包括如下步骤:
15.(1)猕猴桃溃疡病菌噬菌体的分离
16.将分离的psa菌液作为宿主转入20ml lb培养液中,25℃,150rpm/min振荡培养16h小时。将培养好的psa培养液与污水或土壤样品混合后,取200ul混合物加入准备好的10ml34-36℃半固体培养基,迅速倒在提前冷却好的薄层固体培养基上,25℃下培养,双层平板法分离噬菌体。
17.(2)纯化、效价测定和保存:挑取单个噬菌斑接种,稀释后,双层平板再培养,噬菌斑统计,进行噬菌体的纯化和效价测定。纯化后的噬菌体可直接将双层平板倒置于4℃冰箱进行短时间保存,如果需要长时间保存噬菌体液,可按1:1体积比加入30%的灭菌甘油,充分混匀,密封,置-80℃保存,并定期对噬菌体复苏。
18.所述噬菌体能够用于丁香假单胞菌猕猴桃致病型细菌的药物制备中,尤其是psa引起病症的药物的制备中。
19.此外,所述的噬菌体在较大的ph范围、温度和自然的紫外条件下都能保持活性,说明可以用于猕猴桃果园复杂气候环境下的溃疡病害防治。
20.本发明的优点和技术效果:
21.本发明提供的噬菌体特异性强,有较强的环境适应能力,能够应用于由丁香假单胞菌猕猴桃致病型所引起的植物细菌性病害的防治中,并具有明显的优势:
22.(1)效果显著:在适宜条件下,噬菌体一个裂解周期可产生200个子代,噬菌体将以200n的速度进行增殖,利用噬菌体进行防治时只需少量即可,并且可随细菌运动到达植物组织内部,起到其它药剂无法防治的效果;
23.(2)特异性强:能特异地杀灭病原菌,作用时间快,持续时间久;
24.(3)细菌很难对噬菌体产生抗性:不受细菌多重耐药性的影响,可有效防控耐药性细菌引起病害,细菌对抗生素产生的抗性突变率为10-6
,而对噬菌体的抗性突变率为10-7
,抗生素和噬菌体联合用药的突变率为10-13
,且噬菌体会产生适当的变异以适应宿主菌的变异;
25.(4)绿色环保:只针对目标病原菌群,不会对土壤和植株等环境中其他正常微生物产生影响,且具有自我复制的局限性,即只要环境中存在寄主细菌时它们便通过感染寄主细胞启动自我复制模式,而无寄主细菌存在时则降解,具有较好的生态安全性,对真核细胞无毒,不影响植株的正常生理代谢;
26.(5)成本较低:本发明涉及的噬菌体从自然界中获得,数量庞大,来源广,容易分离获得,研发生产周期短,属于天然生物,能自我复制,可以在4℃下保存数月,效价也无显著降低,因此,作为治疗及预防生物制剂可降低成本低;
27.(6)作为丁香假单胞菌猕猴专化型,可用于植物、食物和环境中病原菌的快速检测。
附图说明
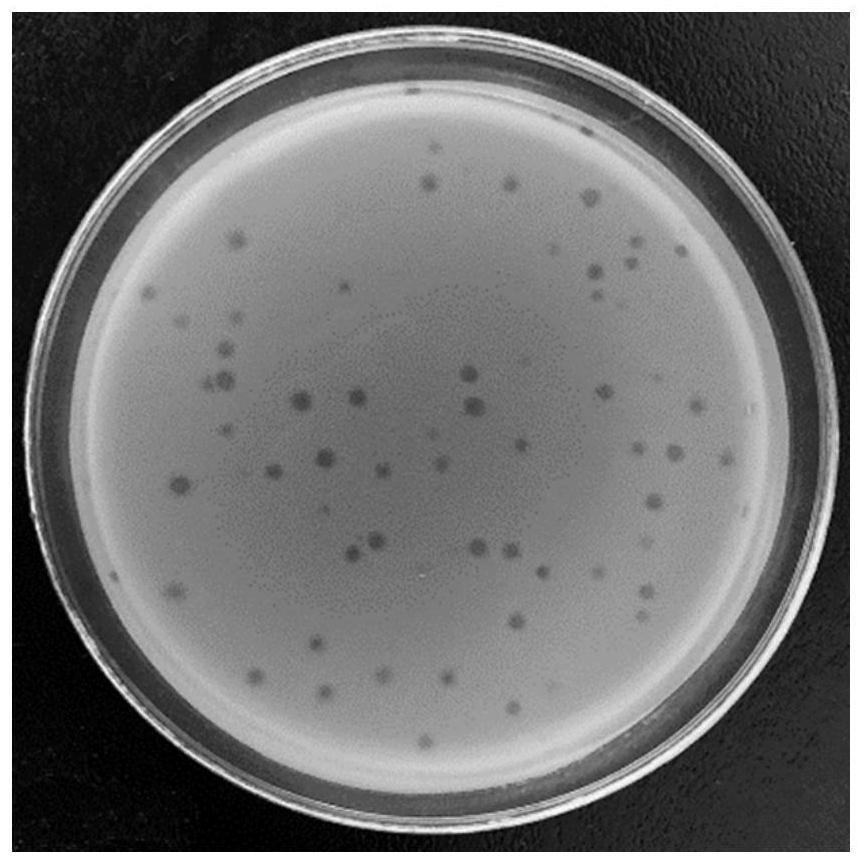
28.图1为本发明中分离噬菌体时双层平板培养中的噬菌斑。
29.图2为本发明中噬菌体的透射电镜图像。
30.图3为本发明中噬菌体的生长曲线。
31.图4为本发明中噬菌体在不同温度下的活性曲线。
32.图5为本发明中噬菌体在不同ph值下的活性曲线。
33.图6为本发明中噬菌体在不同紫外条件下的活性曲线。
具体实施方式
34.下面将结合附图和实施例对本发明的技术方案进行清楚、完整地解释和说明,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.实施例1
36.本实施例为本发明所述的烈性噬菌体psa-pe的制备方法,包括如下步骤:
37.(1)猕猴桃溃疡病菌噬菌体的分离、纯化和效价测定
38.将分离的psa菌液作为宿主转入20ml lb培养液中,25℃,150rpm/min振荡培养16h小时。取上述摇好的psa培养液,与污水或土壤样品混合后,取200ul混合物加入10ml半固体培养基,提前将半固体培养基置于水浴锅中,保持其温度在34-36℃。迅速倒在提前冷却好
的薄层固体培养基上,即采用双层平板法分离噬菌体,在25℃下培养16h后观察有无噬菌斑形成。
39.培养16h后若在双层平板上观察到清晰的噬菌斑,挑取单个噬菌斑接种于200ul对数期宿主菌液中,置于25℃培养箱,150rpm/min振荡培养12h后于12,000rpm离心3min,获得上清液便是分离一个噬菌体得到的纯培养液。将使用0.22um孔径一次性过滤器过滤后的噬菌体纯培养液用lb培养液作10倍梯度稀释,每个稀释度吸取100ul与200ul psa菌液混合加入到20ml lb培养液中,采用双层平板法计数测定效价。
40.噬菌体的保存:短时间保存可直接将双层平板倒置于4℃冰箱保存,固定时间取出进行噬菌体活化。长期保存时,在无菌条件下,向2ml无菌保藏管中加入纯化后的噬菌体培养液并与甘油按体积比1:1混合,充分混匀,密封,置-80℃保存,定期对噬菌体进行复苏。
41.噬菌体的电镜形态观察
42.将含有浓缩噬菌体的溶液放置在铜网上,并添加ph=4.0的2%醋酸铀酰水溶液,对噬菌体粒子负染20s。用jem 1200ex透射电子显微镜观察纯化的噬菌体,用设备照相机扫描图像,如见图2所示。可以看出该噬菌体的结构为球形,且只有球形头部,无尾部结构,根据国际病毒分类委员会的指南可知,该噬菌体属于无尾噬菌体,其形态是囊状病毒科成员的典型形态,直径和长度为92
±
5nm。
43.生长特性实验
44.最佳感染复数moi的测定
45.首先,通过测定对数期生长的宿主菌的od
600
值,以及梯度稀释培养计数菌斑,建立菌液的od
600
值与其对应浓度的关系。再通过噬菌体的稀释和双层平板培养计数噬菌斑,确定噬菌体的浓度,计算噬菌体效价。确定噬菌体纯化或杀菌试验的最佳moi为1,对应的效价是2.32
±
0.24
×
10
12
pfu/ml,最佳感染复数可以明显提高噬菌体的子代裂解量,提升了滴度的数量级。
46.一步生长曲线的测定
47.为研究噬菌体的生长动力学,按照moi为1的比例将5ml噬菌体培养液添加到等量宿主psa细菌培养物中,置于25℃振荡培养5min,将混合物8,000rpm离心30s,倒掉上清液,用lb培养液洗涤管底沉淀2次。再将菌体颗粒重悬于10ml的lb中,150rpm/min,25℃振荡培养;每隔15min取样300ul,双层平板测定噬菌体效价,共150min,三次重复,取平均值,并设置不加噬菌体的psa培养液和噬菌体置于同等条件下培养为对照。以感染宿主菌的时间为横坐标,噬菌体效价的对数值作为纵坐标,得到的一步生长曲线,见图3,可以看出,该噬菌体的潜伏期分别为75min,裂解期为35min,爆发量大小分别为150。在感染噬菌体后90-100min达到稳定期。
48.致病菌的快速检测和鉴定
49.通过植物组织、食物或环境的取样,样品粉碎后或直接与无菌水搅拌,水样中细菌常规分离培养。将挑取的单菌落纯化培养后,取备存的moi为1的噬菌体psa-pe 200μl与5ml与分离纯化细菌混和,25℃双层平板培养。观察噬菌斑的产生和计数,根据噬菌斑的有无及数量,判断供试样品中有无丁香假单胞菌猕猴桃致病型以及含量的高低,实现病原菌的快速检测和鉴定,为病害发生提供预测预警。
50.实施例2
51.本实施例为本发明所述的烈性噬菌体psa-pe的稳定性实验,包括如下步骤:
52.(1)热稳定性
53.为了评价噬菌体在不同温度下的稳定性,实验在ph值为7.0的无菌lb中进行。把待测噬菌体分别4℃,25℃,37℃和50℃放入水浴锅处理,并分别于0h,3h,6h,12h,24h取样,处理后的样品立即置于冰浴中冷却,用lb培养液进行梯度稀释,通过双层平板法测得噬菌体效价,置于25℃培养箱培养16h,各时间点均做三个重复取平均值。
54.通过对平板上的噬菌斑计数,得出噬菌体效价,如图4所示,该噬菌体在4℃和25℃下储存24小时,浓度降低小于0.16lg pfu/ml,当温度升高到37℃时,实验噬菌体的最大灭活量为0.16lg pfu/ml,实验噬菌体在50℃时的最大灭活量为1.06lg pfu/ml,这意味着即使偶尔出现高温,也不会对噬菌体的存活产生很大影响。因此,该噬菌体psa-pe在4-37℃下比较稳定。
55.(2)ph稳定性
56.为了评估噬菌体的ph稳定性,配置ph梯度为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的lb培养液,分别取4.5ml置于25℃恒温培养箱中,待温度平衡后分别加入0.5ml噬菌体培养液,处理2h后用双层平板法测定噬菌体效价,以检测其活性的变化。各处理均做三个重复取平均值。
57.如图5所示,当噬菌体psa-pe浓度存在于不同ph值下测试时,观察到在偏酸性和偏碱性条件下噬菌体浓度都略有下降,但在ph范围为7到8之间存活率最高,相对稳定。
58.(3)紫外线稳定性
59.噬菌体液离心后稀释至109pfu/ml,分装离心管,将离心管置于20w,50cm、700mw/m2规格的uv-b紫外灯下方30cm处做直射处理,分别于0min,5min,15min,25min,50min收集处理后的噬菌体培养液,置暗处30min平衡,用lb培养液进行梯度稀释后测噬菌体效价,置于25℃培养箱培养16h,各组均做三个重复取平均值。
60.通过平板噬菌斑计数,得出效价,绘制噬菌体效价随时间变化曲线图,见图6,可知,噬菌体在uv-b灯照射下,时间越长,效价越低,5min内活性下降明显,15min时出现拐点,获得一定抗性,但噬菌体浓度下降只有0.61lg pfu/ml,在uv-b辐射下比较稳定。
61.总之,所述噬菌体psa-pe在自然温度、ph值和uv-b照射条件下活性持续,非常稳定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1