喹唑啉衍生物及其制备方法和应用与流程
1.本发明属于新化合物领域,具体涉及喹唑啉衍生物及其制备方法和应用。
背景技术:
2.表皮细胞生长因子受体(egfr)是一个巨大的跨膜糖蛋白,分子量约为180kda,具有配体诱导的酪氨酸蛋白激酶活性,它是erbb这个保守的受体家族的一个成员,这个家族的其他成员包括her2/neu/erbb2,her3/erbb3和her4/erbb4。erbb受体的共同特征是:包含一个胞外(ec)配体结合区,是由两个重复的富含半胱氨酸的区域组成的单一跨膜区,以及含有酪氨酸蛋白激酶和自身磷酸化位点的胞内序列。当与配体结合后,受体二聚化,这对于改变配体和受体间的高亲和力状态以及受体在分子间传递磷酸化信号都至关重要。至于形成同二聚体,还是异二聚体,则取决于这四种受体的相对水平以及活化的配体。其中egfr和her2与多种肿瘤的发生发展密切相关,基础和临床研究较多。
3.研究表明在许多实体肿瘤中存在egfr的高表达或异常表达。egfr与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。其可能机制有:egfr的高表达引起下游信号传导的增强;突变型egfr受体或配体表达的增加导致egfr的持续活化;自分泌环的作用增强;受体下调机制的破坏;异常信号传导通路的激活等。egfr的过表达在恶性肿瘤的演进中起重要作用,胶质细胞、肾癌、肺癌、前列腺癌、胰腺癌、乳腺癌等组织中都有egfr的过表达。对胶质细胞瘤的研究发现egfr的高表达主要与其基因扩增有关。但有时egfr表达水平的调节异常也存在于翻译及翻译后。egfr在肿瘤中的高表达还可能与活化后降解减少有关,一些研究指出c-src可通过抑制受体泛素化和内吞作用而上调egfr水平。许多肿瘤中有突变型egfr存在,现已发现许多种egfr突变型。突变型egfr的作用可能包括:具有配体非依赖型受体的细胞持续活化;由于egfr的某些结构域缺失而导致受体下调机制的破坏、异常信号传导通路的激活、细胞凋亡的抑制等。突变体的产生是由于egfr基因的缺失、突变和重排。egfr的配体对细胞内信号传导有很大影响。egfr的配体通过自分泌形式激活egfr促进细胞增殖,他们的共表达往往预示肿瘤预后不良,例如,在乳腺浸润性导管癌的研究中发现,tgfα与egfr共表达,且这种共表达与病人的生存率显著相关。kopp等人对结/直肠癌的研究表明肿瘤的自分泌生长是egfr的过表达及其配体表达共同作用的结果。
4.人表皮生长因子受体-2(her2)是迄今为止乳腺癌中研究较为透彻的基因之一,于20世纪80年代分别由三个研究小组独立发现。her2基因的过表达不仅与肿瘤的发生发展相关外,还是一个重要的临床治疗监测及预后指标,并且是肿瘤靶向治疗药物选择的一个重要靶点。血清her2与组织学her2、乳腺癌患者的肿瘤负荷、淋巴结状况均有一定关联,并可能对化疗或内分泌治疗疗效产生一定影响,可能是一个独立的预后因素。her2癌基因的致瘤机制是抑制凋亡,促进增殖;增加肿瘤细胞的侵袭力;促进肿瘤血管新生和淋巴管新生。her2蛋白通常只在胎儿时期表达,成年以后只在极少数组织内低水平表达。然而有研究表明30%以上的人类肿瘤中存在her2基因的扩增/过度表达(如乳腺癌、卵巢癌、子宫内膜癌、输卵管癌、胃癌和前列腺癌等);其中20%-30%的原发性浸润性乳腺癌有her2基因的扩
增/过度表达。her2基因扩增是影响乳腺癌生长与转移的最重要的因素之一。在大约30%的乳腺癌中可出现her2基因过度表达,并与患者预后较差相关。her2过度表达的乳腺癌患者病情进展迅速,化疗缓解期短,内分泌治疗效果差,无病生存和总生存率低。her2的含量可作为一个独立的强有力的预后指标,尤其对那些腋窝淋巴结阳性的乳腺癌患者它甚至比常用的一些肿瘤指标更有说服力。her2扩增阳性的乳腺癌具有一些特殊的生物学和临床特征,例如组织学分级更差、低er、pr水平、更多的非整倍体、更倾向于转移至中枢神经系统和内脏、内分泌治疗无效、肿瘤的增殖指数更高、对阿霉素敏感等。
5.尽管市面上具有很多靶向抑制egfr的小分子抑制剂,但是活性和安全性都具有各种问题,造成临床治疗效果不佳或者患者不耐受的情况。因此,临床依然需要开发更多的egfr抑制剂来满足不同病人的临床用药需求。
技术实现要素:
6.本发明的目的是解决现有技术的不足,发明人在研究的过程中发现了一种喹唑啉衍生物,其具有极强的egfr的抑制作用,比现有egfr小分子抑制剂的活性都要强。且通过herg实验,发现该化合物无心脏毒性风险。在临床前的动物荷瘤模型上的评价的结果显示,该化合物在实验动物模型上具有很好的耐受性,相对于阳性药物来说,对包括肺癌在内的多种肿瘤显示出更强效的抑制作用。
7.该喹唑啉衍生物的结构如下所示:
[0008][0009]
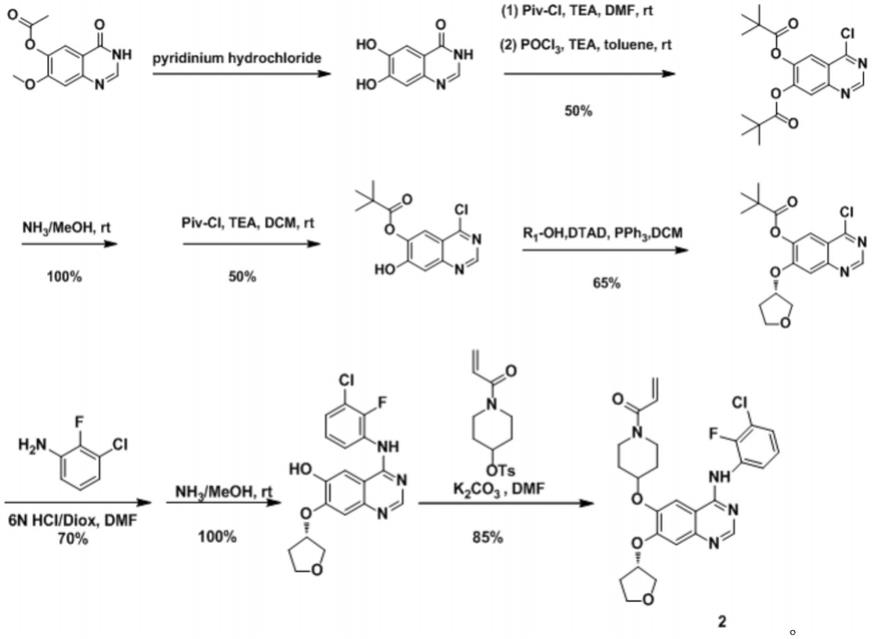
本发明还提供了上述喹唑啉衍生物的制备方法,其合成路线如下:
[0010][0011]
上述喹唑啉衍生物或其溶剂合物、可药用盐可用于制备治疗和/或预防癌症的药物。其中,所述癌症为具有表皮生长因子受体异常激活的癌症。具体为表皮生长因子受体异常的肺癌、胰腺癌、乳腺癌、头颈癌、结直肠癌、胃癌或脑胶质瘤。
[0012]
本发明的有益效果为:本发明的喹唑啉衍生物相比于现有药物对egfr具有更强的抑制活性,无心脏毒性风险。在临床前的动物荷瘤模型上的评价的结果显示,该化合物在实验动物模型上具有很好的耐受性,相对于阳性药物来说,对包括肺癌在内的多种肿瘤显示出更强效的抑制作用。
附图说明
[0013]
图1所示为化合物2的核磁谱图。
具体实施方式
[0014]
以下将结合实施例和附图对本发明的构思及产生的技术效果进行清楚、完整的描述,以充分地理解本发明的目的、方案和效果。
[0015]
实施例1:
[0016]
化合物2的合成与表征:
[0017][0018]
(1)化合物1a的合成
[0019]
将过量的吡啶盐酸盐(55.8g,483mmol)的混合物于电热套加热,待固体全部溶解以后,将3,4-二氢-7-甲氧基-4-氧代喹唑啉-6-醇乙酸酯(2.00g,8.05mmol)缓慢加入反应器中,于120℃反应4h。反应完成后,反应液冷却,加入少量水并用氨水调至ph=7,产品析出。后将反应液抽滤,所得滤饼先用少量清水洗后用乙醚洗涤,得化合物1a(棕色固体,1.20g,84%)。
[0020]
其检测结果为:1h nmr(400mhz,dmso-d6)δ10.23(s,1h),9.84(s,1h),7.91(s,1h),7.39(s,1h),6.98(s,1h).
13
c nmr(100mhz,dmso-d6)δ160.4,152.9,146.5,143.7,143.4,115.4,111.4,109.6.hrms(esi):m/z calculated for c8h6n2nao
3+
:201.0271,found 201.0273。
[0021]
(2)化合物1b的合成
[0022]
将化合物1a(3.00g,16.2mmol),三乙胺(4.94g,48.8mmol)溶解在n,n-二甲基甲酰胺中,0℃下滴加三甲基乙酰氯(5.89g,48.8mmol),升至室温继续反应3h。反应完成后用饱和氯化钠洗(48.0ml),乙酸乙酯萃取(10.0ml),有机相干燥浓缩,柱层析纯化(二氯甲烷:甲醇=40:1至25:1)得化合物3(黄色固体,4.00g,71%)。后将化合物(3.00g,16.2mmol),三乙胺(2.07g,20.4mmol)溶解在甲苯中,0℃下缓慢滴加三氯氧磷(2.74g,17.8mmol)),升至40℃继续反应4h。反应完成后用饱和碳酸氢钠溶液淬灭反应(40.0ml),乙酸乙酯萃取(300ml),有机相干燥浓缩,柱层析纯化(石油醚:乙酸乙酯=8:1至5:1)得化合物1b(黄色固体,1.36g,73%)。
[0023]
其检测结果为:1h nmr(400mhz,cdcl3)δ9.01(s,1h),8.03(s,1h),7.89(s,1h),1.41(d,j=5.0hz,18h).
13
c nmr(100mhz,cdcl3)δ175.4,171.0,161.4,153.9,153.9,149.5,149.4,144.0,122.0,118.8,39.4,39.3,27.2,27.2,27.2,27.1,27.1,27.1.hrms
(esi):m/zcalculated for c
18h21
cln2nao
4+
:387.1082,found 387.1083。
[0024]
(3)化合物1c的合成
[0025]
将化合物1b(1.00g,2.81mmol)溶解在甲醇中,0℃下加入4m的氨水甲醇溶液(30.0ml),升至室温继续反应1h。反应完成后将反应液旋干备用。将上述反应所得的粗品,溶解在二氯甲烷中,后加入三乙胺(849mg,8.40mmol)0℃下缓慢滴加三甲基乙酰氯(405mg,3.36mmol),升至室温继续反应30min。反应完成后用1n hcl(10.0ml)洗,二氯甲烷(5.00ml)萃取,有机相干燥浓缩,柱层析纯化(二氯甲烷:甲醇=60:1至30:1)得化合物1c(黄色固体,350mg,44%)。
[0026]
其检测结果为:1h nmr(400mhz,cdcl3)δ8.84(s,1h),7.77(s,1h),7.24(s,1h),1.42(s,9h).
13
c nmr(100mhz,cdcl3)δ176.4,161.6,156.9,153.4,149.4,142.9,118.6,118.4,109.9,39.4,27.2,27.2,27.1.hrms(esi):m/z calculated for c
13h13
cln2nao
5+
:303.0507,found 303.0508。
[0027]
(4)化合物1d的合成
[0028]
将化合物1c(1.00g,2.81mmol)溶解在干燥的二氯甲烷(23ml)中,加入三苯基膦(2.08g,7.94mmol),(r)-(-)-3-羟基四氢呋喃(235mg,2.67mmol)。然后在0℃,氩气保护下,滴加偶氮二甲酸二叔丁酯(615mg,2.67mmol)。滴加完毕后,缓慢升至室温继续反应1h。反应完成后用饱水溶液淬灭反应(40.0ml),乙酸乙酯萃取(300ml),柱层析纯化(二氯甲烷:甲醇=45:1至30:1)得化合物1d(白色固体,160mg,51%)。
[0029]
其检测结果为:1h nmr(400mhz,cdcl3)δ8.95(s,1h),7.87(s,1h),7.35(s,1h),5.19-5.09(m,1h),4.09-3.87(m,4h),2.36-2.16(m,2h),1.41(s,9h).
13
c nmr(100mhz,cdcl3)δ176.2,160.8,155.8,154.1,151.2,143.3,119.0,118.6,109.1,79.2,72.7,67.1,39.2,32.6,27.2,27.2,27.2.hrms(esi):m/z calculated for c
17h19
cln2nao
4+
:373.0926,found 373.0928。
[0030]
(5)化合物2e的合成
[0031]
将化合物1d(110mg,0.313mmol),3-氯-2-氟苯胺(54.0mg,0.376mmol)溶解在n,n-二甲基甲酰胺(3.00ml)中,然后在0℃下,缓慢滴加6n hcl和1,4-dioxane溶液,缓慢升至80℃继续反应1h。反应完成后用饱和nahco3(10.0ml)洗,乙酸乙酯(10.0ml)萃取,有机相干燥浓缩,柱层析纯化(石油醚:乙酸乙酯=3:1)得化合物2e(黄色固体,196mg,60%)。
[0032]
其检测结果为:1h nmr(400mhz,cdcl3)δ8.69(s,1h),8.43(ddd,j=10.2,7.6,3.6hz,1h),7.57(d,j=6.5hz,2h),7.16(s,1h),7.15-7.12(m,2h),4.95-4.91(m,1h),4.02-3.88(m,4h),2.22-2.07(m,2h),1.41(s,9h).
13
c nmr(100mhz,cdcl3)δ176.8,156.4,154.8,153.9,150.8,150.06,148.3,141.1,132.0,124.9,124.5,121.6,114.3,109.9,109.1,78.7,72.8,67.1,39.2,32.6,27.3,27.2,27.2.hrms(esi):m/z calculated for c
23h23
clfn3nao
4+
:482.1253,found 482.1255。
[0033]
(6)化合物2的合成
[0034]
将化合物2e(143mg,0.314mmol)溶解在甲醇中,0℃下加入4m的氨水甲醇溶液(5.00ml),升至室温继续反应1h。反应完成后将反应液旋干备用。将上述反应所得的粗品,碳酸钾(130mg,0.942mmol)溶解在n,n-二甲基甲酰胺中,然后在ar保护下加入1-n-丙烯酰基-4-(4-甲基苯磺酰氧基)哌啶(116mg,0.377mmol),升至70℃继续反应7h。反应完成后用
饱和氯化钠洗(3.0ml),乙酸乙酯萃取(10.0ml),有机相干燥浓缩,柱层析纯化(二氯甲烷:甲醇=20:1)得化合物2(白色固体,109mg,64%)。其核磁谱图如图1所示。
[0035]
其检测结果为:1h nmr(400mhz,cdcl3)δ8.67(s,1h),8.30-8.24(m,1h),7.76(s,1h),7.41(s,1h),7.21(s,1h),7.14(q,j=8.2,6.8hz,2h),6.59(dd,j=16.8,10.6hz,1h),6.27(dd,j=16.8,1.8hz,1h),5.69(dd,j=10.6,1.8hz,1h),5.09(d,j=5.4hz,1h),4.67-4.59(m,1h),4.07(d,j=3.4hz,2h),4.02-3.92(m,2h),3.79(p,j=7.0hz,3h),3.55(d,j=13.8hz,1h),2.35(dt,j=14.3,7.4hz,1h),2.23(dt,j=12.9,5.6hz,1h),1.92(d,j=7.8hz,4h).
13
c nmr(100mhz,cdcl3)δ165.6,156.1,154.7,153.8,151.3,148.9,147.6,128.4,128.3,128.0,127.5,125.2,124.5,124.5,122.3,110.1,109.5,78.7,74.7,72.9,67.3,42.5,38.7,33.0,31.4,30.1.
19
f nmr(376mhz,cdcl3)δ-121.1.hrms(esi):m/z calculated for c
26h26
clfn4nao
4+
:535.1519,found 535.1521.5。
[0036]
实施例2:
[0037]
egfr家族酶学测试:
[0038]
利用发光adp检测测定法用于评估化合物的egfr结合能力(adp-glo
tm
激酶测定法,promega)。选择化合物波齐替尼作为阳性对照。用激酶缓冲液(40mm tris-hcl(ph=7.5),0.10%bsa,1mm dtt和20mm mncl2)稀释该激酶,并将部分溶液添加到含有该化合物溶液的384孔板中,并于室温下孵育10分钟。用激酶缓冲液稀释蛋白和atp,然后将不同浓度的药物溶液添加到含有反应溶液的384孔板中,并于室温下孵育10分钟。然后加入10μladp-glo试剂于室温下孵育40分钟,以终止反应并消耗掉过量的atp。加入10μl激酶检测试剂,室温下孵育40分钟,在读取发光信号,计算抑制率。结果如表1所示。可以看到,目前在egfr小分子抑制剂领域,波齐替尼是报道的最强的广谱抑制剂分子。化合物2具有比波齐替尼更强的对各种egfr亚型的抑制活性。
[0039]
表1
[0040][0041]
实施例3:
[0042]
herg蛋白抑制测试:
[0043]
herg蛋白结合试验用来体外评价药物分子潜在的心脏毒性。按照手动膜片钳方法测试小分子药物对herg蛋白的结合能力。采用全细胞膜片钳技术记录herg电流。取细胞悬液加于培养皿中,置于倒置显微镜(nikon ti-fl,japan)载物台上。待细胞贴壁后,用细胞外液灌流。玻璃微电极由微电极拉制仪(narishige pc-10puller,japan)两步拉制,充灌电极内液后其入水电阻值为2-5mω。建立全细胞记录模式后,保持钳制电位为-80mv。给予去极化电压至+60mv持续850ms,然后复极化至-50mv维持1275ms引出herg尾电流。这样一组脉
冲程序每15秒钟重复一次,贯穿整个实验。进行刺激发放及信号采集,膜片钳放大器放大信号。所得到的数据,进一步数据分析和曲线拟合。结果如表2所示。阳性参照物阿法替尼和波齐替尼具有一定的心脏毒性风险,顺铂具有高风险。化合物2体外结果预测无心脏毒风险。
[0044]
表2
[0045][0046]
实施例4:
[0047]
细胞抗增殖实验:
[0048]
本发明采用mtt比色法评价化合物对多种肿瘤细胞的增殖抑制作用。胰酶消化收集对数生长期的肿瘤细胞,用1ml新鲜培养基重悬,然后取少量进行稀释,用血球计数板计算细胞数量。根据细胞生长速度不同,按照3000-5000个/孔的密度将肿瘤细胞接种到96孔板中,然后放置细胞培养箱中培养24h。随后用化合物36处理肿瘤细胞,设置8个浓度,每个浓度设置三个复孔,孵育96h。孵育完成后,每孔加入10μl mtt溶液(5mg/ml),拍打混匀后继续放入细胞培养箱中培养3-4h。孵育完成后,小心地吸空孔板中液体,随后每孔加入100μl dmso溶液。设置酶标仪程序,分别在490nm和570nm处的测定吸光光度值,根据公式计算每个浓度的增殖抑制率,最后用graphpad prism 7软件进行数据处理,计算ic50。结果如表3所示,化合物2相对于波齐替尼来说,对多种肿瘤细胞具有显著增强的抗增殖活性。
[0049]
表3
[0050][0051]
实施例5:
[0052]
动物实验:
[0053]
收集生长状态良好的肿瘤细胞,用1
×
pbs洗涤2次,细胞计数仪计算细胞总数,用1xpbs将细胞液稀释成1*107个/ml。每只小鼠接种细胞量为1
×
106个,取100ul细胞悬浮液接种至小鼠前肢腋窝处。待肿瘤平均体积超过100cm3时(个体间肿瘤体积差异不超过10%),将小鼠随机分组,每组8只。药物每两天口服灌胃给药,100mg/kg。给药结束后,用安乐死的方法处死小鼠,测量肿瘤重量与体积。
[0054]
实验结果如表4所示。egfr抑制剂小分子在多种肿瘤细胞上均能显著抑制肿瘤的增殖。
[0055]
表4
[0056][0057]
以上所述,只是本发明的较佳实施例而已,本发明并不局限于上述实施方式,只要其以相同的手段达到本发明的技术效果,都应属于本发明的保护范围。在本发明的保护范围内其技术方案和/或实施方式可以有各种不同的修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1