一种利用滚环扩增合成纳米酶的方法、纳米酶及其应用与流程
1.本发明属于生物医药领域,涉及一种一种利用滚环扩增合成纳米酶的方法、纳米酶及其应用,具体涉及一种通过对滚环扩增(rca)模板序列及扩增时间设计,调控编码纳米酶中金纳米颗粒的数量及空间间隔,实现调控纳米酶具有类过氧化氢酶催化活性的合成方法。
背景技术:
2.由于易于制造、高稳定性及低成本等特点,具有催化活性的金属纳米颗粒已经被开发作为自然酶的仿生物—纳米酶。比如,金纳米颗粒具有葡萄糖氧化酶和过氧化物酶的催化活性,已经被广泛用于生物传感中信号产生、基于活性氧的杀菌与癌症治疗及纳米机器人中的动力源。金纳米颗粒的催化活性高度依赖其暴露的催化表面,因此,相对于大尺寸纳米颗粒,多个小尺寸纳米颗粒组装形成团簇,具有更大的比表面积,更适合纳米酶的开发。近年来,通过自下而上的自组装构建高度有序的金属纳米颗粒团簇的研究取得了很大进展,然而该方法需要用dna或蛋白等对金属纳米颗粒表面进行高密度修饰,这将覆盖其催化表面,抑制纳米酶的催化活性。现有技术还报道了是利用预先制备的模板进行金属纳米颗粒的原位生长和沉积,这种方法虽然能够保护金属纳米颗粒的催化表面,但无法调控纳米颗粒间的空间间隔,同样影响纳米酶的催化活性。
技术实现要素:
3.本发明的目的是为了解决现有纳米酶合成中纳米颗粒的数量及空间间隔无法调控的问题,提供一种利用滚环扩增dna编码纳米颗粒的数量及空间间隔,以实现催化活性可编程的纳米酶合成方法。
4.本发明的目的之一是提供一种纳米酶,所述纳米酶包括具有周期性重复多聚腺嘌呤茎环单元的单链dna框架,以及在所述单链dna框架的茎环单元上生长的金纳米颗粒。
5.本发明的另一目的是提供如上所述的纳米酶的合成方法,所述方法以具有周期性重复多聚腺嘌呤茎环单元的单链dna框架为模板,以该单链dna框架的茎环单元为生长位点,在其上生长金纳米颗粒,得到所述纳米酶。
6.本发明的另一目的是提供如上所述方法制备得到的纳米酶。
7.本发明的另一目的是提供如上纳米酶在作为过氧化物酶中的应用。
8.本发明相比现有技术具有以下优点:本发明通过对rca模板的序列设计,调控纳米酶中金属纳米颗粒的数量和空间间隔,实现对纳米酶催化活性的可编程调控。同时,相对于传统的基于dna修饰金纳米颗粒构建纳米酶的技术,本发明构建的纳米酶最大程度的暴露了金纳米颗粒的催化表面,表现出更高的过氧化氢酶催化活性。
附图说明
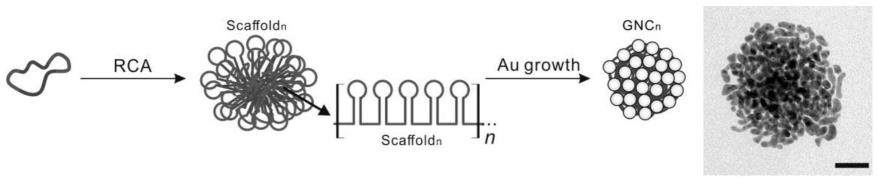
9.图1为本发明制备纳米酶方法的示意图。
10.图2为本发明实施例1中经rca扩增合成的单链dna框架的(a)凝胶电泳成像图、(b)afm成像图及(c)激光共聚焦荧光成像图。
11.图3为本发明实施例1中(a)经rca扩增合成的单链dna框架的afm成像图及(b)高度统计,(c)合成的纳米酶afm成像图及(d)高度统计,(e)不同尺寸单链dna框架与纳米酶的占比对比,(f)单链dna框架与纳米酶的高度对比,(g)纳米酶的tem成像图及(h)元素分布分析和(i)纳米酶的edx分析结果。
12.图4为本发明实施例1中合成的(a)纳米酶的tem成像图(与图3g相同,仅观察视野不同)、(b)吸收光谱及(c)暗场显微成像图。
13.图5为本发明实施例1中合成的单链dna框架及纳米酶的tmb显色图及化学反应方程式。
14.图6为本发明实施例1中合成的纳米酶催化活性最适ph(a)和最适温度(b)。
15.图7为本发明实施例2中不同合成活性最佳纳米酶的金前驱体浓度得到的纳米酶的紫外光吸收谱(a,下图),tmb显色图(b,上图)以及在652nm处最大吸收峰值散点图(b,下图)。
16.图8为本发明实施例3中调控rca的时间,合成的三种不同序列长度的单链dna框架(scaffold
n-1到3)的afm图(a)、尺寸分布统计图(c),三种不同纳米酶(gnc
n-1到3)的tem成像图(b)、尺寸分布统计图(d)、及米氏方程拟合曲线(e)。
17.图9为本发明实施例3中合成的三种纳米酶(gnc
n-1到3)的催化tmb显色反应的时间动力学光谱吸收曲线。
18.图10为本发明合成的三种单链dna框架1-3(scaffold
n-1到3)的afm成像图(依次为a~c)及纳米酶1-3(gnc
n-1到3)的tem成像图(依次为d~f)。
19.图11为本发明调控生长单元间隔序列长度合成两种纳米酶(gnc
n-3和gnc
n-4)的结构示意图和tem成像图(a)及粒径分布统计图(b)、吸收光谱(c)、tmb光吸收值随时间改变图(d)、米氏方程拟合曲线(e)及gnc
n-3与游离金纳米颗粒(free gnps)和辣根过氧化物酶(hrp)米氏常数的统计图(f)。
20.图12为本发明实施例4中合成的纳米酶-3和纳米酶-4的tem成像图;其中a图为gnc
n-3的tem图,b图为gnc
n-4的tem图(相对于图11a,观察视野更大)。
21.图13为seq id no.1所示的单链dna模板形成的茎环结构示意图。
22.图14为seq id no.2所示的单链dna模板形成的茎环结构示意图。
23.图15为seq id no.3所示的单链dna模板形成的茎环结构示意图。
具体实施方式
24.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
25.本发明人经过无数实验研究,首次提出了一种合成人工纳米酶的新方法,该方法是通过滚环扩增(rca)构建具有周期性重复多聚腺嘌呤(polya)茎环单元的长单链dna框架(下文简称为dna框架),并以该dna框架为模板,以茎环单元为生长位点,通过编码金纳米颗
粒的数量及空间间隔,以此构建催化活性可编程的纳米酶。本发明合成的纳米酶具有可编程的过氧化物酶催化活性,通过调节框架的序列长度及polya单元间隔序列的长度、以及金前驱体的浓度等,可实现对纳米酶催化活性的调控。
26.本发明提供了一种纳米酶,所述纳米酶包括具有周期性重复多聚腺嘌呤茎环单元的单链dna框架,以及在所述单链dna框架的茎环单元上生长的金纳米颗粒。
27.在一些实施方式中,所述单链dna框架的粒径为50-450nm。
28.在一些实施方式中,所述单链dna框架包括(i)连续的a碱基组成的环部、(ii)由(i)的两端的部分序列互补配对形成的茎部,(iii)间隔序列;其中所述(i)和(ii)组成茎环结构;所述a碱基的个数为x,x≥10;形成所述茎部的互补配对的碱基对数为y,y≥2;所述间隔序列的碱基的个数z为3-80nt。
29.其中,对于a碱基,其个数为x,x≥10;可以是10-20,20-30,30-40,40-50,50-60,60-70,70-80,80-100,100以上;优选地,x为10-50;进一步优选地,x为15-30;进一步优选地,x为20。
30.其中,对于形成茎部的互补配对的碱基,其碱基对数为y,y≥2;可以是y≥3,y≥4,y≥5,y≥6,y≥7,y≥8,y≥9,y≥10,y≥11,y≥12;优选地,y为2-30;进一步优选地,y为4-20;进一步优选地,y为4-10。
31.其中,对于间隔序列,其碱基个数为z,z为3-80nt;可以是3-8、8-15、15-20、20-25、25-30、30-35、35-40、40-45、45-50、50-55、55-60、60-65、65-70、70-75、75-80nt;优选地,为4-50nt;进一步优选地,为8-50nt;更进一步优选地,为8nt、21nt、50nt;更进一步优选地,为8nt。
32.在一些优选实施方式中,所述单链dna框架的序列为[ccctaaccctaaccctaacccgcatccgaaaaaaaaaaaaaaaaaaaacggatgc]n、[tctaggccaaaaaaaaaaaaaaaaaaaaggccacgt]n、[cacgactagctctgaacactctacgcatccaaaaaaaaaaaaaaaaaaaacgatgcgacgtgaacctaaccgccttgcact]n,n≥1。其中,n可以是1-10,10-20,20-30,30-40,40-50,50-60,60-70,70-80,80-90,90-100,100-200,200-300,300-400,400-500,500-600,600-700,700-800,800-900,900-1000,1000-1500,1500-2000,2000-3000,3000-4000,4000-5000,5000-6000,6000-7000,7000-8000,8000-9000,9000-10000,10000-20000,20000-50000,50000-100000,大于10000等。本发明中,根据原料的用量,反应时间的控制,酶活性的控制等,能够控制合成的单链dna框架中n的个数。
[0033]
其中所述单链dna框架包含的重复序列分别为seq id no.7~9,即ccctaaccctaaccctaacccgcatccgaaaaaaaaaaaaaaaaaaaacggatgc(seq id no.7),tctaggccaaaaaaaaaaaaaaaaaaaaggccacgt(seq id no.8),gattaccacttctgatacaccttacgcatccaaaaaaaaaaaaaaaaaaaaggatgctctgatacaccttacattcaccact(seq id no.9)。其中包含的颈环结构单元的序列分别选自seq id no.10~12任一,即gcatccgaaaaaaaaaaaaaaaaaaaacggatgc(seq id no.10),ggccaaaaaaaaaaaaaaaaaaaaggcc(seq id no.11),gcatccaaaaaaaaaaaaaaaaaaaaggatgc(seq id no.12)。
[0034]
在一些实施方式中,所述纳米酶具有过氧化物酶催化活性或类过氧化物酶催化活性.
[0035]
在一些实施方式中,所述纳米酶为纳米球、纳米管或纳米棒中的一种或几种。
[0036]
本发明还提供了一种纳米酶的合成方法,所述方法以具有周期性重复多聚腺嘌呤茎环单元的单链dna框架为模板,以该单链dna框架的茎环单元为生长位点,在其上生长金纳米颗粒,得到所述纳米酶。
[0037]
在一些实施方式中,所述单链dna框架的粒径为50-450nm。
[0038]
在一些实施方式中,所述单链dna框架包括(i)连续的a碱基组成的环部、(ii)由(i)的两端的部分序列互补配对形成的茎部,(iii)间隔序列;其中所述(i)和(ii)组成茎环结构;所述a碱基的个数为x,x≥10;形成所述茎部的互补配对的碱基对数为y,y≥2;所述间隔序列的碱基的个数z为3-80nt,优选地,为8-50nt。
[0039]
其中,对于a碱基,其个数为x,x≥10;可以是10-100;进一步优选地,为10-80;进一步优选地,为10-50;进一步优选地,为20-40;更进一步优选地,为20。
[0040]
其中,对于形成茎部的互补配对的碱基,其碱基对数为y,y≥2;可以是y≥3,y≥4,y≥5,y≥6,y≥7,y≥8,y≥9,y≥10,y≥11,y≥12;优选地,y为2-30;进一步优选地,y为4-20;进一步优选地,y为4-10。
[0041]
其中,对于间隔序列,其碱基个数为z,z为3-80nt;可以是3-8、8-15、15-20、20-25、25-30、30-35、35-40、40-45、45-50、50-55、55-60、60-65、65-70、70-75、75-80nt;优选地,为4-50nt;进一步优选地,为8-50nt;更进一步优选地,为8nt、21nt、50nt;更进一步优选地,为8nt。
[0042]
在一些优选实施方式中,所述单链dna框架的序列为[ccctaaccctaaccctaacccgcatccgaaaaaaaaaaaaaaaaaaaacggatgc]n、[tctaggccaaaaaaaaaaaaaaaaaaaaggccacgt]n、[gattaccacttctgatacaccttacgcatccaaaaaaaaaaaaaaaaaaaaggatgctctgatacaccttacattcaccact]n,n≥1。其中所述单链dna框架包含的重复序列分别为seq id no.7~9,即ccctaaccctaaccctaacccgcatccgaaaaaaaaaaaaaaaaaaaacggatgc(seq id no.7),tctaggccaaaaaaaaaaaaaaaaaaaaggccacgt(seq id no.8),gattaccacttctgatacaccttacgcatccaaaaaaaaaaaaaaaaaaaaggatgctctgatacaccttacattcaccact(seq id no.9)。
[0043]
在一些实施方式中,所述单链dna框架通过滚环扩增获得;
[0044]
在一些实施方式中,所述生长金纳米颗粒的步骤包括:将所述单链dna框架与金前驱体,在还原剂的作用下进行还原反应,使得金单质在所述单链dna框架的茎环单元上进行生长。所述反应的机理为,溶液中游离态的金前驱体易富集在polya茎环结构上,在还原剂的作用下,金前驱体被还原成零价金,进而在特定的茎环结构上形成单质金纳米颗粒;通过反应条件的调控,最终合成所述的纳米酶。
[0045]
在一些实施方式中,所述滚环扩增获得单链dna框架的步骤包括:孵育包括环状dna模板、dna聚合酶、dntps、缓冲液的混合溶液,进行滚环扩增,获得所述单链dna框架;
[0046]
在一些实施方式中,所述金前驱体为氯金酸溶液。
[0047]
在一些实施方式中,所述还原剂为弱还原剂;优选地,选自柠檬酸三钠、抗坏血酸、盐酸羟胺中的一种或几种;进一步优选地,为柠檬酸三钠。本发明采用弱还原剂对金前驱体进行还原反应,可以控制金单质生成的速度,以及在茎环单元上生长的速度和生成的纳米酶的结构和活性。若还原剂的还原性太强,容易在溶液中随机形成杂质金纳米颗粒,而非无法在茎环单元有序生长。
[0048]
在一些实施方式中,所述单链dna框架在还原反应体系中的终浓度为0.05-0.3ng/
μl;可以是0.05-0.08、0.08-0.1、0.1-0.12、0.12-0.15、0.15-0.18、0.18-0.2、0.2-0.22、0.22-0.25、0.25-0.28、0.28-0.3ng/μl;优选地,为0.06-0.2ng/μl;进一步优选地,为0.08-0.12ng/μl;进一步优选地,为0.1ng/μl。
[0049]
在一些实施方式中,所述金前驱体在反应体系中的终浓度为0.2-3mm;可以是0.2-0.5、0.5-0.8、0.8-1、1-1.2、1.2-1.5、1.5-1.8、1.8-2、2-2.2、2.2-2.5、2.5-2.8、2.8-3mm;优选地,为0.4-2mm;进一步优选地,为0.4-1.2mm;进一步优选地,为0.6-1mm;更进一步优选地,为0.8mm。
[0050]
在一些实施方式中,所述还原剂的浓度为0.5-20mm;可以是0.5-2、2-4、4-8、8-12、12-16、16-20mm;优选地,为2-6mm;进一步优选地,为4mm。
[0051]
在一些实施方式中,所述还原反应的温度为20-50℃;可以是20-25、25-30、30-35、35-40、40-45、45-50℃;优选地,为25-45℃;进一步优选地,为30-40℃;更进一步优选地,为35℃。
[0052]
在一些实施方式中,所述还原反应的时间为0.5-6h;可以是0.5-1、1-1.5、1.5-2、2-2.5、2.5-3、3-3.5、3.5-4、4-4.5、4.5-5、5-5.5、5.5-6h;优选地,为2-4h;进一步优选地,为2.5-3.5h;更进一步优选地,为3h。
[0053]
在一些实施方式中,所述环状dna模板为单链环状dna。
[0054]
在一些实施方式中,所述环状dna模板在滚环扩增混合溶液中的终浓度为2-30nm;优选地,为10nm。
[0055]
在一些实施方式中,所述dna聚合酶选自phi29 dna聚合酶、bst 2.0dna polymerase、φ29polymerase中的一种或几种;优选地,为phi29 dna聚合酶。
[0056]
在一些实施方式中,所述dna聚合酶在混合溶液中的终浓度为0.5-5u/μl;优选地,为2u/μl。
[0057]
在一些实施方式中,所述dntps包括datp、dttp、dctp、dgtp,其浓度分别为1.5-4mm/μl;所述datp、dttp、dctp、dgtp的浓度可以相同或不同;优选地,datp、dttp、dctp、dgtp的浓度相同,均为2.5mm/μl。
[0058]
在一些实施方式中,所述缓冲液为磷酸钠缓冲液、tae缓冲液、tbe缓冲液中的一种或几种;优选地,为磷酸钠缓冲液。
[0059]
在一些实施方式中,所述滚环扩增中孵育的温度为20-35℃;优选地,为30℃。
[0060]
在一些实施方式中,所述滚环扩增中孵育的时间为0.5-8h;优选地,为4h。
[0061]
在一些实施方式中,在滚环扩增孵育完成后,还包括对dna聚合酶进行高温变性的步骤;优选地,在68℃,15min进行高温变性处理;进一步优选地,还包括离心去除聚合酶的步骤,所述离心条件为14000rpm/min,2min。
[0062]
在一些实施方式中,所述环状dna模板的合成步骤包括:
[0063]
(1)将碱基数为50-210个碱基的单链dna进行模板组装;
[0064]
(2)在dna连接酶的作用下,连接成环,得到所述环状dna模板。
[0065]
步骤(1)中,所述单链dna为5’端经过修饰的单链dna,具体为磷酸化修饰、亲和素修饰、羧基修饰中的一种。在一些优选实施方式中,所述单链dna的序列如seq id no.1~3任一所示;进一步优选地,在5’端包含选自以下任一种修饰:磷酸化修饰、亲和素修饰、羧基修饰中。
no.3)。
[0078]
其成环后的示意图如图15所示。图15中,seq id no.3的5’端的gcatcc与3’端的ggatgc互补配对,5’端的和3’端各有二十五个游离的碱基,进而在制备获得单链dna框架的茎环结构之间形成50nt间隔序列。5’端的二十五个游离的碱基agtggtgaatgtaaggtgtatcaga(seq id no.14)和3’端的二十五个游离的碱基gtaaggtgtatcagaagtggtaatc(seq id no.15),在制备获得单链dna框架的茎环结构之间形成50nt间隔序列(如gtaaggtgtatcagaagtggtaatcagtggtgaatgtaaggtgtatcaga(seq id no.16))。
[0079]
步骤(2)中,所述缓慢降至室温是指在2h内逐步冷却至室温。
[0080]
步骤(2)中,所述连接酶用于生成磷酸二酯键,选自t4 dna连接酶、e.coli dna连接酶、circligase
tm ii单链dna连接酶中的一种或几种;优选地,为t4 dna连接酶。
[0081]
步骤(2)中,所述连接的温度为10-25℃;优选地为16℃。
[0082]
步骤(2)中,所述连接的时间为3-10h;优选地为5h。
[0083]
在采用连接酶连接后,所述方法还包括(3)在高温下,对连接酶进行变性的步骤;优选地,在65℃,孵育10min进行变性处理。
[0084]
本发明还提供了如上任一项所述方法制备得到的纳米酶。
[0085]
本发明还提供了如上所述的纳米酶,所述纳米酶具有过氧化物酶催化活性或类过氧化物酶催化活性;和/或,所述纳米酶为纳米球、纳米管或纳米棒中的一种或几种。
[0086]
本发明还提供了如上所述的纳米酶在作为过氧化物酶中的应用。
[0087]
在一具体实施方式中,本发明提供了滚环扩增模板的制备方法以及通过其原位生长合成纳米酶的方法,包括以下步骤:
[0088]
(1)环状模板的合成:磷酸化的单链dna(10μm)(polya茎环间隔序列长度为21nt,模板序列:5’p-gcatccgttttttttttttttttttttcggatgcgggttagggttagggttaggg(seq id no.1))混合于0.1m的磷酸钠缓冲液(pbs,0.1m of nacl,10mm of na2hpo4和nah2po4,ph 7.4)中,95℃加热5min,在2h内逐步冷却至室温。合成的产物与t
4 dna连接酶(10u/μl)在16℃共孵育5h,然后在65℃孵育10min,最后逐步降温至25℃,并用聚丙烯酰胺凝胶电泳纯化回收环状模板。
[0089]
(2)dna框架合成:将环状模板(10nm)、phi29 dna聚合酶(2u/μl)和dntps(每种2.5mm/μl)在磷酸钠缓冲液中(50mm tris-hcl,10mm(nh4)2so4,10mm mgcl2和4mm二硫苏糖醇)混匀,在30℃共孵育,孵育时间可调节。
[0090]
(3)将(2)中混合体系在68℃下孵育15min以终止反应。反应结束后,在14,000g的转速下离心2min以去除变性后的酶。
[0091]
(4)回收(3)中上清液,然后用透析盒(20k mwco)在去离子水中透析48h。回收产物并于4℃下储存。
[0092]
(5)纳米酶的合成:将得到dna框架(0.1ng/μl)与不同浓度的金前驱体(氯金酸溶液)混合孵育5h后,在体系中继续加入还原剂(柠檬酸三钠溶液,4mm na
+
,ph 6.0),在35℃下连续震荡孵育3h。
[0093]
(6)纳米酶的纯化:在10,000g的转速下离心20min回收合成纳米酶,最终沉淀用去离子水重悬。
[0094]
在一些实施方式中,在环状模板设计时,控制polya茎环的间隔序列长度(8nt,模板序列:5’p-acgtggccttttttttttttttttttttggcctaga(seq id no.2))和(50nt,模板序列:5’p-agtggtgaatgtaaggtgtatcagagcatccttttttttttttttttttttggatgcgtaaggtgtatcagaagtggtaatc(seq id no.3))。
[0095]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0096]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0097]
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。
[0098]
下面结合附图对本发明进行详细说明。
[0099]
(1)rca扩增形成dna框架介导纳米酶的合成
[0100]
如图1所示,为滚环扩增编码纳米酶合成的示意图。通过对环状模板的滚环扩增制备了具有周期性重复polya茎环单元的单链dna框架,以polya茎环单元为成核位点进行金纳米颗粒原位生长,合成空间间隔可调的纳米酶。
[0101]
(1)环状模板的合成:磷酸化的单链dna(10μm)(polya茎环间隔序列长度为21nt,模板序列:5’p-gcatccgttttttttttttttttttttcggatgcgggttagggttagggttaggg(seq id no.1))混合于0.1m的磷酸钠缓冲液(pbs,0.1m of nacl,10mm of na2hpo4和nah2po4,ph 7.4)中,95℃加热5min,在2h内逐步冷却至室温。合成的产物与t
4 dna连接酶(10u/μl)在16℃共孵育5h,然后在65℃孵育10min,最后逐步降温至25℃,得到环状模板;用聚丙烯酰胺凝胶电泳纯化回收环状模板。
[0102]
(2)rca反应合成单链dna框架:将环状模板(10nm)、phi29 dna聚合酶(2u/μl)和dntps(每种2.5mm/μl)在磷酸钠缓冲液中(50mm tris-hcl,10mm(nh4)2so4,10mm mgcl2和4mm二硫苏糖醇)混匀,在30℃共孵育,孵育4h。
[0103]
(3)将(2)中混合体系在68℃下孵育15min以终止反应,控制polya茎环的间隔序列长度21nt,反应结束后,在14,000g的转速下离心2min以去除变性后的酶。
[0104]
(4)回收(3)中上清液,然后用透析盒(20k mwco)在去离子水中透析48h。回收产物即单链dna框架,并于4℃下储存。
[0105]
图2a中凝胶电泳表示通过rca扩增成功制备了大尺寸单链dna框架;图2b afm结果显示单链dna框架的非晶态形貌,展宽直径为128
±
42nm,高度为40
±
10nm;图2c激光扫描共聚焦显微图像显示了经1
×
sybr green染色的rca扩增产物中有离散的荧光点,说明长单链dna框架的形成。这些表征结果说明通过rca扩增方法可以成功合成长单链dna框架。
[0106]
(5)纳米酶的合成:将得到dna框架(0.1ng/μl)与0.8mm浓度的金前驱体(氯金酸溶液)混合孵育5h后,在体系中继续加入还原剂(柠檬酸三钠溶液,500mm na
+
,ph6.0),在35℃下连续震荡孵育3h。
[0107]
(6)纳米酶的纯化:在10,000g的转速下离心20min回收合成纳米酶,最终沉淀用去离子水重悬。
[0108]
图3-4所示,afm(图3a、c)及tem(图3g、图4a)图像显示了以dna框架为模板进行金纳米颗粒原位生长合成的纳米酶,展宽直径为167
±
43nm,高度为55
±
18nm(图3d、f);图3b、d、e和f显示金生长过程前后团簇的展宽和高度在统计学水平上明显增长,说明金生长后dna框架内有其他材料掺入;tem图像的元素分布分析(图3h)及edx(图3i)结果显示团簇结构中有大量au和p元素,表面该团簇由dna和金纳米颗粒组成。该团簇光吸收峰(图4b)为~530nm,在暗场显微镜下呈红色(图4c),表明相对于单分散金纳米颗粒发生了等离子体性质的红移。综上,表明了聚合金纳米颗粒即纳米酶的合成。
[0109]
对纳米酶进行tmb显色反应,步骤包括:通常将一定量的tmb(0.2mm)、h2o2(200mm)、gncn溶液与0.2m的醋酸钠缓冲液在一定的ph和温度下混合。反应10min后,通过紫外-可见分光光度计记录tmb氧化产物在652nm的吸光度来监测反应;若是测定其米氏常数,则通过紫外-可见分光光度计记录tmb氧化产物在652nm处随时间变化动态吸光值来监测反应,再利用lineweaver burk方程计算其结果。
[0110]
如图5下图中反应式所示,其反应机理为基于gncn具有过氧化氢酶催化活性,低ph条件下,gncn可以催化h2o2快速氧化无色的tmb底物,生成蓝色的氧化态oxtmb产物,进而观察到溶液呈现出从无色快速变成蓝色的现象。
[0111]
结果如图5所述,tmb显色反应表示合成的纳米酶具有过氧化氢酶催化活性,单链dna框架无过氧化氢酶催化活性。
[0112]
对纳米酶在不同ph条件下的过氧化氢催化活性进行测定,步骤包括:相同温度条件下,将一定量的tmb(0.2mm)、h2o2(200mm)、gncn溶液与0.2m的醋酸钠缓冲液在不同的ph下混合。反应10min后,通过紫外-可见分光光度计记录tmb氧化产物在652nm的吸光度来监测反应。
[0113]
结果如图6a所示,说明该纳米酶过氧化氢催化活性的最适ph为3.8。
[0114]
对纳米酶在不同温度条件下的过氧化氢催化活性进行测定,步骤包括:将一定量的tmb(0.2mm)、h2o2(200mm)、gncn溶液与0.2m ph为3.8的醋酸钠缓冲液在不同的温度下混合。反应10min后,通过紫外-可见分光光度计记录tmb氧化产物在652nm的吸光度来监测反应。。
[0115]
结果如图6b说明该纳米酶过氧化氢催化活性的最适温度为40℃。
[0116]
实施例2不同金前驱体浓度对编码纳米酶中金纳米颗粒数量以及纳米酶催化活性的影响
[0117]
操作步骤同实施例1,仅将步骤(5)中的金前驱体(氯金酸溶液)浓度分别调整为0.4mm、0.6mm、0.8mm、1.0mm、1.2mm、2.0mm,控制合成纳米酶中金纳米颗粒的数量,实现对酶活性的调控,并用tmb显色反应对纳米酶催化活性进行测定。
[0118]
在相同的rca条件下(4h),不同金前驱体浓度生长3h后得到的纳米酶的肉眼观察图如图7a上图所示。各纳米酶在400-800nm波长紫外光吸收谱如图7a下图所示,可知,随着
金前驱体浓度的增加,纳米酶的最大紫外吸收峰逐渐红移,表明其尺寸也逐渐变大。
[0119]
在相同的rca条件下(4h),对不同金前驱体浓度生长3h后得到的纳米酶进行tmb显色后,肉眼观察图如图7b上图所示;各显色溶液在652nm处最大吸收峰值散点图如图7b下图所示,可知,在相同的rca条件下(4h),0.8mm金前驱体生长3h后形成了具有最佳催化活性的纳米酶结构。这可能是由于从足够的金前驱体中得到的每gnc催化粒子数量较多。然而,随着金前驱体浓度(1.0,1.2或2.0mm)的增加,得到的纳米酶的催化活性下降,表明过度生长可能导致纳米酶结构的增大,其相对比表面积减小。
[0120]
实施例3不同dna框架的序列长度对编码纳米酶中金纳米颗粒数量以及纳米酶催化活性的影响
[0121]
操作步骤同实施例1,仅将步骤(2)中的rca反应的时间分别调整为1h,2h,4h,控制形成不同序列长度的dna框架,从而控制金纳米颗粒生长位点(polya茎环)的个数,步骤(5)中的金前驱体(氯金酸溶液)浓度为0.8mm,最终编码纳米酶中金纳米颗粒的数量,合成纳米酶1-3(gnc
n-1到3),实现对酶活性的调控,并用tmb显色反应对纳米酶催化活性进行测定。
[0122]
如图8a中afm图像显示,不同rca时间(1,2和4h;对应合成dna框架1-3及纳米酶1-3)下dna框架的展宽分别为90
±
32nm,126
±
43nm和208
±
66nm(图10上图从左至右依次为合成dna框架1-3的afm图像,相对于图8a视野更大),表明dna框架的尺寸可以通过rca的时间调控。如图8b中tem图像显示,经金生长过程后,纳米酶的展宽分别为109
±
36nm,140
±
51nm,和234
±
77nm(图10下图从左至右依次为合成的纳米酶1-3的tem图像,相对于图8b视野更大),与金生长前dna框架的尺寸成正相关。图9为本实施例合成的三种纳米酶(gnc
n-1到3)的催化tmb显色反应的时间动力学光谱吸收曲线,纳米酶中金纳米颗粒的数量也随纳米酶尺寸增加,这是由于polya生长单元的增加。因此每个纳米酶中金纳米颗粒的数量可以通过rca时间控制的dna框架的序列长度编码。如图8e所述,经计算,三种纳米酶的最大反应速率分别为1.857
×
10-8
,1.536
×
10-8
和1.946
×
10-8
m.s-1
,米氏常数分别为0.1058,0.0519和0.0481mm。综上,纳米酶的底物亲和力随框架尺寸增加,且纳米酶-3获得最大底物亲和力,表明可以通过框架长度(尺寸)调控纳米酶中金纳米颗粒的数量,进而调控其催化活性。
[0123]
实施例4不同polya生长单元间序列长度对编码金纳米颗粒空间间隔以及纳米酶催化活性的影响
[0124]
操作步骤同实施例1,仅调整以下参数条件:在步骤(1)在环状模板设计时,分别控制polya茎环的间隔序列长度(8nt,模板序列:5’p-acgtggccttttttttttttttttttttggcctaga(seq id no.2))和(50nt,模板序列:5’p-agtggtgaatgtaaggtgtatcagagcatccttttttttttttttttttttggatgcgtaaggtgtatcagaagtggtaatc(seq id no.3)),设定步骤(2)rca反应时间为4h,合成dna框架模板;步骤(5)选定0.8mm氯金酸溶液为金前驱体,控制合成纳米酶中金纳米颗粒的空间间隔,合成纳米酶3-4(gnc
n-3到4),其中gnc
n-3由seq id no.2的模板序列对应合成,gnc
n-4由seq id no.3的模板序列对应合成,实现对酶活性的调控,并用tmb显色反应对纳米酶催化活性进行测定。
[0125]
图11-12中,tem图像显示尽管纳米酶-4(50nt间隔)展宽分布为226
±
70nm,与纳米酶-3(8nt间隔)相当,但纳米酶-4中金纳米颗粒的分布更离散;由图11c吸收光谱看,纳米酶-4的等离子共振峰为528nm,相对于等离子共振峰为534nm的纳米酶-3发生了蓝移,这表明可通过调控框架内polya生长单元间的序列长度,来调控纳米酶内纳米颗粒间的空间间
隔。tmb显色反应(图11d)及米氏方程曲线(图11e)拟合均显示纳米酶-4(km=0.1136mm)的催化活性低于纳米酶-3(km=0.0481mm),这可能是由于0.8mm的金前驱体浓度,不足以使纳米酶-3过度生长以掩盖催化表面。但以上结果依然表明可以通过调控框架的序列来调控纳米酶的催化活性。且值得注意的是,本发明构建的纳米酶-3的催化活性明显优于游离的金纳米颗粒和辣根过氧化物酶。
[0126]
综上所述,本发明利用滚环扩增合成纳米酶的方法,能够编码单链dna框架上金纳米颗粒的数量及空间间隔,进而可以用于构建催化活性可编程的纳米酶。所以,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0127]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1