利用乳酸菌发酵法生产乳酸的方法
1.本发明涉及生物工程技术领域,具体涉及一种利用乳酸菌发酵法生产乳酸的方法。
背景技术:
2.乳酸菌是一种益生菌,其能够将碳水化合物发酵成乳酸。在利用乳酸菌发酵生产乳酸的过程中,往往还会产生一种胞外多糖(exopolysaccharides,eps),该糖其实是菌体细胞生物被膜的一部分,它是由细菌菌体及胞外分泌物如多糖、纤维蛋白、脂蛋白等相互作用而形成的具有复杂结构的膜样物质,是乳酸菌在生长代谢过程中分泌到细胞壁外的常渗于培养基中的一类糖类化合物,分子量在1
×
104~6
×
106da之间,这些次生代谢产物,有的依附于微生物细胞壁形成荚膜,称为荚膜多糖,少量的进入培养基形成粘液,称为粘液多糖。根据不同的分类标准,乳酸菌的eps有同多糖(homopolysaccharides,hops)和杂多糖(heteropolysaccharides,heps),中性和酸性eps之分,这些eps中存在的单体数量约为50~5000。最常见的单糖是葡萄糖、木糖、半乳糖、果糖、甘露糖、鼠李糖、阿拉伯糖等。
3.eps作为乳酸菌的重要次级代谢产物,被公认为安全无毒的,且由于其具有一致性和流变学的特性,在乳品工业生产中占有重要地位,是现代医学和食品功能化学共同关注的焦点。遗憾的是,现在乳酸菌发酵体系中一些eps的浓度水平不高,一般不超过17g/l,而且不稳定,自然生长则更是在3g/l以下。
4.为提高eps的浓度水平,boels等(applied and environmental m-crobiology,2003b,69(8):5029-5031)报道将eps基因簇克隆到高拷贝的质粒中,提高质粒的拷贝数,增强基因簇相关基因的表达水平,促进eps的产出,只是该技术因适用的宿主菌范围窄等缺陷而受到限制。刘超楠等(食品科技,2020,(45)11:1-7)通过筛选菌种以期提高eps的浓度水平,但因菌种稳定性的困扰而无法大规模应用。
技术实现要素:
5.本发明所要解决的技术问题是提供一种利用乳酸菌发酵法生产乳酸的方法,利用该方法生产乳酸,其次级代谢产物eps的含量将显著增加。
6.为解决上述技术问题,本发明所设计的技术方案为:
7.一种利用乳酸菌发酵法生产乳酸的方法,该方法包括如下步骤:
8.1)以发酵体积为基准,以80~120(g/l)的大米为原料,经糊化、液化、糖化后,添加0.1~2(g/l)干酪素、3~5g/l酵母膏和10~30(g/l)戊聚糖源,并进行灭菌处理;
9.2)按5%(v/v)接种量接种乳酸菌,52℃进行发酵;
10.3)发酵12~20h后,添加50~110(g/l)蔗糖和30~80(g/l)蛋白粉;
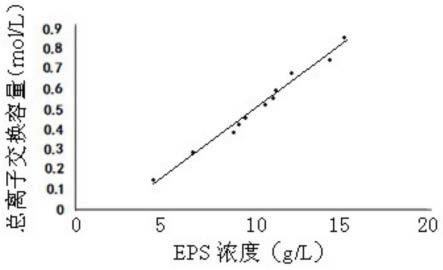
11.4)发酵36~40h后,添加弱阴离子交换树脂,48~60h后用cao进行中和,其中,cao用量按树脂总离子交换容量的10~30%(mol/mol)进行,以使ph控制在ph6~7;
12.5)每隔4~12h进行ph检测,当ph低于6时,则继续添加cao以使ph控制在ph6~7,直
至发酵结束。
13.优选的,所述发酵结束,是指从接种开始计时,发酵7天。
14.优选的,所述戊聚糖源为含戊聚糖的原料,包括但不限于苹果渣、玉米穗、阔叶粉等天然材料。
15.优选的,所述弱阴离子交换树脂为d301、d900等带氨基活性基团的离子交换树脂。
16.优选的,所述弱阴离子交换树脂的添加量为0.3~0.8mol/l。更优选的,所述弱阴离子交换树脂的添加量为0.6~0.8mol/l。
17.本发明的发明人经过长期研究发现,eps浓度水平(g/l)与发酵液中总的离子交换容量(mol/l)为线性的函数关系,在添加以氨基为基团的弱碱性阴离子交换树脂构成的缓冲体系中,随着总离子交换容量的增大,氨基基团与菌体荚膜的糖链之间形成氢键的几率就越大,氢键的形成以及发酵液中ph的微小变化,导致菌体荚膜多糖与细胞表层蛋白之间产生移位,信号因子ai-2更容易进入菌体内部启动相关基因簇,最后体现在发酵液中eps的浓度水平上,利用该函数可以确定发酵过程中所需的总交换容量,方便进行相关树脂的筛选和添加。而由于cao的添加量的控制直接影响到eps与细胞表层蛋白之间的衔接模式和eps的产能水平,通过ca
2+
在弱阴离子交换树脂上进行吸附的热力学、动力学实验,可以呈现出ca
2+
在树脂上的吸附模式及其变化规则,利用该吸附模式及其变化规则,可以优化条件,从而降低ca
2+
在弱阴离子交换树脂上的吸附。
18.基于以上研究和实验,本发明在发酵过程中,添加以氨基为基团的弱碱性阴离子交换树脂构成的缓冲体系,不仅为菌体的生长提供一个相对稳定的环境,而且可使糖基转移酶的活性达到最佳,从而很好地保护了菌体的生长,促进了eps的生物合成;而添加cao作为中和剂,可以提高eps的浓度水平;特定选择52℃的高温发酵,又可以减少所用弱碱性阴离子交换树脂对钙的吸附效果,维持较好的缓冲能力,提高了发酵液中eps的浓度水平。
附图说明
19.图1为eps浓度水平与d301阴离子交换树脂总离子交换容量关系图。
20.图2为ca
2+
在d301阴离子交换树脂上吸附容量比(w/w)与温度的关系(平衡时间5h)
21.实验中ca
2+
原始浓度c0(mol/l)分别为:系列1,0.80;系列2,0.72;系列3,0.66。
22.图3为ca
2+
原始浓度c0(mol/l 50℃)与d301阴离子交换树脂吸附容量比(%w/w)的关系(平衡时间5h)。
23.图4为实施例1平行样1发酵液的检测色谱流出曲线。
24.图5为实施例1平行样2发酵液的检测色谱流出曲线。
25.图6为实施例1平行样3发酵液的检测色谱流出曲线。
26.图7为实施例1平行样4发酵液的检测色谱流出曲线。
27.图8为实施例1平行样5发酵液的检测色谱流出曲线。
具体实施方式
28.以下结合附图和具体实施例对本发明做进一步的说明。
29.图1为eps浓度水平与弱阴离子交换树脂总离子交换容量关系的数学模型图。本发明具体实施例中,选用的弱阴离子交换树脂为d301阴离子交换树脂。eps浓度水平与阴离子
交换树脂(具体实施例中,指d301)的总离子交换容量关系,是利用gpc-激光光散射进行样液分析,采用总峰面积,外标定量的方法来确定的。
30.如图2、3所述,中和剂cao形成的ca2在
+
弱阴离子交换树脂上的吸附容量可以通过以下游离ca
2+
在弱阴离子交换树脂上吸附热力学、动力学实验方法确定:
31.所述游离ca
2+
在弱阴离子交换树脂上吸附热力学、动力学实验,是指以电位计、钙离子选择电极、能斯特方程为基础,建立定量测定ca
2+
方法的使用的,具体包括:
32.a)ca
2+
在树脂上吸附热力学实验:考虑到具体的实际可能的环境,其平衡吸附实验分别在40、50、55℃三个不同温度、ca
2+
共3~7个浓度水平(0.2~1.1mol/l)下进行(本具体实施方式中,选择了3个浓度水平)。准确称取预处理的弱阴离子交换树脂6.500g(干重),加入不同浓度的ca
2+
溶液100ml,以150r.min-1
转速恒温振荡5h,测定吸附前后溶液中的ca
2+
浓度,根据式(1)计算树脂平衡吸附量qe(g/g干树脂)
33.qe=(c
0-ce)/w
×vꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)
34.式中,c0为溶液中ca
2+
(mol/l)原始浓度,ce为吸附平衡时的ca
2+
(mol/l),v为溶液体积(ml),w为树脂的质量(干重,g)
35.b)ca
2+
在弱阴离子交换树脂上吸附动力学实验:在100ml一定浓度的ca
2+
溶液中加入6.500g(干重)的树脂,以150r.min-1
的转速恒温振荡,每20min取样测定其中的ca
2+
浓度,直至接近吸附平衡(rsd≤2%),分别得到40、50、55℃下树脂瞬时吸附量q
t
与吸附时间的关系,q
t
可用式(2)计算
36.q
t
=(c
0-c
t
)/w
×vꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)
37.式中,q
t
为瞬时吸附量(g/g干树脂),c
t
为t时刻ca
2+
浓度(mol/l)
38.分别建立ca
2+
在所用树脂上的吸附容量比与温度、ca
2+
原始浓度的数学模型,结果见图2、3。
39.本具体实施方式中,样品要按以下方法进行处理,以将发酵液中的小分子及其蛋白质消除,具体步骤为:移取部分发酵液,调节ph≥10,添加24万u/g碱性蛋白酶80μl,50℃3h,离心(8000r/min;5min)、移取5ml上清液于透析袋中(截留分子量10000da),透析三天后将透析袋溶液通过装填有强酸性阳离子交换树脂的微柱(h型;14
×
50;mm),10ml水冲洗柱子,合并下来液,冷冻干燥,用5ml流动相溶解、离心后测定。
40.本具体实施方式中的色谱条件为:利用色谱柱super galary sec s2000 3μ300
×
7.8mm进行分离,流动相0.2mol/l naac,流速0.7ml/min,检测器:dawn helos
‑ⅱ
和optilab t-rex,varian 210泵,7725i手动进样器,zim模型进行分子量的计算。
41.本具体实施方式中的乳酸菌(凝结芽孢杆菌bacillus coagulans)购于atcc;d301购于天津心悦华美环保科技有限公司。
42.实施例1
43.以100(g/l)的大米(发酵体积5l,大米量为500g)为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按发酵体积5%(v/v)的接种量接种,52℃进行发酵,15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后根据发酵液中蛋白质水平和所选择的树脂交换参数,按总离子交换容量0.75mol/l添加弱阴离子交换树脂d301,48h后用cao进行中和,中和剂量按总离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测(即检测
ph,当ph低于6时,则继续添加cao以使ph控制在ph6~7,当ph在6~7之间时,不做任何处理,继续发酵至下次检测ph,如此反复,直至发酵结束),接种开始计时,发酵7天。该实施例包括五组平行试验。
44.利用gpc-激光光散射进行样液分析,总峰面积,外标定量,结果见表1,色谱图见图4~8,各段eps均值分子量的波动幅度rsd小于5%,其分布略有差异,发酵液中eps的浓度可达14~15g/l,说明在重复发酵过程中,eps浓度水平、各段分子量大小及其分布都具有良好的重现性,测定发酵液中的ca
2+
,其回收率只有92~94%,说明在本发明的控制条件下,绝大部分ca
2+
都进入了发酵液中,仅有小部分ca
2+
已被树脂吸附。
45.表1eps分子量分布及其所占比例(%)
46.mw(按zimm计算da)所占比例(%)
*
4.936
×
106(
±
1.146%)33.87.546
×
105(
±
1.217%)44.93.924
×
105(
±
3.024%)17.96.617
×
105(
±
2.216%)3.4
47.*用面积归一化法计算
48.实施例2
49.以100(g/l)的大米为原料,经糊化、液化、糖化,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵(发酵体积5l),24h后用caco3按4g/l进行中和,控制ph5~6,每隔12h进行ph维持和检测,接种开始计时,发酵7天。利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达0.8g/l。
50.实施例3
51.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后按总离子交换容量0.75mol/l添加弱阴离子交换树脂d301,48h后用caco3进行中和,中和剂量按总离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天。利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达3.0g/l。
52.实施例4
53.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和80(g/l)蛋白粉,48h后用cao按2g/l进行中和,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天。利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达4.0g/l。
54.实施例5
55.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,35℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后按总离子交换容量0.75mol/l添加弱阴离子交换树脂d301,48h后用cao进行中和,中
和剂量按离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天,利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达3.6g/l。
56.实施例6
57.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,48℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后按总离子交换容量0.75mol/l添加弱阴离子交换树脂d301,48h后用cao进行中和,中和剂量按总离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天,利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达7.2g/l。
58.实施例7
59.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后按总离子交换容量1.0mol/l添加弱阴离子交换树脂d301,48h后用cao进行中和,中和剂量按总离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天,在发酵中、后期,溶液粘度会大幅增加,很难进行cao的中和以及发酵液的后续处理。
60.实施例8
61.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1(g/l)干酪素、5(g/l)酵母膏和10(g/l)紫叶李树叶粉,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵(发酵体积5l),15h后添加110(g/l)蔗糖和40(g/l)蛋白粉,36h后按总离子交换容量0.75mol/l添加弱阴离子交换树脂d301,48h后用cao进行中和,中和剂量按总离子交换容量的50%(mol/mol)进行,控制ph7~8,结果发现菌体的生长受到极大的限制,与正常发酵相比,发酵后延24~48h甚至停止。
62.实施例9
63.以100(g/l)的大米为原料,经糊化、液化、糖化,添加0.8(g/l)干酪素、4(g/l)酵母膏和20(g/l)苹果渣,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵,12h后添加80(g/l)蔗糖和50(g/l)蛋白粉,36h后根据发酵液中蛋白质水平和所选择的树脂交换参数,按总离子交换容量0.75mol/l添加弱阴离子交换树脂d900,48h后用cao进行中和,中和剂量按总离子交换容量的30%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天,利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达14.5g/l。
64.实施例10
65.以100(g/l)的大米为原料,经糊化、液化、糖化,添加1.2(g/l)干酪素、4(g/l)酵母膏和25(g/l)玉米穗,灭菌处理后,利用凝结芽孢杆菌bacillus coagulans,按5%(v/v)接种量接种,52℃进行发酵,15h后添加100(g/l)蔗糖和50(g/l)蛋白粉,36h后根据发酵液中蛋白质水平和所选择的树脂交换参数,按总离子交换容量0.8mol/l添加弱阴离子交换树脂
d900,48h后用cao进行中和,中和剂量按总离子交换容量的25%(mol/mol)进行,控制ph6~7,每隔12h进行ph维持和检测,接种开始计时,发酵7天,利用gpc-激光光散射进行样液分析,总峰面积,外标定量,其eps的浓度可达15.2g/l。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1