一种提高脐带间充质干细胞增殖的方法与流程
1.本发明属于干细胞技术领域,尤其涉及一种提高脐带间充质干细胞增殖的方法。
背景技术:
2.骨损伤是常见的一种健康问题,过去骨损伤主要的治疗方式是自体骨移植和异体骨移植。但是自体骨移植会对供股部位造成一定程度的损伤,并且容易出现并发症,而异体移植则可能导致潜在感染,受体体内排斥反应和术后疼痛等缺点。因此,目前,临床上开始使用骨组织工程的方式来体外构建新生替代股,从而有效的修改和重建损伤骨。骨髓间充质干细胞是骨组织工程常用的细胞,但是骨髓间充质干细胞存在数量少的缺点。
3.人脐带间充质干细胞是从新生儿的脐带组织中提取出的多能干细胞,来源更加广泛,而且其免疫原性低,可以减少免疫排斥反应,适合将其作为新的组织工程细胞,因此通过有效的方法来提高脐带间充质干细胞的增殖将有助于脐带间充质干细胞在组织工程中的更好应用。
技术实现要素:
4.本发明的目的在于提供一种可以有效提供脐带间充质干细胞增殖的方法,从而在组织工程中更好的发挥脐带间充质干细胞的作用。
5.为了实现上述的目的,本发明提供了如下的技术方案:一种提高脐带间充质干细胞增殖的方法,所述方法包括如下步骤:(1)配置含有dermaseptin-ta1多肽的dmem/f12培养基;(2)将脐带间充质干细胞接种于细胞培养皿中,加入含有dermaseptin-ta1多肽的脐带间充质干细胞培养基;(3)将细胞培养皿置于细胞培养箱中,设置培养条件为37℃,5% co2进行培养。
6.优选地,所述含有dermaseptin-ta1多肽的dmem/f12培养基中dermaseptin-ta1多肽的浓度大于100μg/ml。
7.优选地,所述dermaseptin-ta1多肽的氨基酸序列为:alwkdvlkkigtvalhagkaalgavadtisq。
8.dermaseptin-ta1多肽在制备脐带间充质干细胞增殖促进药物上的用途,所述dermaseptin-ta1多肽促进脐带间充质干细胞的增殖,并且促进脐带间充质干细胞增殖相关蛋白cyclin-d1和cdk1的蛋白表达。
9.优选地,所述药物由dermaseptin-ta1多肽和药学上可接受的载体组成,所述药学上可接受的载体为载剂,稀释剂,赋性剂。
10.优选地,所述药物中所述dermaseptin-ta1多肽的浓度大于100μg/ml。
11.dermaseptin-ta1多肽在制备脐带间充质干细胞衰老抑制药物上的用途,所述dermaseptin-ta1多肽抑制脐带间充质干细胞的衰老。并且抑制脐带间充质干细胞衰老相关蛋白p16和p21的蛋白表达。
12.优选地,所述药物由dermaseptin-ta1多肽和药学上可接受的载体组成。
13.优选地,所述药物中所述dermaseptin-ta1多肽的浓度大于100μg/ml。
14.本发明的有益效果是:在本发明中,本发明发现了使用高于100μg/ml dermaseptin-ta1多肽处理脐带间充质干细胞的时候,可以有效的提高脐带间充质干细胞的增殖能力,并促进脐带间充质干细胞中细胞增殖相关蛋白的表达;同时,其可以降低脐带间充质干细胞的衰老,并降低脐带间充质干细胞中细胞衰老相关蛋白的影响,因此我们根据上述结果去设计了提高脐带间充质干细胞增殖的方法。
附图说明
15.图1不同浓度dermaseptin-ta1多肽对于脐带间充质干细胞增殖的调控的结果;图2 dermaseptin-ta1多肽调控脐带间充质干细胞的细胞周期蛋白表达的结果;图3 dermaseptin-ta1多肽调控脐带间充质干细胞衰老的结果;图4 dermaseptin-ta1多肽调控脐带间充质干细胞的衰老相关蛋白的结果;图5 dermaseptin-ta1多肽调控脐带间充质干细胞成骨相关蛋白runx2和成脂相关蛋白c/ebpα的结果。
具体实施方式
16.为能清楚说明本方案的技术特点,下面通过具体实施方式,对本方案进行阐述。
17.实施例1检测不同浓度dermaseptin-ta1多肽对于脐带间充质干细胞增殖的调控(1)使用dmem/f12培养基配置含有0μg/ml,25μg/ml,50μg/ml,100μg/ml和200μg/ml的dermaseptin-ta1多肽的细胞培养基;(2)将本公司培养的p3代人脐带间充质干细胞接种于96孔板中,每孔5000个细胞,100μl培养基;(3)培养过夜后,去除培养基,按照如下分组处理细胞:a组:添加含有0μg/ml dermaseptin-ta1多肽的细胞培养基;b组:添加含有25μg/ml der maseptin-ta1多肽的细胞培养基;c组:添加含有50μg/ml dermaseptin-ta1多肽的细胞培养基;d组:添加含有100μg/ml dermaseptin-ta1多肽的细胞培养基;e组:添加含有200μg/ml dermaseptin-ta1多肽的细胞培养基;(4)添加完成后,将细胞置于细胞培养箱中培养72h,培养结束后,每孔加入10μl cck-8试剂,孵育4h后,使用酶标仪检测各组细胞的450nm吸光度。
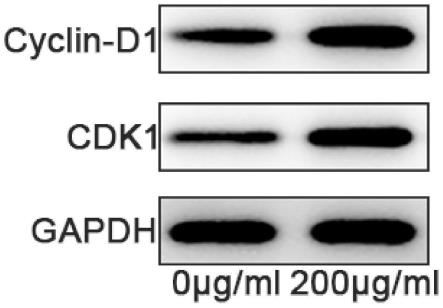
18.实施例2检测dermaseptin-ta1多肽是否可以调控脐带间充质干细胞的细胞周期蛋白(1)将p3代脐带间充质干细胞接种于6孔板中,待细胞密度达到80-90%时,对照组培养基更换为含有0μg/ml dermaseptin-ta1多肽的细胞培养基,实验组培养基更换为含有200μg/ml dermaseptin-ta1多肽的细胞培养基每组设置有3个重复,添加完成后将细胞置于细胞培养箱中进行培养;
(2)培养48h后,离心收集细胞,使用pbs清洗细胞后,加入100μl蛋白裂解液,超声破碎细胞2min;(3)置于离心机中,4℃,12000rpm离心10min,吸取上清,即得到总细胞裂解液;(4)使用bca定量法测定蛋白浓度,加入适量的蛋白loading buffer,沸水浴煮样10min使蛋白变性,得到蛋白样品;(5)按照3.3ml去离子水,4.0ml 30%丙烯酰胺,2.5ml 1.5mol/l tris.cl(ph8.8),100μl 10% sds,100μl 10% ap,4μl temed配置12%分离胶,混合均匀后,缓缓注入已经准备好的玻璃板中,上层加水压平;(6)按照2.1 ml去离子水,0.5 ml 30%丙烯酰胺,0.38 ml 1 mol/l tris.cl(ph6.8),30μl 10% sds,30μl 10% ap,3μl temed配置5%浓缩胶,混合均匀后灌制上层凝胶,插入1.5mm的上样孔梳子,待上层胶凝固后,轻轻的拔掉梳子;(7)组装电泳架,加入电泳液,取适量蛋白样品进行上样,开始使用80v电泳,待蛋白marker进入分离胶后,改用130v继续电泳;(8)电泳结束后,按照3层滤纸+胶+nc膜+3层滤纸的顺序放到夹子上,250ma恒流转膜120min;(9)电转结束之后,将膜放入含有5%的脱脂奶粉的tbst中,室温缓慢摇1h;(10)使用含有5%脱脂奶粉的tbst稀释cyckin-d1,cdk1和gapdh一抗,4℃孵育一抗过夜;(11)次日使用tbst震荡洗膜3次,每次10min,之后孵育二抗,每次洗膜3次,每次10min;(12)将化学发光底物a和b混合液涂在膜上显色1min,压片、显影、定影。
19.实施例3检测dermaseptin-ta1多肽是否可以调控脐带间充质干细胞衰老(1)将p9代脐带间充质干细胞接种于6孔板中,待细胞密度达到80-90%时,对照组培养基更换为含有0μg/ml dermaseptin-ta1多肽的细胞培养基,实验组培养基更换为含有200μg/ml dermaseptin-ta1多肽的细胞培养基,每组设置有3个重复,添加完成后将细胞置于细胞培养箱中进行培养;(2)培养48h之后,将细胞从细胞培养箱中取出,将各组的培养基去除后,加入pbs对细胞进行轻轻的清洗;(3)在每个孔中加入1ml的细胞固定液,室温下固定20min;(4)去除固定液,使用pbs轻轻的清洗细胞,每次3min,每孔中加入1ml的β-半乳糖苷酶染色液,使用保鲜膜将孔封住后,置于37℃孵育12h;(5)孵育结束后,将染色液去除,进行染色细胞的计数,计算阳性率。
20.实施例4检测dermaseptin-ta1多肽是否可以调控脐带间充质干细胞的衰老相关蛋白(1)将p9代脐带间充质干细胞接种于6孔板中,待细胞密度达到80-90%时,对照组培养基更换为新的脐带间充质干细胞完全细胞培养基,实验组培养基更换为含有200μg/ml dermaseptin-ta1多肽的细胞培养基;(2)培养48h后,离心收集细胞,使用pbs清洗细胞后,加入100μl蛋白裂解液,超声
破碎细胞2min;(3)置于离心机中,4℃,12000rpm离心10min,吸取上清,即得到总细胞裂解液;(4)使用bca定量法测定蛋白浓度,加入适量的蛋白loading buffer,沸水浴煮样10min使蛋白变性,得到蛋白样品;(5)按照3.3ml去离子水,4.0ml 30%丙烯酰胺,2.5ml 1.5mol/l tris.cl(ph8.8),100μl 10% sds,100μl 10% ap,4μl temed配置12%分离胶,混合均匀后,缓缓注入已经准备好的玻璃板中,上层加水压平;(6)按照2.1 ml去离子水,0.5 ml 30%丙烯酰胺,0.38 ml 1 mol/l tris.cl(ph6.8),30μl 10% sds,30μl 10% ap,3μl temed配置5%浓缩胶,混合均匀后灌制上层凝胶,插入1.5mm的上样孔梳子,待上层胶凝固后,轻轻的拔掉梳子;(7)组装电泳架,加入电泳液,取适量蛋白样品进行上样,开始使用80v电泳,待蛋白marker进入分离胶后,改用130v继续电泳;(8)电泳结束后,按照3层滤纸+胶+nc膜+3层滤纸的顺序放到夹子上,250ma恒流转膜120min;(9)电转结束之后,将膜放入含有5%的脱脂奶粉的tbst中,室温缓慢摇1h;(10)使用含有5%脱脂奶粉的tbst稀释p21,p16和gapdh一抗,4℃孵育一抗过夜;(11)次日使用tbst震荡洗膜3次,每次10min,之后孵育二抗,每次洗膜3次,每次10min;(12)将化学发光底物a和b混合液涂在膜上显色1min,压片、显影、定影。
21.实施例5检测dermaseptin-ta1多肽是否可以调控脐带间充质干细胞成骨相关蛋白runx2和成脂相关蛋白c/ebpα(1)将脐带间充质干细胞接种于6孔板中,待细胞密度达到80-90%时,对照组培养基更换为含有0μg/ml dermaseptin-ta1多肽的细胞培养基,实验组培养基更换为含有200μg/ml dermaseptin-ta1多肽的细胞培养基;(2)培养48h后,离心收集细胞,使用pbs清洗细胞后,加入100μl蛋白裂解液,超声破碎细胞2min;(3)置于离心机中,4℃,12000rpm离心10min,吸取上清,即得到总细胞裂解液;(4)使用bca定量法测定蛋白浓度,加入适量的蛋白loading buffer,沸水浴煮样10min使蛋白变性,得到蛋白样品;(5)按照3.3ml去离子水,4.0ml 30%丙烯酰胺,2.5ml 1.5mol/l tris.cl(ph8.8),100μl 10% sds,100μl 10% ap,4μl temed配置12%分离胶,混合均匀后,缓缓注入已经准备好的玻璃板中,上层加水压平;(6)按照2.1 ml去离子水,0.5 ml 30%丙烯酰胺,0.38 ml 1 mol/l tris.cl(ph6.8),30μl 10% sds,30μl 10% ap,3μl temed配置5%浓缩胶,混合均匀后灌制上层凝胶,插入1.5mm的上样孔梳子,待上层胶凝固后,轻轻的拔掉梳子;(7)组装电泳架,加入电泳液,取适量蛋白样品进行上样,开始使用80v电泳,待蛋白marker进入分离胶后,改用130v继续电泳;(8)电泳结束后,按照3层滤纸+胶+nc膜+3层滤纸的顺序放到夹子上,250ma恒流转
膜120min;(9)电转结束之后,将膜放入含有5%的脱脂奶粉的tbst中,室温缓慢摇1h;(10)使用含有5%脱脂奶粉的tbst稀释runx2,c/ebpα和gapdh一抗,4℃孵育一抗过夜;(11)次日使用tbst震荡洗膜3次,每次10min,之后孵育二抗,每次洗膜3次,每次10min;(12)将化学发光底物a和b混合液涂在膜上显色1min,压片、显影、定影。
22.实验结果实施例1的结果参见图1,其中,a组的od值为0.358
±
0.024,b组的od值为0.371
±
0.029,c组的od值为0.389
±
0.028,d组的od值为0.478
±
0.026,e组的od值为0.603
±
0.031,可以看出,低浓度时,dermaseptin-ta1多肽对于脐带间充质干细胞的增殖没有显著的影响,当浓度达到100μg/ml时,其对于脐带间充质干细胞的增殖产生了显著影响,而且,当浓度达到200μg/ml的时候,促进效果显著,因此当使用高于100μg/ml的dermaseptin-ta1多肽处理脐带间充质干细胞时,可以对细胞的增殖产生促进作用。
23.实施例2的结果参见图2,可以看出,相较于对照组,实验组中,细胞周期相关的蛋白cyclin-d1和cdk1的灰度值明显升高,说明使用200μg/ml dermaseptin-ta1多肽处理脐带间充质干细胞后,可以有效的提高脐带间充质干细胞中cyclin-d1和cdk1的表达。
24.实施例3的结果参见图3,可以看出,相较于对照组,实验组中,β-半乳糖苷酶阳性的细胞比例显著降低,说明使用200μg/ml dermaseptin-ta1多肽处理衰老的脐带间充质干细胞后能够有效的降低脐带间充质干细胞的衰老率。
25.实施例4的结果参见图4,可以看出,相较于对照组,实验组中,细胞衰老相关的蛋白p21和p16的灰度值明显降低,说明使用200μg/ml dermaseptin-ta1多肽处理脐带间充质干细胞后,可以有效的降低脐带间充质干细胞中p16和p21的蛋白表达。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1