1.本发明属于微生物领域,具体涉及一种从土壤中分离产淀粉酶的微生物的方法。
背景技术:2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.淀粉是高等植物自然储存的多糖,是由葡萄糖分子聚合而成的均聚物。它具有良好的生物降解性和可再生性。淀粉制品不仅仍然是现今人类所不可或缺的基本食物来源,也为现代工业和生产活动提供了大量重要的原材料。利用淀粉酶对淀粉进行异糖化的作用而产生葡萄糖、麦芽糊精糖和麦芽糖等。
4.淀粉酶作为一种生物催化剂,是中国最早的投入研制到实现工业化的生产应用的主要酶制剂种类之一。按照其水解作用方式的不同,可以将淀粉酶分为两大类,分别为α-淀粉酶、β-淀粉酶。作为生活中常用的淀粉酶,α-淀粉酶是一种钙金属酶,在缺钙时不能发挥作用。它能催化淀粉及其衍生物内部的α-1,4-糖苷键断裂,也能跨越α-1,6-糖苷键。其在动物消化方面起到促进作用。β-淀粉酶是一类可以把淀粉水解为麦芽糖的作用酶。仅作用于非还原端,每次切割下一个麦芽糖为单位,主要催化α-1,4-糖苷键。常见于甘薯中,不存在于动物组织中。淀粉酶的生产制备方法包括微生物发酵及动植物提取。微生物发酵产淀粉酶具有高稳定性,高生产率和较低的生产成本等优点,所以工业应用上优先选择微生物发酵法。淀粉酶的用途广泛,涉及到食品业、纺织业、造纸业、医疗卫生、饲料业等工业中,并且在环境保护、化学试剂生产等方面也发挥了重要作用,有较高的经济价值和社会效益,其产量约占工业酶总产量的85%以上。随着近几年学术界对生物制酶工业及其发展现状的认识的提高,选育高产淀粉酶的优良菌株日益成为一个当下重要研究和发展热点。目前仍然以自然分离野生型产酶菌株后驯化或诱变育种为主,需要持续从自然界中筛选挖掘具有较高性能的菌株,为淀粉酶的工业生产提供新的选择,增添新的动力,尽可能的为工业生产方面减少人力、物力等成本。
5.土壤中蕴含着丰富的微生物资源,富含可以产生出各种特殊酶类作用的优良菌株。从土壤微生物中分离出来的产淀粉酶菌株大多以芽孢杆菌属为主,例如bacillus megaterium(巨大芽孢杆菌)、bacillus amyloliquefaciens(解淀粉芽孢杆菌)等,也有分离出放线菌,曲霉,酵母等微生物。针对淀粉酶的研究,目前集中于产淀粉酶菌株的选育,基于产酶条件的培养基优化与控制和菌株诱变效应等机制的研究。但仍缺少拥有优越性能,酶的生物活性较高的菌株,以满足工业生产的需求。
技术实现要素:6.为了解决上述问题,本发明提供了一种从土壤中分离产淀粉酶的微生物的方法。
7.本发明是通过以下技术方案实现的:以下所涉及的浆料的浓度若无特殊说明,均
为质量百分数;所涉及的试剂、药品的用量,若无特殊说明,都是相对于绝干浆而言。
8.本发明的第一个方面,提供了一种从土壤中分离产淀粉酶的微生物的方法,包括:
9.取地表土壤,加入无菌水,混合均匀,得到样品稀释液;
10.将所述样品稀释液注入固体筛选培养基进行倒置培养,然后,对不同形态的单菌落进行分类和纯化,保藏;
11.对纯化的菌株进行分子生物学鉴定、溶圈试验、酶活性测定,得到产淀粉酶的微生物。
12.本发明筛选出了拥有优越性能,酶的生物活性较高的菌株,为后续淀粉酶的研究提供更多的目标菌株,为工业生产提供具有潜在开发价值的菌株。
13.本发明的第二个方面,提供了上述的方法筛选出的产淀粉酶的微生物,包括:巨大芽孢杆菌bacillus megaterium、灿烂类芽孢杆菌paenibacillus lautus、草地链霉菌streptomyces pratensis、细黄链霉菌streptomyces microflavus、暗黑链霉菌streptomyces atratus、田无链霉菌streptomyces tanashiensis、华西肠杆菌enterobacter huaxiensis、非脱羧勒克菌leclercia adecarboxylata、黑曲霉aspergillus niger、黄曲霉aspergillus flavus、dt06simplicillium lanosoniveum、产红青霉penicillium rubens、酒色青霉penicillium vinaceum、产黄青霉penicillium chrysogenum,链格孢alternaria alternata、枝孢菌cladosporium allicinum。
14.本发明的有益效果在于:
15.(1)本发明采用添加可溶性淀粉的平板从土壤中分离出31株产淀粉酶菌株,经过基因序列比对,鉴定出9株巨大芽孢杆菌(bacillus megaterium),1株灿烂类芽孢杆菌(paenibacillus lautus),1株草地链霉菌(streptomyces pratensis),1株细黄链霉菌(streptomyces microflavus)1株暗黑链霉菌(streptomyces atratus),1株田无链霉菌(streptomyces tanashiensis),1株华西肠杆菌(enterobacter huaxiensis),1株非脱羧勒克菌(leclercia adecarboxylata),2株黑曲霉(aspergillus niger),2株黄曲霉(aspergillus flavus),2株dt06(simplicillium lanosoniveum),1株产红青霉(penicillium rubens),1株酒色青霉(penicillium vinaceum),5株产黄青霉(penicillium chrysogenum),1株链格孢(alternaria alternata),1株枝孢菌(cladosporium allicinum)。使用碘染色法对已经成功分离出的菌株进行了初筛,可知有29株菌株是可以明显的观察到产生了透明圈,h/c值的大小直接反映出菌株产酶能力水平上的相对强弱,比值越大,产酶能力越强。可以初步快速的筛选出产酶能力较强的菌株。
16.(2)本发明的方法简单、成本低、实用性强,易于推广。
附图说明
17.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
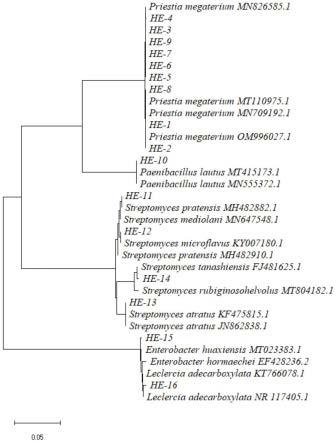
18.图1为本发明实施例1中细菌16srrna系统发育树;
19.图2为本发明实施例1中真菌its系统发育树;
20.图3为本发明实施例1中八株菌株淀粉水解圈图。
具体实施方式
21.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
22.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
23.一种从土壤中分离产淀粉酶的微生物的方法,包括:
24.取地表土壤,加入无菌水,混合均匀,得到样品稀释液;
25.将所述样品稀释液注入固体筛选培养基进行倒置培养,然后,对不同形态的单菌落进行分类和纯化,保藏;
26.对纯化的菌株进行分子生物学鉴定、溶圈试验、酶活性测定,得到产淀粉酶的微生物。
27.在一些实施例中,取地表5~10cm深的土壤。
28.在一些实施例中,固体筛选培养基中各物质的浓度为:硫酸铵10~12g/l、氯化钠5~8g/l、磷酸氢二钠8~10g/l、可溶性淀粉10~20g/l,另外加入1.5%~2%琼脂粉。
29.在一些实施例中,富集培养基中各物质的浓度为:蛋白胨10~12g/l、氯化钠10~12g/l、酵母粉5~8g/l、可溶性淀粉10~12g/l。
30.在一些实施例中,液体淀粉培养基:蛋白胨1~3g/l、可溶性淀粉10~12g/l、酵母粉0.5~0.8g/l、氯化钠1~3g/l、磷酸氢二钾2~4g/l、硫酸镁0.1~0.3g/l、氯化钙0.1~0.3g/l、硫酸锰0.001~0.003g/l。
31.在一些实施例中,倒置培养的条件为:35~37℃下培养2~3天。
32.在一些实施例中,采用快速提取酵母dna方法提取菌株的基因组dna。
33.在一些实施例中,采用3,5-二硝基水杨酸dns比色法进行淀粉酶活性的测定实验。
34.第一实施例,
35.1.1材料
36.1.1.1样品采集
37.取自临沂大学校园绿地的地表5~10cm深的土壤。
38.1.1.2主要试剂
39.3,5-二硝基水杨酸:上海麦克林生化科技有限公司;
40.苯酚:天津市大茂化学试剂厂;
41.酵母粉,蛋白胨:oxoid公司;
42.亚硫酸钠,硫酸镁,磷酸氢二钾:罗恩试剂;
43.硫酸锰,硫酸铵:天津博迪化工股份有限公司;
44.可溶性淀粉,氢氧化钠,琼脂粉:天津市恒兴化学试剂制造有限公司;
45.酒石酸钾钠,氯化钠,氯化钙,磷酸氢二钠:天津市光复科技发展有限公司;碘,碘化钾:山东银典化工有限公司。
46.1.1.3培养基
47.固体筛选培养基:硫酸铵10g/l、氯化钠5g/l、磷酸氢二钠8g/l、可溶性淀粉10~20g/l,另外加入1.5%~2%琼脂粉。
48.富集培养基:蛋白胨10g/l、氯化钠10g/l、酵母粉5g/l、可溶性淀粉10g/l。
49.液体淀粉培养基:蛋白胨1g/l、可溶性淀粉10g/l、酵母粉0.5g/l、氯化钠1g/l、磷酸氢二钾2g/l、硫酸镁0.1g/l、氯化钙0.1g/l、硫酸锰0.001g/l。
50.1.1.4主要仪器
51.电子天平:yp30002,上海佑科仪器仪表有限公司;
52.立式压力蒸汽灭菌器:ym75型,上海三申医疗器械有限公司;
53.超净工作台:sw-cj-1fd型,苏州安泰空气技术有限公司;
54.生化培养箱:shp-080型,上海精宏实验设备有限公司,太仓精宏仪器设备有限公司;
55.离心机:tgl-16型,湖南湘仪实验室仪器开发有限公司;
56.基因扩增仪(pcr仪):a300型,杭州朗基科学仪器有限公司制造;
57.分光光度计:wjh12201-7,上海精科实业有限公司;
58.恒温水浴锅:xr 53648型,金坛区西城新瑞仪器厂。
59.培养皿、烧杯、锥形瓶、试管、移液枪等
60.1.2方法
61.1.2.1菌株的分离与鉴定
62.(1)分离
63.在地表5cm下采取一些土样,在无菌纸上称取样品1g。在提前已高压灭菌的锥形瓶中加入99ml无菌水,加入样品,振荡数分钟。取一支10ml的无菌试管,加入9ml的无菌水,在加入1ml样品液,混匀。按此方法依次类推,直至梯度稀释到10-7
。取各梯度样品稀释液各0.1ml,注入固体筛选培养基的平板上(每个梯度涂2~3个平板)。35℃倒置培养2d。
64.培养2d后,观察菌落形态的差异。选择不同形态的单菌落,采用平板划线法依次进行单菌落的分离及纯化,之后甘油管保藏。
65.(2)分子生物学鉴定
66.从上述纯化的菌株中挑取少许菌落利用快速提取酵母dna方法提取菌株的基因组dna,并以获得的dna为模板,进行pcr扩增,测序引物序列见表1-1,pcr扩增反应体系为50μl,各试剂所需含量如表1-2所示,反应程序见表1-3。扩增反应完成后,取少量(约6μl)扩增产物用于进行0.8%的琼脂糖凝胶电泳,对泳带进行分析,初步将菌株分类为细菌和真菌两大类。剩余扩增产物送到生工生物工程(上海)股份有限公司完成后续测序工作。序列拼接结果采用ncbi在线工具blast比对,并采用mega11.0使用邻接(nj)法构建系统发育树,完成同源序列的比较。
67.快速提取酵母dna法:先取500μl浓度为20mmol/l氢氧化钠于1.5ml的离心管中,选一株单菌落,挑取适量菌体加入到氢氧化钠中。沸水浴10min,冷却至室温后,放入高速离心机,以10000rpm/min的速度,离心5min。取上清液为模板dna。
68.表1-1测序引物
69.tab.1-1sequencing primer
[0070][0071]
表1-2pcr反应体系(50μl)
[0072]
tab.1-2components of the pcr system(50μl)
[0073][0074][0075]
表1-3pcr反应程序
[0076]
tab.1-3pcr reaction procedure
[0077][0078]
1.2.2溶圈试验
[0079]
取100μl甘油保藏的菌株,注入筛选培养基固体平板,涂布均匀。将真菌,细菌分别放入28℃,37℃培养箱中,倒置培养48h,进行活化。用无菌枪头挑取少量单菌落,采用点接的方式接种于富集培养基,相同名称的菌株挑选1~2株点接,接种完成后,倒置放置于培养箱,并调节培养箱温度为28℃,培养时间为24h。待菌落长出,使用稀释过的lugol氏碘液均
31。将上述这组31株产淀粉酶菌株的基因序列拼接得到的序列结果可以直接地提交到genbank数据库,进行blast基因序列的比对,得出的基因序列结果如表2-1所示。根据所得结果将此31株菌株分为细菌与真菌,建立系统发育树,其结果如图2-1,2-2所示。
[0095]
表2-1菌种序列比对结果
[0096]
tab.2-1results of strain sequence alignment
[0097]
[0098]
[0099][0100]
2.2透明圈测量
[0101]
待点接于富集培养基上的菌落培养24h后,将卢戈氏碘液均匀的喷洒于富集培养基,记录透明圈的直径以及菌落直径,并计算其比值(见表2-2)。经测定,除了he-16和he-30产生的透明圈不明显之外,其他菌株的透明圈都能明显的观察到。挑选比值≥2.00的菌株进行酶活的测定。则由表2可知产淀粉酶能力较强的菌株为he-10、he-11、he-12、he-13、he-14、he-19、he-27、he-28(见图2-3)。
[0102]
表2-2溶圈试验
[0103]
tab.2-2surface dissolution ring test
[0104][0105][0106]
2.3淀粉酶活性测定
[0107]
将初筛得到的8株菌株接种于液体淀粉培养基放置于摇床中28℃发酵培养,采用3,5-二硝基水杨酸(dns)比色法进行酶活性的测定,结果如表3所示。由表3可知,he-13、he-14、he-17、he-19的酶活性较高,分别达到了5.47、6.40、10.53、7.13u/ml。
[0108]
表2-3淀粉酶的酶活测定
[0109]
tab.2-3determination of amylase activity
[0110][0111]
3讨论与结论
[0112]
土壤中含有丰富的矿物质,有机质等以及可以降解此类物质的微生物,所以土壤成为了筛菌常用的样品。本研究采用添加可溶性淀粉的平板从土壤中分离出31株产淀粉酶菌株,经过基因序列比对,鉴定出9株巨大芽孢杆菌(bacillus megaterium),1株灿烂类芽孢杆菌(paenibacillus lautus),1株草地链霉菌(streptomyces pratensis),1株细黄链霉菌(streptomyces microflavus)1株暗黑链霉菌(streptomyces atratus),1株田无链霉菌(streptomyces tanashiensis),1株华西肠杆菌(enterobacter huaxiensis),1株非脱羧勒克菌(leclercia adecarboxylata),2株黑曲霉(aspergillus niger),2株黄曲霉(aspergillus flavus),2株dt06(simplicillium lanosoniveum),1株产红青霉(penicillium rubens),1株酒色青霉(penicillium vinaceum),5株产黄青霉(penicillium chrysogenum),1株链格孢(alternaria alternata),1株枝孢菌(cladosporium allicinum)。使用碘染色法对已经成功分离出的菌株进行了初筛,可知有29株菌株是可以明显的观察到产生了透明圈,h/c值的大小直接反映出菌株产酶能力水平上的相对强弱,比值越大,产酶能力越强。可以初步快速的筛选出产酶能力较强的菌株。
[0113]
由于两者之间的比值很容易受到外界因素的干扰,例如:接种量的多少,培养时间的长短,生长速度的快慢以及固体平板的厚度等,所以无法准确的判断菌株酶活力的大小,采用3,5-二硝基水杨酸(dns)比色法进行进一步的酶活测定,以便更加准确的获得产淀粉酶能力较强的菌株。由于土壤中筛选出的产淀粉酶菌株的酶活比较低,所以借鉴了论文《3,5-二硝基水杨酸比色法测定还原糖含量的研究[j].食品科学,2008(08):534-536》优化后的方法,结果显示he-13、he-14、he-19的产酶能力较强。经分子生物学方法鉴定后可知he-13、he-14、he-17、he-19分别为暗黑链霉菌(streptomyces atratus)、田无链霉菌
(streptomyces tanashiensis)、黑曲霉(aspergillus niger)、黄曲霉(aspergillus flavus)。黄曲霉普遍存在于食品,饲料工业中,在酒水酿造的工业微生物中也均发挥着了极重要地作用。但黄曲霉容易产生黄曲霉毒素,该毒素生物活性极强,对人及动物的体内组织器官有一定的损害,尤其是肝脏,严重时可导致肝癌甚至死亡。黑曲霉是当今我国境内一种自然界最普通常见的丝状真菌,经常用于酿酒发酵以及制作各种糖浆、饮料以及酱料等。黑曲霉呈现扩散生长状态,且生长旺盛。它基本无毒素物质的产生,是最早的被引进美国fda国家实验室认证为优质安全无公害食品菌种库之一。黑曲霉不仅高产淀粉酶,还可以生产纤维素酶、木聚糖酶、果胶酶、蛋白酶等多种酶,在工业生产方面有着广泛的应用前景。链霉菌属是自然界最高等的一种放线菌,放线菌种类极为繁多,具有高效抑菌与抗感染等的生物学作用,能迅速产生出多种的有益生化代谢类产物,拥有了巨大潜在的临床应用开发价值和社会经济效益。因此放线菌也是当今工业食品生产环节中的有待科学开发应用的且具有巨大潜在开发价值的另一类特殊微生物资源。
[0114]
最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。上述虽然对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
