胰岛细胞及其分离方法
solution缓冲液终止消化,得到消化液;
10.(4)、将消化液离心,弃上清,加入g-solution缓冲液重悬,得到重悬液;
11.(5)、用g-solution缓冲液提前预湿不锈钢筛,将重悬液用预湿的不锈钢筛过滤,得到滤液;
12.(6)、滤液经过数次重悬,得到糜状消化终产物,通过细胞滤器过滤,得到沉淀物;
13.(7)、将细胞滤器倒置于一个新的培养皿中,用移液器吸取配好的细胞培养基,通过移液枪将细胞滤器中的沉淀物吹至培养皿中,显微镜下观察,手工挑选收集胰岛细胞。
14.优选地,步骤(2)中,胶原酶溶液的配制过程为:胶原酶p和hbss缓冲液混合得到,hbss缓冲液由重蒸水(ddh2o)、hbss和碳酸氢钠混合得到。
15.其中,步骤(2)中,对胰腺组织块进行多部位穿刺灌注胶原酶p分离胰岛细胞,严格控制消化时间和温度,达到合理的消化程度,提高收集率。即灌注胶原酶溶液时,无需将灌注针的尾部与胰腺胰管的接口进行缝合结扎,而是将灌注针对胰腺组织进行多部位反复缓慢注射胶原酶溶液,使得胰腺组织充盈,腺叶分散,充盈体积是原体积的2-3倍,此方法简便、成功率高,避免了传统切碎法消化不均匀,与小鼠胆总管内胶原酶灌注技术接近。所需胶原酶的量约为2ml/g。胰腺组织完全充分扩张是分离胰岛的关键步骤,如果胰腺组织膨胀不佳则分离的胰岛产量明显降低。
16.其中,步骤(3)中,胶原酶消化结束后,手动振荡幅度需大,振荡的时间为30-60s。使胶原酶能高效消化胰岛周围结缔和其他胰腺组织。
17.优选地,步骤(3)中,g-solution缓冲液的配制过程为:含0.25%牛血清白蛋白(bsa)的hbss缓冲液和重蒸水混合得到,bsa加入hbss前需要过滤。加入与胶原酶等体积的g-solution缓冲液进行终止消化,约20ml。其中,hbss缓冲液由重蒸水、hbss和碳酸氢钠混合得到。
18.其中,步骤(3)中,消化的时间优选为10min,消化时间过短,胰岛尚未能从胰腺组织中分离出来,又或者是分离出来的胰岛细胞团周围还存在较多的腺泡细胞,因此产量和纯度都得不到保证。反之,消化时间过长,胰岛会被破碎成块状,细胞团外的包膜被消化,因此胰岛活性和功能都将显著下降。
19.优选地,步骤(4)中,离心的转速可以为400-600rpm(优选为600rpm),时间可以为4-6min(优选为6min)。
20.优选地,步骤(5)中,不锈钢筛的孔径可以为400-420μm,优选为420μm。
21.优选地,步骤(6)中,过滤时,细胞滤器的孔径可以为60-70μm,优选为70μm。
22.其中,本发明采用的纯化胰岛方式不是传统的ficoll密度梯度离心法,由于密度梯度离心法所需梯度液配制过程繁琐,反复吸管加样增加了污染的可能性,操作复杂。本发明经两次过滤,步骤(5)中第一次用420μm不锈钢筛,留滤过液,除去未消化完成的间质组织;步骤(6)中,第二次用70μm细胞滤器,留筛子上的组织,沉淀中含胰岛。每次缓冲液重悬需足够充分。
23.优选地,步骤(7)中,细胞培养基的组分为:rpmi-1640培养基、胎牛血清(fbs)和青霉素-链霉素双抗。
24.目的之二,本发明提供了由上述的分离方法能够获得具有胰岛素分泌功能且满足基础实验所需细胞数量的胰岛细胞。
25.由于采用上述方案,本发明的有益效果是:
26.本发明在胰岛细胞的分离过程中,在进行胶原酶胰腺灌注时,采用多部位缓慢注射,从而能充分充盈胰腺组织,无需结扎胰管固定的手术方法,减少操作时间,且操作简便,成功率高,也避免了以往切碎法胶原酶溶液难以到达组织块的内部,组织内外消化速度不一致导致的胰岛损伤;同时本发明的分离方法区别于组织切碎法,不存在机械破坏,从而减少对胰岛细胞的损伤,更好地保留胰岛活性;在消化过程中,分两次37℃水浴,途中观察评估分离情况,手动振荡消化初产物,能够把握最佳消化分离时机,从而避免了消化不充分或消化过度而导致胰岛得率、活性低的问题;在胰岛纯化过程中,本发明采用两次不同的过滤方法,操作简便易行、价格便宜,结合显微镜下手动收集,能够获得高产量、高纯度、高活性的胰岛细胞,实现了小规模小成本胰岛细胞的分离,满足基础实验要求,以期为糖尿病研究领域胰岛分离纯化及移植技术提供实验依据,另外,还减少了传统ficoll密度梯度离心法带来的梯度液配制过程繁琐,反复吸管加样带来污染的可能,同时也避免了梯度液成分对胰岛细胞的潜在毒性作用。
27.总之,本发明对传统原位整体胰腺灌注分离的方法进行了改良,建立一种小规模的胰岛细胞分离纯化技术,实现离体块状胰腺组织的胰岛细胞分离,并成功获得数量较多且具有活性的胰岛细胞,平均每克胰腺收获大约600个胰岛细胞团,胰岛细胞纯度约为80%。本发明避免传统胰管内灌注大量胶原酶消化等操作繁琐、时间长、成本高、胰岛产量纯度不稳定等缺点,能满足体外基础实验的要求。
附图说明
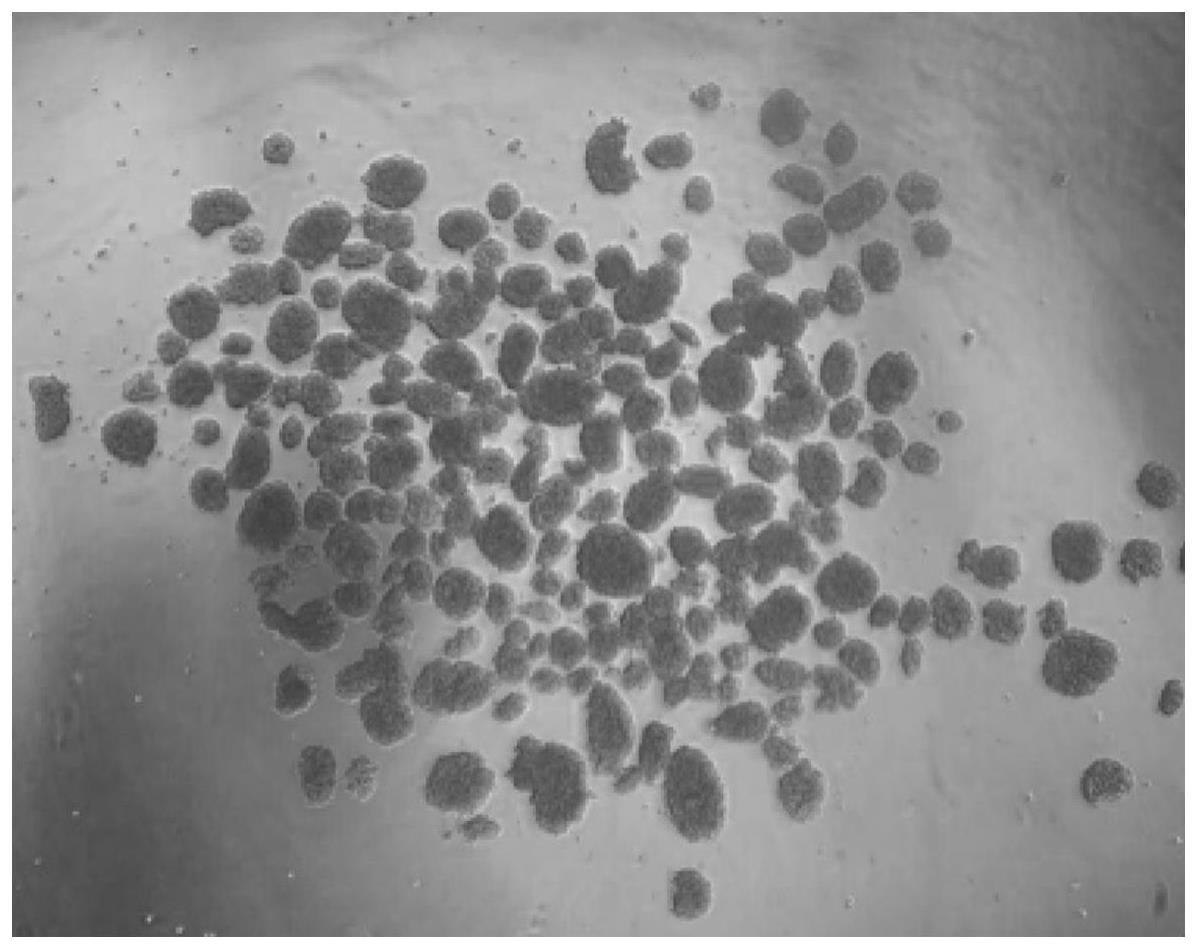
28.图1为本发明实施例1中的胰岛细胞示意图。
29.图2为本发明实施例1中胰岛细胞经双硫腙染色的示意图。
30.图3为是本发明实施例2中胰岛细胞胰岛素分泌功能测试统计图。
具体实施方式
31.本发明提供了一种胰岛细胞及其分离方法。
32.下面结合实施例对本发明的技术内容做进一步的说明。下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
33.一:试剂及仪器:
34.1)、胶原酶collagenase p(roche,cat.1129002001)
35.2)、hbss缓冲液modified hank’s balanced salt solution,hbss(invitrogen,cat.14065-056)
36.3)、牛血清白蛋白bsa-v(solarbio,cat.9048-46-8)
37.4、双硫腙胰岛活性染色剂dithizone(dtz),(生工生物工程有限公司)
38.5)、dpbs缓冲液(sigma,cat.d8537)
39.6)、rpmi-1640培养基(gibco,cat.11875-093)
40.7)、penicillin streptomycin双抗(gibco,cat.15140-122)
41.8)、不锈钢筛420μm(sigma,cat.z632422)
42.9)、细胞滤器70μm(bd,cat.352350)
43.10)、注射器(1ml、5ml)(sigma)
44.11)、0.22μm滤器(millipore)
45.12)、50ml离心管、5ml吸管(corning)
46.13)、10cm细胞培养皿(corning)
47.14)、移液枪(eppendorf research plus)
48.15)、细胞培养箱(thermo forma series ii water jacketed co
2 incubator)
49.16)、超净工作台(上海上净净化设备有限公司)
50.17)、摇床(苏州培英实验设备有限公司thz-c-1全温振荡器)
51.二:液体制备:
52.1)、hbss缓冲液;
53.1xhbss缓冲液:900ml ddh2o+100ml 10xhbss+4.7ml 7.5%nahco3(0.35g/l)。
54.2)、胶原酶溶液:
55.胶原酶p:0.4mg/ml;
56.用1xhbss配制,每g胰岛配制10ml胶原酶溶液。
57.3)、g-solution缓冲液:
58.g-solution:含0.25%bsa的hbss缓冲液和ddh2o混合得到,即2.5g bsa+1l ddh2o,0.22μm滤器滤过。
59.4)、细胞培养基:
60.rpmi-1640(45ml)+10%fbs(5ml)+青霉素-链霉素双抗(550μl)。
61.实施例1:
62.本实施例的胰岛细胞的分离方法(该方法为非疾病的诊断和治疗目的的方法,)包括如下步骤:
63.(1)、取离体的胰腺组织块,约3x3x3cm,10g,放进装有20ml预冷的pbs缓冲液的无菌50ml离心管中。
64.(2)、在超净台中,将胰腺组织倒入10cm细胞培养皿中,用组织剪、血管钳除去胰腺周围脂肪,用预冷的pbs冲干净后放入新的细胞培养皿中,得到处理过的胰腺组织。
65.(3)、配制胶原酶溶液,浓度为0.4mg/ml,使用1ml注射器针头多部位灌注入胰腺组织内,使胰腺组织充分膨胀,总量为2ml/g。
66.(4)、提前预热水浴锅,将肿胀的胰腺组织放入含20ml胶原酶溶液的50ml离心管中,置于37℃水浴振荡消化,200rpm,10min,第一次初消化结束后,手动摇晃离心管30s,根据初消化产物情况调整手动摇晃时间,结束后进行第二次37℃水浴振荡消化,200rpm,10min,加入等体积g-solution缓冲液终止消化,得到消化液。
67.(5)、消化液经室温离心,600rpm,6min,小心弃去上清,加入40ml、g-solution缓冲液充分重悬,得到重悬液。
68.(6)、用g-solution缓冲液提前预湿孔径为420μm的不锈钢筛,重悬液经第一次过滤,留滤过液,得到滤液。
69.(7)、滤液用吸管充分重悬,得到糜状消化终产物,再用孔径为70μm的细胞滤器过
滤,同样细胞滤器使用前需要润湿,此步骤留滤网沉淀,得到沉淀物。
70.(8)、将细胞滤器倒置于一个新的培养皿中,用移液枪吸取配好的细胞培养基,通过移液枪将滤网中的沉淀物吹至培养皿中。
71.(9)、显微镜下观察,得到纯度较高的胰岛细胞,观察胰岛细胞大小、数量等,手工挑选收集胰岛细胞,每克胰腺约能获得600个胰岛细胞,如图1所示。而ficoll密度梯度离心法等,在绝大部分情况下,获得一只大鼠(每克胰腺左右)胰岛数量在200-300个,在实验中有300-500是较为理想的结果,因此本实施例获得胰岛细胞的产量高。
72.(10)、收集的胰岛细胞经双硫腙dtz染色后镜下观察,典型胰岛细胞染成猩红色的圆形或椭圆形细胞团(如图2所示),包膜完整,轮廓清晰,大小不一,而外分泌腺细胞则不着色。
73.(11)、分离的胰岛细胞的质量可用体外试验来检测,培养1天的胰岛行葡萄糖刺激下胰岛素分泌试验gsis。在20mmol/l的葡萄糖刺激下,胰岛素分泌量较2mmol/l葡萄糖明显增加。则葡萄糖刺激胰岛素分泌量是基础状态下的2-3倍,具有较高的活性。
74.实施例2:
75.胰岛细胞的功能检测方法
76.(1)、制备krebs缓冲液
77.129mmol/l nacl、4.8mmol/l kcl、5mmol/l nahco3、1.2mmol/l kh2po4、2.5mmol/l cacl2、1.2mmol/l mgso4、2mmol/l葡萄糖,ph为7.4。
78.(2)、在显微镜下挑出大小相近的胰岛细胞。胰岛细胞在rpmi-1640(10%fbs、1%ps和50μmol/lβ-巯基乙醇)中培养48h。每组至少有4-5个样本,每个样本至少有5-6个胰岛细胞。
79.(3)、将胰岛细胞转移到15ml管中,用krebs缓冲液以1000rpm、5min的速度离心两次。
80.(4)、然后将胰岛细胞用含有2mmol/l葡萄糖和0.1%无脂肪酸bsa的krebs缓冲液在co2培养箱中孵育120min。
81.(5)、以1000rpm,5min离心,弃去上清液。
82.(6)、用每管中含有2mmol/l葡萄糖和0.1%无脂肪酸bsa、1300μl krebs缓冲液重悬胰岛细胞。
83.(7)、将250μl含有2mmol/l葡萄糖和0.1%无脂肪酸bsa的krebs缓冲液添加到a1-a5组的48孔板中。将250μl含有38mmol/l葡萄糖和0.1%无脂肪酸bsa的krebs缓冲液添加到b1-b5组的48孔板中。
84.(8)、将步骤(6)的250μl重悬胰岛细胞加入步骤(7)的48孔板中。因此,对于a组和b组,每个样品的最终体积将为500μl,葡萄糖的最终浓度将分别为2mmol/l和20mmol/l。
85.(9)、30min内在显微镜下计数并记录每孔中胰岛细胞数两次。取平均值得到每个孔中最终的胰岛数目(此步骤可在步骤(10)之后完成)。
86.(10)、20mmol/l葡萄糖刺激30min后,从每孔中仔细转移150μl上清液到1.5ml离心管中,避免取任何胰岛。1000rpm离心5min。
87.(11)、将100μl上清液放入新的1.5ml离心管中,-20℃保存至胰岛素测定。
88.(12)、根据生产商的说明书,使用wide-range胰岛素酶联免疫吸附试验(elisa)测
量分泌到krebs缓冲液中的胰岛素,并与胰岛的数量/大小进行归一化。在20mmol/l的葡萄糖刺激下,胰岛素分泌量较2mmol/l葡萄糖明显增加(如图3所示)。
89.上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1