灵芝多糖的发酵提取方法、灵芝多糖组合物及其应用
1.本发明涉及及天然药物化学领域和化妆品领域,特别是涉及灵芝多糖的发酵提取方法、灵芝多糖组合物及其应用。
背景技术:
2.灵芝是从孢子萌发,经过单核的初级菌丝至双核的次级菌丝和三级菌丝继而形成子实体。灵芝孢子内含有丰富的多糖肽、腺嘌呤核苷、蛋白质、酶、三萜类、有机锗、微量元素等特殊成分。灵芝菌丝体的化学成分主要是蛋白质、核酸、碳水化合物、脂类及各种无机盐类。灵芝子实体包含孢子和菌丝体的所有的营养成分,营养成分丰富,且比市售孢子粉价格低,经济效益高,极具有研究价值。
3.灵芝多糖是灵芝的主要活性成分之一,国内外学者发现的灵芝多糖有200多种,主要以杂多糖形式存在,其中绝大多数是β-葡聚糖,天然的β-葡聚糖被认为是一种功能性多糖,有抗氧化、抗皱、抗紫外线和保湿等活性,经常用于化妆品中。但灵芝细胞壁非常坚硬,会限制灵芝多糖的充分溶出。灵芝细胞壁的结构可分为四层,由外到内依次是β-葡聚糖、糖蛋白、蛋白质、几丁质微丝等,借助有效手段破壁,可助于灵芝多糖的溶出。
4.目前灵芝多糖的提取方法有热水浸提法、微波辅助提取法、酶解法、超声提取等方法,但普遍存在杂质含量高,操作麻烦,易破坏提取物活性影响药效发挥且损耗较大、破壁不完全导致提取量有限等局限性。
5.微生物转化对生物活性物质的提取作用更温和,能够最大程度保留被提取物中的天然活性成分,降低毒副作用,同时微生物在代谢过程中产生的多种活性酶达到增效的作用,因此采用微生物发酵技术提取灵芝多糖,具有原料利用率高和技术温和等优点,已成为植物来源的化妆品原料研发热点,但是现有技术中公开的微生物发酵技术多运用单一菌种发酵,其中,单一菌种发酵代谢产物不够丰富、原料利用率不高。
技术实现要素:
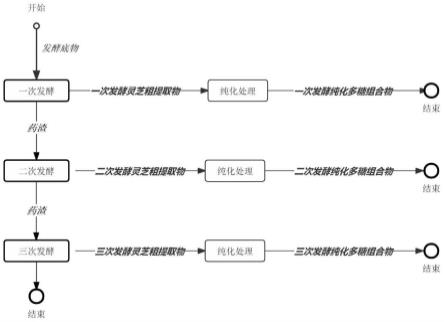
6.为解决上述技术问题,本发明的技术方案是:本发明提供了一种灵芝多糖的发酵提取方法和灵芝多糖组合物及其应用,本发明采用逐级发酵的方式对灵芝子实体进行处理,选用枯草芽孢杆菌、酿酒酵母和植物乳酸杆菌三种益生菌,首先利用枯草芽孢杆菌产酶特性充分瓦解细胞壁,其次利用酿酒酵母菌降解大分子多糖,最后利用植物乳酸杆菌产酸的特性提高生物活性,每一步发酵条件易于控制和调节,且对底物顺序发酵多次,有助于获取更多的小分子多糖。
7.本发明所采用的技术方案是:
8.第一方面,本发明提供了一种灵芝多糖的发酵提取方法,图1a所示,所述提取方法由包括以下步骤的方法制得:
9.①
将发酵底物加10~20倍重量的无菌水,混合均匀,作为半固体发酵培养基,所述发酵底物可以为灵芝子实体初步研磨或机械破壁形成的絮状粗粉、也可以是灵芝原料包括
灵芝子絮状粗粉或孢子粉进一步破壁处理后形成的粘稠絮状物;
10.②
进行一次发酵纯化处理,所述一次发酵纯化处理过程包括:将活化后的枯草芽孢杆菌按接种至半固体发酵培养基中,在空气通风条件下,30℃~37℃温度下恒温摇瓶发酵12~72h,抽滤获取滤液,滤液离心取上清液,上清液去蒸发浓缩冻干保存记为一次发酵灵芝粗提取物,培养基中的剩余药渣高压蒸汽灭菌终止发酵;对一次发酵灵芝粗提取物进行纯化处理,获得一次发酵纯化多糖组合物;
11.③
进行二次发酵纯化,所述二次发酵纯化处理过程包括:将活化后的酿酒酵母菌接种至培养基中,在空气通风条件下,30℃~37℃下恒温摇瓶发酵12~72h,抽滤获取滤液,滤液离心取上清液,上清液去蒸发浓缩冻干保存记为二次发酵灵芝粗提取物;药渣高压蒸汽灭菌终止发酵;二次发酵灵芝粗提取物进行纯化处理,获得二次发酵纯化多糖组合物;
12.④
进行三次发酵纯化,所述三次发酵纯化处理过程包括:将活化后的乳酸菌属的菌株接种至培养基中,在空气通风条件下,30~37℃温度下静置发酵培养12~72h,抽滤获取滤液,滤液离心取上清液,上清液去蒸发浓缩冻干保存记为三次发酵灵芝粗提取物;三次发酵灵芝粗提取物进行纯化处理,获得三次发酵纯化多糖组合物;
13.其中,所述步骤
②
、步骤
③
和步骤
④
中的纯化处理过程均包括:脱脂、脱蛋白和醇沉的步骤。
14.优选的,步骤
②
和步骤
③
中,所述药渣高压蒸汽灭菌终止发酵具体操作为121℃高压蒸汽灭菌15min终止发酵;
15.优选的,步骤
②
和步骤
③
中,所述摇瓶发酵的转速均为200r/min;
16.优选的,步骤
②
、步骤
③
和步骤
④
中,所述滤液离心的转速均为8000r/min,时间均优选为30min;
17.优选的,步骤
②
、步骤
③
和步骤
④
的纯化处理过程中,所述脱脂过程包括:加95%乙醇,涡旋3min,10000r/min离心5min,弃上清液,重复操作3~5次;
18.优选的,步骤
②
、步骤
③
和步骤
④
的纯化处理过程中,所述脱蛋白过程包括:一步沉淀挥干,加水和sevag试剂,每1ml水配置250μl sevag试剂,涡旋10min,10000r/min离心2min,重复操作5~8次,直至无沉淀出现;
19.优选的,步骤
②
、步骤
③
和步骤
④
的纯化处理过程中,所述醇沉过程包括:二步水相挥干有机溶剂,每200μl水相加800μl无水乙醇,4℃条件下放置12-16h,12000r/min离心10min,弃上清液,沉淀50℃烘干。
20.优选的,所述枯草芽孢杆菌活化过程包括:将枯草芽孢杆菌以1:100的比例接到枯草芽孢杆菌专用液体培养基中,30℃,200r/min转速下恒温摇瓶15~24h,600nm测得od值约为1.2时,得到枯草芽孢杆菌液体种子,所述枯草芽孢杆菌专用液体培养基由meb培养基溶于蒸馏水配置而成。
21.优选的,所述酿酒酵母菌的活化过程包括:将酿酒酵母菌以1:100的比例接到100ml的meb液体培养基中,30℃,200r/min转速下恒温摇瓶24h,600nm测得od值约为1.2时,得到酿酒酵母液体种子;
22.进一步的,所述乳酸菌属的菌株包括但不仅限于植物乳杆菌,优选的,所述植物乳杆菌的活化过程包括:将乳酸杆菌以1:100的比例接到100ml mrs液体培养基中,30~37℃条件下恒温培养10~15h,600nm测得od值约为1.7时,得到乳酸杆菌液体种子。
23.相应的,第二方面,本发明还提供由上述提取方法获得灵芝多糖组合物,所述灵芝多糖组合物为上述提取方法中获得的一次发酵纯化多糖组合物、二次发酵纯化多糖组合物或三次发酵纯化多糖组合物中的任意一种或其中两种的任意组合或三种的组合。
24.作为本发明提取方法的一种较佳的实施方式,若所述发酵底物为灵芝原料破壁粘稠絮状物,在配置成发酵培养基之前,还可以先对所述粘稠絮状物进行超声水提处理,初步提取滤液,滤液去蒸发浓缩冻干保存记为初始灵芝粗提取物;对初始灵芝粗提取物也采用上述相同的纯化过程进行纯化获得初始纯化多糖组合物,这种处理方式可快速获得未发酵前的灵芝多糖组合物,缩短发酵处理时间,提高提取效率;优选的,所述超声水提处理过程包括:将所述粘稠絮状物按料液比1:20加水,在破壁机中破壁搅拌4min,转移至超声机中,60℃温度条件下,360w超声60min,后提取滤液,循环所述破壁搅拌和超声处理至少三次后,合并滤液,旋转蒸发仪浓缩至约1/10,冻干后保存,剩余的残渣作为发酵底物进行后续发酵。相应的,由上述提取方法获得的灵芝多糖组合物则还包括了所述初始纯化多糖组合物。
25.与现有技术相比,本发明的有益效果是
26.本发明所述的灵芝多糖的发酵提取方法,首先利用枯草芽孢杆菌进行发酵,枯草芽孢杆菌能产生多种纤维素酶和蛋白酶,从而促进子实体的细胞壁快速瓦解,快速释放细胞壁上以及胞内的包含灵芝多糖在内的大量胞内活性成分;然后,将枯草芽孢杆菌发酵剩余的残渣进行再利用,具体采用酿酒酵母菌将残渣中未降解的大分子多糖进行降解,对残渣进行二次利用且转化出更多种类的小分子灵芝多糖;最后,将酿酒酵母菌发酵剩余的二次残渣进行最后的发酵利用,具体采用乳酸菌属的菌株将二次残渣中的未降解成分进行发酵,有提高发酵产物保湿嫩肤功效的作用。
27.本发明所述的灵芝多糖的发酵提取方法,结合了现有单一菌种发酵和混合菌种发酵的优势,每一步发酵是单菌种发酵,发酵条件易控制,采用不同菌逐级发酵,对发酵底物处理多次,原料利用率高,提取出的多糖成分总含量高、种类丰富,且有利于获得更多的小分子多糖。
28.由上述提取方法获得的所述的灵芝多糖组合物,由逐级发酵降解大分子多糖得到的灵芝多糖分子量更小,多糖成分种类更加丰富、生物活性更好;应用于护肤品,可获得更好的护肤效果,主要表现在抗氧化、保湿和抗衰老方面。
附图说明
29.图1a为本发明所述发酵提取方法流程图;
30.图1b为具体实施方式中所述提取实验流程图;
31.图2为具体实施方式中单糖标准品的hplc色谱图(a)和四个灵芝多糖组分的hplc色谱图(b);
32.图3为具体实施方式中葡萄糖和蛋白质的标准曲线;
33.图4为具体实施方式中灵芝药材不同阶段的电镜扫描;
34.图5为具体实施方式中标准葡聚糖分子量图谱(a-d)和四个灵芝多糖组分的分子量图谱(e);
35.图6各具体实施方式中多糖组分的抗氧化活性;
36.图7各具体实施方式中多糖组分的抑制糖基化终产物(ages)形成的活性;
37.图8各具体实施方式中多糖组分对aqp3、has3和tgm-1基因表达的影响;
38.图9灵具体实施方式中芝多糖对uva诱导的成纤维细胞衰老的预保护作用。
具体实施方式
39.为了使本领域的技术人员更好的理解本发明的技术方案,下面结合具体实施例对本发明所述技术方案作进一步的详细说明。
40.实施例中涉及的仪器设备:摇床、超净台、超声波清洗机、高压蒸汽灭菌锅、酶标仪;实施例中涉及的材料试剂:灵芝为赤灵芝,购于南京海源中药饮片有限公司;枯草芽孢杆菌(saccharomyces cerevisiae)选自中国工业微生物菌株保藏管理中心(菌株编号cicc10071);酿酒酵母(bacillus subtilis),cicc31622;植物乳酸杆菌(lactobacillusplantarum),cicc6240;葡萄糖;蛋白胨;牛肉膏;氯化钠;meb培养基,mrs培养基购于北京陆桥技术股份有限公司;
41.实施例中采用的逐级发酵培养基和菌种活化准备如下:
42.半固体发酵培养基:经过水醇超声提取后的灵芝子实体残渣加(10~20)倍重量的无菌水;
43.枯草芽孢杆菌(s.cerevisiae)液体培养基的配制:葡萄糖10g、牛肉膏10g、蛋白胨10g和氯化钠5g溶于1l蒸馏水;酿酒酵母菌(b.subtilis)液体培养基的配制:称取20g meb培养基溶于1l蒸馏水;植物乳杆菌(l.plantarum)液体培养基的配制:称取55.2g mrs培养基溶于1l蒸馏水;
44.枯草芽孢杆菌的活化:将枯草芽孢杆菌以1:100的比例接到100ml的液体培养基中,30℃,200r/min转速下恒温摇瓶16h,600nm测得od值约为1.2时,得到枯草芽孢杆菌液体种子;
45.酿酒酵母菌的活化:例如,将酿酒酵母菌以1:100的比例接到100ml的meb液体培养基中,30℃,200r/min转速下恒温摇瓶24h,600nm测得od值约为1.2时,得到酿酒酵母液体种子;
46.植物乳杆菌的活化:发酵菌种隶属乳酸菌属但不限于乳酸杆菌:将乳酸杆菌菌以1:100的比例接到100mlmrs液体培养基中,37℃条件下恒温培养10~15h,600nm测得od值约为1.7时,得到乳酸杆菌液体种子;
47.本发明较佳的灵芝多糖的发酵提取方法实施例,如图1b所示,具体操作步骤如下所示:
48.步骤s1,破壁机打粉:取800g灵芝子实体切片后采用破壁机破壁打碎2min至絮状粗粉;
49.步骤s2,第一次破壁机协同超声水提取:取上述絮状粗粉,按料液比1:20加水,在破壁机中破壁搅拌4min,转移至超声机中,60℃,360w超声60min,提三次,合并滤液,旋转蒸发仪浓缩至约1/10,冻干后收集冻干粉,称量计重,命名为gwe
‑ⅰ
,经过本步骤的水提取后剩余的药渣命名为药渣1;
50.步骤s3,破壁协同超声醇提取:将上述药渣1按料液比1:15加70%乙醇,在破壁机中破壁搅拌2min,转移至超声机中,60℃,360w超声60min,提三次,合并滤液,旋转蒸发仪浓缩至约1/10,冻干后收集冻干粉,称量计重,命名为gee,经过本步骤的醇提取后剩余的药渣
命名为药渣2;
51.步骤s4,第二次超声水提取:取50g药渣2按料液比1:20加水,60℃,360w超声60min,再提取一次,滤液命名为gwe
‑ⅱ
。
52.步骤s5,多菌种逐级发酵,按枯草芽孢杆菌、酿酒酵母菌和植物乳杆菌的顺序对发酵底物逐级发酵;
53.步骤s5.1,枯草芽孢杆菌发酵:取700g药渣2按料液比1:10加无菌水且接种1%的枯草芽孢杆菌种子液至半固体发酵培养基中,空气通风条件下、30℃,200r/min转速下恒温摇瓶48h,及时抽滤,滤液在8000r/min转速下离心30min进行除菌终止发酵,合并发酵液,浓缩至约1/10,冻干后收集冻干粉,称量计重,命名为gsfe,抽滤后剩余的滤渣烘干,命名为药渣3;
54.步骤s5.2,酿酒酵母菌发酵:取500g药渣3,121℃高压蒸汽灭菌15min;按料液比1:10加无菌水,接种1%的酿酒酵母菌种子液至半固体发酵培养基中,空气通风条件下、30℃,200r/min转速下恒温摇瓶48h,及时抽滤,滤液在8000r/min转速下离心30min进行除菌终止发酵,合并发酵液,浓缩至约1/10,冻干后收集冻干粉,称量计重,命名为gbfe。抽滤的滤渣烘干,命名为药渣4。
55.步骤s5.3,植物乳杆菌发酵:称取400g药渣4,121℃高压蒸汽灭菌15min。按料液比1:10加无菌水,接种1%的植物乳杆菌种子液至半固体发酵培养基中,空气通风条件下、37℃条件下恒温静置培养48h,及时抽滤,滤液在8000r/min转速下离心30min进行除菌终止发酵,合并发酵液,浓缩至约1/10,冻干后收集冻干粉,称量计重,命名为glfe;抽滤的滤渣烘干,命名为药渣5。。
56.步骤s6,灵芝多糖的纯化:精密称取灵芝粗提组分gwe
‑ⅰ
、gsfe、gbfe、glfe各400mg,每100mg均经历以下三步操作:
57.第一步脱脂:加1ml 95%乙醇,涡旋3min,10000r/min离心5min,弃上清液,重复操作4次。
58.第二步脱蛋白:一步沉淀挥干,加1ml水和250μl sevag试剂,涡旋10min,10000r/min离心2min,重复操作8次,直至无沉淀出现。
59.第三步醇沉:二步水相挥干有机溶剂,每200μl水相加800μl无水乙醇,4℃过夜,12000r/min离心10min,弃上清液,沉淀50℃烘干;
60.gwe
‑ⅰ
、gsfe、gbfe和glfe分别得纯化多糖glp
‑ⅰ
,glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
。
61.对上述实施例的粗提取物中多糖和蛋白质含量进行测定,按照标准t/sfaba 3-2018《银耳多糖产品中多糖含量的测定》中的苯酚—硫酸法测定上述实施例1中获得的不同阶段的粗提取物中多糖含量,按照标准sn/t 3926-2014《出口乳、蛋、豆类食品中蛋白质含量的测定》中的考马斯亮蓝法测定蛋白含量,根据不同浓度的葡萄糖标准溶液及其对应的吸光值,得到苯酚—硫酸法的标准曲线:y=0.0029x+0.0609(r2=0.9994),根据不同浓度牛血清蛋白标准溶液及其对应的吸光值,得到考马斯亮蓝法的标准曲线:y=1.5786x+0.0454(r2=0.9747),葡萄糖和蛋白的标准曲线如图3所示;通过苯酚—硫酸法测定的多糖含量和考马斯亮蓝法测定的蛋白含量如下表所示:
62.粗提取物多糖含量%蛋白含量%gwe
‑ⅰ
18%0.751%
gwe
‑ⅱ
0.13%/gsfe46%0.282%gbfe65%0.229%glfe54%0.193%
63.通过苯酚浓硫酸法测定总多糖含量,水提液gwe
‑ⅰ
中多糖含量占18%,并且经过水醇提取后,其药渣能提取的水溶性成分gwe
‑ⅱ
,多糖含量仅占0.13%,充分证明药渣成分通过传统的机械破壁结合超声水提法已经很难继续溶出多糖成分。
64.而水醇提取后的灵芝药渣先后经枯草芽孢杆菌、酿酒酵母菌、植物乳酸杆菌发酵得到的发酵液多糖含量分别达到46%、65%、54%。说明微生物对细胞壁成分进行了代谢和转化,降解和溶出了细胞壁大量有效成分,包括多糖类成分,这充分证明,逐级发酵法对于活性成分的回收与利用有重大效果,并且有加速细胞内成分溶出的效果;
65.通过考马斯亮蓝法测定蛋白含量,四个组分蛋白含量均低于1%,结果表明灵芝四个组分的粗提取物本身蛋白含量较少,通过后续脱蛋白操作可去除,对粗提取物进行纯化获得纯化后的多糖组合物。
66.对上述实施例中的不同阶段灵芝材料进行电镜扫描观察,结合如图4所示的电镜扫描结果,如图4所示,通过电镜扫描破壁机搅碎的灵芝粉、逐级发酵前的灵芝药渣和逐级发酵后的药渣,其中,a图、b图和c图为放大倍数1000
×
观察到的电镜图,a图、b图和c图为放大倍数5000
×
观察到的电镜图,a图和a图观察的是仅用破壁机搅碎的灵芝絮状粗粉图,b图和b图观察的是灵芝经进一步破壁处理的逐级发酵底物药渣2电镜图,c图和c图观察的是灵芝逐级发酵后的药渣5电镜图,扫描电镜图显示,灵芝药材在提取有效成分前,仅仅经破壁机机械作用,没有明显的破壁效果,孢子壁表现较完整,灵芝逐级发酵前经水醇超声提取后,其孢子壁出现轻微裂解,但是并不完全,经过枯草芽孢杆菌、酿酒酵母菌和植物乳酸杆菌逐级发酵后,灵芝的孢子壁几乎被消解,说明有效成分都得到充分溶出,证明了逐级发酵法是可以有效瓦解细胞壁并增强营养成分溶出的。
67.对上述实施例中获得的纯化后多糖组合物的分子量测定,如图5所示可以看出,纯化后的四组灵芝多糖组合物glp
‑ⅰ
,glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
的大部分多糖都集中在27min左右流出,此部分的多糖分子量约为6kda左右,但是逐级发酵前获得的glp
‑ⅰ
在5min和15min时均有流出大分子的物质,说明未经过逐级发酵的多糖分子量远远大于450kda,且在27min时有出现微弱的连峰,说明此时多糖分子量不均一,是混合多糖,未分开,经过逐级发酵的第一步,glp
‑ⅱ
仅在15min有一个小峰出现,27min左右的物质也变成尖锐的单峰,说明经过第一次发酵后获得的多糖中,大部分的大分子量物质有被降解,经过第二次和第三次逐级发酵后得到的glp
‑ⅲ
和glp
‑ⅳ
,在15min时已经没有峰出现,表明glp
‑ⅲ
和glp
‑ⅳ
中已经不存在大分子物质,证明逐级发酵法有降解大分子灵芝多糖的作用。
68.对上述实施例中获得的纯化后多糖组合物的单糖组成测定分析,将浓度和保留时间已知的10种单糖标准品和待测灵芝样品glp
‑ⅰ
、glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
通过岛津公司的高效液相串联紫外检测器系统(hplc-uv)进行测定。样品通过(shimadzu shim-pack gis c18,5μm,4.6
×
250mm)c18反相色谱柱分离,色谱柱温度设置为25℃;检测器为uv紫外检测器;流速设定为1ml/min;进样体积为10μl,检测波长为245nm。数据的采集及处理通过lc solution软件完成,待仪器稳定后,测定样品。
69.图2结果显示,glp
‑ⅰ
、glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
在多糖组成(单糖组成种类及其摩尔比)上存在一定的差异,四种多糖的单糖组成中葡萄糖的占比为94.67%、96.81%、97.49%和96.89%,表明是以葡萄糖为主构成的灵芝多糖,与文献研究一致,推测glp
‑ⅰ
、glp
‑ⅱ
、glp
‑ⅲ
和glp
‑ⅳ
以葡聚糖为主。glp
‑ⅰ
单糖组成与glp
‑ⅱ
单糖组成有差异,其中,glp
‑ⅰ
和glp
‑ⅱ
中大分子量的糖会影响多糖的单糖组成,glp
‑ⅲ
和glp
‑ⅳ
单糖组成差异不大,甘露糖、葡萄糖醛酸和木糖等单糖占比有些差异,与酿酒酵母菌和植物乳酸杆菌发酵所产生的环境有关。因此,将上述四种多糖组合物混合使用,在多糖的种类和质量上可实现效果最大化。
70.本发明还提供了上述实施例不同阶段提取纯化的灵芝多糖glp
‑ⅰ
、glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
相关美容功效的测试过程和效果,以下测试过程涉及的细胞株为hacat人永生化角质形成细胞和sd乳鼠原代真皮成纤维细胞。hacat细胞购自国家实验细胞资源共享服务平台;实验动物:sd乳鼠,购自上海西普尔-必凯实验动物有限公司;
71.测试例1:抗氧化性能测试
72.灵芝多糖对dpph自由基清除能力的测定包括:1)试剂配制:dpph溶液配制:称取dpph 0.01g,95%乙醇溶解,定容到100ml配成100μg/ml dpph;vc和样品溶液的配制:配制2mg/ml的灵芝多糖和vc母液,等比稀释6个浓度梯度,分别为2、0.5、0.125、0.031、0.008、0.002mg/ml;2)操作过程:各灵芝多糖样品对dpph自由基的清除率测定采用已有文献报道中的方法
1.,分别取dpph工作液100μl与100μl不同浓度的样品溶液加至96孔板中反应,暗处静置30分钟后,517nm测其吸光值,计算其清除率;试验以95%乙醇为空白对照组,vc为阳性对照。计算各灵芝多糖样品对dpph自由基的清除率,每组实验平行三次;其中,ptio自由基清除率计算方法如下:
73.dpph自由基清除率(%)=[1-(a
1-a2)/a0]
×
100;
[0074]
式中:a1:100μl样品溶液+100μldpph溶液反应的吸光度;a2:100μl样品溶液+100μl pbs溶液反应的吸光度;a0:100μl样品溶剂+100μldpph溶液反应的吸光度;
[0075]
灵芝多糖对ptio自由基清除能力的测定包括:1)试剂准备:ptio溶液配制:称取ptio 25mg定容到50ml配成0.5mg/ml ptio;vc和样品的配制:配制8mg/ml的灵芝多糖母液,等比稀释6个浓度梯度,分别为8、4、2、1、0.5、0.25mg/ml;配制0.5mg/ml的vc,等比稀释5个浓度梯度,分别为0.5、0.25、0.125、0.062、0.031mg/ml;2)操作过程:分别取ptio工作液100μl与100μl不同浓度的样品溶液加至96孔板中,在药品稳定性试验箱中避光反应2h,560nm测其吸光值,计算其清除率。试验以pbs缓冲液为空白对照,vc为阳性对照。计算各灵芝多糖样品对ptio自由基的清除率,每组实验平行三次;其中,ptio自由基清除率计算方法如下:
[0076]
ptio自由基清除率(%)=[1-(b
1-b2)/b0]
×
100;
[0077]
式中:b1:100μl样品溶液+100μl ptio溶液反应的吸光度;b2:100μl样品溶液+100μlpbs溶液反应的吸光度;b0:100μl样品溶剂+100μlptio溶液反应的吸光度;
[0078]
如图6所示为上述不同阶段提取纯化的多糖组合物对dpph自由基和ptio自由基的清除测试结果,其中,“*”表示差异显著(p《0.05),“***”表示差异极显著(p《0.001),(a)图表示各个多糖组分和阳性药对dpph自由基的抑制率测量;(b)图表示各个多糖组分浓度为0.25mg/ml时对dpph自由基的抑制率测量;(c)图表示各个多糖组分和阳性药对ptio自由基的抑制率测量;(d)图表示各个多糖组分浓度为4mg/ml时对ptio自由基的抑制率测量。
[0079]
不同阶段得到的多糖组合物对于dpph和ptio自由基的清除都存在量效关系,随着浓度的提高,清除率也有所提高,四组多糖组分对dpph自由基的清除效果表现为glp
‑ⅱ
》glp
‑ⅳ
》glp
‑ⅲ
》glp
‑ⅰ
,0.25mg/ml的glp
‑ⅱ
对dpph自由基的清除率可达到72%;四个多糖组分对ptio自由基的清除效果表现为glp
‑ⅳ
》glp
‑ⅲ
(
ⅱ
)》glp
‑ⅰ
,glp
‑ⅳ
对ptio自由基的清除率最高,4mg/ml可达到63%,测试结果说明,灵芝破壁协同超声的方法和逐级发酵法得到的多糖组分都有一定的抗氧化能力,对于dpph和ptio自由基的清除效果,药渣2经过逐级发酵后仍能够提取出有效的多糖组分,且逐级发酵无论哪个阶段获得的多糖组合物在抗氧化效果方面都明显优于初始灵芝破壁协同超声方法提到的多糖组合物,四组多糖组合物混合后,可最大程度的利用灵芝原料,共同发挥抗氧化的功能。
[0080]
因此,上述四种多糖组合物均可单独用于制备抗氧化皮肤外用剂,也可进行任意组合用于制备抗氧化皮肤外用剂。
[0081]
测试例2:抗糖化性能测试
[0082]
抗糖化性能测试过程包括:1)试剂准备,0.01%防腐溶剂:称取硫柳汞钠0.01g用pbs定容到100ml;30mg/ml bsa:称取3g bsa用防腐溶剂定容到100ml;1.5mol/l果糖:称取27g果糖用防腐溶剂定容到100ml;2)氨基胍盐酸盐和样品溶液的配制:配制4mg/ml的灵芝多糖和氨基胍盐酸盐母液,等比稀释6个浓度梯度,分别为4、1、0.25、0.063、0.016、0.004mg/ml;3)操作过程:准备96孔黑板,每孔加样品溶液70μl和70μl果糖溶液混合,37℃孵育2h后加入bsa溶液70μl,封上保鲜膜,置于药品稳定性试验箱中37℃孵育,在激发波长370nm和发射波长440nm的条件下,测定反应7、14、21天样品的荧光强度,计算样品对ages的抑制率。试验以氨基胍盐酸盐为阳性对照,计算各灵芝多糖样品对糖基化终产物的抑制率,每组实验平行三次。
[0083]
其中,ages的抑制率的计算方法如下:
[0084]
ages的抑制率(%)=[1-(f
a-fb)/f0]
×
100
[0085]
式中:fa:70μl样品溶液+70μl果糖2h,37℃反应后加入70μlbsa反应的吸光度;fb:70μl样品溶液+70μl防腐溶剂2h,37℃反应后加入70μlbsa反应的吸光度;f0:70μl防腐溶剂+70μl果糖2h,37℃反应后加入70μlbsa反应的吸光度。
[0086]
如图7所示为不同阶段提取纯化的多糖组合物对对果糖与牛血清蛋白反应生成的糖基化终产物(ages)的抑制效果,其中,“*”表示差异显著(p《0.05),“**”表示差异极显著(p《0.01),(a)图表示各个多糖组分和阳性药氨基胍盐酸第7天的糖基化终产物的抑制率测量;(b)图表示各个多糖组分和阳性药氨基胍盐酸第14天的糖基化终产物的抑制率测量;(c)图表示各个多糖组分和阳性药氨基胍盐酸第21天的糖基化终产物的抑制率测量;(d)图表示各个多糖组分浓度为0.25mg/ml时在第7、14、21天的糖基化终产物的抑制率;
[0087]
结果显示,灵芝破壁协同超声方法和逐级发酵法得到的多糖组分glp
‑ⅰ
、glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
对糖基化终产物在7天、14天、21天都有一定的抑制能力;在0~0.25mg/ml的浓度范围内,灵芝各个多糖组分抗糖化效果和阳性对照氨基胍盐酸盐不相上下,甚至优于阳性对照;各个多糖组分抗糖化作用有着量效关系,随着浓度的提高,四个多糖组分对糖基化终产物的抑制率也有所提高。第7天时,浓度为0.25mg/ml时,灵芝的四个多糖组分都能明显的抑制过半的糖基化终产物形成。第7天的作用效果是最强的,随着时间推移,第14天和21天效果都有所下降(图7(d))。第7天时,灵芝逐级发酵最后得到的glp
‑ⅳ
作用效果极显
著优于破壁协同超声法得到的glp
‑ⅰ
(p》0.001)。灵芝逐级发酵法得到的三个多糖组分glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
之间发挥作用有差异性,glp
‑ⅳ
》glp
‑ⅲ
》glp
‑ⅱ
,glp
‑ⅳ
作用效果显著优于glp
‑ⅲ
(p》0.05),glp
‑ⅳ
作用效果极显著优于glp
‑ⅱ
(p》0.01)。
[0088]
因此,上述四种多糖组合物均可单独用于制备抗糖化皮肤外用剂,也可进行任意组合用于制备抗糖化皮肤外用剂。
[0089]
测试例3:保湿性能测试
[0090]
灵芝多糖的保湿性能测试可通过灵芝多糖对aqp3、has3和tgm-1基因表达的影响进行表征的,测试过程包括:步骤1细胞铺板:hacat细胞以2
×
105个细胞每孔接种至6孔板,每孔2ml完全培养液,在37℃,5%co2的条件下培养至细胞贴壁并融合80%左右;步骤2给药(体系0.2mg/ml):吸出上一步培养基,加含药量10%的基础培养基2ml,37℃,5%co2培养12~16h;步骤3细胞处理:弃去细胞培养液,用pbs清洗3次;步骤4rt-qpcr操作:严格按照试剂说明书步骤操作。
[0091]
如图8所示为上述hacat细胞正常给药后测定的保湿相关基因aqp3、has3和修复屏障相关基因tgm-1的表达量,其中“**”表示差异显著(p《0.01),“***”表示差异极显著(p《0.001),“****”表示差异特别显著(p《0.0001);“#”表示各个多糖组分和阳性药透明质酸钠(ha)对比,“*”表示各组分于control组对比;(a)图为aqp3 mrna的相对表达量,(b)图为has3 mrna的相对表达量,(c)图为tgm-1mrna的相对表达量;
[0092]
如图8中的(a)图所示,灵芝各个多糖组分都有明显的促aqp3 mrna表达的作用,与ha相比,灵芝各个多糖组分都较ha有极显著的促aqp3 mrna表达作用(p《0.001),四个多糖组分的作用强度排序是glp
‑ⅱ
》glp
‑ⅰ
》glp
‑ⅳ
》glp
‑ⅲ
,结果表明灵芝的各个多糖组分对皮肤都有较好的保湿作用,其中glp
‑ⅱ
的保湿效果作用最好。
[0093]
如图8中的(b)图所示,灵芝各个多糖组分都有明显的促has3 mrna表达的作用,灵芝各个多糖组分都有极显著的促has3 mrna表达作用(p《0.001),四个多糖组分的作用强度排序是glp
‑ⅱ
》glp
‑ⅰ
》glp
‑ⅲ
》glp
‑ⅳ
,结果表明灵芝的各个多糖组分都能较好的促进表皮合成透明质酸,其中glp-ii的发挥效果最好。
[0094]
如图8中的(c)图所示,灵芝破壁协同超声得到的glp
‑ⅰ
对tgm-1mrna表达有抑制作用,但是灵芝逐级发酵法得到的三个组分都有一定的促tgm-1mrna表达的作用,glp
‑ⅱ
和glp
‑ⅲ
有极显著的促tgm-1mrna表达作用(p《0.001),glp
‑ⅳ
对tgm-1mrna表达无抑制也无明显促进作用。
[0095]
结果表明灵芝破壁协同超声得到的glp
‑ⅰ
对修复皮肤屏障无作用,灵芝逐级发酵法得到的glp
‑ⅱ
和glp
‑ⅲ
有较好的保护皮肤屏障的作用。因此,上述多糖组合物glp
‑ⅱ
和glp
‑ⅲ
可单独用于制备抗糖化皮肤外用剂,也可进行组合用于制备抗糖化皮肤外用剂。
[0096]
测试例4:抗衰老性能测试
[0097]
灵芝多糖的抗衰老性能可通过p16、p21、p53基因表达量的荧光数据分析进行表征,以下测试用的细胞为原代sd乳鼠真皮成纤维细胞;
[0098]
具体测试过程包括:准备6孔板,每孔种4
×
105个细胞,待细胞融合至80%,弃去原培养液,选择合适的给药浓度,在5%37℃二氧化碳培养箱给药培养12~16小时,用pbs清洗2遍,每孔加1mlpbs开始照射,实验设三个组,空白组、模型组和给药模型组,照射1~3j/cm2后,换2%fbs dmem培养液,每孔2ml培养12h,按“保湿性能测试过程的实时荧光定量pcr技
术”项进行操作。
[0099]
如图9所示,uva照射sd乳鼠成纤维细胞造模,剂量为1~3j/cm2,测定衰老相关基因p16、p53和p21的表达量测试结果,其中“#”表示model组与control组比较,“#”表示有差异(p《0.05),“##”表示差异显著(p《0.01),“###”表示差异极显著(p《0.001),“####”表示差异特别显著(p《0.0001);*表示model组与给药组比较,未标注*表示无显著差异,“*”表示有差异(p《0.05),“**”表示差异显著(p《0.01),“***”表示差异极显著(p《0.001);图9中(a)图为glp
‑ⅰ
对p53、p21和p16基因的表达影响;图9中(b)图glp
‑ⅱ
为对p53、p21和p16基因的表达影响;图9中(c)图为glp
‑ⅲ
对p53、p21和p16基因的表达影响;图9中(d)图为glp
‑ⅳ
对p53、p21和p16基因的表达影响;
[0100]
图9所示,模型组和对照组相比,p53/p21和p16基因表达均上调,证明uva诱导的成纤维细胞衰老的模型正常。图9(a)所示,200μg/ml的glp
‑ⅰ
能显著性抑制p53和p21基因表达上调(p《0.01),对p16基因没有特别影响;图9(b)所示,100μg/ml的glp
‑ⅱ
能抑制p16和p21基因表达上调,200μg/ml的glp
‑ⅱ
能显著性抑制p53基因表达上调(p《0.01);图9(c)所示,200μg/ml的glp
‑ⅲ
能显著性抑制p21和p53基因表达上调(p《0.01),对p16基因没有特别影响;图9(d)所示,200μg/ml的glp
‑ⅳ
能抑制p16和p21基因表达上调(p《0.05),显著性抑制p53基因表达上调(p《0.01)。四个灵芝多糖组分glp
‑ⅰ
、glp
‑ⅱ
,glp
‑ⅲ
和glp
‑ⅳ
对p53/p21和p16基因表达上调都有一定抑制作用,部分多糖的抑制作用有量效趋势,高浓度多糖抑制作用更强。
[0101]
因此,上述四种多糖组合物均可单独用于制备抗衰老皮肤外用剂,也可进行任意组合用于制备抗衰老皮肤外用剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1