一种基于脱氧核酶的细菌高通量定量检测系统与应用
1.本发明属于生物检测技术领域,更具体地说,涉及一种基于脱氧核酶的细菌高通量定量检测系统与应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.目前,致病型细菌已成为公众健康的重大威胁,针对细菌的高通量检测是实现致病菌有效控制的关键。目前,临床上已发现多种严重威胁人类健康和生态系统的致病菌。因此,发展对于致病菌的快速、高通量检测技术,对实现污染控制、进一步防止抗生素滥用、阻止多药耐药菌的形成以及临床治疗指导等方面具有重大意义。
4.当前细菌检测方法主要包括培养法和基因检测法。其中,培养法是金标法,但受灵敏度限制,该方法需对采集样本长时间培养,获得相对大量存活的细菌来满足定性和定量分析的准确性,具有周期长(1~2天)、样品前处理步骤繁琐等固有缺陷,已经难以满足当前临床的需求。近年来,发展了多种基于基因检测的新兴分子生物学技术,例如定量pcr (filmarray bcid)、合成生物学(crispr)、测序法(oxford nanoporeminion)以及一些新兴的生物传感法。许多细菌鉴定方法可将检测时间缩短至数小时且检测通量较高,但对于低浓度细菌(1~100cfu/ml)仍需长时间培养富集、检测通量有限。此外,这些方法通常需要昂贵的设备和复杂的样品前处理(如细胞裂解、核酸提取)来纯化和富集目标,而且纯化时还可能导致目标物丢失,进一步降低检测灵敏度。因此,建立具有高灵敏、高通量的细菌分析方法是解决细菌快速分析问题的关键,创建对应的分析系统也是实现检测的基础。
5.脱氧核酶是指通过体外筛选即指数富集的配体系统进化技术 (systematic evolution of ligands by exponential enrichment,selex)获得的具有特殊结构和功能的核酸分子片段,主要包括具有特异性识别靶标物质的适配体、具有催化能力的脱氧核酶和同时具有靶标物质识别和催化功能的适配体核酶等。其中,脱氧核酶的生物学识别功能与抗体极为相似,且具有靶标范围广、稳定性高、便于化学修饰和合成等诸多优点。将脱氧核酶与荧光分子键合后,可以形成分子信标,用于检测目标物。因此,其为识别分子用于生物传感得到快速发展,广泛应用于核酸、蛋白质、生物活性分子、疾病标志物的识别与检测,并表现出良好的应用前景。
6.目前,针对致病菌的高通量、快速检测方法多为基因分析法,只能完成基因型分析,并不能实现表型分析,为获得更详细的耐药信息,开发新型、高通量的致病菌表型分析方法和检测系统具有重要意义。
技术实现要素:
7.为解决现有技术存在的问题,本发明提供了一种基于脱氧核酶的细菌高通量定量
检测系统与应用,此系统包括:电源模块、供压模块、微流控液滴生成模块、荧光检测模块和光电转换模块。其中,电源模块和供压模块为整个系统提供动力,微流控液滴生成模块将包含细菌的水相与油相共混,实现单细菌包裹,在细菌包裹后,在液滴生成模块中进行短时的孵育,完成目标物识别;其中,微流控芯片模块中的微型通道直径与毛细管检测光窗直径相当,使得在进样时,保证每次只有一个液滴经过检测光窗;荧光检测模块包括荧光检测器;光电转换模块包括数据采集器和数据处理器,存在细菌的液滴会产生明亮的荧光,原因是在脱氧核酶(rfd-ec)上同时键合荧光基团和猝灭基团,当不存在细菌时,rfd-ec处于荧光猝灭状态,在激光照射下,形成较低的荧光检测背景;当检测到细菌特异性分泌蛋白时,rfd-ec的脱氧核苷酸链被切割至短链,分子内的荧光基团(f) 与猝灭基团(q)距离加大,在激发光照射下可以恢复荧光,产生强烈的荧光信号,被荧光检测器检测,经光电转换装置传输至电脑,进行细菌计数。
8.本发明的技术方案是:
9.一种基于脱氧核酶的细菌高通量定量检测系统,包括顺次连接的供压模块、滴液生产模块、检测模块和光电转换模块;所述供压模块包括顺次连接的气体供应装置、压力泵、样品瓶组,所述样品瓶组与液滴生成模块连接,所述样品组包括并联在压力泵和液滴生成模块之间的油相样品瓶和水相样品瓶;所述水相样品瓶和滴液生产模块之间设有流量传感器a,所述油样样品瓶和滴液生产模块之前设有流量传感器b;所述液滴生成模块包括微流控芯片,所述微流控芯片包括水样入口、油样入口、出口以及连接入口和出口的流道,连接水样入口的流道与连接油样入口的通道在达到出口前交汇,所述水相样品瓶与水样入口连接,所述油样样品瓶与油样入口连接,所述出口与毛细管的一端连接,毛细管的另一端与检测模块连接。
10.进一步地,上述技术方案中,所述气体供应装置包括氮气瓶或空气压缩机;所述气体供应装置的气体流速是10~100nl/min。
11.进一步地,上述技术方案中,所述毛细管的内径为25~100μm,长度为10~200cm;所述毛细管内的液滴为水包油或油包水,每个液滴内包含一个细菌。
12.进一步地,上述技术方案中,所述微流控芯片上设有水样入口、油样入口、出口以及连接水样入口和出口的水样流道)、连接油样入口和出口的油样流道,所述水样入口、油样入口和出口在同一条直线上;所述油样流道由靠近油样入口处分支成两条平行的流道,并在出口前与水样流道交汇,共同连接至出口;或者所述水样流道由靠近水样入口处分支成两条平行的流道,并在出口前与油样流道交汇,共同连接至出口。
13.进一步地,上述技术方案中,滴液生产模块包括温控系统,所述温控系统控制微流控芯片和毛细管的温度。
14.进一步地,上述技术方案中,所述检测模块包括荧光检测器,所述荧光检测器的光源照射至毛细管的透明光窗上,用于激发荧光标记的目标蛋白。
15.进一步地,上述技术方案中,所述光电转换模块包括信号采集器和数据处理器,荧光信号被荧光检测器接收,然后通过信号采集器传输至数据处理器,定量计数细菌数目。
16.所述供压模块与电源模块连接。
17.所述数据处理器包括电脑;电源模块为直流电源。
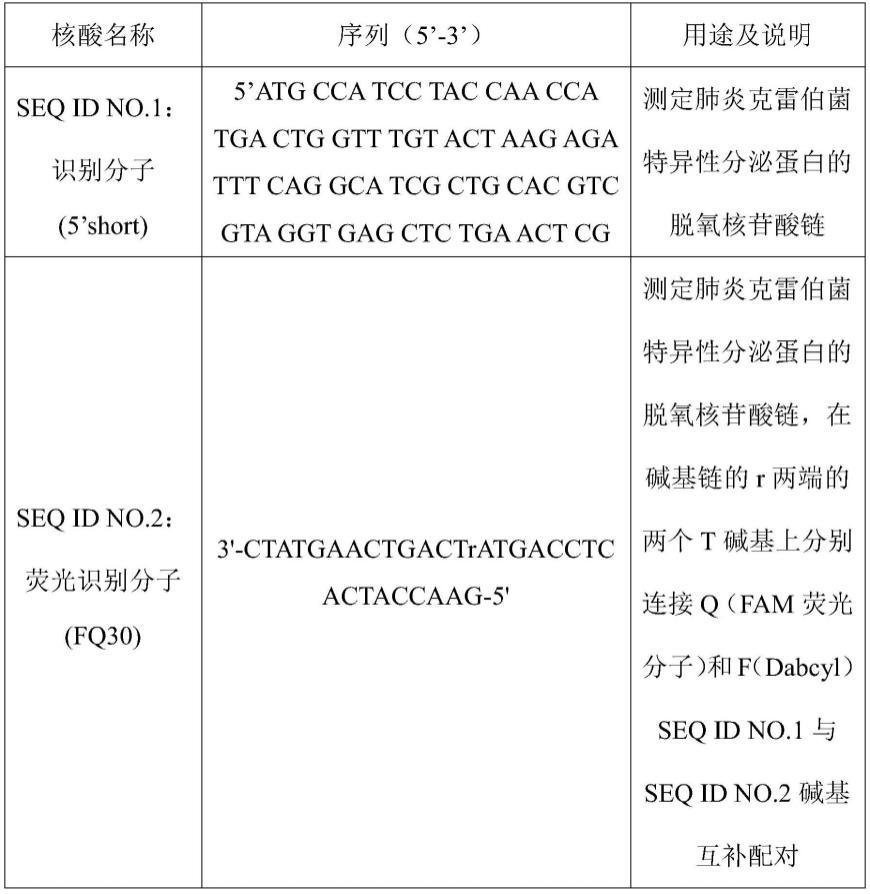
18.进一步地,上述技术方案中,所述细菌包括肺炎克雷伯菌、大肠杆菌。
19.进一步地,上述技术方案中,所述水相样品瓶中包括细菌样品、缓冲溶液、脱氧核酶溶液;所述细菌样品包括尿液、痰液或者粪便;所述油相样品瓶中包括3m
tm
novec
tm
7500的氟化油。
20.当细菌为肺炎克雷伯菌时,细菌样品包括痰液;当细菌为大肠杆菌时,细菌样品包括尿液、痰液或者粪便。
21.进一步地,上述技术方案中,所述脱氧核酶溶液包括如seq id no.1 和seq id no.2所示的脱氧核苷酸链。
22.本发明还提供了上述系统在高通量定量检测细菌中的应用。
23.与现有技术相比,本发明系统具有如下优点:
24.1、本系统结构简单,成本低,且易于在其他实验室使用。
25.2、该系统能够实现单个细菌的在线、集成化包裹,在微反应体系内实现快速反应,极大的提高检测速度与检测通量。
26.3、在线、高度集成化的系统,整个过程减少了人工操作带来的误差,有利于提高定量的准确性
附图说明
27.图1为本发明所述基于脱氧核酶的细菌高通量定量检测系统结构示意图。
28.图中,1、气体供应装置;2、压力泵;3、油相样品瓶;4、水相样品瓶;5、流量传感器b;6、流量传感器a;7、进气管b;8、出液管b;9、进气管a;10、出液管a;11、微流控芯片;12、水样入口;13、油样入口; 14、出口;15、毛细管;16、温控系统;17、检测模块;18、光电转换模块;19、油样流道;20、水样流道。
29.图2为本发明应用例1中单层液滴成像图,在荧光显微镜下液滴照片(液滴中的亮点代表肺炎克雷伯菌)。
具体实施方式
30.为了更好地理解本发明,通过实施例和应用例对本发明进行说明。本发明所列的这些具体实施例和应用例仅限于说明本发明,而非对本发明的限定。
31.表1本发明中使用的核酸序列
[0032][0033]
实施例1
[0034]
本发明提供了一种定量检测单细胞内蛋白质的系统,此系统包括:电源模块,用于为整个系统供电;
[0035]
供压模块,用于为系统提供压力,压力模块包括压力提供装置和流量传感器;
[0036]
微流控液滴生成模块,用于包裹单细菌和单细菌操控,包括芯片基底、芯片上盖、样品入口管(两相:分别为油相和水相)、样品出口管和微型通道,将芯片上盖盖在已刻蚀有微型通道的芯片基底上形成微型通道;芯片示意图如图1,其中微型通道的直径为50μm,芯片上盖的材料是pdms,芯片基底材料是石英,微型通道的截面是圆形;采用聚四氟乙烯管作为样品入口管和出口管,样品入口管的一端与芯片微型通道的入口端相连,另一端插入装有细菌悬浮液的试管中(水相),另一个样品入口管的一端与芯片微型通道的入口端相连,另一端插入装有油相的试管中,密封连接;样品出口管一端与芯片微型通道的出口端相连,另一端与一个变径二通相连,此变径二通的另一端与外径为365μm的石英毛细管相连,石英毛细管内径为50μm;液滴生成模块还包括温控及电阻丝;
[0037]
供压模块将油相和水相样品分别泵入油样入口和水样入口中,两者在水样流道和油烟流道的交汇处混合,形成油包水的微液滴,芯片中的微液滴经变径二通后进入毛细管,
在毛细管中完成快速反应和有效识别,完成目标单细菌的捕获和标记;最后,流经检测模块中的检测光窗,测定荧光强度并计数;
[0038]
荧光检测模块,包括荧光检测器,荧光检测器的光源的波长是450nm,光电放大器的光谱响应范围是320~1100nm;
[0039]
光电转换模块,包括:数据采集器是sepu3010,数据处理器是电脑,荧光检测器的光源照射至透明的毛细管光窗上,光窗直径为50μm,被光源照射的荧光分子发射荧光,被检测器接收,然后通过sepu3010传输至电脑后,根据荧光阈值判断阳性微液滴的数目,通过高斯分布计算细菌数目。
[0040]
模块的工作顺序为:1、电源模块启动,为整个系统供电;2、供压模块为系统供压;3、微流控芯片液滴生成模块形成微液滴;4、液滴流经毛细管,在毛细管中快速完成反应和生物识别;5、荧光检测模块对荧光进行定量检测;6、光电转换模块对细菌进行计数。
[0041]
应用例1利用rfd-ec识别分子快速测定肺炎克雷伯菌,并进行细菌计数
[0042]
利用rfd-ec识别分子快速测定耐卡那霉素型肺炎克雷伯菌,具体操作如下:
[0043]
a)培养耐卡那霉素型肺炎克雷伯菌的工程菌,在5ml的sob培养基中加入10μl的耐卡那霉素菌,进行过夜培养,摇床的温度为37℃,摇速为150rpm;
[0044]
b)过夜培养后,采用酶标仪测定肺炎克雷伯菌的菌浓度,当od600=0.5时,将细菌从摇床中取出,此时细菌的浓度约为108cfu/ml;
[0045]
c)采用无菌水对耐卡那霉素型肺炎克雷伯菌进行稀释,使菌浓度在103~105cfu/ml,通过计算在105μl的细菌样本中,细菌的数目分别为100、1000、10000个细菌;
[0046]
d)将细菌在8000rpm下离心10min(4℃),采用rb溶液进行重悬,rb溶液成分为60mmol/lhepes,130mmol/lnacl,25mmol/lmgcl2,并采用移液枪反复吸打均匀;
[0047]
e)采用fam和dabcyl分子对seqidno.2分子进行荧光标记,形成seqidno.2所示的脱氧核苷酸;
[0048]
f)将seqidno.1与seqidno.2混合,形成rfd-ec识别分子;
[0049]
g)在试管中加入105μl抗生素(浓度是32μg/ml)、105μl肺炎克雷伯菌、30μlrfd-ec识别分子(包括25μl100μm的seqidno.1和5μl10μm的seqidno.2),采用本系统按照实施例1中步骤操作并测定荧光,采用油包水式液滴微流控芯片将细菌包裹至微液滴中,优化细菌浓度,使得每个微液滴内包裹的细菌数目≤1,设置激发波长为450nm,发射波长与所用荧光标记的分子和参比溶液的激发和发射波长相匹配,测定荧光强度。
[0050]
图2为本实施例中单层液滴成像图,在荧光显微镜下液滴照片(液滴中的亮点代表肺炎克雷伯菌)。由图2可以看到,在显微镜下可清晰的观察到细菌被液滴包裹,呈现明显的荧光亮点。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1