基于噬菌体生物扩增双重实时荧光定量PCR快速检测试剂盒及其方法和应用
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒及其方法和应用
技术领域
1.本发明涉及食品安全领域,具体涉及一种基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒及其方法和应用。
背景技术:
2.沙门氏菌是世界上最常见的食源性病原体之一,有的专对人类致病,有的只对动物致病,有的对人和动物都致病。沙门氏菌病是指由各种类型沙门氏菌所引起的对人类、家畜以及野生禽兽所产生的不同形式疾病的总称。据统计在世界各国的细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。沙门氏菌作为主要的食源性病原体之一,每年造成数十万人死亡。2015年欧洲报告了94625例沙门氏菌病,约占欧洲所有食源性疾病报告的28%,比2014年增加了1.9%;此外,10个会员国报告了126例死亡病例。在美国,沙门氏菌造成的年经济损失超过30亿美元,这还不包括未报告的病例。此前的研究报告称,受污染的动物源性食品或新鲜农产品可能是沙门氏菌感染的来源。摄入受污染的食物,如牛肉、家禽、牛奶、鸡蛋或蔬菜,会导致沙门氏菌病。沙门氏菌病的症状包括摄入受污染食物后12至72h的腹泻,发烧和腹部痉挛,持续4-7d。有时,感染沙门氏菌的患者可能会在后期发展为reiter综合征,其中包括关节频繁疼痛,眼睛刺激和排尿疼痛,甚至有些患者会发生菌血症、败血症而死亡。
3.金黄色葡萄球菌是常见的食源性致病菌之一,在自然环境中广泛存在。金黄色葡萄球菌在适当的条件下,能够产生肠毒素,引起食物中毒。近几年,金黄色葡萄球菌引发的食物中毒报道层出不穷,由金黄色葡萄球菌引起的食物中毒占食源性微生物食物中毒事件的25%左右,金黄色葡萄球菌成为仅次于沙门氏菌和副溶血弧菌的第三大微生物致病菌。金黄色葡萄球菌导致的食物中毒究其原因是食物沾染了金黄色葡萄球菌产生的肠毒素引起的。金黄色葡萄球菌致病力的强弱跟所产生的毒素和侵袭性酶有所关联。金黄色葡萄球菌污染牛奶及奶制品、肉类、蛋类等水分和淀粉含量较多的食品时,在合适的温度下,8-10h内就会产生大量的肠毒素,且100℃下加热30min也不会被破坏,随被污染的食物进入人体后引起食物中毒,导致严重的呕吐、腹泻等症状。根据全国各地的调查研究报道,生肉、牛奶及奶制品、速冻食品、熟食等是金黄色葡萄球菌污染的重灾区。根据美国疾病控制中心相关报告,1983-1997年间,金黄色葡萄球菌引起的食物中毒事件平均18.5万人/年,损失高达15亿美元。2000年,日本雪印奶粉事件中,肠毒素导致超过1.4万人食物中毒。因此,对沙门氏菌和金黄色葡萄球菌进行准确快速检测具有重要意义。
4.传统培养法简单易操作,结果准确,但其花费的时间较长,实验过程较为繁琐,已经不能满足当前对食源性病原菌快速检测的要求。噬菌体分布广泛,分离方法简单,价格便宜,对宿主菌具有特异性,具有广泛的应用前景。噬菌体生物扩增法(phage amplification assay,paa)是基于烈性噬菌体裂解宿主菌产生子代噬菌体,在培养基上形成噬菌斑,从而实现对宿主菌进行间接检测的一种方法。该方法操作简单快速,灵敏度高,成本低廉,特别
2020562,于2020年9月29日将该噬菌体lsa2311保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武汉大学,保藏编号为:cctcc m 2020562,保藏日期为:2020年9月29日。在申请号为2020112108493、发明名称为金黄色葡萄球菌噬菌体lsa2311及其应用的中国发明专利公开。
19.进一步地,所述试剂盒还包括含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液、含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液、阴性对照品、阳性对照品、硫酸亚铁铵溶液和柠檬酸三钠溶液。
20.再进一步地,所述含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液中肠炎沙门氏菌噬菌体sep37效价为107pfu/ml,所述含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液中金黄色葡萄球菌噬菌体lsa2311效价为108pfu/ml;阴性对照品:灭菌超纯水;
21.阳性对照品为肠炎沙门氏菌、金黄色葡萄球菌,分别为肠炎沙门氏菌atcc 13076、金黄色葡萄球菌atcc 25923;
22.硫酸亚铁铵溶液浓度为30mm;
23.柠檬酸三钠溶液为20mm。
24.本发明还提供了一种利用上述快速检测试剂盒同时检测沙门氏菌和金黄色葡萄球菌的方法,包括以下步骤:
25.1)双重噬菌体生物扩增法检测
26.a.将含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液和含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液混合,得到混合悬液,然后混合悬液与前处理的待检测样品混合,培养,得到培养物;
27.b.将培养物与硫酸亚铁铵溶液混合,并加入lb液体培养基培养;然后加入柠檬酸三纳溶液,得到混合液;
28.c.将混合液离心,得到上清液,即为肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的混合子代噬菌体;
29.2)子代噬菌体的双重实时荧光定量pcr检测:
30.a.热裂解法提取混合子代噬菌体的dna,并保存于-20℃;
31.b.以混合子代噬菌体的dna为模板,利用检测肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的两对引物和探针进行实时荧光定量pcr得到pcr产物,其中,两对引物对和探针分别为:
32.sep37-f:5
’‑
tccgtaccttggcagaaactt-3’;
33.sep37-r:5
’‑
gtacggtcaccagctaagttga-3’;
34.sep37-probe:5
’‑
fam-aagctgctccaatgcccgctggtatcg-bhq1-3’;
35.lsa2311-f:5
’‑
tgataagacaggtgaaatgtaccaagt-3’;
36.lsa2311-r:5
’‑
ccgttgcctttatcatatagttctttaa-3’;
37.lsa2311-probe:
[0038]5’‑
hex-taaacgcagaggagacgaccattacgcac-bhq2-3’;
[0039]
c.qpcr产物的ct值与标准曲线分析得到待检测的样品中是否含有沙门氏菌和金黄色葡萄球菌并确定沙门氏菌和金黄色葡萄球菌的含量。
[0040]
再进一步地,所述步骤1)第a小步中,培养物是由混合悬液与待检测样品按体积1:
1混合而成,混合悬液中,肠炎沙门氏菌噬菌体sep37的效价为106pfu/ml,金黄色葡萄球菌噬菌体lsa2311的效价为107pfu/ml。
[0041]
再进一步地,所述步骤1)第b小步中,培养物与硫酸亚铁铵溶液的按体积1:1混合,硫酸亚铁铵溶液浓度为30mm,培养温度为37℃,培养时间为10min;
[0042]
柠檬酸三钠溶液添加量为100μl,柠檬酸三钠溶液浓度为20mm。
[0043]
再进一步地,所述步骤2)第b小步中,双重qpcr的反应扩增体系如下:
[0044][0045]
qpcr扩增条件:94℃预处理3min,进行40个循环反应,每个循环包括94℃5s,60℃30s。
[0046]
本发明还提供了一种上述基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒在食品安全检测中的应用。
[0047]
进一步地,所述食品为生菜或牛奶。
[0048]
本发明基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒可特异性检测活的沙门氏菌、金黄色葡萄球菌,该方法灵敏度高、特异性强、稳定性好、重复性高;其具体优点如下:
[0049]
1)本发明检测所用时间为4h,前期不需要进行增菌,与传统培养法相比检测时间缩短了56h;
[0050]
2)本发明可特异性同时检测样品基质中的活的沙门氏菌、金黄色葡萄球菌。
[0051]
3)本发明最低可检测到101cfu/ml的沙门氏菌、金黄色葡萄球菌,具有快速灵敏的优势。
[0052]
综上所述,本发明以噬菌体生物扩增法结合双重实时荧光定量pcr同时检测沙门氏菌、金黄色葡萄球菌的方法,可特异性只检出活的沙门氏菌、金黄色葡萄球菌,检出限均低至101cfu/ml,相比传统培养法,检测时间大大缩短,可在4h内完成检测。
附图说明
[0053]
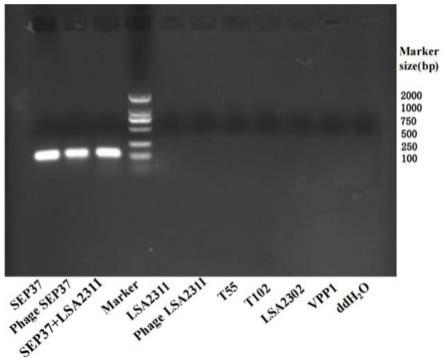
图1和图2分别为实施例1肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的引物特异性实验电泳图。
[0054]
图3为实施例3双重qpcr扩增效率。
[0055]
图4为实施例6噬菌体生物扩增法结合双重qpcr同时检测沙门氏菌、金黄色葡萄球菌试剂盒的最低检出限。
[0056]
图5为实施例9噬菌体生物扩增法结合双重qpcr同时检测沙门氏菌、金黄色葡萄球菌试剂盒在加标食品中应用的最低检出限。
[0057]
图中,图5a为试剂盒在加标生菜中的最低检出限。
[0058]
图5b为试剂盒在加标牛奶中的最低检出限。
具体实施方式
[0059]
下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
[0060]
实施例1引物设计及引物特异性筛选
[0061]
根据肠炎沙门氏菌噬菌体sep37的尾纤蛋白基因和金黄色葡萄球菌噬菌体lsa2311的末端酶大亚基基因进行分析设计,采用primer primer 5设计能特异性鉴别肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的两对引物,引物由上海生工公司合成:
[0062]
sep37-f:5
’‑
tccgtaccttggcagaaactt-3’(如seq id no:1所示);
[0063]
sep37-r:5
’‑
gtacggtcaccagctaagttga-3’(如seq id no:2所示);
[0064]
lsa2311-f:5
’‑
tgataagacaggtgaaatgtaccaagt-3’(如seq id no:4所示);
[0065]
lsa2311-r:5
’‑
ccgttgcctttatcatatagttctttaa-3’(如seq id no:5所示);
[0066]
为了确定该双重实时荧光定量pcr检测试剂盒的两对引物的特异性,分别使用肠炎沙门氏菌噬菌体sep37及其dna、金黄色葡萄球菌噬菌体lsa2311及其dna、sep37和lsa2311的dna混合物、沙门氏菌噬菌体t55、t102、金黄色葡萄球菌噬菌体lsa2302、副溶血弧菌噬菌体vpp1的dna作为模板,并用灭菌超纯水作为无模板空白对照,经普通pcr反应,琼脂糖凝胶电泳观察所得到的pcr产物。结果只有在肠炎沙门氏菌噬菌体sep37基因组中能扩增出来120bp的目的片段,在金黄色葡萄球菌噬菌体lsa2311基因组中能扩增出123bp的目的片段,其他噬菌体均未扩增出目的片段(如图1和图2所示),这表明所设计的引物具有较好的特异性,可用于沙门氏菌、金黄色葡萄球菌的特异性检测。
[0067]
其反应程序如下:
[0068]
[0069]
pcr程序为:94℃3min;94℃15s,55℃15s,72℃30s,30个循环;94℃3min。
[0070]
实施例2taqman探针设计
[0071]
利用primer primer 5设计满足以下要求的探针:
①
首字母不能为“g”;
[0072]
②
尽量不要出现连续≥3的“g”;
[0073]
③
一般尽量“c”碱基含量》“g”碱基,a、t、c、g含量均匀,gc含量在40%~60%;
[0074]
④
探针长度尽量≤27bp,最好不要超过30bp,tm值比引物≥10℃,探针由上海生工公司合成:
[0075]
sep37-probe:5
’‑
fam-aagctgctccaatgcccgctggtatcg-bhq1-3’(如seq id no:3所示);
[0076]
lsa2311-probe:
[0077]5’‑
hex-taaacgcagaggagacgaccattacgcac-bhq2-3’(如seq id no:6所示)。
[0078]
实施例3双重qpcr扩增效率
[0079]
将热裂解提取的肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的dna作为模板进行扩增,分别评估两对引物扩增的效率;其中,双重qpcr的反应扩增体系如下:
[0080][0081]
qpcr扩增条件:94℃预处理3min,进行40个循环反应,每个循环包括94℃5s,60℃30s。
[0082]
将肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311混和物的dna进行10倍梯度稀释,各取1μl稀释后各个梯度的dna做模板,进行qpcr检测,(如图3所示)结果显示每个反应管内两个待测基因的荧光信号达到阈值所需的循环数(ct)和起始模板拷贝数的对数存在明显的线性关系(肠炎沙门氏菌噬菌体sep37标准曲线为y=-3.14286x+29.26857,r2=0.9922,扩增效率为108%;金黄色葡萄球菌噬菌体lsa2311标准曲线为y=-3.12857x+30.0214,r2=0.9919,扩增效率为108%)。设计引物符合标准,双重qpcr反应体系正常。
[0083]
实施例4
[0084]
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒,包括特异性检测肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的引物和探针、含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液、含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液、阴性对照品、阳性对照品、硫酸亚铁铵溶液和柠檬酸三钠溶液;其中,
[0085]
特异性检测肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的引物和探针,具体序列如下:
[0086]
sep37-f:5
’‑
tccgtaccttggcagaaactt-3’;
[0087]
sep37-r:5
’‑
gtacggtcaccagctaagttga-3’;
[0088]
sep37-probe:
[0089]5’‑
fam-aagctgctccaatgcccgctggtatcg-bhq1-3’;
[0090]
lsa2311-f:5
’‑
tgataagacaggtgaaatgtaccaagt-3’;
[0091]
lsa2311-r:5
’‑
ccgttgcctttatcatatagttctttaa-3’;
[0092]
lsa2311-probe:
[0093]5’‑
hex-taaacgcagaggagacgaccattacgcac-bhq2-3’。
[0094]
含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液中肠炎沙门氏菌噬菌体sep37效价为107pfu/ml,所述含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液中金黄色葡萄球菌噬菌体lsa2311效价为108pfu/ml;
[0095]
阴性对照品:灭菌超纯水;
[0096]
阳性对照品为肠炎沙门氏菌、金黄色葡萄球菌,分别为肠炎沙门氏菌atcc 13076、金黄色葡萄球菌atcc 25923;
[0097]
硫酸亚铁铵溶液浓度为30mm;
[0098]
柠檬酸三钠溶液为20mm。
[0099]
实施例5
[0100]
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒同时检测沙门氏菌和金黄色葡萄球菌的方法如下:
[0101]
1)双重噬菌体生物扩增法检测
[0102]
a.将含有肠炎沙门氏菌噬菌体sep37的磷酸缓冲液和含有金黄色葡萄球菌噬菌体lsa2311的磷酸缓冲液混合,得到混合悬液,然后混合悬液与前处理的待检测样品按体积1:1混合,37℃培养,得到培养物;其中,混合悬液中,肠炎沙门氏菌噬菌体sep37的效价为106pfu/ml,金黄色葡萄球菌噬菌体lsa2311的效价为107pfu/ml;
[0103]
b.培养物与硫酸亚铁铵溶液的按体积1:1混合,硫酸亚铁铵溶液浓度为30mm,培养时间为10min;并加入lb液体培养基并补充至1ml,37℃培养;然后加入100μl浓度为20mm的柠檬酸三钠溶液;
[0104]
c.将混合液离心,得到上清液,即为肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的混合子代噬菌体;
[0105]
2)子代噬菌体的双重实时荧光定量pcr检测:
[0106]
a.热裂解法提取混合子代噬菌体的dna:取100μl子代噬菌体原液于ep管中,沸水煮20min,冰浴20min,10000r/min离心10min,转移上层溶液至新的ep管中。并保存于-20℃;
[0107]
b.以混合子代噬菌体的dna为模板,利用检测肠炎沙门氏菌噬菌体sep37和金黄色葡萄球菌噬菌体lsa2311的两对引物和探针进行实时荧光定量pcr得到pcr产物,其中,两对引物对和探针分别为:
[0108]
sep37-f:5
’‑
tccgtaccttggcagaaactt-3’;
[0109]
sep37-r:5
’‑
gtacggtcaccagctaagttga-3’;
[0110]
sep37-probe:
[0111]5’‑
fam-aagctgctccaatgcccgctggtatcg-bhq1-3’;
[0112]
lsa2311-f:5
’‑
tgataagacaggtgaaatgtaccaagt-3’;
[0113]
lsa2311-r:5
’‑
ccgttgcctttatcatatagttctttaa-3’;
[0114]
lsa2311-probe:
[0115]5’‑
hex-taaacgcagaggagacgaccattacgcac-bhq2-3’;
[0116]
c.qpcr产物的ct值与标准曲线分析得到待检测的样品中是否含有沙门氏菌和金黄色葡萄球菌并确定沙门氏菌和金黄色葡萄球菌的含量;其中,
[0117]
双重qpcr的反应扩增体系如下:
[0118][0119]
qpcr扩增条件:94℃预处理3min,进行40个循环反应,每个循环包括94℃5s,60℃30s。
[0120]
实施例6
[0121]
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒最低检出限
[0122]
将金黄色葡萄球菌atcc 25923和肠炎沙门氏菌atcc 13076的混合菌液十倍梯度稀释(10
8-100cfu/ml),采用噬菌体sep37和lsa2311的双重噬菌体生物扩增条件:将梯度稀释的混合菌液与106cfu/ml的噬菌体sep37和107cfu/ml的噬菌体lsa2311共同孵育20min,加入30mm的fas作用10min,再加入20mm的柠檬酸三钠作用10min,培养30min以释放子代噬菌体。再采用热裂解法提取子代噬菌体dna,各取1μl做模板,在荧光定量pcr仪上进行扩增反应。以宿主菌浓度为横坐标,ct值为纵坐标建立标准曲线(如图4所示)。结果显示宿主菌浓
度与ct值成线性关系(肠炎沙门氏菌atcc 13076标准曲线为y=-2.3774x+29.3615,r2=0.9931;金黄色葡萄球菌atcc 25923标准曲线为y=-2.2898x+29.7976,r2=0.9990)。且当宿主菌浓度小于101cfu/ml时,沙门氏菌和金黄色葡萄球菌均无法检出,因此沙门氏菌、金黄色葡萄球菌的最低检出限均为101cfu/ml。
[0123]
实施例7
[0124]
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒特异性检测实验
[0125]
分别以菌液浓度均为108cfu/ml的肠炎沙门氏菌atcc13076、金黄色葡萄球菌atcc 25923、灭活的atcc 13076和atcc25923、大肠杆菌o157:h7、副溶血弧菌atcc 33846、单增李斯特菌atcc 19114及混合菌液作为特异性样本采用噬菌体sep37和lsa2311的双重噬菌体生物扩增条件:将梯度稀释的混合菌液与106cfu/ml的噬菌体sep37和107cfu/ml的噬菌体lsa2311共同孵育20min,加入30mm的fas作用10min,再加入20mm的柠檬酸三钠作用10min,培养30min以释放子代噬菌体。采用热裂解法分别提取培养0min和30min后混合液中混合噬菌体的dna,各取1μl做模板,在荧光定量pcr仪上进行扩增反应。计算δct值,当δct≥1时,认定为阳性,即检测出沙门氏菌和金黄色葡萄球菌,否则为阴性。以传统培养法作为标准:将上述菌液于37℃增菌12h后分别接种于baird parker平板和xld平板上,将平板倒置于37℃培养48h,观察baird parker平板和xld平板上是否有特征菌落出现。结果如表1所示,只有活的肠炎沙门氏菌atcc13076和金黄色葡萄球菌atcc 25923有明显扩增,含有上述两种活菌的混合菌液也有明显扩增,并且与传统培养法的结果一致,说明该方法具有特异性。
[0126]
表1基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒特异性结果
[0127][0128]
实施例8
[0129]
基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒稳定性检测实验
[0130]
对样品进行组内重复实验(intra-assay variation)(n=3),并计算变异系数值(coefficient of variation,cv),评估该方法的重复性和稳定性。热裂解法提取噬菌体sep37和lsa2311混合子代噬菌体的dna,将其10倍梯度稀释后进行qpcr扩增,重复3次,结果如表2所示,组内变异系数均小于15%,即结果离散程度小,建立的双重qpcr同时检测沙门氏菌、金黄色葡萄球菌方法稳定性好,重复性高。
[0131]
表2基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒稳定性结果
[0132][0133]
实施例9
[0134]
利用基于噬菌体生物扩增双重实时荧光定量pcr快速检测试剂盒在加标食品中的应用
[0135]
1、在加标生菜样品同时检测沙门氏菌、金黄色葡萄球菌的应用
[0136]
(1)生菜样品的制备:从菜市场买回生菜去除最外两层,剩下部分用无菌水冲洗,同时用75%酒精擦拭一遍,再置于紫外光照20min(正反各10min)。之后以无菌钻孔器(直径1.5cm)取中间鲜嫩的部分,置于无菌培养皿中,暂存于4℃。
[0137]
(2)最低检出限:
[0138]
吸取1ml所制备的沙门氏菌和金黄色葡萄球菌混合菌悬液,梯度稀释。取10μl菌悬液(10
0-109cfu/cm2)滴加于生菜表面,均匀涂在生菜表面,得到样品上人工污染沙门氏菌菌液10
0-108cfu/cm2。将样品放置至安全柜中放置45min。用镊子轻取生菜样品于含有800μl无菌水的ep管中混匀。样品研磨匀浆,匀浆液在37℃下,8000r/min离心10min,取上清液。按上述试剂盒使用方法以热裂解法提取基因组进行qpcr反应。结果如图5所示,对于加标生菜样品中,肠炎沙门氏菌atcc 13076标准曲线为y=-2.1722x+30.1989,r2=0.9947;金黄色葡萄球菌atcc 25923标准曲线为y=-1.9296x+29.9408,r2=0.9994。当生菜样品中宿主菌浓
13076和atcc 25923混合菌液,按上述试剂盒使用方法以热裂解法提取基因组进行qpcr反应。结果如图6所示,肠炎沙门氏菌atcc 13076标准曲线为y=-2.1722x+30.1989,r2=0.9947;金黄色葡萄球菌atcc 25923标准曲线为y=-1.9296x+29.9408,r2=0.9994。且当牛奶样品中宿主菌浓度小于101cfu/ml时,沙门氏菌和金黄色葡萄球菌均无法检出,因此沙门氏菌、金黄色葡萄球菌的最低检出限均为101cfu/ml。
[0146]
(3)特异性实验:牛奶样品中分别接种100μl肠炎沙门氏菌atcc 13076、金黄色葡萄球菌atcc 25923、灭活的atcc 13076和atcc 25923、大肠杆菌o157:h7、副溶血弧菌atcc 33846、单增李斯特菌atcc 19114,以及混合菌液。按上述试剂盒使用方法以热裂解法分别提取培养0min和30min后混合子代噬菌体的dna进行qpcr反应,计算δct值,当δct≥1时,认定为阳性,即牛奶样品中检测出沙门氏菌和金黄色葡萄球菌,否则为阴性。以传统培养法作为标准:将上述菌液于37℃增菌12h后分别接种于baird parker平板和xld平板上,将平板倒置于37℃培养48h,观察baird parker平板和xld平板上是否有特征菌落出现。结果如表4所示。由表可知,只有活的肠炎沙门氏菌atcc 13076和金黄色葡萄球菌atcc 25923有明显扩增,含有上述两种活菌的混合菌液也有明显扩增,并且与传统培养法的结果一致,说明该方法具有特异性。
[0147]
表4快速检测试剂盒在加标牛奶中的特异性结果
[0148][0149]
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1