1.本发明属于基因工程领域,具体涉及一种大肠杆菌重组表达载体及其应用。
背景技术:
2.胎盘样硫酸软骨素a(plcsa)为附着至蛋白聚糖的、交替的氨基糖和己糖醛酸残基的直链聚合物,已有研究证实plcsa广泛地在胎盘滋养细胞上表达。此外,研究证实,表达疟疾蛋白var2csa的恶性疟原虫只粘附在胎盘上,var2csa通过介导受恶性疟原虫感染的红细胞与合体滋养细胞表面的plcsa结合从而聚集在胎盘。可见,疟疾蛋白var2csa可以特异性地与plcsa结合。于是有研究者通过噬菌体筛选方法鉴定了来自var2csa的最小plcsa结合区的肽,然后通过组织学分析证明了其靶向性,并将其命名为胎盘硫酸软骨素a结合肽(plcsa-bp)。因此,采用plcsa-bp制备的纳米粒子未来有望用作针对人类胎盘滋养细胞的靶向药物的工具。
3.小干扰rna(small interfering rna,sirna)是一种靶向核酸的治疗药物。与小分子和单克隆抗体药物相比,sirna有一个天然优势。小分子和单克隆抗体药物通常是依靠识别对应蛋白质复杂的空间构象来发挥作用。由于多数蛋白质的空间构象难以匹配吻合度高的小分子和单克隆抗体药物,以至于很多疾病都无法通过该类药物治疗。而sirna是凭借与mrna完全碱基互补配对的方式发挥作用。于是从理论上讲,sirna可通过序列特异性的特点靶向沉默任何致病基因,以此对多种疾病都可以进行精准靶向治疗。但是sirna药物所具有的一些致命缺点又极大地限制了其临床应用。例如裸露的sirna极易被降解难以通过血液循环到达靶细胞、游离的sirna很难进行跨膜运输、sirna的有义链(或过客链)导致的脱靶效应等。为了清除上述障碍,让sirna药物真正发挥出价值,相关学者致力于对sirna进行各种化学修饰并开发出大量的递送系统,目前构建了包括脂质体、聚合物、细胞外膜囊泡、无机纳米颗粒、肽类大分子等递送载体。
4.在上述递送载体中,细菌外膜囊泡(outer membrane vesicles,omvs)凭借粒径小、稳定、生物相容性好等优点成为一种理想的药物递送载体。细菌外膜囊泡是革兰氏阴性菌分泌的一种直径为30-200nm的球形纳米囊泡,属于磷脂双分子层蛋白脂质体,它在细菌的生命活动中发挥着重要作用,能够保护细菌免受有害物质侵害、调节细菌生物膜的形成、介导细菌间的交流等。
5.目前,工程化omvs在靶向递送系统领域已经有不少研究,但是针对载sirna胎盘靶向的工程化omvs,现有技术中并未见相关报道。因此,如何制备并成功构建得到产率高、特异性强、安全性好,能够有效载sirna的胎盘靶向的工程化omvs,从而有效促进胎盘病变相关疾病治疗药物的开发,成为亟待解决的技术问题。
技术实现要素:
6.基于以上目的,本发明的目的之一在于提供一种大肠杆菌重组表达载体,其能够分泌在表面表达目标蛋白plcsa-bp的细菌外膜囊泡(omvs),并且产率高,胎盘靶向性好,能
够有效作为sirna载体。
7.本发明的目的之二在于提供一种大肠杆菌重组表达载体在生产细菌外膜囊泡中的应用,生产所得细菌外膜囊泡是一种具有安全性和靶向性、能够有效保护sirna的omvs载体。
8.为了实现上述目的,本发明的大肠杆菌重组表达载体,采用如下技术方案实现:
9.一种大肠杆菌重组表达载体,含有如seq id no.1所示的核苷酸序列;所述大肠杆菌重组表达载体在构建时,是将inaxn冰核蛋白、sfgfp绿色荧光蛋白和plcsa-bp目标蛋白的编码基因构建成重组质粒后,转入减毒大肠杆菌得到。
10.inaxn冰核蛋白为冰核蛋白n末端结构域蛋白,sfgfp为超折叠绿色荧光蛋白(super fold green fluorescent protein)。本发明通过前期研究证实,采用inaxn冰核蛋白作为铆钉蛋白,可将sfgfp绿色荧光蛋白和pics-bp目标蛋白有效融合表达在细胞膜上。
11.基于此,本发明利用基因工程技术设计了一种能够分泌具有安全性和靶向性omvs载体的大肠杆菌重组表达载体,其含有如seq id no.1所示的核苷酸序列,开放阅读框序列全长1326bp,依次编码inaxn冰核蛋白、sfgfp绿色荧光蛋白、pics-bp目标蛋白。其中1~528bp位点处为inaxn冰核蛋白编码基因(528bp),529-1242bp位点处为sfgfp绿色荧光蛋白编码基因(714bp),1243~1326bp位点处为pics-bp目标蛋白编码基因(84bp)。
12.为了使目标蛋白plcsa-bp稳定表达于大肠杆菌以及omvs表面,并有效提高omvs的表达量,本发明通过将plcsa-bp与inaxn冰核蛋白融合表达,并连接sfgfp作为指示蛋白,使得omv表达量提高,并且具有绿色荧光可以在显微镜下被示踪,同时,表达得到omv的既具有优于脂质体的特点,同时有更好的稳定性、生物相容性、安全性以及胎盘靶向性,是一种能有效保护sirna的载体,能够有效促进胎盘病变相关的疾病治疗药物的开发,具有良好的临床应用价值。
13.基于安全性的首要考虑,本发明采用的减毒大肠杆菌,为预先敲除了msbb基因的大肠杆菌。具体操作时,可采用crispr法敲除大肠杆菌msbb基因。本发明通过实验证实,通过msbb基因的预先敲除,能够有效降低表达产物的毒性,更利于产物安全性的提高。
14.本发明的另一方面在于提供一种大肠杆菌重组表达载体在生产细菌外膜囊泡中的应用,所述细菌外膜囊泡的表面表达有plcsa-bp目标蛋白。
15.采用本发明的大肠杆菌重组表达载体,能够生产表达得到含有plcsa-bp蛋白的细菌外膜囊泡,实验证实,本发明生产的omvs内毒素值低,表达量高,是一种更加安全的omvs载体。并且,omvs稳定性好,有利于长期保存,是一种兼具胎盘靶向性、安全性的载sirna天然生物载体。
16.产物的表达同时受培养温度、培养时间和诱导剂的多重影响。本发明在进行诱导剂、温度、时间筛选后,选择大肠杆菌重组表达载体生产细菌外膜囊泡的诱导表达的条件为:含有0.1~1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,20~30℃条件下诱导4~14h。
17.为进一步提高产物表达量,更优选地,所述大肠杆菌重组表达载体诱导表达的条件为:含有1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,30℃条件下诱导14h。
18.进一步优选地,为提高omvs分离回收效果,所述大肠杆菌表达载体在诱导表达细菌外膜囊泡后,采用超滤浓缩法对分泌得到的细菌外膜囊泡进行提取和纯化。
附图说明
19.图1为本发明实施例1的表达载体中大肠杆菌sfgfp的蛋白质印迹分析;
20.图2为本发明实施例1和对照组得到的omv的重组蛋白检测结果;
21.图3为本发明中wtomv、momv和affi
plcsa-bp
omv水合粒径及电位分布曲线图;
22.图4为本发明实施例1中重组大肠杆菌的透射电镜图;
23.图5为本发明中纯化前后omvs的透射电镜图(标尺:200nm);
24.图6为本发明中wtomv、momv和affi
plcsa-bp
omv的透射电镜图;
25.图7为本发明中放置前后omv的透射电镜图:(a)现制omv;(b)pbs中放置一个月后;
26.图8为本发明中不同实验组中omvs的产率;
27.图9为本发明中不同诱导条件下omv的重组蛋白检测结果;
28.图10为本发明中裂解前后各组omvs的内毒素结果;
29.图11为本发明实施例2所得omvs的药物释放曲线;
30.图12为本发明中不同制剂在rnase a中孵育后的琼脂糖凝胶电泳图。
具体实施方式
31.下面结合附图以及具体实施例对本发明做进一步的详细说明。以下实施例中所用大肠杆菌为杭州丰海生物科技有限公司提供的大肠杆菌bl21(de3),lb液体培养基购自北京索莱宝科技有限公司;bca蛋白定量试剂盒购自上海雅酶生物科技有限公司;pcr产物纯化试剂盒购自杭州宝赛生物科技有限公司;2
×
superpfu pcr mix、e.coli dh5α感受态细胞来自杭州宝赛生物科技有限公司。其他未做特殊说明的设备及试剂,均可从商业途径得到。
32.实施例1
33.本实施例的大肠杆菌重组表达载体,含有如seq id no.1所示的核苷酸序列;大肠杆菌重组表达载体在构建时,是将inaxn冰核蛋白、sfgfp绿色荧光蛋白和plcsa-bp目标蛋白的编码基因构建成重组质粒后,转入减毒大肠杆菌得到。减毒大肠杆菌为预先敲除了msbb基因的大肠杆菌bl21(de3)
△
msbb。
34.表达载体的具体构建过程如下:
35.1)sfgfp基因的扩增:以sfgfp绿色荧光蛋白的质粒作为模板,采用sfgfp-ecori-f/sfgfp-saci-r引物按照如下程序进行扩增:2
×
superpfu pcr mix 25μl;引物p1(10μm)2μl;引物p2(10μm)2μl;sfgfp质粒2μl;ddh2o 19μl;total 50μl。扩增条件:94℃预变性5min;(94℃30s、55℃30s、68℃20s)30个循环;然后10℃保持。其中,sfgfp-ecori-f/sfgfp-saci-r引物序列如下所示:
36.sfgfp-ecori-f:ggaattcatgagcaaaggagaagaactttt;
37.sfgfp-saci-r:cgagctctttgtagagctcatccatgccat。
38.2)多肽片段融合:反应体系为:10
×
退火buffer 1μl;tai-f1(50μm)4.5μl;tai-r1(50μm)4.5μl;total 10μl。其中,tai-f1、tai-r1序列如下:
39.tai-f1:attaattttgatacaaaagagaaatttctagcaggatgcttaattgtttct;
40.tai-r1:agaaacaattaagcatcctgctagaaatttctcttttgtatcaaaattaat。
41.上述反应体系于95℃反应5min,自然降温后作为pcr模板,采用引物tai-f2saci和
tai-r2hindiii进行反应。反应体系为:2
×
superpfu pcr mix 25μl;tai-f2saci(10μm)2μl;tai-r2hindiii(10μm)2μl;sfgfp质粒2μl;ddh2o 19μl;total 50μl。反应条件为:94℃预变性5min;(94℃30s、55℃30s、68℃10s)30个循环;然后10℃保持。引物序列如下:
42.tai-f2saci:cgagctctacaaagaagatgtaaaggatattaattttgatacaaaagag;
43.tai-r2hindiii:cccaagcttttaattttttccttcatgaaaagaaacaattaagcatcctgct。
44.3)sfgfp与多肽片段融合:扩增的sfgfp及多肽片段经saci单酶切后连接后作为pcr模板,用sfgfp-ecori-f/tai-r2hindiii进行扩增,扩增体系为:2
×
superpfu pcr mix 25μl;sfgfp-ecori-f(10μm)2μl;tai-r2hindiii(10μm)2μl;sfgfp-肽连接产物2μl;ddh2o 19μl;total 50μl。扩增条件为:94℃预变性5min,(94℃30s、55℃30s、68℃30s)30个循环,然后10℃保持。
45.4)酶切:将步骤3)融合的扩增产物经pcr产物纯化试剂盒回收后,按照如下条件进行酶切:
46.10
×
fast digest buffer 5μl;fast digest ecori 1μl;fast digest hindiii 1μl;sfgfp-picsa-bps43μl;total 50μl。37℃酶切3h,pcr产物纯化后得载体酶切回收产物。
47.10
×
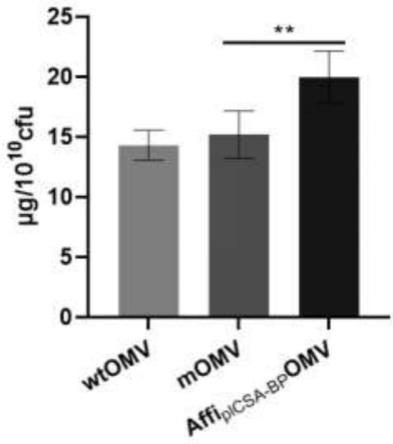
fast digest buffer 5μl;fast digest ecori 1μl;fast digest hindiii 1μl;pet30b-inaxn20μl;ddh2o 23μl;total 50μl。37℃酶切1h,pcr产物纯化后得pcr酶切产物。
48.5)连接转化:取10
×
t4 dna ligase buffer 1μl;载体酶切回收产物2μl;pcr酶切产物6μl;t4 dna ligase 1μl;total 10μl。16℃过夜连接转化ecoli dh5alpha感受态细胞涂布kan抗性(50μg/ml)平板,37℃培养,对长出的克隆菌落进行pcr鉴定。
49.6)菌落pcr鉴定:鉴定采用的引物为:t7:taatacgactcactataggg;t7 ter:tgctagttattgctcagcgg。
50.扩增体系:挑取单克隆产物至10μl无菌水中混匀,取0.5μl作为模板按照如下体系扩增:2
×
taq pcr mix 10μl;t7(10μm)0.5μl;t7 ter(10μm)0.5μl;菌液0.5μl;ddh2o 8.5μl;total 20μl;扩增条件为:94℃预变性5min;(94℃30s、55℃30s、72℃30s)32个循环,然后10℃保持。扩增后挑取阳性克隆体接种至lb液体培养基中培养提取质粒进行测序。
51.7)转化大肠杆菌:将测序正确的inaxn-sfgfp-plcsa-bp重组质粒(序列如seq id no.1所示)转化至制备好的减毒大肠杆菌bl21(de3)
△
msbb感受态细胞中,得到重组大肠杆菌bl21(de3)。
52.实施例2
53.本实施例为大肠杆菌重组表达载体在生产细菌外膜囊泡中的应用,生产的细菌外膜囊泡的表面表达有plcsa-bp目标蛋白。利用本发明实施例1的大肠杆菌重组表达载体生产细菌外膜囊泡的具体操作如下:
54.1)重组大肠杆菌bl21(de3)的培养
55.将实施例1得到的重组大肠杆菌bl21(de3)菌株于37℃融化,pbs稀释10倍,平板划线法接种至平板中,37℃培养20~22h,挑单菌落接种到11ml lb液体培养基中,37℃,150r/min培养20~22h得到种子液,种子液以每1ml接种到100ml空白lb液体培养基的同条件比例扩大培养,以空白培养基作为对照,用酶标仪测细菌培养液的od600值,直到od600值为1,即
可进行提取细菌外膜囊泡。另外重组大肠杆菌od600为0.5~0.8时,通过添加1m(0.2383g/ml)异丙基β-d-1-硫代吡喃半乳糖苷(iptg;在细菌培养物中以1:1000稀释)诱导蛋白质表达。将培养物在30℃下孵育14h,测od600后提取细菌外膜囊泡。
56.2)omvs的制备及纯化
57.使用超滤浓缩法,1l菌液通过在4℃下5000g离心30min来去除细菌细胞。通过0.45μm醋酸纤维素滤膜过滤所得上清液,并使用100k超滤膜(millipore)浓缩至1/5体积,4℃下4000g离心。4℃下5000g离心10min来去除浓缩过程中的杂质,0.22μm微孔滤膜过滤。然后在4℃、150000g超速离心3h,弃去上清,沉淀以适量pbs缓冲液重悬;再次在4℃、150000g超速离心3h,弃去上清。然后用pbs将沉淀重悬在50ml、100k超滤离心管中浓缩至原体积的1/5,再次在超滤管中加入pbs浓缩至原体积的1/5,重复该步骤10次。4℃下5000g离心10分钟来去除浓缩过程中的杂质,0.22μm微孔滤膜过滤。然后在4℃、150000g超速离心3h,弃去上清,最终将沉淀重悬于200μlpbs,再次用0.22μm醋酸纤维素滤膜过滤,分装50微升每管,共4管,并保存在-20℃的条件下。平板划线培养过夜以确定无菌。
58.实验例
59.实验例1蛋白质印迹分析检测重组蛋白的表达
60.为了确认重组大肠杆菌菌株上是否存在特定抗原,对野生型大肠杆菌菌株(记为wte.coli)、减毒大肠杆菌菌株(记为me.coli)、本发明实施例1所得的重组大肠杆菌菌株(记为affi
plcsa-bp
e.coli)进行蛋白质印迹分析(westerrn blotting),以标签蛋白sfgfp荧光蛋白为目标检测融合蛋白(约55kda)(包括有inaxn冰核蛋白(约25kda)、sfgfp荧光蛋白(26.2kda)、plcsa-bp肽(3.4kda))的表达情况。具体操作时包括以下步骤:(1)大肠杆菌细胞培养物蛋白的提取;(2)bca蛋白定量;(3)聚丙烯酰胺凝胶电泳;(4)转膜、封闭、抗体孵育;(5)使用化学发光凝胶成像仪对目标蛋白条带进行扫描成像。结果如图1所示。
61.由图1可知,将在野生型大肠杆菌(wte.coli)、减毒大肠杆菌(me.coli)和重组大肠杆菌(affi
plcsa-bp
e.coli)中分别提取的外膜蛋白进行westerrn blotting检测,以sfgfp蛋白作为指示蛋白对其进行检测,55kda是融合蛋白理论上表达的位置,wte.coli和me.coli在55kda处均没有蛋白印迹,而affi
plcsa-bp
e.coli在此处有明显的印迹。上述结果表明野生型大肠杆菌和减毒大肠杆菌外膜蛋白中不含重组蛋白,而本发明的重组大肠杆菌的外膜成功表达了融合蛋白。
62.进一步的,为了进一步确认affi
plcsa-bp
omv是否表达了重组蛋白以及蛋白是否定位在外膜上,继续用westerrn blotting实验提取纯化后的wtomv(野生)、momv(减毒)和本发明实施例1表达得到的affi
plcsa-bp
omv以及经pk或edta处理后的affi
plcsa-bp
omv进行检测。其中pk只能降解暴露在omvs外面的蛋白质,而edta能够破坏膜结构,使膜内蛋白暴露出来。结果如图2所示,首先wtomv、momv和affi
plcsa-bp
omv中,只有affi
plcsa-bp
omv在55kda处有蛋白印迹,说明affi
plcsa-bp
omv成功表达了目标蛋白。另外,经pk单独处理的affi
plcsa-bp
omv在55kda处的有蛋白印迹消失,说明在affi
plcsa-bp
omv暴露在外面的重组蛋白被降解,膜内表达的重组蛋白不会被westerrn blotting技术检测到;edta单独处理affi
plcsa-bp
omv则对融合蛋白几乎无影响,即裂解前后目标蛋白表达无变化,可见该蛋白大部分暴露在膜表面;而pk处理后再经edta裂解的affi
plcsa-bp
omv在55kda处没有蛋白印迹,再次印证重组蛋白在膜内几乎没有表达。上述结果说明经由inaxn冰核蛋白引导序列引导,目的蛋白成功地呈递在omvs的
表面,并且在膜内几乎不表达。
63.实验例2omvs的形貌和尺寸
64.本实验例对实施例2表达得到的omvs的形貌和尺寸进行分析,具体过程简述如下:实验采用激光粒度仪来测定omvs的粒径和电位。取适量affi
plcsa-bp
omv,加入pbs稀释至1ml,混合均匀,使用马尔文激光粒径仪测定。利用tccnai透射电子显微镜对纯化前后和在室温条件下放置一个月前后的affi
plcsa-bp
omv以及重组大肠杆菌的形貌进行表征。选择200目的铜网,吸取10μl纳米粒稀释液滴于其正面,放置1~3min后,从液珠边缘吸去多余液体,稍晾干,取2%磷钨酸染色液,滴一小滴于蜡盘上,将吸附有样品的铜网放置于染液表面,染色时间3~5min,白炽灯下晾干,拍照。结果如下所示:
65.采用激光粒度仪对提取纯化的wtomv、momv和affi
plcsa-bp
omv进行水合粒径及电位的测定。如图3所示,wtomv的水合粒径为51.49
±
1.31nm,电位为-16.3
±
1.9mv,pdi为0.31
±
0.04;momv的水合粒径为51.33
±
1.64nm,电位为-16.6
±
1.3mv,pdi为0.33
±
0.05;affi
plcsa-bp
omv的水合粒径为51.34
±
1.44nm,电位为-16.9
±
0.7mv,pdi为0.31
±
0.03。三组载体的水合粒径及电位均没有观察到显著的差别。
66.利用透射电子显微镜对重组大肠杆菌、纯化前后的omvs以及wtomv、momv和affi
plcsa-bp
omv以及在室温条件下放置一个月前后的affi
plcsa-bp
omv的形貌特征进行表征,对重组大肠杆菌形态、纯化效果、三组omvs的形态进行评价,结果如图4~7所示。
67.通过透射电镜观察重组大肠杆菌的形态如图4所示,是两端钝圆的杆菌,长度约在1~3微米左右,因生长条件的不同,个别菌体可呈近视球状或长丝状,没有观察到与普通大肠杆菌的明显区别。
68.在透射电镜下对纯化前后的omvs进行了观察,结果如图5所示,发现经过纯化后,原本存在的大量鞭毛几乎都消失了。对比wtomv、momv和affi
plcsa-bp
omv的透射电镜图(图6),未发现三组omvs的形态大小有明显差异。omvs的粒径大多分布在20~60nm,较激光粒度仪测得的50nm左右的水合粒径小,个别较大的omvs粒径可以达到80nm左右。omvs呈球形囊泡结构,表现出细胞膜的磷脂双分子层结构,并且个别omvs呈类似红细胞扁状的囊泡结构。
69.对比在室温条件下的pbs中放置一个月前后的透射电镜图,未发现affi
plcsa-bp
omv的形态大小有明显改变,只有轻微的聚集现象(见图7),说明本发明得到的affi
plcsa-bp
omv在pbs中的稳定性良好,在室温下的pbs中至少可以放置一个月。
70.实验例3omvs的产率测定
71.omvs的产率是衡量细菌成囊率的关键指标。本实验例对不同实验组的omvs的产率进行测定,具体过程如下:
72.根据bca试剂盒说明,按照体积比50:1将试剂a和试剂b混合,配制bca工作液。于96孔板中,将标准蛋白(2mg/ml)用ddh2o稀释成不同浓度比例(n=3),每孔分别加入200μlbca工作液,于微孔板恒温振荡器中37℃轻微震荡孵育30min。待冷却至室温后,用多功能酶标仪在562nm的波长处测定吸光值。根据设置的标准蛋白浓度绘制标准曲线,并计算待测蛋白样品浓度。分别测得提取纯化出的wtomv、momv和实施例2得到的affi
plcsa-bp
omv的蛋白含量后,以od600值计算所收获细菌的数量(od600=1所对应的细菌数为5.6*10
10
cfu/ml)。最后以蛋白产率比,即每10
10
个细菌所获得的总蛋白量(μg)分别计算三种omvs的产率。结果如图8所示。
73.由图8可知,wtomv、momv和affi
plcsa-bp
omv的产率比分别为14.32
±
1.24μg/10
10
个细菌、15.19
±
1.97μg/10
10
个细菌、19.98
±
2.18μg/10
10
个细菌。其中wtomv和momv的产率无显著性差异(p》0.05);affi
plcsa-bp
omv的产量显著性高于wtomv和momv的产率(**p《0.01),可见本发明通过蛋白融合表达,能够显著提高owv的产率。
74.实验例4omvs膜上重组蛋白表达条件的优化
75.本实验例在前期探究实验的基础上,选择的较佳表达条件为:含有0.1~1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,20~30℃条件下诱导4~14h。为了进一步确定最佳条件,本发明进一步研究了两个温度、两个时间段和两个诱导剂浓度对表达量的影响。实验条件和结果如图9所示,1组和2组,以及4和5组比较,发现无论是诱导4h还是诱导14h,30℃条件下诱导的蛋白条带都比20℃诱导更多的重组蛋白表达(*p《0.05);2组和3组,以及5组和6组比较,发现无论是20℃还是30℃条件下,诱导14h的条件下诱导的蛋白表达量都比诱导4h多(****p《0.0001);另外1和4组,2和5组,以及3和6组比较,发现1mm异丙基β-d-1-硫代吡喃半乳糖苷(iptg)诱导的蛋白条带都比0.1mm的iptg诱导的蛋白条带明显(**p《0.01)。综上所述,在本发明中目标蛋白诱导的最佳条件是加入终浓度为1mm的iptg,30℃条件下诱导14h。
76.实验例5鲎试剂法检测omvs的内毒素含量
77.通过配制一系列浓度梯度的内毒素标准品,利用鲎试剂试剂盒,以内毒素浓度为横坐标,以545nm处的吸光度为纵坐标进行线性回归,标准曲线方程为y=1.2917x+0.0161,r2=0.998。标准曲线的相关系数r2为0.998》0.980。affi
plcsa-bp
omvs和momvs均为敲除msbb基因的大肠杆菌所分泌的囊泡,所以affi
plcsa-bp
omvs内毒素检测浓度与momvs一致。wtomvs、momvs和affi
plcsa-bp
omvs三组载体裂解前后的内毒素结果如图10所示,结果显示裂解前后三组内毒素均没有显著性差异(p》0.05);且裂解前后wtomvs的内毒素值均显著大于momvs和affi
plcsa-bp
omvs的内毒素值(****p《0.0001)。上述结果表明经过msbb基因敲除的大肠杆菌与普通大肠杆菌相比,其所分泌的omvs内毒素值显著减小,降低了细菌内毒素在体内外给药带来的毒性,是一种更加安全的omvs载体。
78.实验例6affi
plcsa-bp
omv载体对sirna药物的载药性能研究
79.本实验例利用电穿孔技术将设计好的sirna药物分别载入提取纯化后的wtomv、momv和affi
plcsa-bp
omv中。然后通过共聚焦显微镜、westerrn blotting技术、激光纳米粒度仪、透射电子显微镜、荧光分光光度计、琼脂糖凝胶电泳等手段对载药后的wtomv
sirna
、momv
sirna
和affi
plcsa-bp
omv
sirna
进行电穿孔前后外膜蛋白表达、粒径电位变化、形貌变化、omv对sirna的保护效果、不同载药条件下的载药量、不同ph条件下的释放量等进行全面评价。本实验所使用的gadd45αsirna序列为5
’‑
aacgtcgaccccgataacgtg-3’,该序列由上海吉玛制药技术有限公司合成。
80.其中,采用电穿孔的方法将sirna药物载入实施例2得到的affi
plcsa-bp
omv载体中,共聚焦显微镜、聚丙烯酰胺凝胶电泳以及westerrn blotting实验均验证了载药后affi
plcsa-bp
omv
sirna
膜上靶向蛋白plcsa-bp在电穿孔后依旧正常表达。同时tem图像显示在本实验的电穿孔条件下affi
plcsa-bp
omv
sirna
没有破损现象,粒径有增大现象,主要集中在90nm左右。affi
plcsa-bp
omv
sirna
的水合粒径为90.00
±
2.04nm,电位为-20.0
±
0.2mv,pdi为0.344
±
0.013。
81.此外,纳米载体负载药物的能力主要是通过载药量和载药效率进行衡量。载药量是指药物存在单位质量载体材料中的质量,载药效率也称为包封效率,指的是被载药物的质量占初始投入药量的百分比。载药后用depc水稀释适宜倍数,取400ul转移至截留量为100kda的超滤管中,4℃、1500g离心去除游离sirna。取外管液体100μl于石英底96孔板中,分别于酶标仪激发波长560nm,发射波长610nm下检测样品的荧光强度,每组重复实验三次。通过与标曲对比,计算出体系中游离sirna的质量。载药量实验结果见表1和2。
82.载药量和载药效率计算公式如下:载药量(%)=(总sirnas量-游离sirnas量)/总sirnas量;载药比计算公式如下:载药比(%)=(总sirnas量-游离sirnas量)/总载体量。
83.表1最佳电穿孔电压的考察(n=3)
[0084][0085][0086]
表2最佳质量比的考察(n=3)
[0087][0088]
载药量实验结果表明:affi
plcsa-bp
omv
sirna
在最佳条件下(电穿孔电压700v、omv与sirna质量比为1:1)可实现的载药率高达20.17
±
1.56%。
[0089]
药物释放测定过程如下:各取2份等量的载药后含cy3-sirna 10ug的囊泡于截留量为100kda的超滤管中,于4℃、1500g条件下离心去除游离的sirna并定量,记为w游离。以ph7.4和ph5.0的pbs分别作为正常生理环境和酸性环境下的释放介质。将超滤管置于50ml离心管内,往各离心管内加入2ml对应的释放介质至液面恰好超过超滤管的分子筛部位。将各装置放入37℃恒温摇床内进行药物释放。于对应时间点2h、4h、6h、8h、10h、24h、48h取出200ul释放介质并以空白释放介质补足。样品于酶标仪进行荧光量检测,对比标准曲线计算总sirna释放量记为w释放。最后按公式w释放/(w总-w游离)*100%计算药物释放度。结果
如图11所示。
[0090]
体外释放研究表明,在ph等于7.4的条件下,affi
plcsa-bp
omv
sirna
在48h内累计释放量达到30.25
±
1.19%。在ph等于5.0的条件下,affi
plcsa-bp
omv
sirna
在48h内累计释放量达到35.71
±
1.57%,释放量较中性环境下显著提升(****p《0.0001)。不同ph条件下的药物释放曲线表明,在微酸环境下可以实现更高的药物释放。这可能是由于omvs与外泌体均具有磷脂双分子层结构,因此与外泌体一样,当暴露在酸性环境中时,磷脂双分子层发生变形和重组,促进了sirna药物的释放。以上结果表明affi
plcsa-bp
omv
sirna
在正常生理环境以及酸性环境中均具有良好的稳定性,可有效延缓药物释放,保护sirna药物在到达靶细胞之前不被代谢消除。
[0091]
此外,核糖核酸酶a(rnase a)是一种被详细研究和具有广泛应用的核酸内切酶,对rna有水解作用,所以sirna在体内非常不稳定。因此,为了保证sirna能在体内安全运输至靶细胞达到治疗目的,本实验考察了omv
siran
在rnase a存在下对sirna的保护效果。affi
plcsa-bp
om
sirna
和游离sirna在rnase a存在下的稳定性结果如图12所示。
[0092]
由图12可知,游离sirna与rnase a共孵育2h时,已经几乎看不到凝胶上sirna条带,说明sirna在2h内几乎被rnase a全部降解;而affi
plcsa-bp
om
sirna
与rnase a共孵育6h后,在各个时间点凝胶板上仍可见清晰的条带,共孵育12h后,条带明显变淡,但依然存在未被降解的sirna,说明affi
plcsa-bp
om
sirna
对sirna具有一定的保护作用,能够降低血清中rnase a对sirna的降解作用,进而保证sirna药物在体内能安全运输至靶细胞。
[0093]
综上可知,本发明成功构建了敲除msbb基因且在外膜上表达目标靶向蛋白plcsa-bp的重组大肠杆菌,并成功提取纯化出了其分泌的affi
plcsa-bp
omv,并且通过实验证实:得到的affi
plcsa-bp
omv产率高,稳定性良好,毒素含量低,是一种兼具靶向性、安全性的载sirna天然生物载体,能够有效促进胎盘病变相关的疾病治疗药物的开发,具有良好的临床应用价值。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:刘洋 高兴丽 李淑丽 郭永然
- 技术所有人:郑州大学
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....