一种DNA甲基化调控MMP2基因转录的方法
一种dna甲基化调控mmp2基因转录的方法
技术领域
1.本发明属于细胞工程和基因工程技术领域,具体涉及一种dna甲基化调控mmp2基因转录的方法。
背景技术:
2.表观遗传修饰是研究基因表达的热点,其中dna甲基化是研究最多和最为深入的表观遗传修饰之一。dna甲基化是指基因组胞嘧啶-鸟嘌呤二核苷酸(cpg),在dna甲基转移酶(dnmts)的作用下,共价结合一个游离的甲基形成5-甲基胞嘧啶的过程。细胞中染色体结构、dna构象和稳定性以及dna与蛋白质互作方式都可能受dna甲基化水平的影响。在哺乳动物中,高甲基化的启动子和增强子可以在基因转录中发挥重要的作用。有研究表明,dna甲基化会影响包括凋亡在内的不同细胞信号通路基因的表达,进而影响颗粒细胞的功能。用甲基转移酶抑制剂5-aza-cdr处理雌性小鼠后,能诱导卵泡闭锁和抑制卵泡成熟,进而显著延缓小鼠的初情启动日龄。综上所述,dna甲基化可能通过调控颗粒细胞内关键基因的表达进而影响哺乳动物卵泡的发育和初情启动。
3.基质金属蛋白酶2基因(matrix metalloproteinases 2,mmp2)是mmps家族的重要成员,又称明胶酶a,为ⅳ型胶原酶的一种。mmp2编码的蛋白酶能分解卵泡液中的明胶蛋白、纤维蛋白和iv型胶原蛋白等蛋白,影响卵泡内颗粒细胞的凋亡和增殖,进而影响雌性动物的繁殖能力。
技术实现要素:
4.为解决相关问题,本发明的首要目的在于提供一种dna甲基化调控mmp2基因转录的方法。
5.为了实现上述发明目的,本发明采用以下技术方案:
6.一种dna甲基化调控mmp2基因转录的方法,通过调节mmp2基因启动子区dna甲基化水平,实现猪卵巢颗粒细胞中mmp2基因转录活性的调控。
7.进一步地,所述的mmp2基因启动子区dna甲基化为mmp2基因启动子区中bsp1甲基化和/或bsp2甲基化;所述的bsp1为mmp2基因启动子-1884~-1654bp区域,所述的bsp2为mmp2基因启动子-1381~-1148bp区域;
8.所述的mmp2基因启动子区dna甲基化水平降低,mmp2基因转录活性升高。
9.更进一步地,所述的bsp1甲基化的位点为第10个cg位点,所述的bsp2甲基化的位点为第2个cg位点。
10.更进一步地,所述的mmp2基因启动子区dna甲基化水平降低通过dna甲基转移酶抑制剂5-aza-cdr或rna干扰技术抑制dna甲基转移酶dnmt3a或dnmt3b的表达实现,其中:
11.采用的抑制dnmt3a的sirna如下:
12.dnmt3a-sirna:5
′‑
acccttacaaagaagtttaca-3
′
;
13.采用的抑制dnmt3b的sirna如下:
14.dnmt3b-sirna:5
′‑
ctcattttatcttctaaaact-3
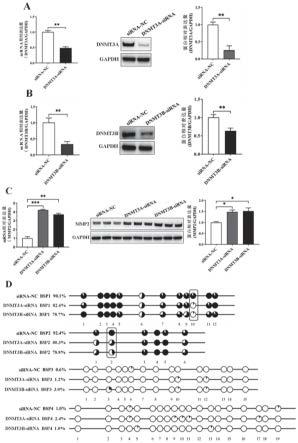
′
。
15.一种猪卵巢颗粒细胞mmp2基因的核心启动子功能调节区,为mmp2基因启动子-1884~-1654bp区域或-1381~-1148bp区域。
16.一种调控猪卵巢颗粒细胞mmp2基因表达的核酸片段,为dna甲基转移酶dnmt3a或dnmt3b的sirna,所述sirna为如下序列中的任意一种:
17.dnmt3a-sirna:5
′‑
acccttacaaagaagtttaca-3
′
;
18.dnmt3b-sirna:5
′‑
ctcattttatcttctaaaact-3
′
。
19.上述核心启动子功能调节区或上述核酸片段在调控猪卵巢颗粒细胞mmp2基因表达中的应用。
20.本发明前期通过分析全基因组dna甲基化测序数据,发现mmp2基因启动子的dna甲基化水平与母猪初情启动密切相关,且在初情启动延缓母猪的卵巢中mmp2基因的mrna表达水平显著高于初情正常母猪的卵巢。同时通过网站预测发现mmp2启动子存在两个cpg岛。由此我们提出假设dna甲基化可能调控mmp2基因的转录水平。
21.本发明的验证结果如下:
22.1、通过生物信息学网站预测mmp2基因启动子区(-2142~+191,+1为转录起始位点)的cpg岛。由图1结果可知,mmp2基因启动子区存在两个cpg岛。
23.2、我们分离了小卵泡(≤3mm)、中卵泡(3~5mm)以及大卵泡(≥5mm)的颗粒细胞,利用qrt-pcr、western blot以及bsp分别检测mmp2基因在各阶段卵泡中的表达和甲基化水平。qrt-pcr和western blot结果显示,随着卵泡不断发育增大,mmp2基因的mrna和蛋白表达水平逐步降低。bsp结果显示,随着卵泡不断发育增大,mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平逐渐升高(图2)。综上,dna甲基化可能参与mmp2基因的表达。
24.3、我们分别用5-aza-cdr或dnmt1-sirna处理卵巢颗粒细胞,利用qrt-pcr、western blot和bsp分别检测mmp2基因的表达和甲基化水平。qrt-pcr和western blot结果显示,5-aza-cdr能显著促进mmp2基因的mrna和蛋白表达水平,同时,bsp结果显示,5-aza-cdr能降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平,而dnmt1-sirna对mmp2基因表达的影响差异不显著(图3)。综上,dnmt1可能不是影响mmp2基因表达的主要酶类。
25.4、我们接着又分别转染甲基转移酶dnmt3a和dnmt3b的小干扰rna(dnmt3a-sirna和dnmt3b-sirna)至颗粒细胞中,利用qrt-pcr、western blot以及bsp分别检测mmp2基因的表达和甲基化水平。qrt-pcr和western blot结果显示,dnmt3a-sirna和dnmt3b-sirna都能显著升高mmp2基因的mrna和蛋白表达水平,同时,也都能降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平(图4)。综上,dnmt3a-sirna和dnmt3b-sirna可能通过降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平进而促进mmp2基因的表达。
26.本发明相对于现有技术具有如下的优点及效果:
27.(1)mmp2基因启动子区dna甲基化以及mmp2基因直接或间接参与了卵泡闭锁、卵泡发育以及初情启动,本发明是以mmp2基因启动子区dna甲基化以及mmp2基因(id:397391)为研究对象,采用了分子和细胞生物学技术研究mmp2基因启动子区的dna甲基化水平对mmp2
基因的转录调控。对研究mmp2基因启动子区dna甲基化参与卵巢卵泡闭锁和初情启动等的分子机制具有很好的应用价值。
28.(2)本发明技术方案设计周详,结果可靠。为证实mmp2基因启动子区dna甲基化对mmp2基因的转录调控,本发明从多层次、多角度验证,首先在真实水平上验证,检测各生长阶段卵泡中mmp2基因启动子区的甲基化与表达水平。然后通过药物或小干扰rna改变mmp2基因启动子区甲基化后的表达情况。
附图说明
29.图1是mmp2基因启动子cpg岛预测图;
30.图2是mmp2基因在小、中以及大卵泡发育过程中的表达和甲基化情况研究结果图;其中,a是基因表达,b是基因甲基化;
31.图3是5-aza-cdr以及dnmt1-sirna对mmp2基因表达或dna甲基化水平的影响图;其中,a是5-aza-cdr处理对mmp2 mrna和蛋白表达水平的影响,b是干扰片段dnmt1-sirna的效率检测,c是dnmt1-sirna对mmp2 mrna和蛋白表达水平的影响,d是5-aza-cdr处理对mmp2基因启动子甲基化水平的影响;
32.图4是dnmt3a-sirna和dnmt3b-sirna对mmp2基因表达或dna甲基化水平的影响图;其中,a是干扰片段dnmt3a-sirna的效率检测,b是干扰片段dnmt3b-sirna的效率检测,c是dnmt3a-sirna和dnmt3b-sirna对mmp2 mrna和蛋白表达水平的影响;d是dnmt3a-sirna和dnmt3b-sirna对mmp2基因启动子甲基化水平的影响。
具体实施方式
33.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。下列实施例中未注明具体条件的实验方法,通常按照常规条件。
34.本发明中应用统计学方法,分析各实施例中3次独立实验的结果,分别计算“平均值
±
标准差”,使用单因素方差分析进行差异显著性分析(图中“*”表示p《0.05,“**”表示p《0.01)。
35.实施例1:猪卵巢颗粒细胞的培养和转染
36.(1)在广州市孔旺记屠宰场采集商品母猪健康的卵巢,清洗2次,置于含1%双抗高压灭菌的pbs中,于冰盒中迅速带回实验室;
37.(2)用含1%双抗高压灭菌的pbs清洗卵巢3次,转移卵巢进细胞房的超净台(提前用酒精棉擦拭并照紫外30min);
38.(3)配制完全培养基:89%dmem、10%血清和1%双抗,上下颠倒混匀;
39.(4)先在15ml离心管中加入5ml完全培养基,用1ml一次性无菌注射器小心吸取2ml卵泡液于离心管中;1000rpm离心5min;
40.(5)倒掉上清,加入5ml pbs缓冲溶液清洗两次;每次1000rpm离心3min,最后用3ml完全培养基重悬细胞沉淀;
41.(6)75ml培养瓶中先加入12ml完全培养基,再加入上述重悬液,轻柔地摇晃均匀;
42.(7)置于37℃,5%co2培养箱中培养,48h后观察颗粒细胞生长情况。
43.(8)用含预热的含1%双抗的pbs清洗两次,再培养24h后可进行后续实验。所述的
双抗为青霉素和链霉素。
44.实施例2:猪卵巢颗粒细胞的铺板和转染
45.(1)等颗粒细胞长至90%左右,倒掉培养基,用预热的含1%双抗的pbs洗2遍;
46.(2)加入5ml胰蛋白酶,置于培养箱消化5min左右,显微镜下观察至大部分细胞漂起,立即加入等量完全培养基终止消化;
47.(3)转移至15ml的离心管,1000rpm离心5min;弃上清,用含1%双抗的pbs清洗2遍,期间1000rpm离心5min;
48.(4)用完全培养基轻轻重悬细胞沉淀,均匀分到每个孔中,用完全培养基补充体积,轻轻摇匀,放培养箱中培养;
49.(5)24h左右,观察细胞状态,待细胞汇合度达80%左右时进行转染;
50.(6)转染方法按invitrogen公司的3000试剂盒说明书进行,每组设置3个重复;
51.(7)转染后的孔板置于37℃,5%co2培养箱中培养,转染后24h~72h,观察细胞状态,生长良好即可进行后续实验。
52.实施例3:qrt-pcr
53.本发明中基因的qrt-pcr检测采用maxima sybr green qpcr master mix(2x)试剂盒(上海翊圣生物科技有限公司)。实验采用比较ct值法检测样品基因的含量,具体计算公式如下:
54.基因相对表达量=2-{〈﹙实验组目的基因ct值﹚-﹙实验组内参基因ct值﹚〉-〈﹙对照组目的基因ct值﹚-﹙对照组内参基因ct值﹚〉}
55.检测基因用gapdh做内参,本发明所用到的qrt-pcr引物为:
56.qrt-pcr-mmp2 f:5
′‑
gacaagtggtgcgtgtgaag-3
′
(seq id no.1);
57.qrt-pcr-mmp2 r:5
′‑
catggtgaacagggcttcgt-3
′
(seq id no.2);
58.qrt-pcr-dnmt1 f:5
′‑
gacccgtctcttgaaggtgg-3
′
(seq id no.3);
59.qrt-pcr-dnmt1 r:5
′‑
tcgagtcagggttgttctgc-3
′
(seq id no.4);
60.qrt-pcr-dnmt3a f:5
′‑
atcagtacgacgatgacggc-3
′
(seq id no.5);
61.qrt-pcr-dnmt3ar:5
′‑
tcctggtcgtggttattggc-3
′
(seq id no.6);
62.qrt-pcr-dnmt3b f:5
′‑
atcagaggccgcagatcaag-3
′
(seq id no.7);
63.qrt-pcr-dnmt3b r:5
′‑
gctggactttcagaccgagt-3
′
(seq id no.8);
64.qrt-pcr-gapdh f:5
′‑
ggactcatgaccacggtccat-3
′
(seq id no.9);
65.qrt-pcr-gapdh r:5
′‑
tcagatccacaaccgacacgt-3
′
(seq id no.10)。
66.细胞总rna的提取:采用rna提取试剂盒(购自magen公司)抽提细胞总rna,具体如下:收集约1
×
107个细胞样品于1.5ml去酶离心管中,加入100μl pbs缓冲溶液吹打重悬细胞;加入500μl细胞裂解液(crl),涡旋13s,并静置1min;转移液体至柱子中,离心,去除液体,加入600μl buffer cw,离心1min,去除液体,再空离2min;把柱子置于1.5ml去酶离心管中,加入60μl rnase free water,静置2min,离心洗脱rna,于负80℃保存。
67.使用takara公司的primescript
tm rt master mix(perfect real time)cdna反转录试剂盒反转录总rna。
68.实施例4:western blot
69.(1)卵巢颗粒细胞总蛋白的提取与定量:弃培养基,用预冷的pbs清洗细胞2次,加入适量含0.2%蛋白酶抑制剂的裂解液(5~10
×
106个细胞加500μl),混匀后,在4℃条件下振荡20min,4℃13000rpm离心10min,取上清于预冷的1.5ml灭菌离心管中;
70.(2)利用bca法测定蛋白样品浓度:
①
先根据样品数配制bca工作液(试剂a:试剂b=50:1);
②
取10μl蛋白标准品于1.5ml灭菌离心管中,加pbs稀释至终浓度为0.5mg/ml;
③
将稀释好的蛋白标准品按0、1、2、4、8、12、16、20μl加入至96孔板中,再依次加20、19、18、16、12、8、4、0μlpbs至相应的孔中;
④
加2μl蛋白样品和18μlpbs至样品孔中;每个孔都加入0.2ml bca工作液,37℃孵育30min;
⑤
用酶标仪(570nm的波长)测定吸光度,计算蛋白的浓度;。
71.(3)sds-page电泳:每组取20μg总蛋白和5
×
上样缓冲液按5:1混合,煮沸5min。sds-page电泳至溴酚蓝刚出胶底部为止;
72.(4)转膜:先用甲醇活化pvdf膜3min,接着用pvdf膜平衡液平衡2min,然后将海绵,pvdf膜,凝胶,海绵依次叠在转膜夹的正极上,盖上转膜夹负极,插入快速转膜仪的通道中进行转膜(使用仪器默认的参数);
73.(5)免疫印记:取下pvdf膜,用tbst清洗3次,每次10min,用6%脱脂奶粉室温封闭2.5h;用tbst洗掉多余的脱脂奶粉,用tbst稀释抗体(mmp2:10373-2-ap,proteintech,1:1000;gapdh:10494-1-ap,proteintech,1:30000),4℃孵育过夜;二抗孵育:取出膜,用tbst洗膜3次,10min/次,用tbst按比例(鼠源为1:3000,兔源为1:5000)稀释二抗,室温下孵育约2h;孵育完二抗后,取出膜,用tbst洗膜3次,10min/次,然后将a和b发光液按1:1混合后,将膜的正反面浸泡混合液30s后,用化学发光仪进行显影,拍照保存,最后使用image plus软件分析蛋白条带。
74.实施例5:bsp
75.用dna提取试剂盒(d3396-02,omega bio-tek,usa)从gcs和卵泡中提取基因组dna。按照美国zymo公司ez dna methylation-god tm kit说明书,将纯化的dna进行亚硫酸氢盐转化。以亚硫酸氢盐转化的dna为模板,用bsp引物扩增相应片段,产物经回收与纯化后,连接pmd18-t载体和转化,通过菌液pcr判断是阳性单克隆菌后,送公司测序,最后通过quma网站(http://quma.cdb.riken.jp/)将测序结果与原始序列进行比较分析并绘制点图。每个样品需要10个克隆来计算甲基化率。
76.本发明所用到的bsp引物为:
77.bsp1 forward:5
′‑
attggttattaatgttttgggaatg-3
′
(seq id no.11);
78.bsp1 reverse:5
′‑
taatttaccacaatccccactactc-3
′
(seq id no.12);
79.bsp2 forward:5
′‑
ttaggttaggttgaggggtttg-3
′
(seq id no.13);
80.bsp2 reverse:5
′‑
cataccctaaaaaaatcacaacaac-3
′
(seq id no.14);
81.bsp3 forward:5
′‑
ggttatttatttttgatttttttt-3
′
(seq id no.15);
82.bsp3 reverse:5
′‑
accaactactttatccctttac-3
′
(seq id no.16);
83.bsp4 forward:5
′‑
gtaaagggataaagtagttggt-3
′
(seq id no.17);
84.bsp4 reverse:5
′‑
caaaacctttatatatttaaaacccca-3
′
(seq id no.18)。
85.结果分析:
86.1、通过生物信息学网站预测mmp2基因启动子区(-2142~+191,+1为转录起始位
点)的cpg岛。由图1结果可知,mmp2基因启动子区存在两个cpg岛。主要检测mmp2基因启动子的甲基化区域为bsp1(-1884~-1654bp),bsp2(-1381~-1148bp),bsp3(-142~-165bp),bsp4(-176~+90bp)。
87.2、我们分离了小卵泡(≤3mm)、中卵泡(3~5mm)以及大卵泡(≥5mm)的颗粒细胞,利用qrt-pcr、western blot以及bsp分别检测mmp2基因在各阶段卵泡中的表达水平和甲基化水平。qrt-pcr和western blot结果显示,随着卵泡的生长发育,mmp2基因的mrna和蛋白表达水平逐步降低。bsp结果显示,随着卵泡的生长发育,mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平逐渐升高(图2)。因此,我们初步推测dna甲基化可能参与mmp2基因的转录过程。
88.3、我们分别用dna甲基转移酶抑制剂5-aza-cdr或dnmt1-sirna处理卵巢颗粒细胞,利用qrt-pcr、western blot和bsp分别检测mmp2基因的表达和甲基化水平。qrt-pcr和western blot结果显示,5-aza-cdr能显著促进mmp2基因的mrna和蛋白表达水平,同时,bsp结果显示,5-aza-cdr能降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平,而dnmt1-sirna对mmp2基因表达的影响差异不显著(图3)。综上,dnmt1可能不是影响mmp2基因表达的主要酶类。
89.4、我们接着又分别转染甲基转移酶dnmt3a和dnmt3b的小干扰rna(dnmt3a-sirna和dnmt3b-sirna)至颗粒细胞中,利用qrt-pcr、western blot以及bsp分别检测mmp2基因的表达和甲基化水平。qrt-pcr和western blot结果显示,dnmt3a-sirna和dnmt3b-sirna都能显著升高mmp2基因的mrna和蛋白表达水平,同时,也都能降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平(图4)。综上所述,dnmt3a-sirna和dnmt3b-sirna可能通过降低mmp2基因启动子bsp1第10个cg位点和bsp2第2个cg位点的甲基化水平进而促进mmp2基因的转录。
90.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述的实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1