一种受茉莉酸甲酯诱导的人参PgWRKY40基因及其应用
一种受茉莉酸甲酯诱导的人参pgwrky40基因及其应用
技术领域
1.本发明涉及基因工程技术领域,具体涉及一种受茉莉酸甲酯诱导的人参pgwrky40基因及其应用。
背景技术:
2.人参为五加科人参属植物,是我国名贵的中药材,在许多亚洲国家已经有几千年的使用历史,人参中的次生代谢产物人参皂苷是其最主要的药效成分。人参皂苷的生物合成受多种转录因子的调控。因此,研究人参皂苷积累及其转录调控机制具有重要的理论和应用价值。wrky是植物中重要的转录因子家族之一,广泛参与植物的生长、发育、生物或非生物胁迫响应等多种生理过程,最近研究发现该家族成员参与多种次生代谢物合成的调控,然而,有关人参wrky转录因子调控人参皂苷的生物合成研究甚少。
3.为此,本文采用生物信息学、分子生物学、植物化学等方法对人参wrky家族成员的种类、结构特征、表达谱、以及其与人参皂苷积累进行关联分析,筛选参与人参皂苷生物合成与积累调控的候选wrky转录因子,进而实现利用wrky转录因子持久高效的调控人参皂苷生物合成与积累,以提高人参皂苷含量和人参的药用价值,对于精准调控人参皂苷的积累、规模化高效生产人参皂苷具有重要的应用价值。
技术实现要素:
4.为解决上述技术问题,本发明提出了一种受茉莉酸甲酯诱导的人参pgwrky40基因及其应用,其目的是通过茉莉酸甲酯诱导后筛选出pgwrky40转录因子基因转化人参组织并表达,从而促进人参细胞中人参皂苷生物合成与积累,达到提高人参皂苷产量的目的。
5.为了实现上述目的,本发明首先提供了一种受茉莉酸甲酯诱导的pgwrky40转录因子基因,所述受茉莉酸甲酯诱导的pgwrky40转录因子基因序列如seq id no.1所示,该受茉莉酸甲酯诱导的pgwrky40转录因子基因来自人参。
6.作为优选,所述pgwrky40基因序列的获得方法为:提取经茉莉酸甲酯诱导后的人参发根总rna,反转录合成cdna,根据茉莉酸甲酯诱导的人参转录组测序所获得的候选基因序列信息设计pcr扩增引物,进行扩增获得pgwrky40基因。
7.作为优选,所述茉莉酸甲酯的诱导时间为12~72h,更优选为12~24h。
8.作为优选,所述的pcr扩增引物序列如seq id no.3和seq id no.4所示。
9.作为优选,所述的一种受茉莉酸甲酯诱导的pgwrky40基因编码的蛋白氨基酸序列如seq id no.2所示。
10.作为优选,所述的受茉莉酸甲酯诱导的pgwrky40基因与植物表达载体组成重组载体。
11.作为优选,所述表达载体为pcambia1302。
12.作为优选,所述重组载体的构建方式如下:以所述一种受茉莉酸甲酯诱导的pgwrky40基因的开放读码框作为超表达序列,将该cdna片段插入到植物表达载体
pcambia1302中制得。
13.基于一个总的发明构思,本发明还提供了一种受茉莉酸甲酯诱导的pgwrky40基因在调节人参皂苷积累中的应用。
14.与现有技术相比,本发明具有以下有益效果:
15.本发明采用茉莉酸甲酯(meja)诱导的人参根基因差异表达的转录组测序方法,初步筛选出人参wrky转录因子家族基因,再通过发根农杆菌a4介导的转化人参叶片实验,从多个人参wrky转录因子基因中筛选到受meja显著诱导的pgwrky40转录因子,经meja诱导后获得的pgwrky40转录因子基因编码的蛋白具有典型的七肽序列wrkygqk,属于植物wrky转录因子;筛选获得的pgwrky40基因及其编码的蛋白参与到人参皂苷生物合成与积累的调控,pgwrky40基因在瞬时超表达的人参叶片中表达,从而达到提高人参皂苷产量的目的,该基因及其编码的蛋白是一种切实可行的提高人参中皂苷含量的方法;
16.本发明通过构建了pgwrky40转录因子基因的植物超表达载体,利用发根农杆菌a4介导pgwrky40转录因子基因转化人参叶片,通过pgwrky40转录因子基因在人参叶片中瞬时高水平表达,介导转化pgwrky40基因后人参叶片中pgwrky40基因的表达水平可以达到对照组的3倍以上;与对照人参叶片相比,pgwrky40转录因子基因瞬时超表达人参叶片中人参皂苷rb1、rb2、rc、rd、re、rg1和rg3各个单体均得到有效提高,从而使得人参总皂苷含量显著提高,可以达到对照组的2倍。由此说明,利用基因编辑pgwrky40转录因子基因能够获得人参总皂苷含量提高的人参组织或植株,为提高人参总皂苷产量提供了一种有效的技术手段。
附图说明
17.图1是本发明实施例1中pgwrky40基因pcr产物电泳结果,图中,泳道1、2和3均表示pcr扩增产物,m表示dna标准分子量;
18.图2是本发明实验例1中荧光定量pcr(qrt-pcr)检测100μmol/l外源性meja处理不同时间后人参发根中pgwrky40转录因子基因的表达水平,以β-actin作为内参;
19.图3是本发明实验例2中pgwrky40转录因子基因植物超载体表达框示意图;
20.图4是本发明实验例2中qrt-pcr检测发根农杆菌a4介导转化人参叶片中pgwrky40基因瞬时表达水平;
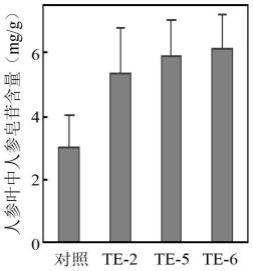
21.图5是本发明实验例2中发根农杆菌a4介导转化pgwrky40转录因子基因的人参叶片中人参皂苷含量。
具体实施方式
22.以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
23.实施例1
24.pgwrky40转录因子基因的克隆
25.1、人参rna提取及其反转录合成cdna
26.(1)人参rna提取
27.取1/2ms固体培养基中培养的人参发根,将其接种于1/2ms液体培养基中,在
120rpm、25℃暗培养3周,然后在培养基中加入终浓度为100μmol/l的meja,再以同样的条件培养24h,诱导与meja有关的基因表达。
28.取meja诱导24h的人参发根,快速置于液氮预冷的研钵内,立即加入液氮后快速研磨成细粉。取40mg于1.5ml无rna酶的离心管中,加入1ml trizol和40μlβ-巯基乙醇,快速混匀后置于室温放置5-10min;加入0.2ml氯仿,振摇l5s,室温放置10min;4℃,12000
×
g离心15min,收集上层置于于1.5ml离心管中,弃去沉淀;再加入0.4ml 3mol/l醋酸铵(ph5.2)和0.6ml异丙醇后混匀,室温放置10min,4℃、12000
×
g离心10min,弃去上清;加入1ml 75%的乙醇,混匀;4℃,10000
×
g离心5min,弃去上清液,再加入20μl depc水溶解rna,备用。
29.(2)反转录合成cdna
30.以oligod(t)18为引物,利用逆转录酶合成cdna第一链,反转录反应体系如下:template mrna(200ng/μl)10μl,5
×
1st strand synthesis buffer 4μl,dntp mixture(10mmol/l)1μl,rnase inhibitor1μl,oligo(dt)(50μmol/l)2μl,m-mlv(200u/μl)1μl,rnase-free h2o 1μl。轻柔搅拌混匀;室温放置10min后,移至恒温水浴箱,42℃反应1h;反应结束后,快速置于冰上冷却2min,最后置于-20℃备用。
31.2、pcr扩增pgwrky40基因
32.根据meja诱导的人参转录组测序所获得的候选pgwrky40基因序列信息,设计pcr扩增引物,pgwrky40基因pcr扩增引物如下。
33.pgwrky40-f:5
′‑
atggattataccacttttgttgaca-3
′
;(seq id no.3)
34.pgwrky40-r:5
′‑
ctaaactctttcaagtcccttgaac-3
′
;(seq id no.4)
35.pcr扩增pgwrky40基因的反应条件如下:预变性94℃2min,变性94℃30s,退火59℃30s,72℃60s,35个循环;终延伸72℃7min。pcr产物以琼脂糖凝胶电泳进行分析。
36.图1为pgwrky40基因pcr产物经1%琼脂糖凝胶电泳后的结果,图1中泳道1、2和3均表示pcr扩增产物,m表示dna标准分子量,结果显示pcr产物大小约为1041bp,与预期的理论大小一致。
37.3、pgwrky40基因的亚克隆及其测序分析
38.将上述pcr产物中大小约为1041bp的电泳条带胶回收,再将胶回收产物连接至pgem-t easy亚克隆载体,转化感受态大肠杆菌dh5α,经筛选后,提取阳性菌落的质粒,对质粒进行测序,测序结果在ncbi中blast进行比对分析,结果显示该基因编码的蛋白具含有一段高度保守的七肽序列wrkygqk,属于植物wrky转录因子基因。
39.实验例1
40.荧光定量pcr(qrt-pcr)分析pgwrky40基因的表达水平
41.1、rna提取及反转录
42.取1/2ms固体培养基中25℃暗培养3周后的发根,接种于1/2ms液体培养基中25℃、110rpm暗培养21d,再加入100μmol/l meja进行诱导处理,处理不同时间后分别取出发根,用于提取rna,提取方法同实施例1。上述rna以oligod(t)18为引物,以逆转录酶合成cdna。β-actin和pgwrky40基因的qrt-pcr分析引物如下:
43.β-actin荧光定量引物f:5
′‑
tgccccagaagagcaccctgt-3
′
;(seq id no.5)
44.β-actin荧光定量引物r:5
′‑
agcatacagggaaagatcggcttga-3
′
;(seq id no.6)
45.pgwrky40荧光定量引物f:5
′‑
tcgaagtgaagcttccgaca-3
′
;(seq id no.7)
46.pgwrky40荧光定量引物r:5
′‑
cagggcaagtaggagcgaaa-3
′
;(seq id no.8)
47.2、qrt-pcr分析pgwrky40基因表达水平
48.以cfx connect荧光定量pcr仪对pgwrky40基因表达水平进行分析检测,按照sybr premix ex taq荧光定量pcr试剂盒进行扩增,qrt-pcr反应体系为2
×
premix ex taq
tm ii 12.5μl,正向引物(10μm)0.5μl,反向引物(10μm)0.5μl,cdna 0.5μl,ddh2o 11μl。反应条件为:预变性95℃1min,变性95℃40s,退火60℃30s,40个循环;变性95℃15s,退火60℃60s,变性95℃15s,1个循环。
49.每个样品三次重复。反应结束后确认扩增曲线和溶解曲线,采用2-δδct
方法计算pgwrky40基因的表达水平差异。图2是qrt-pcr检测100μmol/l外源性meja处理不同时间后人参发根中pgwrky40基因的表达水平结果,以β-actin作为内参。结果显示人参发根中pgwrky40基因的表达水平受meja诱导后会显著提升,当meja处理12h后,pgwrky40基因表达水平最高,是对照人参发根中表达水平的4.62倍,随后pgwrky40基因的表达水平下降,但仍然保持很高的表达水平。表明pgwrky40基因与meja介导的信号通路有关。
50.实验例2
51.pgwrky40基因植物超表达载体构建及其在人参叶片瞬时超表达
52.1、pgwrky40基因植物超表达载体构建,其超表达载体表达框如图3所示。
53.(1)pcr扩增用于同源重组的pgwrky40基因片段
54.根据pgwrky40基因序列设计同源重组引物以扩展其cdna全长,同源重组扩增引物如pgwrky40-f1(seq id no.9)和pgwrky40-r1(seq id no.10)。并以nco i和spe i限制性核酸内切酶酶切pcambia1302制备线性化载体,将pcr扩增产物和线性化的载体胶回收。
55.pgwrky40-f1:5
′‑
ggactcttgaccatggattataccacttttgttgaca-3
′
;(seq id no.9)
56.pgwrky40-r1:5
′‑
tcgcctttggaagttgaatgcctcaaactctttcaagtcccttga-3
′
;(seq id no.10)
57.pcr反应条件为:预变性94℃3min,变性94℃30s,退火60℃30s,72℃60s,35个循环;终延伸72℃7min。
58.(2)pcambia1302-pgwrky40表达载体构建及转化发根农杆菌a4
59.以in-fusion hd cloning kit将pgwrky40基因重组至pcambia1302载体,经pcr和测序鉴定重组载体连接正确后,将构建的重组表达载体命名为pcambia1302-pgwrky40。以冻融法将构建好的pcambia1302-pgwrky40载体转化发根农杆菌a4,转化后阳性克隆以pcr进行鉴定。再经测序鉴定成功后获得含pgwrky40基因超表达载体的农杆菌。
60.2、农杆菌介导pgwrky40基因转化人参叶片
61.(1)含pcambia1302-pgwrky40的发根农杆菌培养
62.挑取含有pcambia1302-pgwrky40载体的农杆菌和对照农杆菌(含有空载体pcambia1302)单菌落分别接种于10ml加有相应抗生素的yeb液体培养基中培养16-24h。取1ml菌液转接到100ml加有相应抗生素的yeb液体培养基中,并加入10μl 100mmol/l乙酰丁香酮(acetosyringone,as;母液用dmso配制,使其终浓度为20μmol/l)。28℃培养过夜。培养液于5000rpm、4℃离心10min,收集菌体,用1/2ms培养基清洗3次后,用1/2ms+as(终浓度为20μmol/l)培养基将菌液稀释至od600为0.8左右,作为转化人参叶片的侵染液。
63.(2)发根农杆菌a4介导pgwrky40基因转化人参叶片
64.用1ml无针头的无菌注射器吸取农杆菌侵染液,从人参叶片下表皮注射到人参叶片内;注射3天后,剪下人参叶片,分析pgwrky40基因表达水平、meja和人参皂苷含量。
65.3、qrt-pcr分析人参叶片中pgwrky40基因的瞬时表达水平
66.取发根农杆菌a4侵染3天后的人参叶片,采用实施例2方法中qrt-pcr分析人参叶片中pgwrky40基因的表达水平,结果如图4所示。
67.图4是荧光定量pcr(qrt-pcr)检测发根农杆菌a4介导转化pgwrky40基因3天后人参叶片中pgwrky40基因的表达水平;以β-actin作为内参;图中对照表示转化空载体的人参叶片,te-2、te-5和te-6分别表示瞬时超表达pgwrky40基因的不同人参叶片;结果显示转化pgwrky40基因的人参叶片中pgwrky40基因的表达水平均上调,te-2、te-5和te-6叶片中pgwrky40基因的表达水平分别是对照的2.57、1.68和3.69倍。表明pgwrky40基因在瞬时超表达的人参叶片中表达。
68.4、瞬时超表达pgwrky40基因的人参叶片中人参皂苷含量测定
69.(1)人参皂苷的提取
70.取发根农杆菌a4侵染3天后的人参叶片,自来水清洗2min后用双蒸水清洗两遍,60℃干燥至恒重。将其研磨成细粉,用80%甲醇60℃浸提(1g:40ml),超声波处理3次,每次15min;60℃水浴蒸干甲醇,水洗超声溶解,乙醚萃取两次,取水相,用水饱和正丁醇萃取,收集正丁醇层。60℃水浴蒸干正丁醇,即得到人参总皂苷,用适量的甲醇超声波溶解,定容至刻度,过0.45μm的微孔滤膜,得到样品溶液。
71.(2)人参皂苷含量测定
72.人参总皂苷含量测定采用hplc法,hplc测定条件为:以rp18柱(1.7μm,2.1mm
×
50mm);流动相为乙腈和1%甲酸,进行梯度洗脱。流速为1.0ml/min,柱温为35℃,进样量为3μl,检测波长为202nm。
73.以人参皂苷rb1、rb2、rc、rd、re、rg1和rg3作为标准品,分别测定样品中的各皂苷单体的含量,再以各皂苷单体含量之和代表人参细胞中总皂苷的含量,结果如图5所示。图5是发根农杆菌a4介导转化pgwrky40基因3天后的人参叶片中人参皂苷含量,图中对照表示转化空载体的人参叶片,te-2、te-5和te-6分别表示瞬时超表达pgwrky40基因的人参叶片;结果显示转化pgwrky40基因的人参叶片中7种主要人参皂苷单体及总皂苷含量明显增加,te-2、te-5和te-6叶片中人参皂苷分别是对照的1.77、1.94和2.02倍。上述结果表明pgwrky40基因可以有效的促进人参细胞中人参皂苷的合成与积累。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1