一种小鼠毛囊干细胞的分离培养方法与流程
1.本发明涉及一种毛囊干细胞分离培养技术,属于生物技术领域。
背景技术:
2.干细胞是一类具备自我复制能力和多向分化潜能的细胞,在特定条件下,它可能分化成多种功能细胞。干细胞存在于多种组织细胞中,能够通过特定分化和自我更新再生成新的组织。干细胞的特性为许多疾病的治疗提供了新的方向,相对于传统的药物治疗,干细胞的功能更强大,且副作用小,因此在临床医学上有着重要的意义。
3.毛囊干细胞就是成体干细胞的一种,位于毛囊外根鞘的隆突区(bulge区),能分化成表皮、皮脂腺、毛囊等皮肤相关组织的形成细胞。毛囊干细胞的研究为表皮创伤修复、皮肤组织工程、秃发机制研究等,提供了重要的理论依据。除此之外,毛囊干细胞也可以定向诱导成其他组织细胞如泌尿系统组织,相关研究为毛囊干细胞在新的领域奠定了基础。因此获取高质量的毛囊干细胞是一切研究的根本条件。
4.目前毛囊干细胞的分离方法主要运用到显微分离法、差速贴壁筛选法、酶解法、免疫磁珠法。显微分离法指的是在体视显微镜下分离出目的组织,差速贴壁筛选法是利用干细胞贴壁快的特点将初分离得到的杂细胞群接种到胶原蛋白包被的培养皿中,通过短时间贴壁来分离干细胞群。酶解法是通过胶原酶或胰酶对消化组织使目的细胞游离出来。而免疫磁珠法则是利用细胞表面抗原能与连接磁珠的特异性抗体相结合的原理,将毛囊干细胞用特异性抗体标记从而分离出来。以上方法通常以2-3种结合的方式用于分离毛囊干细胞。
5.常用组织有人或大鼠的毛囊组织。小鼠毛囊组织由于组织面积小,细胞得率低,目前很少被用于提取干细胞。差速贴壁筛选法操作简单,但是得到的细胞纯度相对较低。酶解法消化不当可能会对分离出来的细胞造成损伤。免疫磁珠法操作复杂,成本较高,得到的细胞状态会受到影响。
技术实现要素:
6.针对上述问题,本发明的目的在于提供一种小鼠毛囊干细胞的分离培养方法,所述方法包括以下步骤:
7.s1,分离小鼠毛囊组织;所述小鼠为出生24小时内的小鼠
8.s2,酶解消化组织;
9.s3,差速贴壁筛选毛囊干细胞;
10.s4,小鼠毛囊干细胞的培养和传代;
11.其中,所述s1,分离小鼠毛囊组织的方法为:
12.s11,剪取小鼠触须皮肤组织,放入组织暂存液,置于冰上;
13.s12,酒精洗涤触须皮肤组织,组织清洗液浸泡;
14.s13,在体式显微镜下解剖出完整的毛囊组织,加入组织暂存液,置于冰上。
15.在一种实施方式中,所述s1,分离小鼠毛囊组织的方法为:
16.s11,剪取小鼠触须皮肤组织,放入离心管中,加入组织暂存液,离心管置于冰上;
17.s12,触须皮肤组织使用75%酒精漂洗3次,每次30秒,使用组织清洗液再次浸泡3次,每次2-3分钟;
18.s13,将触须部组织修剪成0.5cm
×
0.5cm大小,在体式显微镜下剪除上端毛干及毛球部,解剖出完整的毛囊组织,放入离心管中,加入组织暂存液,离心管置于冰上。
19.在一种实施方式中,所述小鼠触须部组织包括小鼠触须部位皮肤及皮下组织。
20.在一种实施方式中,所述s1,分离小鼠毛囊组织的方法为:
21.选择刚出生24小时内的c57小鼠,剪取小鼠触须部位皮肤及皮下组织,放入50ml离心管中,加入组织暂存液,离心管置于冰上;
22.触须皮肤组织使用75%酒精漂洗3次,每次30秒,使用组织清洗液再次浸泡3次,每次2-3分钟;
23.将触须部组织修剪成0.5cm
×
0.5cm大小,在体式显微镜下解剖出完整的毛囊组织,剪除上端毛干及毛球部,放入15ml离心管中中,加入组织暂存液,离心管置于冰上。
24.所取小鼠必须为24小时内的新生小鼠,此时小鼠组织中的干细胞纯度最高,且毛囊组织洁净度高、分离难度低。
25.在一种实施方式中,所述组织暂存液为dmem基础培养基、5%青链霉素、50μg/ml庆大霉素的混合;所述组织清洗液为pbs、5%青链霉素、50μg/ml庆大霉素的混合。
26.配置专用的组织暂存液和组织清洗液,保证组织最低程度的受到外界污染,以及组织内的细胞活力。
27.在一种实施方式中,所述s2,酶解消化组织的方法为:
28.s21,中性蛋白酶消化;
29.s22,胰蛋白酶与乙二胺四乙酸钠消化。
30.在一种实施方式中,所述s2,酶解消化组织的方法为:
31.s21,中性蛋白酶消化:用dmem基础培养基漂洗毛囊组织,加入dispaseii溶液,4℃过夜消化,离心后舍弃上清液,用dmem基础培养基漂洗;
32.s22,胰蛋白酶与乙二胺四乙酸钠消化:加入0.125%trypsin-0.01%edta溶液,37℃水浴震荡消化,静置,吸取上清液,置于含dmem基础培养基+10%fbs离心管中;余下的未消化的毛囊组织重复上次操作,直到移液器吹打,肉眼可见毛囊组织被分解成絮状物,得到细胞混合溶液。
33.在一种实施方式中,所述s2,酶解消化组织的方法为:
34.1)中性蛋白酶(dispaseii)消化:用dmem基础培养基漂洗毛囊组织1-2次,加入5ml浓度为2.5mg/ml的dispaseii溶液,4℃冰箱中过夜消化,2000rpm离心后舍弃上清液,之后用dmem基础培养基漂洗1次。
35.2)胰蛋白酶+乙二胺四乙酸钠消化:加入0.125%trypsin-0.01%edta溶液5ml,37℃水浴震荡消化10min,静置数秒,未消化的组织块下沉底部,吸取上清液,置于含dmem基础培养基和10%fbs 50ml离心管中中,余下的未消化的毛囊组织重复上次操作,直到移液器吹打,肉眼可见毛囊组织被分解成絮状物,得到细胞混合溶液。
36.为了确保酶对组织的消化不会过度,使用低浓度的中性蛋白酶低温过夜消化,胰酶则使用短时间分批次消化的方式,保证酶解出来的细胞最低程度受到损害。
37.在一种实施方式中,所述s3,差速贴壁筛选毛囊干细胞的方法为:
38.s31,过滤组织块、洗涤所述细胞混合溶液;
39.s32,用ⅳ型胶原蛋白包被细胞培养皿,将洗涤后的细胞混合液用k-fsm无血清培养基重悬后接种于所述包被细胞培养皿中,置于37℃,5%co2培养箱中培养,2h后更换为培养基为含10%fbs的k-fsm培养基,得到p0代细胞。
40.在一种实施方式中,所述s31,具体为收集的细胞混合溶液过200目筛网滤去组织块,收集上清液,1500rpm离心8min,dmem基础培养基洗涤2次。
41.在一种实施方式中,所述s4,小鼠毛囊干细胞的培养和传代的方法为:
42.s41,将分离得到p0代细胞用含10%fbs的k-fsm培养基在37℃、5%co2培养箱中继续培养至细胞密度达到80%以上;
43.s42,弃去培养上清,用pbs或生理盐水清洗;
44.s43,加入胰酶,37℃消化;
45.s44,显微镜下观察大部分细胞回缩且有少量细胞脱落,加入k-fsm完全培养基终止消化,并收集细胞悬液;
46.s45,细胞悬液离心,弃上清;
47.s46,用k-fsm完全培养基重悬细胞并接种于新的t25瓶中,得到p1代细胞。
48.本专利用到干细胞培养基为k-fsm培养基,更合适干细胞的筛选及培养。
49.有益效果:
50.专利所述方法提取的小鼠毛囊干细胞纯度更高,p0代干细胞含量可达90%以上;提取的小鼠毛囊干细胞活性好,增殖能力强,干性强,具备更好的分化能力。
附图说明
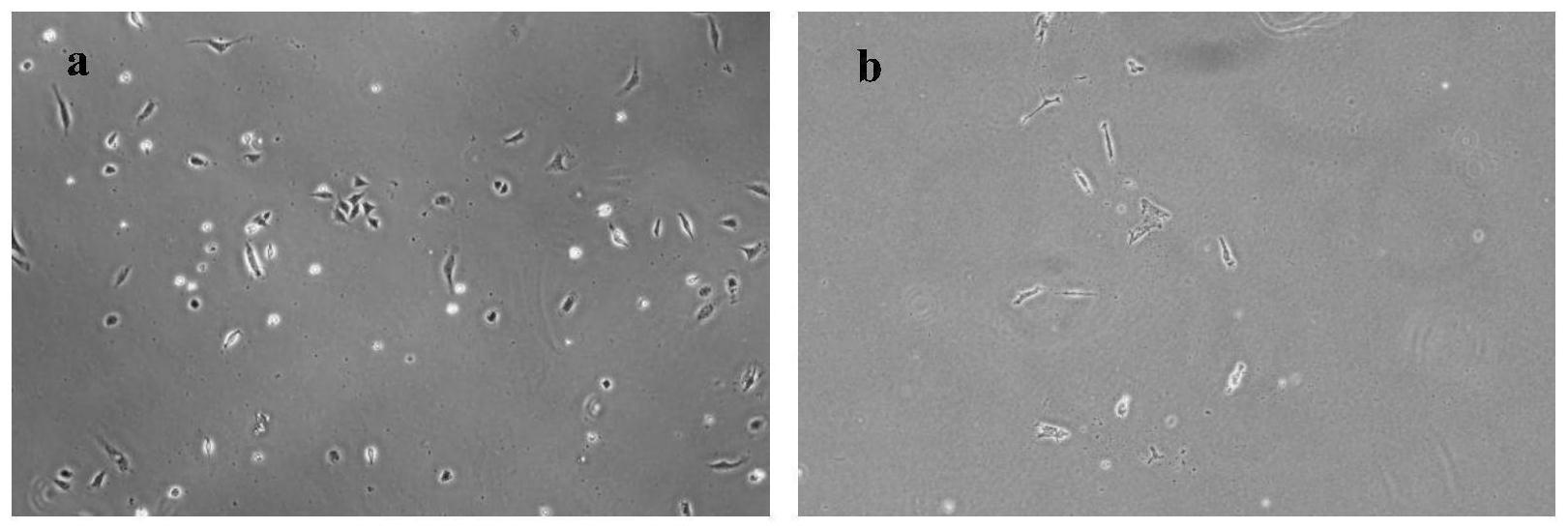
51.图1光学显微镜下毛囊干细胞分离后t1(a)、t2(b)对比图;
52.图2光学显微镜下毛囊干细胞p0代(a)和p1代(b);
53.图3cd34(a)和k15(b)免疫荧光鉴定小鼠毛囊干细胞;
54.图4生长曲线图。
具体实施方式
55.实施例1:小鼠毛囊干细胞原代分离
56.取10只出生24小时内的c57小鼠,剪取小鼠触须部位皮肤及皮下组织,放入50ml离心管中,加入20ml组织暂存液(94.9%dmem基础培养基+5%青链霉素+0.1%50μg/ml庆大霉素),将离心管置于冰上。
57.触须皮肤组织使用75%酒精漂洗3次,每次30秒,使用组织清洗液(94.9%pbs+5%青链霉素+0.1%50μg/ml庆大霉素)再次浸泡3次,每次3分钟。
58.将触须部组织修剪成0.5cm
×
0.5cm大小,在体式显微镜下解剖出完整的毛囊组织,剪除上端毛干及毛球部,放入15ml离心管中,加入组织暂存液,离心管置于冰上。
59.用dmem基础培养基漂洗毛囊组织2次,加入5ml浓度为2.5mg/ml的dispase ii溶液,4℃冰箱中过夜消化,2000rpm离心5分钟,小心弃去上清,再用dmem基础培养基漂洗1次。
60.加入0.125%trypsin、0.01%edta溶液5ml,37℃水浴震荡消化10min,静置数秒,
未消化的组织块下沉底部,吸取上清液,置于50ml离心管(含90%dmem基础培养基+10%fbs)中,余下的未消化的毛囊组织重复上次操作,直到移液器吹打,肉眼可见毛囊组织被分解成絮状物。
61.将得到到的组织细胞混合溶液过200目筛网滤去组织块,收集上清,1500rpm离心8min,dmem基础培养基洗涤2次。
62.将得到的细胞混合液用k-fsm(购买自gibco)无血清培养基重悬后接种于ⅳ型胶原蛋白(sigma)包被好的60mm细胞培养皿中,置于37℃,5%co2培养箱中培养,2h后更换为培养基为含10%fbs的k-fsm培养基(该皿胞标记为t1),同时将未贴壁的细胞收集下来另接种于一新的培养皿中,用于对照(该皿细胞标记为t2)。
63.第二天在光学显微镜下观察培养皿中毛囊干细胞的贴壁情况如图1,可以看出t1皿中的细胞已经贴壁并伸张,t2皿中极少细胞贴壁且状态较差。
64.实施例2:小鼠毛囊干细胞的培养和传代
65.将分离得到p0代细胞(t1)用含10%fbs的k-fsm培养基在37℃、5%co2培养箱中继续培养至细胞密度达到80%以上时,进行传代。
66.弃去培养上清,用pbs或生理盐水清洗1次。
67.加入1ml 0.25%胰酶(t25瓶),使胰酶覆盖整个瓶或皿,37℃消化。
68.约1分钟左右,显微镜下观察细胞,大部分细胞回缩且有少量细胞脱落,加入1ml k-fsm完全培养基终止消化,用移液枪吹打并收集细胞。
69.细胞悬液1000rpm离心5min,弃上清。
70.用5-6ml k-fsm完全培养基重悬细胞并接种于新的t25瓶中,得到p1代细胞。
71.毛囊干细胞p0代和p1代如图2所示。
72.实施例3:小鼠毛囊干细胞免疫荧光鉴定
73.取p1代小鼠毛囊干细胞,用胰酶消化,计数,调整浓度至5
×
104/ml。
74.取24孔板,每孔均匀加入1ml细胞悬液,放入37℃培养箱中培养,等待细胞贴壁并呈现完整细胞形态。共铺6个孔。
75.弃去孔中培养基,生理盐水清洗1-2次。
76.每孔加入500μl 4%多聚甲醛固定20min,生理盐水清洗3次;
77.每孔加入500μl 0.5tritonx-100通透15min,生理盐水清洗3次;
78.每孔加入500μl 20g/l bsa封闭1h;
79.每孔加入300μl一抗(cd34和k15分别各加3孔),4℃孵育过夜,生理盐水清洗3次;
80.每孔加入300μl二抗(1:50稀释),37℃孵育2h,生理盐水清洗3次,显微镜下观察细胞荧光。
81.每孔加入300μl dapi(1:1稀释)复染核5min,生理盐水清洗3次,最后加入500μl生理盐水保存或滴加防猝灭剂。
82.荧光显微镜下观察并拍照,同视野分别拍摄不同荧光的照片,用软件叠加荧光后如图3,细胞中可见明显干细胞指标cd34和k15的表达,因此小鼠毛囊干细胞分离成功。
83.cd34和k15作为干细胞鉴定的指标,通过细胞免疫荧光实验来鉴定所分离细胞的纯度,荧光显微镜下观察到的90%以上的细胞都被荧光标记了,因此可以判定干细胞的含量也在90%以上,细胞干性强。
84.实施例4:台盼蓝染色测定细胞活力
85.参照实施例2的方法制备出p2、p3代小鼠毛囊干细胞。分别取p1、p2、p3代小鼠毛囊干细胞,消化收集细胞并制备成1
×
105/ml的细胞悬液,将细胞悬液与0.4%的台盼蓝溶液按照9:1混匀,染色3~5分钟后,用血球计数板计数,细胞活率(%)=活细胞数/细胞总数
×
100%。实验结果如下表。三代细胞的活率都在95%以上,细胞活力好,且不会随着代数的增加而降低。
86.细胞代数活细胞数细胞总数细胞活率p11.66
×
105个/ml1.60
×
105个/ml96.4%p21.53
×
105个/ml1.46
×
105个/ml95.4%p31.72
×
105个/ml1.65
×
105个/ml95.9%
87.实施例5:mts测定细胞增殖能力
88.分别取p1、p2、p3代小鼠毛囊干细胞,消化后以3000个/孔接种至96孔板中,每个细胞接种5个复孔,设置0h、24h、48h、72h、96h共5个时间点,各组细胞在检测时间点时,每孔加入20μl mts溶液(5mg/ml),在37℃、5%co2培养中孵育2小时。2小时候取出孔板,放入酶标仪,震荡3分钟,测定490nm波长下各孔的吸光值,然后以时间为横坐标,吸光值为坐标绘制细胞生长曲线。所测生长曲线如图4,三代细胞增殖能力强,且随着代数的增加,增殖能力并未降低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1