一种农杆菌介导白三叶愈伤组织遗传转化方法
1.本发明属于生物遗传转化技术领域,具体涉及一种农杆菌介导白三叶愈伤组织遗传转化方法。
背景技术:
2.白三叶(trifolium repens l.)是一种世界范围内广泛栽植的豆科草种,具有产量高、品质优良、饲用价值高、为各种牲畜所喜食等特点,同时,白三叶根部富含大量根瘤菌,固氮能力强、固氮量高,常常用于牧草补播和退化的天然草地改良。除此之外,白三叶观赏价值高、花朵饱满、覆盖地表、匍匐生长扩展能力强,也是国内外广泛种植的草坪地被植物。然而,极端温度、洪水、盐水和干旱等不利环境事件的发生率不断增加,限制了白三叶草的生产力并影响其产量。
3.在应用传统育种方法的同时,转基因白三叶的开发提供了一种解决限制生长或生产力的基本方法。由于白三叶的全基因组已经获得,有效利用基因组信息将有助于功能基因组学研究。同时,识别在抗逆调控机制中有前景的功能基因具有重要意义。但是,目前在开发适用于白三叶的有效遗传转化系统方面进展甚微。筛选合适的外植体以及适当遗传转化程序,来进行白三叶遗传转化是亟待解决的问题。
4.非专利文献谷俊涛等."农杆菌介导白三叶草高效遗传转化和转基因植株再生."草业学报16.2(2007):6.公开了一种以子叶下胚轴为外植体,通过农杆菌ti质粒介导建立的白三叶遗传转化方法。
5.非专利文献王丹等."利用农杆菌浸种法建立白三叶草遗传转化体系的研究."中国农业科技导报1(2009):6.公开了一种以白三叶萌动种子作为转化受体,建立的农杆菌浸种途径介导的白三叶遗传转化体系。
技术实现要素:
6.在上述背景基础上,本发明提供了一种农杆菌介导白三叶愈伤组织遗传转化方法,以幼苗根系为外植体材料诱导愈伤组织,再以农杆菌侵染愈伤组织的途径进行遗传转化。所述农杆菌介导遗传转化再生体系具有方法简单、易操作等特点,为基因工程技术在白三叶中的应用提供有力支撑。
7.本发明的目的通过如下技术方案实现。
8.第一方面,本发明提供一种农杆菌介导白三叶愈伤组织遗传转化方法,其特征在于,所述遗传转化方法包括如下步骤:
9.(1)建立遗传转化受体
10.取3-4天的白三叶幼苗的根、子叶、下胚轴、叶片或者叶柄作为外植体,于愈伤诱导培养基中诱导培养,获得胚性愈伤组织;
11.(2)制备农杆菌工程菌液
12.将带有trcml6质粒的农杆菌在lb固体培养基上划线活化至od
600
值为0.4-0.5之
间,并重悬于侵染液中用于侵染;
13.(3)侵染与共培养
14.将步骤(1)获得的胚性愈伤组织置于侵染液中,低转速侵染25-30min,再将侵染的愈伤组织放于共培养基中,黑暗条件下,23-25℃与农杆菌共培养3-4天;
15.(4)抗性愈伤组织筛选培养
16.将共培养后的愈伤组织洗干净,放置于抗性愈伤筛选培养基中,黑暗条件下继续诱导抗性愈伤组织14-16天;
17.(5)抗性愈伤组织分化诱导
18.将步骤(4)诱导的抗性愈伤组织转移至分化筛选培养基中,在23-25℃、16h光照/8h黑暗、光强4000lx环境下诱导抗性芽生成;
19.(6)抗性芽生根诱导
20.将步骤(5)诱导获得的抗性芽切下,转移至生根筛选培养基中,诱导生成白三叶根系;
21.(7)抗性植株分子鉴定
22.将步骤(6)中生根且叶片长势良好的白三叶幼苗移栽至土壤中,并通过pcr方法验证转化是否成功。
23.优选的,所述步骤(1)中的诱导培养条件为:黑暗条件,温度23-25℃,每2周继代一次,培养5-6周。
24.在本发明的具体实施方式中,步骤(1)中所述的根、子叶和下胚轴外植体取自发芽4天白三叶幼苗,具体操作为:将根系和下胚轴横切成2-3cm的片段;将子叶沿子叶中线进行分离,将每片子叶继续切割成2-3瓣。
25.所述的叶片和叶柄外植体取自30日龄的白三叶无菌苗,具体操作为:将叶柄切成3-4mm的柄段,白三叶叶片的单个叶子剪成3-4部分。
26.在本发明的最优选实施方式中,所述外植体选自白三叶幼苗的根。
27.步骤(2)中所述的带有trcml6质粒的农杆菌通过如下方法得到:
28.a:将trcml6基因重组到质粒载体骨架上,筛选、鉴定,获得过表达重组质粒载体;
29.b:采用冻融法转化过表达重组质粒载体至农杆菌,得到带有trcml6质粒的农杆菌。
30.在本发明的具体实施例中,所述农杆菌菌株为eha105,具有利福平抗性;质粒载体为pbi121,其t-dna区携带有gus基因和卡那霉素抗性npt
‑ⅱ
基因。
31.本发明所述的trcml6基因是白三叶钙调素类似蛋白trcml6基因,其核苷酸序列如seq id no.1所示。
32.seq id no.1所示的核苷酸序列具体为:
33.atgggataaacacaaaaacacagcacatttcacatttcctcaaaacaaaacaaaccaaacaacatcatgtgtccttctggcagaaccctccgtccacaacctcccacaaccgatttccgaccggcattcgacattctcgacaccgattgcgacggcaaaataagccgagacgatctccgttcattctacgcaaccaccagcggcgaaggcgtctctgccgacgcaatcggtgccatgatgtcggttgcggacacaaacatggacggatttgtggaatacgaggaattcgagcgtgttgttagtggaaacaatgaaaagaaaccgttaggatgtggagccatggaagatgtgttcaaggtgatggatagagatggtgatggtaaacttagtcatgaagatttgaagaattatatgaattgggctggttttgctgcaacagatgaagaga
taaatgctatgattaagcttggtggtggtgatcaaaacggtggcgttagcttcgatggtttgattcgtatattagctcttgatcatttcgtccctgtttattgattcattaa attaatgatgatatattattatct
34.本发明所述的trcml6基因,是在前期实验的基础上通过壳聚糖外施转录组数据分析筛选得到的具有提高白三叶耐旱性的功能基因。具体有关trcml6基因核苷酸序列、trcml6基因编码的氨基酸序列,以及其在提高植物抗干旱性能中的应用可见发明人同日申请的名称为“白三叶钙调素类似蛋白trcml6基因及在抗旱中的应用”发明专利。
35.本发明涉及的各阶段培养基制备方法如下:
36.所述步骤(1)中的愈伤诱导培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10μg/l。
37.所述步骤(2)中的侵染液配制方法:ms培养基加入30g/l蔗糖、0.5g/l水解酪蛋白和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至4.8,在121℃下高压灭菌15min,加入vc至终浓度10μg/l,再加入as至终浓度20mg/l。
38.所述步骤(3)中的共培养基配制方法:ms培养基加入30g/l蔗糖、0.5g/l水解酪蛋白和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至4.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10μg/l,再加入as至终浓度20mg/l。
39.所述步骤(4)中的愈伤筛选培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10μg/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
40.所述步骤(5)中的分化筛选培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度1.5mg/l,加入naa至终浓度0.1mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10μg/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
41.所述步骤(6)中的生根筛选培养基配制方法:1/2ms培养基中加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入naa至终浓度1mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10μg/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
42.所述的kan抗生素为农杆菌转入的目的质粒pbi121携带的nptii抗性基因对应的抗生素。
43.在本发明的最优选实施方式中,所述农杆菌介导白三叶愈伤组织遗传转化方法包括如下步骤:
44.(1)以生长3-4天的白三叶幼苗的根作为外植体,置于愈伤诱导培养基,23℃、黑暗条件下培养,每2周继代一次,生长5-6周后,获得胚性愈伤组织;
45.(2)将带有trcml6质粒的农杆菌活化至od600值为0.4,并重悬于侵染液中,将步骤(1)中获得的胚性愈伤组织置于侵染液中,低转速侵染25min,随后将侵染的愈伤组织放于共培养基中,在23℃、黑暗条件下,与农杆菌一起共培养4天;
46.(3)将共培养后的愈伤组织洗干净后,放置于抗性愈伤筛选培养基,黑暗条件下,
继续诱导抗性愈伤组织的生成;
47.(4)2周后,将步骤(3)中诱导的抗性愈伤组织,转移至分化筛选培养基中,在23℃、16h光照/8h黑暗、光强4000lx环境下,诱导抗性芽的生成,每2周继代一次;
48.(5)将步骤(4)诱导获得的抗性芽切下,转移至生根筛选培养基中,诱导白三叶根系的生成;
49.(6)将步骤(5)中生根且叶片长势良好的阳性白三叶幼苗移栽至土壤中,并通过pcr方法验证转化是否成功。
50.通过npt
‑ⅱ
基因序列设计特异性引物,pcr用引物序列为:
51.上游引物:5
’‑
gaggctattcggctatgactgg-3’(seq id no.2)
52.下游引物:5
’‑
atcgggagcggcgataccgta-3’(seq id no.3)
53.本发明所述的白三叶为
‘
拉丁诺’白三叶品种。
54.本发明所提供的白三叶愈伤组织的遗传转化方法具有如下技术优势:
55.(1)发明人筛选发现白三叶的根作为外植体进行愈伤诱导,获得的胚性愈伤组织是最佳的白三叶遗传转化受体;
56.(2)发明人采用带有trcml6质粒的农杆菌工程菌液进行侵染,最终可获得具有良好抗旱效果的转基因白三叶植株;
57.(3)本发明提供的遗传转化方法操作简单易行,愈伤组织的转化率较高,为白三叶的基因工程研究和分子育种提供材料,具有科研价值、经济价值和生态价值。
附图说明
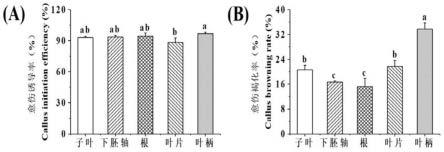
58.图1不同外植体的愈伤诱导率(a)和愈伤褐化率(b)
59.图2根系诱导的胚性愈伤组织
60.图3与农杆菌共培养4天后的愈伤组织
61.图4筛选诱导2周后的抗性愈伤组织
62.图5分化筛选诱导2周后的外植体
63.图6分化筛选得到的丛芽
64.图7生根筛选得到的全株白三叶幼苗
65.图8转基因白三叶pcr鉴定(a)和转基因白三叶gus染色(b)
具体实施方式
66.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
67.表1缩略表
[0068][0069]
本发明涉及的培养基配方如下:
[0070]
愈伤诱导培养基:ms+0.5mg/l 6-ba+2mg/l 2,4-d+10μg/l vc+8g/l琼脂+30g/l蔗糖+200mg/l葡萄糖酸钙,ph=5.8;
[0071]
侵染液:ms+0.5mg/l 6-ba+2mg/l 2,4-d+20mg/l as+10μg/l vc+30g/l蔗糖+0.5g/l水解酪蛋白+200mg/l葡萄糖酸钙,ph=4.8;
[0072]
共培养基:ms+0.5mg/l 6-ba+2mg/l 2,4-d+20mg/l as+10μg/l vc+8g/l琼脂+30g/l蔗糖+0.5g/l水解酪蛋白+200mg/l葡萄糖酸钙,ph=4.8;
[0073]
抗性愈伤筛选培养基:ms+0.5mg/l 6-ba+2mg/l 2,4-d+10μg/l vc+50mg/l kan+250mg/l cef+8g/l琼脂+30g/l蔗糖+200mg/l葡萄糖酸钙,ph=5.8;
[0074]
分化筛选培养基:ms+1.5mg/l 6-ba+0.1mg/l naa+10μg/l vc+50mg/l kan+250mg/l cef+8g/l琼脂+30g/l蔗糖+200mg/l葡萄糖酸钙,ph=5.8;
[0075]
生根筛选培养基:1/2ms+1mg/l naa+10μg/l vc+50mg/l kan+250mg/l cef+8g/l琼脂+30g/l蔗糖+200mg/l葡萄糖酸钙,ph=5.8。
[0076]
用于白三叶外遗传转化的植体筛选优化
[0077]
将
‘
拉丁诺’白三叶的种子浸泡在75%酒精中约5分钟,然后用无菌水冲洗两次;随后,将种子放于0.1%的hgcl2溶液中浸泡10分钟,对种子进行表面灭菌。灭菌后,用无菌蒸馏水洗涤5-6次。随后,将白三叶种子均匀的铺撒在无菌滤纸上并发芽4天,或者将种子转移到ms培养基中生长30天。在此期间,植物保持在23℃,16h光照/8h黑暗的循环,光照强度为3000lx。获得的无菌幼苗或无菌苗作为外植体剪取的材料。
[0078]
根、子叶和下胚轴外植体取自发芽的4天白三叶幼苗,具体操作为:将根系和下胚轴横切成2-3cm的片段;将子叶沿子叶中线进行分离,将每片子叶继续切割成2-3瓣。
[0079]
叶片和叶柄的外植体取自30日龄的白三叶无菌苗,具体操作为:将叶柄切成3-4mm的柄段,白三叶叶片的单个叶子剪成3-4部分。
[0080]
将所获得的无菌外植体接种到愈伤诱导培养基,接种时外植体伤口紧贴于培养基上,放于23℃、黑暗条件下诱导愈伤。为保证培养基的营养成分,每隔2周将外植体继代一次。2周后统计愈伤诱导率,4周后统计愈伤褐化率。
[0081]
当接种在愈伤诱导培养基上时,从白三叶的子叶、下胚轴、根、叶和叶柄外植体中均可以获得愈伤组织。诱导2周后,各个外植体的愈伤诱导率均达到88%以上;但是,在诱导4周后,子叶、下胚轴、叶片和叶柄诱导的愈伤组织大量褐化,而根系诱导的愈伤组织的褐化率仅为15.3%(图1)。在诱导4周后,体式显微镜下,根系诱导的愈伤组织表面可以看到大量原胚或体细胞胚(图2),其他外植体则表现较差。
[0082]
所述的愈伤诱导培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至5.8,加入8g/l琼脂,
在121℃下高压灭菌15min,加入vc至终浓度10ug/l。
[0083]
白三叶根愈伤组织的遗传转化方法
[0084]
(1)根愈伤组织的获得
[0085]
先将种子浸泡在75%酒精中约5分钟,然后用无菌水冲洗两次;随后,将种子放于0.1%的hgcl2溶液中浸泡10分钟,对种子进行表面灭菌。灭菌后,用无菌蒸馏水洗涤5-6次。将吸涨种子平铺于含无菌滤纸的培养皿中,待其生根后(约3-4d)进行剪取外植体操作。采用无菌手术刀片,将幼苗根系分切成2-3mm长的根段,放于白三叶愈伤诱导培养基中,23℃黑暗条件下进行根来源愈伤的诱导。为保证培养基的营养成分,每隔2周继代一次,并弃去继代培养过程中的褐化愈伤组织。待白三叶根系愈伤诱导40天后,将淡黄色、结构紧密、颗粒状的胚性愈伤组织挑出,用于农杆菌侵染。
[0086]
(2)农杆菌工程菌液的制备
[0087]
引物对的设计和克隆方法具体参考名称为“白三叶钙调素类似蛋白trcml6基因及在抗旱中的应用”的发明专利,得到序列全长共584bp的trcml6基因序列。
[0088]
依据pbi121载体序列,设计5’端分别引入xba i和sac i酶切位点和同源臂碱基的引物:pbi121-trcml-f(seq id no.4)和pbi121-trcml-r(seq id no.5)。以“拉丁诺”白三叶cdna为模板,用高保真酶对trcml6进行pcr扩增。xba i和sac i对pbi121载体进行双酶切,而后回收酶切片段。用无缝重组酶将trcml6的pcr片段与线性化pbi121载体片段进行连接,连接产物转化dh5α大肠杆菌感受态细胞后,将感受态细胞涂布于含50mg/l kan的lb固体抗性平板上,37℃过夜培养,挑取菌落pcr验证重组载体后,并进行测序验证,获得的植物过表达重组载体记为pbi121-trcml6。
[0089]
pbi121-trcml-f:
[0090]
agaacacgggggactctagaatgtgtccttctggcagaaccc
[0091]
pbi121-trcml-r:
[0092]
ggggaaattcgagctctcaataaacagggacgaaatga
[0093]
将测序验证后的菌落进行扩大培养,提取pbi121-trcml6过表达重组载体。采用冻融法转化重组质粒至农杆菌eha105感受态细胞中,已转化感受态细胞于28℃、200rpm震荡活化培养4h,放于离心机5000rpm离心1min收取菌液,轻轻吹打重悬菌块并且涂布于含50mg/l kan、10mg/l利福平(rif)抗生素的yeb固体培养基上,倒置放于28℃培养箱培养2-3天。挑取单菌落,摇菌扩繁后,采用菌液pcr检测阳性克隆。
[0094]
取50μl,-80℃保存的eha105农杆菌感受态于冰上融化,向感受态中加入1ug pbi121-trcml6过表达重组载体,混匀冰上静置30分钟、液氮3分钟、37℃水浴5分钟、冰浴5分钟。加入500μl无抗生素的yeb液体培养基,于28℃,200rpm振荡培养4小时,5000rpm离心一分钟收取菌液,轻轻吹打重悬菌块并且涂布于含kan、rif抗生素的yeb固体培养基上,倒置放于28℃培养箱培养2-3天。菌液pcr检测阳性克隆,即带有trcml6质粒的农杆菌eha105,将阳性菌液分装至2ml离心管,并向每一管中添加50%的甘油,放置于-80℃保存菌液。
[0095]
(3)农杆菌侵染和共培养
[0096]
将带有trcml6质粒的农杆菌解冻,取2ml农杆菌菌液于含有kan、rif抗生素的yeb液体培养基中,28℃,200r/min过夜培养。取菌液50ml于8000r/min离心10min,倒掉上清液,将菌体重新悬浮于侵染液中,测定菌液od600值为0.4。
[0097]
将胚性愈伤组织切成5mm的小块,而后投入到含pbi121的农杆菌侵染液中,在28℃、60rpm低速震荡25min。用无菌镊子轻轻夹取附着侵染液的愈伤组织至共培养基,于23℃、黑暗条件下共培养4d,共培养后的愈伤组织如图3所示。
[0098]
所述的侵染液配制方法:ms培养基加入30g/l蔗糖、0.5g/l水解酪蛋白和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至4.8,在121℃下高压灭菌15min,加入vc至终浓度10ug/l,再加入as至终浓度20mg/l。
[0099]
所述的共培养基配制方法:ms培养基加入30g/l蔗糖、0.5g/l水解酪蛋白和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至4.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10ug/l,再加入as至终浓度20mg/l。
[0100]
(4)抗性愈伤组织筛选
[0101]
共培养结束后,用无菌水清洗愈伤组织3-4次,洗净附着在愈伤表面的农杆菌,并将愈伤组织放在无菌滤纸上,吸干表面水分。将干燥的愈伤组织转移至愈伤筛选培养基中,继续诱导愈伤生长2周。未转化愈伤在筛选培养基中会褐化、死亡,转化愈伤组织可正常生长增殖。如图4所示,部分转化组织长出新的愈伤。
[0102]
所述的愈伤筛选培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度0.5mg/l,加入2,4-d至终浓度2mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10ug/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
[0103]
(5)抗性愈伤组织分化诱导
[0104]
将未褐化、生长良好的愈伤组织转移至分化筛选培养基中,置于4000lx、23℃、16h光照/8h黑暗环境下诱导芽的分化。为保证培养基的营养成分和抗性效价满足芽的芽的诱导和伸长生长,以及抗性筛选,每隔2周继代一次。未转化愈伤组织不会发生分化;或者,在分化时芽点黄化、死亡。约2周后,愈伤组织开始分化(如图5所示)。6周后,外植体已经分化出白三叶幼苗地上部分,周围未转化的愈伤组织变为褐色或芽点变黄(如图6所示)。
[0105]
所述的分化筛选培养基配制方法:ms培养基加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入6-ba至终浓度1.5mg/l,加入naa至终浓度0.1mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10ug/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
[0106]
(6)抗性芽生根诱导
[0107]
用无菌手术刀将诱导形成的白三叶幼芽切下(每一个愈伤组织仅取一颗幼芽),转入生根筛选培养基中,幼芽插入生根筛选培养基约4-5mm。在23℃、16h光照/8h黑暗、光照强度4000lx下,诱导幼苗生根。为保证培养基的营养成分和抗性效价满足根的伸长生长和抗性筛选,每隔2周转换一次培养基。如图7所示,在诱导4周后,转基因幼苗的根系可生长8-10cm。
[0108]
所述的生根筛选培养基配制方法:1/2ms培养基中加入30g/l蔗糖和200mg/l葡萄糖酸钙,加入naa至终浓度1mg/l,调节ph值至5.8,加入8g/l琼脂,在121℃下高压灭菌15min,加入vc至终浓度10ug/l,加入kan至终浓度50mg/l,再加入cef至终浓度250mg/l。
[0109]
(7)转基因幼苗鉴定
[0110]
将已生根幼苗转入生长室开盖,倒入蒸馏水炼苗1周。将生根的白三叶幼苗从培养
基中拔出、洗净,移栽至完全湿润的营养土中,继续培养扩繁4周。取叶片和叶柄组织进行dna提取,dna提取后通过npt
‑ⅱ
基因序列设计特异性引物,总扩增长度为700bp。以提取的幼苗的dna为模板,进行pcr反应,验证标记基因整合情况。
[0111]
pcr用引物序列:
[0112]
上游引物:5
’‑
gaggctattcggctatgactgg-3’(seq id no.2)
[0113]
下游引物:5
’‑
atcgggagcggcgataccgta-3’(seq id no.3)
[0114]
如图8a所示,所获得的11株白三叶幼苗经pcr检测后,有7株最终确定为转基因白三叶幼苗,其转基因植株阳性率为63%。将未转化白三叶与转基因白三叶分别进行gus染色后,对照植株叶片脱色后呈黄白色,转基因植株呈蓝色(如图8b所示)。
[0115]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1