一株互隔交链孢霉、除草剂及其应用
1.本发明涉及微生物技术领域,尤其涉及一株互隔交链孢霉、除草剂及其应用。
背景技术:
2.播娘蒿(descurainia sophia)又名麦蒿,属于十字花科播娘蒿属植物,其抗酸耐盐碱、耐寒,具有高度的环境适应性,在我国除华南地区外各地区均有分布,是黄河中下游地区麦田数量最大的阔叶类杂草,也是麦田里常见的恶性杂草。其生长迅速、植株高大,极易与小麦竞争有效资源,还可引起植株倒伏,严重影响小麦质量和产量,最高可使小麦产量损失53.96%。
3.目前,叶面喷施化学除草剂是我国防治播娘蒿的最主要的方法,受除草剂对小麦的安全性的影响,化学防治窗口期短暂,小麦拔节后无法使用除草剂防治播娘蒿。此外,播娘蒿已普遍对化学除草剂产生了严重的抗药性,导致防效明显下降。开发播娘蒿生防菌无疑可弥补化学除草剂对作物和环境安全性不高、容易诱发抗药性等的缺点,成为综合治理播娘蒿的重要手段。
4.相对于化学防治,生物防治具有毒性低、选择性强、无农药残留、不产生抗药性等优点,具有很好的发展前景。但是目前,尚无可用于有效防治播娘蒿的微生物菌种被报道。
5.因此,现有技术有待进一步改进。
技术实现要素:
6.针对上述问题,本发明提供了一株播娘蒿致病菌-互隔交链孢霉(alternaria alternata)jm,其对播娘蒿具有优异的防治效果,可用于制备播娘蒿除草剂,具有使用安全、选择性强、无农药残留、不产生抗药性等优点。
7.申请人在偶然田间发现:播娘蒿的茎、幼嫩角果及果梗可被真菌侵染,使角果干枯,无法结实(见图1)。因此,从该染病的播娘蒿中分离得到所述互隔交链孢霉(alternaria alternata)jm,并对其生物学特性以及除草活性进行充分研究,发现:该菌种的菌丝和孢子都对播娘蒿具有侵染作用;接种该菌的菌丝体24h后就可在播娘蒿叶片上观察到大量绒毛状菌丝,10d后播娘蒿完全死亡。
8.基于上述研究成果,本发明提供以下的技术方案:
9.第一方面,本发明提供一株互隔交链孢霉,其特征在于,其被命名为互隔交链孢霉(alternaria alternata)jm,其保藏号为cgmcc no.23848。
10.经鉴定,该互隔交链孢霉(alternaria alternata)jm是属于半知菌亚门、丝孢纲、丝孢目、暗色科、链格孢属、互隔交链孢霉种。在2021年11月10日,该互隔交链孢霉jm被保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏号为:cgmcc no23848,保藏地址为北京市朝阳区北辰西路1号院3号。
11.经实验发现,该互隔交链孢霉jm在7种培养基(psa、pda、oma、cma、sda、ca和wa培养基)上均能生长,其中,在psa和pda培养基上生长最快。这说明该菌株对培养条件要求不严
格,培养成本低。
12.jm菌株在5~35℃范围内均能生长,适宜生长温度为15~30℃,最适温度为28℃。jm菌株在ph5~12均能较快生长,jm菌株在连续光照、12h光暗交替、全黑暗3种光照条件下均可生长。此外,互隔交链孢菌在16-37℃的温度范围内均可产孢子,22-25℃产孢量最大。这说明jm菌株对环境的适应能力强,在田间应用时其存活能力强,有效延长该菌制备的除草剂的持效期,提高其除草效率。
13.第二方面,本发明还提供一种微生物菌剂,其活性成分包括上述的互隔交链孢霉jm。优选地,所述微生物菌剂为互隔交链孢霉jm的菌丝体和/或孢子或其发酵上清液。所述菌丝体和/或孢子为菌丝体和/或孢子的悬液或进一步进行剂型处理后得到的粉剂、可湿性粉剂、水分散粒剂、干悬浮剂、泡腾剂或冻干粉。
14.所述微生物菌剂可作为活性成分用于制备除草剂、复合型微生物菌肥或复合杀虫剂(具有杀虫、除草多种活性)等各个应用方面。
15.第三方面,本发明还提供上述微生物菌剂的制备方法,该制备方法包括以下步骤:
16.s1、将权利要求1所述的互隔交链孢霉接种到液体培养基中,26~30℃,振荡培养5~7d;
17.s2、将得到的培养液进行过滤,收集菌丝体或收集菌丝体和孢子后,以电磨机粉碎10min,获得菌丝体片段,接着用无菌水稀释,得到菌丝体片段的悬浊液,直接作为微生物菌剂;或进一步进行剂型处理微生物菌剂。
18.该方法是利用互隔交链孢霉的菌丝体片段制备微生物菌剂。
19.或者,微生物菌剂的制备方法包括以下制备步骤:
20.s01、将所述互隔交链孢霉接种到固体培养基中,黑暗条件下培养6~8d;
21.s02、将得到的固体培养基加入到带玻璃珠的灭菌水中,静置后震荡,再进行过滤,得到互隔交链孢霉孢子悬浮液,将其直接作为微生物菌剂;或进一步进行剂型处理微生物菌剂。
22.该方法是利用互隔交链孢霉的孢子悬浮液制备微生物菌剂。
23.优选地,所述固体培养基为水稻固体培养基、麦麸固体培养基、玉米粉固体培养基、小麦固体培养基、燕麦片固体培养基、psa、pca、pda、ca、玉米粉培养基或燕麦片培养基。培养条件为:25℃,黑暗培养7d。实验证明,水稻培养基的产孢效果最好,麦麸、燕麦片、小麦和玉米粉培养基也可用于互隔交链孢霉的产孢,产孢都超过1
×
106。优选地,所述固体培养基为水稻固体培养基。
24.优选地,s02步骤的条件具体为:将得到的固体培养基加入到50ml带玻璃珠的灭菌水中,静置30分钟,200rpm震荡30分钟,四层纱布过滤,得到孢子悬浮液,将其直接作为微生物菌剂;或进一步进行剂型处理微生物菌剂。
25.为降低成本,可直接将得到的菌丝体片段的悬浊液或孢子悬浮液作为微生物菌剂进行使用;在此基础上,为了便于存储或达到缓释效果,可对菌丝体片段的悬浊液或孢子悬浮液与载体、其他助剂混合进行进一步的剂型加工(采用现有技术),得到不同剂型的微生物菌剂,如粉剂、可湿性粉剂、水分散粒剂、干悬浮剂、泡腾剂等。
26.优选地,所述s1步骤中的液体培养基为:pd液体培养基。
27.优选地,上述s1步骤最佳的制备条件为:取互隔交链孢霉jm菌株的2块直径10mm的
菌块,接种于培养基中,25℃恒温暗培养7d。
28.第四方面,本发明还提供一种除草剂,其活性成分包括上述的互隔交链孢霉。所述除草剂的剂型为粉剂、可湿性粉剂、水分散粒剂、干悬浮剂、泡腾剂等。优选地,所述除草剂还包括其他各种助剂,用以延长除草剂的持效期和稳定性。
29.优选地,为了进一步提高除草剂的除草活性或拓宽除草谱,所述除草剂还包括其他化学除草剂或微生物除草成分,如苯磺隆、噻吩磺隆、甲基二磺隆、氟唑磺隆、氯吡嘧磺隆、啶磺草胺、双氟磺草胺、2,4-滴、2甲4氯、氯氟吡氧乙酸、氟氯吡啶酯、绿麦隆、异丙隆、麦草畏、灭草松。可选地,所述除草剂的活性成分包括上述互隔交链孢霉的菌丝体、孢子或其发酵上清液。
30.第五方面,本发明还提供上述互隔交链孢霉、微生物菌剂或所述除草剂在防治杂草中的应用。优选地,所述杂草为播娘蒿。
31.优选地,进行应用时,互隔交链孢霉的菌丝浓度不低于1
×
107cfu/ml。实验证明,随着菌丝浓度的升高,播娘蒿的发病指数、发病率呈升高趋势。当菌丝浓度为1
×
107cfu/ml时,发病率达到76.92%,显著高于其他浓度。
32.优选地,进行应用时,互隔交链孢霉的孢子悬浮液浓度不低于1
×
106个/ml。实验证明,随着孢子悬浮液浓度的升高,播娘蒿的发病指数、发病率呈升高趋势。当菌丝浓度为1
×
106个/ml时,发病率达到60.77%。
33.本发明具有以下有益效果:
34.1、本发明首次发现一株播娘蒿致病菌互隔交链孢霉(alternaria alternata)jm,该菌的菌丝和孢子都对播娘蒿具有侵染性,接种菌丝体5天后发病率达到76.9%,结种孢子悬浮液5天后发病率达到60.77%,菌丝侵染导致的播娘蒿的发病率更高。因此,可将该菌作为除草剂的活性成分,专门应用于田间播娘蒿的防治。该菌制备的除草剂或微生物菌剂的制备方法简单,适于进行大规模发酵生产。
35.2、互隔交链孢霉jm菌的致病性具有高选择性,对小麦、芝麻、油菜、红豆、绿豆常见作物等非常安全,对荞麦、豌豆、高粱、玉米、有轻度危害但不影响生长,对雀麦、荠菜、婆婆纳有显著危害影响其生长。因此,互隔交链孢霉jm菌使用安全、不会诱发播娘蒿的抗药性、环境安全性高且杀草谱广,在播娘蒿的防治方面具有很好的发展前景。
附图说明
36.图1为田间观察到被互隔交链孢霉jm侵染的播娘蒿的形态;显示播娘蒿的茎、幼嫩角果及果梗可被真菌侵染,使角果干枯,无法结实;
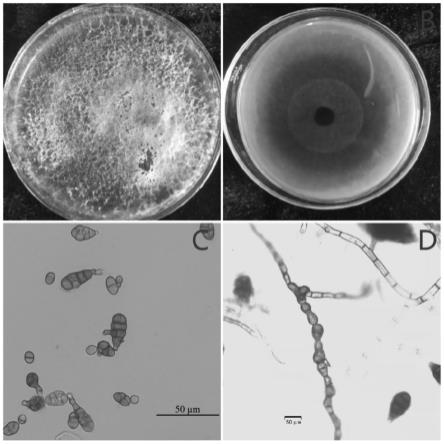
37.图2为互隔交链孢霉jm的菌落形态及分生孢子形态;其中,a.pda上正面菌落形态;b.pda上背面菌落形态;c分生孢子;d.菌丝;
38.图3为基于its序列构建的系统发育树;
39.图4为基于ef-ia序列构建的系统发育树;
40.图5为基于altal序列构建的系统发育树;
41.图6为基于endopg序列构建的系统发育树;
42.图7为基于β-tubulin序列构建的系统发育树;
43.图8为不同培养基对互隔交链孢霉jm菌株菌丝生长的影响;其中,pda为马铃薯葡
萄糖琼脂培养基,psa为马铃薯蔗糖琼脂培养基,ca为胡萝卜琼脂培养基,oma为燕麦片琼脂培养基,sda为沙氏葡萄糖琼脂培养基,cma为玉米粉琼脂培养基,wa为水琼脂培养基;相同字母间无显著性差异;
44.图9为不同速效碳源对互隔交链孢霉jm菌株菌丝生长影响;
45.图10为不同速效氮源对互隔交链孢霉jm菌株菌丝生长的影响;
46.图11为温度对互隔交链孢霉jm菌株菌丝生长的影响;
47.图12为不同ph对菌丝生长的影响;
48.图13不同光照条件对菌丝生长的影响;
49.图14为孢子和菌丝体接种5天后的结果;其中,
①
对照;
②
接种孢子悬浮液;
③
接种喷菌丝体;
50.图15为接种菌丝体10天后的结果;注:
①
对照;
②
喷菌丝体;
51.图16为孢子悬浮液浓度对播娘蒿侵染的影响;
①
对照;
②1×
106个/ml;
③
0.5
×
106个/ml;
④1×
105个/ml;
52.图17为菌丝体浓度对播娘蒿侵染的影响;
①
对照;
②
0.25
×
107cfu/ml;
③
0.5
×
107cfu/ml;
④1×
107cfu/ml;
53.图18为菌丝体培养时间对互隔交链孢霉jm菌株致病能力的影响;
54.图19为菌丝体接种对角果期播娘蒿的侵染的结果;
55.图20为菌丝体接种体对小麦无危害;其中,
①
对照组;
②
实验组;
56.图21为菌丝体接种体对芝麻无危害;其中,
①
对照组;
②
实验组;
57.图22为菌丝体接种体对荞麦的安全性检测结果;
①
对照组;
②
实验组;
58.图23为菌丝体接种体对油菜的安全性检测结果;
①
对照组;
②
实验组;
59.图24为菌丝体接种体对红豆的安全性检测结果;
①
对照组;
②
实验组;
60.图25为菌丝体接种体对绿豆的安全性检测结果;
①
对照组;
②
实验组;
61.图26为菌丝体接种体对豌豆的安全性检测结果;
①
对照组;
②
实验组;
62.图27为菌丝体接种体对高粱的安全性检测结果;
①
对照组;
②
实验组;
63.图28为菌丝体接种体对玉米的安全性检测结果;
①
对照组;
②
实验组;
64.图29为菌丝体接种体对雀麦的防治检测结果;
①
对照组;
②
实验组;
65.图30为菌丝体接种体对荠菜的防治检测结果;
①
对照组;
②
实验组;
66.图31为菌丝体接种体对婆婆纳的防治检测结果;
①
对照组;
②
实验组;
67.图32为侵染前后的角果果实的图片;
①
为被互隔交链孢霉侵染后的角果果实;
②
为未被互隔交链孢霉侵染的角果果实。上述涉及的附图中,相同字母间无显著性差异。
具体实施方式
68.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。在本发明中,若非特指,所采用的设备和原料等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
69.实施例1互隔交链孢霉的分离和鉴定
70.1、播娘蒿病株的采集
71.播娘蒿感病植株于2020年6月采于山东省青岛市即墨区,切下感病植株地上部分,在室内晾干保存。
72.2、播娘蒿的培养
73.选取低温层积处理后的播娘蒿种子,用0.1%升汞溶液消毒2m,无菌水清洗数次,播种于装有松软土壤的小花盆中,覆土后置于温室内培养(15-25℃),生长至幼苗期后移栽,每盆里一株,继续培养至抽苔。
74.3、播娘蒿病原菌的分离与鉴定
75.(1)菌株的分离纯化
76.切取感病播娘蒿病健交界处约0.2cm
×
0.2cm大小组织,75%酒精消毒20-30s,0.1%升汞溶液消毒1.5-2m,无菌水冲洗3次,在无菌操作台上将其接种于pda培养基上,28℃黑暗条件下培养7d后,打取直径10mm的菌饼接种于新的pda培养基上,相同条件继续培养,直至出现生长整齐一致且无杂菌的单菌落,将纯化的病原菌接种于pda培养基斜面,置于4℃保存。
77.(2)播娘蒿病原菌的形态观察
78.a、实验方法:
79.按上述条件将病原菌活化后培养,观察菌落形态、颜色以及生长状况,在光学显微镜下观察分生孢子的大小、纵横隔等形态特征,参照真菌检索表及真菌鉴定手册,初步鉴定侵染播娘蒿病原菌的种类。
80.b、实验结果及分析
81.如图2所示,菌株在pda培养基上的菌落近圆形,边缘规则,呈灰青色至暗褐色,菌丝致密,菌落背面呈深褐色至黑色;分生孢子呈倒棍棒状,卵状,近椭圆状或倒梨状,褐色,具3-8个横隔膜,分隔处略隘缩或不隘缩,0-4个纵斜隔膜。根据病原菌形态特征,参照真菌检索表及真菌鉴定手册,初步认定该菌为链格孢属(alternaria),命名为jm菌株。
82.(3)播娘蒿病原菌的分子生物学鉴定
83.a、实验方法:
84.取播娘蒿病原菌菌丝100mg,ctab法提取总dna,以其为模板,分别使用表1的6对引物扩增相应基因片段,pcr反应体系为20μl,包括供试菌株dna模板1μl,正向引物和反向引物各1μl,2
×
m5 hiper plus taq hifi pcr mix(with blue dye)10μl,ddh2o 8μl。反应条件为,95℃预变性5m;95℃变性30s,退火30s,72℃延伸45s,共34个循环;72℃后延伸5m,4℃保存。引物序列及退火温度间表1。pcr扩增产物经1%琼脂糖凝胶电泳检测后,将具有目的条带的产物送至生工生物工程(上海)股份有限公司测序。将测序结果在genbank数据库中序列比对,下载同源性较高的相应序列,用mega 6.0软件的邻接法(neighbor-joining method)构建系统发育树,确定播娘蒿病原菌的种类。
85.表1播娘蒿病原菌的分子生物学鉴定所用引物序列及其退火温度
[0086][0087]
b、实验结果及分析
[0088]
引物abre1和abre2未能扩增出目的片段,该引物为扩增芸苔链格孢(a.brassicae)的特异性引物,故排除jm菌株为芸苔链格孢的可能。its、ef-ia、endopg、altal和β-tubulin等基因扩增均得到目的片段,大小分别约500bp、250bp、500bp、600bp、475bp,序列的测序结果依次分别见序列表中seq id n0:1~seq id n0:5。
[0089]
如图3-5所示,基于its、ef-ia、altal序列构建的系统发育树显示,jm菌株与a.alternata、a.tenuissima聚在同一单源分支上,其同源性分别达到100%、91%和92%;而基于endopg和β-tubulin序列构建的系统发育树显示,jm菌株与a.alternata在同一单源分支上,同源性更高,聚类分析结果可区分a.alternata(互隔交链孢霉)和a.tenuissima(细极链格孢菌)(图6-图7),结果表明jm菌株为互隔交链孢霉(a.alternata)。
[0090]
实施例2互隔交链孢霉jm菌株菌丝生长特性
[0091]
1、培养基对互隔交链孢霉jm菌株菌丝生长的影响
[0092]
(1)实验方法:按前述菌株的分离纯化的条件活化菌株,当菌落直径达到80mm时,打取直径为6mm的菌饼,分别转接到不同培养基中,于28℃恒温暗培养7d,十字交叉法测量菌落直径。共考察pda、psa、ca、oma、sda、cma和wa 7种培养基,每处理重复3次。
[0093]
(2)实验结果及分析:从图8的结果可知,jm菌株在7种培养基上均能生长,在psa和pda培养基上生长最快,菌丝均生长致密,7d后菌落直径分别为76.13、75.70mm,菌丝生长速率显著快于其他培养基,但二者间无显著差异。jm菌株在oma、cma、sda、ca培养基上菌丝生长较快,菌落平均直径分别为65.48、62.28、64.26、62.23mm,处理之间无显著差异;在wa培养基上的菌落平均直径为21.06mm,显著低于以上6种培养基。上述结果说明pda和psa是最适合该菌生长的培养基。
[0094]
2、碳源对互隔交链孢霉jm菌株菌丝生长的影响
[0095]
(1)实验方法:以pda培养基为基础培养基,分别以蔗糖、可溶性淀粉、乳糖、麦芽糖、木糖、甘露糖等质量替换其中的葡萄糖,以不加碳源的基础培养基作为对照。按菌株的分离纯化中的方法培养和测量菌落直径,每处理重复3次。
[0096]
(2)实验结果及分析:从图9的结果可知,菌株在7种碳源培养基上均能生长,以蔗糖和葡萄糖利用率最高,7d后菌落直径分别为76.69、76.14mm,显著高于其它碳源处理;甘露糖、木糖、可溶性淀粉、乳糖利用率次之,菌落平均直径分别为71.47、70.55、70.15、68.11mm;麦芽糖利用率最低,菌落平均直径为64.06mm。
[0097]
3、氮源对互隔交链孢霉jm菌株菌丝生长的影响
[0098]
(1)实验方法:以pda培养基作为基础培养基,分别以氯化铵、硝酸钠、苯丙氨酸、硫酸铵、尿素、蛋白胨、牛肉浸膏等质量替换其中的葡萄糖,以不加氮源的基础培养基作为对照。按前述菌株分离纯化中的方法培养和测量菌落直径,每处理重复3次。
[0099]
(2)实验结果及分析:从图10的结果可知,jm菌株对氮源的利用率普遍不高。在7种氮源培养基中,苯丙氨酸利用率最高,7d后菌落平均直径为54.28mm,显著高于其它氮源处理;尿素利用率最低,菌丝生长速度显著低于其它处理.
[0100]
4、温度对互隔交链孢霉jm菌株菌丝生长的影响
[0101]
(1)实验方法:按前述的方法接种菌饼至pda培养基上,分别置于5、10、15、20、25、28、30、35℃恒温暗培养7d,十字交叉法测定菌落直径,每处理重复3次。
[0102]
(2)实验结果及分析:从图11的结果可知,jm菌株在5~35℃范围内均能生长,适宜生长温度为15~30℃,最适温度为28℃,7d后菌落平均直径为76.96mm,显著高于其它处理。5℃、10℃、35℃菌丝生长速度显著低于其他处理,表明过高的温度和过低的温度都不适宜jm菌株生长。
[0103]
5、ph对互隔交链孢霉jm菌株菌丝生长的影响
[0104]
(1)实验方法:分别用1mol/l盐酸溶液和1mol/l氢氧化钠溶液调节pda培养基ph至5、6、7、8、9、10、11、12。按本实施例的第1部分的方法接种、培养和测量菌落直径,每处理重复3次。
[0105]
(2)实验结果及分析:从图12的结果可知,jm菌株在ph 5~12均能较快生长,7d后菌落平均直径依次为76.09、71.02、74.95、74.82、72.72、68.70、68.40、68.12mm。
[0106]
6、光照对互隔交链孢霉jm菌株菌丝生长的影响
[0107]
(1)实验方法:按本实施例的第1部分的方法接种菌饼至pda培养基上,设连续光照、12h光暗交替、全黑暗3种处理,于28℃恒温培养7d,十字交叉法测量菌落直径,每处理重复3次。
[0108]
(2)实验结果及分析:从图13的结果可知,jm菌株在连续光照、12h光暗交替、全黑暗3种光照条件下均可生长,7d后菌落平均直径分别为74.20、47.42、67.43mm,在连续光照条件下的菌落平均直径显著高于其它2种处理,表明连续光照最适合菌丝生长。
[0109]
实施例3互隔交链孢霉jm菌株固体培养产孢特性
[0110]
1、固体培养基配制
[0111]
采用250ml三角瓶作为发酵容器,装瓶量为20.00g/瓶,拌水量为75%,预浸24小时,121℃灭菌20m后备用。
[0112]
2、发酵培养与孢子含量测定方法
[0113]
除特别提及外,均按此方法进行。取互隔交链孢霉jm菌株的2块直径10mm的菌块,接种于培养基中,28℃恒温暗培养7d,每处理重复3次。取全部培养基加入到50ml带玻璃珠的灭菌水中,静置30分钟,200rpm震荡30分钟,四层纱布过滤,将孢子悬浮液滴至血球计数板上,显微镜下观察,记录5个中格共计80个小方格内孢子总数,通过公式(1)计算出每克固体培养基的孢子数,用spss 26.0分析各组之间的差异显著性。
[0114]
每克固体培养基中孢子数=80个小格中孢子总数
×
125000
ꢀꢀ
(公式1)
[0115]
3、培养基对互隔交链孢霉jm菌株产孢的影响
[0116]
(1)实验方法:
[0117]
①
分别配置psa、pca、pda、ca、玉米粉培养基、燕麦片培养基和水琼脂培养基,并制备培养基平板,并分别将1块直径10mm的菌块接种到各个培养基平板中央,28℃恒温暗培养7d,每处理重复3次。按上述孢子含量测定方法计数。
[0118]
②
分别以水稻、小麦、玉米粉、燕麦片、米糠和麦麸直接作为发酵培养基,按上述发酵培养和孢子含量测定方法接种(喷洒适量无菌水)、培养和计数。
[0119]
(2)实验结果及分析:
[0120]
从表2的结果可知,互隔交链孢jm菌株在这批不同培养基中产生的孢子数量差异明显,在水稻发酵培养基中产生的孢子数量最多,为1.13
×
107个/g,其次为麦麸发酵培养基、玉米粉发酵培养基、psa培养基、小麦发酵培养基等,除水琼脂培养基、玉米粉培养基外的其他培养基的产孢量均超过1
×
106个/g。
[0121]
表2不同培养基对互隔交链孢jm菌株产孢的影响
[0122]
[0123][0124]
注:由a-f产孢依次降低,相同字母间无显著性差异。
[0125]
4、速效碳源对互隔交链孢霉jm菌株产孢的影响
[0126]
(1)实验方法:分别以葡萄糖、蔗糖、麦芽糖为速效碳源,按1%比例添加至水稻培养基中,以不加速效碳源的培养基为对照,按发酵培养和孢子含量测定方法接种、培养和计数。
[0127]
(2)实验结果及分析:速效碳源对jm菌株产孢的影响如表3所示,添加葡萄糖的培养基产孢量最多,但和对照组相比没有显著性差异。
[0128]
表3速效碳源对产孢的影响
[0129][0130]
注:相同字母间无显著性差异。
[0131]
5、速效氮源对互隔交链孢霉jm菌株产孢的影响
[0132]
(1)实验方法:分别以蛋白质、尿素、硫酸铵为速效氮源,按1%比例添加至水稻培养基中,以不加速效氮源的培养基为对照,按发酵培养和孢子含量测定方法接种、培养和计数。
[0133]
(2)实验结果及分析:如表4所示,不添加任何速效氮源的培养基产孢量最多,硫酸铵和尿素显著抑制菌株产孢。
[0134]
表4速效氮源对产孢的影响
[0135][0136][0137]
注:相同字母间无显著性差异。
[0138]
6、培养时间对互隔交链孢霉jm菌株产孢的影响
[0139]
(1)实验方法:以水稻为固体培养基,设5、10、15、20天4种处理,28℃恒温暗培养,按前述的方法计数。
[0140]
(2)实验结果及分析:培养时间对jm菌株产孢的影响如表5,随着培养时间的增加,产孢量增加,培养15-20d产孢量显著高于培养5-10d。
[0141]
表5培养时间对产孢的影响
[0142][0143]
注:由a-b产孢依次降低,相同字母间无显著性差异。
[0144]
7、光照对互隔交链孢霉jm菌株产孢的影响
[0145]
(1)实验方法:以水稻为固体培养基,设连续光照、12h光暗交替、全黑暗3种处理,28℃恒温培养7d后,按发酵培养和孢子含量测定的方法计数。
[0146]
(2)实验结果及分析:光照时间对jm菌株产孢数的影响如表6所示,连续光照和12h光照/黑暗交替均不利于孢子的形成,最适宜jm菌株孢子形成的条件为连续黑暗。
[0147]
表6光照时间对产孢的影响
[0148][0149]
注:相同字母间无显著性差异。
[0150]
8、温度对产孢影响
[0151]
(1)实验方法:以水稻为固体培养基,设16、19、22、25、28、31、34、37℃8个处理,于全黑条件下培养7d,按发酵培养和孢子含量测定的方法计数。
[0152]
(2)实验结果及分析:由表7可见,互隔交链孢菌在16-37℃的温度范围内均可产孢子,22-25℃产孢量最大,低于22℃或高于25℃产孢量均逐渐降低。
[0153]
表7温度对产孢的影响
[0154][0155]
注:相同字母间无显著性差异。
[0156]
实施例4互隔交链孢霉jm菌株对播娘蒿、小麦及其他作物的侵染
[0157]
1、互隔交链孢霉jm菌株菌丝和孢子对播娘蒿的侵染
[0158]
(1)实验方法:
[0159]
a、互隔交链孢霉jm菌株菌丝侵染播娘蒿的操作方法
[0160]
将互隔交链孢霉jm菌株接种到200ml pd液体培养基中,26℃150rpm振荡培养6d,4层纱布过滤,取菌丝体,以厨用电磨机粉碎10m,获得菌丝体片段(≤100μm
×
10μm),用100ml无菌水稀释。按前述实施例3的方法制备孢子悬浮液。
[0161]
取互隔交链孢霉jm菌株不同类型接种体10ml,均匀喷到抽苔期的播娘蒿上,置温室(26
±
1℃)保湿培养5天,观察播娘蒿发病情况,以喷施清水为对照,实验设3次重复。
[0162]
b、病情分级与统计方法
[0163]
调查时记录各处理所有播娘蒿叶片,统计发病率、病情指数,并测量地上部分鲜重。病情分级标准为:0级无枯死;1级枯死面积占叶片0-25%;2级枯死面积占叶片26%-50%;3级枯死面积占叶片51%-75%;4级枯死面积占叶片76%-100%。病情指数计算如公式(2)。
[0164][0165]
(2)实验结果及分析
[0166]
实验结果显示,接种菌丝体5d后,播娘蒿的病情指数、发病率、鲜重抑制率分别为61.5、76.9%、59.3%,接种孢子5d后播娘蒿的病情指数、发病发病率、鲜重抑制率分别为43.2、60.77%、43.03%,可见菌丝体的侵染力更强,见图14。如图15所示,接种菌丝体24h后就可从叶片上观察到大量绒毛状菌丝,10d后播娘蒿完全死亡。
[0167]
表8菌丝体(1
×
107cfu/ml)侵染下播娘蒿的病情指数、发病率、鲜重抑制率
[0168][0169]
表9孢子悬浮液(1
×
106个/ml)侵染下播娘蒿的病情指数、发病率、鲜重抑制率
[0170][0171]
2、互隔交链孢霉jm菌株孢子悬浮液浓度对侵染播娘蒿的影响
[0172]
(1)实验方法:将孢子悬浮液浓度分别调到1
×
106、0.5
×
106、1
×
105个/ml去侵染播娘蒿,培养5d后观察结果。
[0173]
(2)实验结果及分析:
[0174]
图16和表10的结果显示,播娘蒿的发病指数、发病率均随孢子悬浮液浓度的升高而升高,当菌丝浓度为1
×
106个/ml时,发病指数为43.2,发病率达到60.77%。
[0175]
表10不同浓度孢子悬浮液侵染下播娘蒿的病情指数、发病率
[0176][0177]
3、互隔交链孢霉jm菌株菌丝体浓度对侵染播娘蒿的影响
[0178]
(1)实验方法:将菌丝体片段悬浮液分别调到1
×
107、0.5
×
107、0.25
×
107cfu/ml,参照本实施例的第1部分的方法侵染播娘蒿,培养5d后观察结果。
[0179]
(2)实验结果及分析:
[0180]
图17和表11的结果显示,播娘蒿的发病指数、发病率均随菌丝浓度的升高而升高,当菌丝浓度为1
×
107cfu/ml时,发病指数为61.54,发病率达到76.92%,显著高于其他浓度。
[0181]
表11不同浓度的互隔交链孢霉jm菌株菌丝体侵染播娘蒿的结果
[0182]
[0183]
4、互隔交链孢霉jm菌株菌丝体培养时间对播娘蒿侵染的影响
[0184]
(1)实验方法:
[0185]
互隔交链孢霉jm菌株接种到pd培养基中,按本实施例第1部分的方法分别培养5、10、15、20d,配制1
×
107cfu/ml的菌丝悬浮液,侵染观察。
[0186]
(2)实验结果及分析:
[0187]
从图18可以看出,随着菌丝体培养时间的增加,其致病能力逐渐减弱。后期菌丝体致病能力减弱可能由于菌丝衰老,发生自溶,侵染能力下降所致。
[0188]
5、侵染温度对互隔交链孢霉jm菌株菌丝体侵染播娘蒿的影响
[0189]
(1)实验方法:
[0190]
互隔交链孢霉jm菌株接种到pd培养基中,按本实施例第1部分的方法培养6d,配制1
×
107cfu/ml的菌丝悬浮液,设置侵染温度梯度16、20、24、28、32℃侵染观察。
[0191]
(2)实验结果及分析
[0192]
表12显示,播娘蒿的病情指数和发病率随着温度的升高而增加,28℃时病情指数和发病率显著高于其他温度。
[0193]
表12互隔交链孢霉jm菌株菌丝体在不同温度下侵染播娘蒿的结果
[0194][0195]
6、互隔交链孢霉jm菌株菌丝体对角果期播娘蒿的侵染
[0196]
(1)实验方法:
[0197]
互隔交链孢霉jm菌株接种到pd培养基中,按本实施例第1部分的方法培养6d,配制1
×
107cfu/ml的菌丝悬浮液,侵染观察。
[0198]
(2)实验结果及分析:
[0199]
从图19可以看出,侵染后的播娘蒿的角果干枯,上面布满菌丝和田间观察到的情况一致。
[0200]
7、互隔交链孢霉jm菌株菌丝体对常见作物的安全性检测
[0201]
(1)实验方法:将菌丝体浓度调到1
×
107cfu/ml,按本实施例第1部分的接种到2-3叶期的小麦、玉米、高粱、豌豆、绿豆、红豆、油菜、荞麦、芝麻上,培养5d后观察结果。
[0202]
安全性评估方法为:++++:对作物安全没有任何危害;+++对作物有轻度危害,但是不影响整体生长;++对作物有危害,影响生长;+造成作物死亡。
[0203]
具体判定方法为:与对照进行对比,若侵染组的叶片、植株都和对照无异,判定它为“没有任何危害”;若侵染组的叶片出现蜷缩、发黄、或者有部分呈坏死状,但是植株茎秆没有影响仍能正常生长,判定其为“轻度危害”;如果侵染的植株叶片坏死植株倒伏,且摘袋后不可恢复则将其判定为“有危害”;如果相同的套袋时间,侵染植株整株死亡,则将其判定
为“死亡”。
[0204]
(2)实验结果及分析:由表11的结果可知,互隔交链孢霉jm菌株菌丝体对小麦、芝麻、油菜、红豆、绿豆等作物非常安全,对荞麦、豌豆、高粱、玉米有轻度危害但不影响生长。
[0205]
表13互隔交链孢霉jm菌株菌丝体对常见作物的安全性
[0206][0207]
8、互隔交链孢霉jm菌株菌丝体对雀麦的侵染
[0208]
(1)实验方法:按本实施例前述内容和第1部分的方法将jm菌株菌丝体侵染2-3叶期的雀麦,5天后观察发病情况,实验设3次重复。
[0209]
(2)实验结果及分析:如图29所示,菌丝体接种体5d后,可对雀麦造成明显危害,使其叶尖干枯,叶片黄化,显著抑制生长。
[0210]
9、互隔交链孢霉jm菌株菌丝体对荠菜的侵染
[0211]
(1)实验方法:按本实施例前述内容和第1部分的方法将jm菌株菌丝体侵染花叶期的荠菜,5天后观察发病情况,实验设3次重复。
[0212]
(2)实验结果及分析:如图30所示,菌丝体接种体5d后,可对荠菜造成明显危害,使其叶片干枯,黄化严重影响荠菜生长。
[0213]
10、互隔交链孢霉jm菌株菌丝体对婆婆纳的侵染
[0214]
(1)实验方法:按本实施例前述内容和第1部分的方法将jm菌株菌丝体侵染婆婆纳,5天后观察发病情况,实验设3次重复。
[0215]
(2)实验结果及分析:如图31所示,菌丝体接种体5d后,可对婆婆纳造成明显危害,使其叶片失绿干枯,严重影响婆婆纳生长。
[0216]
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及本发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1