一种利用连续发酵分离一体化技术培养酿酒酵母的方法与流程
1.本发明属于微生物技术领域,具体涉及一种利用连续发酵分离一体化技术培养酿酒酵母的方法。
背景技术:
2.核糖核酸(rna)是一类十分重要的生物大分子,普遍存在于动物、植物和微生物细胞中,不仅在基因的表达和蛋白质的生物合成起着关键的作用,而且还能促进细胞的诸多生理功能。核糖核酸主要用于酶解生成amp、gmp、cmp和ump四种5
′–
核苷酸,核苷酸在细胞结构、代谢、能量和调节等方面起着重要的作用,已在医药、食品及农业生产上得到广泛的应用。因此,核糖核酸的开发研究受到越来越多的关注。
3.微生物是工业上大量生产核酸的原料,其中以酵母最为理想,这是因为:1、酵母中的核酸主要是rna(2.67~16.0%),dna含量很少(0.03~0.516%);2、酵母菌体较易收集,rna也易于分离;3、能够得到大量纯度高、浊度低的优质rna;4、酵母培养容易,对培养基的要求极低;5、酵母可以连续培养;6、提取核糖核酸后的脱核酵母可以作为优质的蛋白饲料。啤酒酵母中rna的含量一般在6%~8%,热带假丝酵母中rna的含量一般在8%以上。目前以酵母提取rna的方法被广泛采用,工艺简单、成本低,但却收率较低,核酸产品的质量和产量都不能满足市场的需求。
4.在酵母的培养过程中,一般都是由廉价的废糖蜜来提供碳源,但由此产生的废水一个突出的特点就是污染物浓度高:化学耗氧量cod6~12万mg.l-1
,生化耗氧量bod4~6万mg.l-1
;废水中固形物高,其中主要为残糖、蛋白质、纤维素、胶体物质、无机盐等;呈酸性,含有硫酸根、有机酸等,对碳钢设备腐蚀严重;含有较高的焦糖色素、酚类色素、多糖分解产物等,色度高,大多呈棕黑色。这给环境和厂家都造成了很大的负担。
5.目前发酵工厂用得最多的还是传统的机械搅拌发酵罐,但通气发酵罐的气体分散和料夜循环主要由搅拌器来完成,它存在能量消耗大、罐内结构复杂,染菌机会较多、设备造价高等缺点。采用气升发酵罐可以克服上述缺点,气升式发酵罐结构简单,不需搅拌设备,避免了机械搅拌中轴承不严所带来的杂菌污染问题,氧传质效率高,能耗低,安装维修方便。
技术实现要素:
6.发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种操作简单、劳动强度小、能耗低、降低环保成本、适合工业化大生产的高效生产核糖核酸的方法。
7.为了解决上述技术问题,本发明公开了一种利用连续发酵分离一体化技术培养酿酒酵母的方法,在酿酒酵母发酵的对数生长中期开始连续补料发酵,并耦合微滤膜分离技术,使分离出的培养基母液重新得以利用。
8.具体地,所述方法包括以下步骤:
9.(1)将酿酒酵母斜面培养基上以29~32℃条件进行活化,活化后菌种接种到摇瓶
培养基中进行摇瓶培养得到种子液,在气升发酵罐中,将所得种子液接种到发酵培养基中进行间歇发酵;
10.(2)在所述间歇发酵的对数生长期开始加入补料培养基,进行连续发酵,所得发酵液经微滤膜微滤,所得微滤膜透过液加入连续发酵体系中进行连续发酵。
11.所得发酵液经微滤膜微滤,所得微滤膜浓缩液用于分离提取核糖核酸。
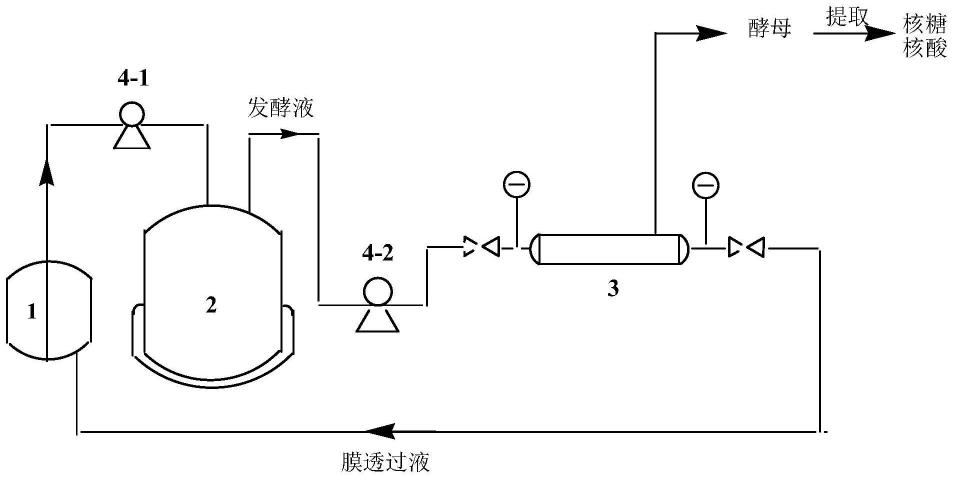
12.在一些实施例中,采用如图1所示的装置培养酿酒酵母,具体为:所述发酵培养基装入气升式发酵罐2中,补料培养基装入补料罐1中;具体包括以下步骤:
13.(1)将酿酒酵母种子液接种到发酵培养基中,先在气升式发酵罐2进行间歇式发酵;
14.(2)在所述间歇发酵的对数生长期开始通过第一泵4-1将补料罐1中补料培养基泵入气升式发酵罐2中进行连续发酵,所得发酵液通过第二泵4-2泵入微滤装置3中,经微滤后,得到微滤膜透过液和微滤膜浓缩液;所得微滤膜透过液流入补料罐1中,用于配补料培养基,泵入气升式发酵罐2中进行连续发酵。
15.步骤(1)中,所述活化为将酵母培养在麦芽汁固体斜面培养基上,29~32℃,培养26~33h。
16.步骤(1)中,所述摇瓶培养为置于摇床以120~320r/min振荡,29~32℃培养5~15h。
17.步骤(1)中,所述发酵培养基的起始装液系数为0.6~0.8;所述酿酒酵母种子液按照5%~20%接种到发酵培养基中进行间歇发酵。
18.步骤(1)中,所述间歇发酵的过程中,控制温度为25~35℃,ph为3.9
±
0.5,气液比为0.5-5:1,罐压为0.06~0.12mpa。
19.步骤(1)中,所述发酵培养基的配方为:还原糖3~6g/l、葡萄糖20~40g/l、(nh4)2so41~4g/l、mgso
4 0.1~1g/l、znso
4 0.01~0.05g/l、feso
4 0.01~0.05g/l、kh2po
4 0.1~0.5g/l、酵母膏1~5g/l、h3po
4 1~4ml/l,溶剂为清糖水溶液。
20.步骤(2)中,所述气升式发酵罐的体积为30l-30m3。
21.步骤(2)中,当发酵液中干菌浓度达到12~16g/l时开始加入补料培养基,进行连续发酵。
22.步骤(2)中,控制补料培养基的加入速率,使得稀释率为0.1-0.8h-1
。
23.步骤(2)中,所述补料培养基的配方为:还原糖2~4g/l、葡萄糖15~30g/l、(nh4)2so41~3g/l、mgso
4 0.1~0.5g/l、znso
4 0.01~0.03g/l、feso
4 0.01~0.03g/l、kh2po40.05~0.3g/l、酵母膏1~3g/l、h3po
4 0.05~0.2ml/l,溶剂为清糖水溶液。
24.其中,所述清糖水溶液的制备方法为:将甘蔗糖蜜用水稀释后释1~2倍,加硫酸调ph至2.0~3.5,加热至95~100℃保温20min,通风0.5~1h驱除有害气体,再用10~15%石灰乳调节ph至5.5~7.0,自然沉降12~16h,所得上清液即为清糖水溶液。
25.步骤(2)中,所述微滤膜为管式陶瓷膜、不锈钢、有机膜等。
26.步骤(2)中,所述微滤膜的孔径为0.02~0.5μm。
27.步骤(2)中,所述微滤的压力为0.08~0.2mpa,温度为30~40℃。
28.本发明所提供的方法大大增加了劳动效率,减少糖蜜的用量,正交发酵母液的循环利用,提高了资源利用率,减轻了环保处理成本的压力。
29.有益效果:与现有技术相比,本发明具有如下优势:
30.本发明采用气升罐进行发酵,操作简单,能耗低,适合于工业化大生产。且本发明发酵过程中的发酵母液经由微滤膜处理重新回到发酵体系继续利用,大大减少了污水的排放量,有效缓解企业的环保成本压力。
31.本发明以糖蜜和葡萄糖为碳源,加入其它无机盐离子,通过微生物连续发酵和膜分离技术相耦合,始终保持菌体发酵处于指数生长期,可连续发酵60天以上;且膜透过液重新回到发酵再利用,两者耦合使用,既能促进菌体增值,也能提高核糖核酸含量。发酵液中的干菌浓度可达21~24g/l,干菌中核糖核酸的含量达20%以上。
附图说明
32.下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
33.图1为气升罐连续发酵分离一体化技术培养酿酒酵母的装置结构示意图,其中,1为补料罐;2为气升式发酵罐;3为微滤装置;4-1为第一泵;4-2为第二泵。
具体实施方式
34.下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
35.下述实施例中种子液的制备与实施例1步骤(2)相同,但时间有些许区别,其对应的干菌浓度不同。
36.下述实施例中,所述清糖水溶液的制备方法为:将甘蔗糖蜜用水稀释后,调ph至3.0,加热至95℃保温20min,通风1h,再调节ph至6.0,自然沉降12h,所得上清液即为清糖水溶液。
37.下述实施例中稀释率=流加速度(v/h)/发酵液体积(v)。
38.如图1所示,下述实施例中,所述发酵培养基装入气升式发酵罐2中,补料培养基装入补料罐1中;当温度降低后,先在气升式发酵罐2进行间歇式发酵;在对数生长期开始通过第一泵4-1将补料罐1中补料培养基泵入气升式发酵罐2中进行连续发酵,所得发酵液通过第二泵4-2泵入微滤装置3中,经微滤后,得到微滤膜透过液和微滤膜浓缩液;所得微滤膜透过液流入补料罐1中,替代水用于配补料培养基,泵入气升式发酵罐2中进行连续发酵,所得微滤膜浓缩液用于分离提取核糖核酸;所述微滤装置3的两侧还设有阀门和压力表,用于调节流量和膜压力。
39.本发明中所述酿酒酵母saccharomyces cerevisiae,菌株名为tkzzy-06,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏时间为2013年4月26日,保藏编号为cgmcc no.7522,保藏地址为北京市朝阳区北辰西路1号院3号,已公开于中国发明专利cn103820337b一种用于发酵生产核糖核酸的酿酒酵母菌及其应用。
40.实施例1:酵母在30l发酵罐的连续发酵培养
41.(1)菌种活化:将4℃保存的酿酒酵母(cgmcc no.7522)接种到麦芽汁固体斜面培养基上,在31℃条件下培养32h。
42.(2)摇瓶培养:将活化后的菌种接种到装有250ml种子培养基的1000ml摇瓶中,置
于摇床中以200r/min振荡,31℃培养12h,得到种子液。
43.(3)30l发酵罐间歇发酵:将20l发酵培养基装入30l发酵罐中,当温度降低到32℃以下时,将摇瓶培养得到的2l种子液(干菌浓度5g/l)接种到发酵罐中进行发酵,控制温度31
±
1℃,ph3.9
±
0.1,气液比4:1,罐压0.1~0.12mpa。
44.(4)30l发酵罐连续发酵:当发酵液中干菌浓度达到12g/l时开始流加补料培养基进行连续发酵;连续发酵开始后,将发酵液泵入微滤膜系统,微滤膜为管式陶瓷膜,膜孔径为0.1μm,操作压力为0.1mpa,温度为30℃,截留的酵母被用以下一步分离提取核糖核酸,滤过液重新回到补料罐中,流加发酵罐中进行发酵;在连续发酵过程中,稀释率从0.35h-1
逐渐提高到0.70h-1
,连续发酵60天后的稀释率为0.60h-1
,干菌浓度达到22g/l,核糖核酸含量为21%。
45.其中,
46.种子培养基组分为:清糖水溶液中的还原糖4g/l、葡萄糖35g/l、(nh4)2so
4 3g/l,kcl 1.5g/l,mgso
4 0.5g/l,nacl 0.1g/l,酵母膏5g/l,ph 6.0。
47.发酵培养基组分为:清糖水溶液中的还原糖4g/l、葡萄糖35g/l、(nh4)2so
4 2g/l、mgso
4 0.6g/l、znso
4 0.02g/l、feso
4 0.04g/l、kh2po
4 0.1g/l、酵母膏2g/l、h3po43ml/l,115℃灭菌30min。
48.补料培养液成分为:清糖水溶液中的还原糖2g/l、葡萄糖18g/l、(nh4)2so
4 1g/l、mgso
4 0.3g/l、znso
4 0.01g/l、feso
4 0.03g/l、kh2po
4 0.1g/l、酵母膏1g/l、h3po40.1ml/l。
49.实施例2:酵母在300l发酵罐的连续发酵培养
50.(1)菌种活化:同实施例1。
51.(2)摇瓶培养:同实施例1。
52.(3)300l发酵罐连续培养:将220l发酵培养基装入300l发酵罐中,当温度降低到32℃以下时,将22l种子液(干菌浓度约为3g/l)移种到300l发酵罐中进行发酵,控制温度31
±
1℃,ph3.9
±
0.1,气液比2.5:1,罐压0.08~0.1mpa。
53.(4)300l发酵罐连续发酵:当干菌浓度达到15g/l时开始流加补料培养基进行连续发酵;连续发酵开始后,将抽出的培养好的菌液泵入微滤膜系统,微滤膜为管式不锈钢膜,膜孔径为0.2μm,操作压力为0.12mpa,温度为36℃,截留的酵母被用以下一步分离提取核糖核酸,滤过液重新回到配料罐中,流加发酵罐中进行发酵;在连续发酵过程中,稀释率从0.32h-1
逐渐提高到0.72h-1
,连续发酵60天后的稀释率为0.5h-1
,干菌浓度达到20.3g/l,核糖核酸含量为20.1%。
54.其中,
55.发酵培养基组分为:清糖水溶液中的还原糖5g/l、葡萄糖40g/l、(nh4)2so
4 4g/l、mgso
4 0.5g/l、znso
4 0.05g/l、feso
4 0.02g/l、kh2po
4 0.3g/l、酵母膏2g/l、h3po43ml/l,115℃灭菌30min。
56.补料培养液成分如下:清糖水溶液中的还原糖2g/l、葡萄糖18g/l、(nh4)2so
4 3g/l、mgso
4 0.4g/l、znso
4 0.01g/l、feso
4 0.01g/l、kh2po
4 0.09g/l、酵母膏3g/l、h3po40.2ml/l。
57.实施例3:酵母在3m3发酵罐的连续发酵培养
58.(1)菌种活化:同实施例1。
59.(2)摇瓶培养:同实施例1。
60.(3)3m3发酵罐连续培养:将2m3发酵培养基装入3m3发酵罐中,当温度降低到32℃以下时,将300l种子液(干菌浓度约为5g/l)移种到3m3发酵罐中进行发酵,控制温度31
±
1℃,ph3.9
±
0.1,气液比3:1,罐压0.1~0.12mpa。
61.(4)3m3发酵罐连续发酵:当干菌浓度达到14.5g/l时开始流加补料培养基,进行连续发酵;连续发酵开始后,将抽出的培养好的菌液泵入微滤膜系统,微滤膜为管式有机膜,膜孔径为0.4μm,操作压力为0.16mpa,温度为40℃,截留的酵母被用以下一步分离提取核糖核酸,滤过液重新回到配料罐中,流加发酵罐中进行发酵;在连续发酵过程中,稀释率从0.35h-1
逐渐提高到0.65h-1
,连续发酵60天后的稀释率为0.58h-1
,干菌浓度达到21g/l,核糖核酸含量为18.6%。
62.其中,
63.发酵培养基组分为:清糖水溶液中的还原糖4g/l、葡萄糖33g/l、(nh4)2so
4 2g/l、mgso
4 0.8g/l、znso
4 0.04g/l、feso
4 0.03g/l、kh2po
4 0.3g/l、酵母膏2g/l、h3po41ml/l,115℃灭菌30min。
64.补料培养液成分如下:清糖水溶液中的还原糖2g/l、葡萄糖16g/l、(nh4)2so
4 3g/l、mgso
4 0.5g/l、znso
4 0.02g/l、feso
4 0.01g/l、kh2po
4 0.07g/l、酵母膏3g/l、h3po40.05ml/l。
65.实施例4:酵母在30m3发酵罐的连续发酵培养
66.(1)菌种活化:同实施例1。
67.(2)摇瓶培养:同实施例1。
68.(3)30m3发酵罐连续培养:将18m3发酵培养基装入30m3发酵罐中,当温度降低到32℃以下时,将3m3种子液(干菌浓度约为6g/l)移种到30m3发酵罐中进行发酵,控制温度31
±
1℃,ph3.9
±
0.1,气液比4.5:1,罐压0.1~0.12mpa。
69.(4)30m3发酵罐连续发酵:当干菌浓度达到16g/l时开始流加补料培养基进行连续发酵;连续发酵开始后,将抽出的培养好的菌液泵入微滤膜系统,微滤膜为管式陶瓷膜,膜孔径为0.2μm,操作压力为0.18mpa,温度为37℃,截留的酵母被用以下一步分离提取核糖核酸,滤过液重新回到配料罐中,流加发酵罐中进行发酵;在连续发酵过程中,稀释率从0.36h-1
逐渐提高到0.75h-1
,连续发酵60天后的稀释率为0.66h-1
,干菌浓度达到24g/l,核糖核酸含量为22.2%。
70.其中,
71.发酵培养基组分为:所述的种子和发酵培养基的配方如下:清糖水溶液中的还原糖5g/l、葡萄糖40g/l、(nh4)2so
4 1g/l、mgso
4 0.9g/l、znso
4 0.04g/l、feso
4 0.01g/l、kh2po
4 0.2g/l、酵母膏3g/l、h3po
4 3ml/l,115℃灭菌30min。
72.补充培养液成分如下:清糖水溶液中的还原糖2g/l、葡萄糖15g/l、(nh4)2so
4 3g/l、mgso
4 0.5g/l、znso
4 0.02g/l、feso
4 0.02g/l、kh2po
4 0.18g/l、酵母膏2g/l、h3po40.15ml/l。
73.本发明提供了一种利用连续发酵分离一体化技术培养酿酒酵母的方法的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若
干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1