基于黄连全基因组开发的SSR分子标记引物组及其应用
基于黄连全基因组开发的ssr分子标记引物组及其应用
技术领域
1.本发明属于分子检测技术领域,具体涉及一种基于黄连全基因组开发的ssr分子标记引物组及其应用,用于黄连群体遗传多样性分析及种质资源鉴定。
技术背景
2.黄连是毛茛科黄连属(coptis salisb.)多年生草本植物,来源于毛茛科植物黄连(coptis chinensis franch.)、云南黄连(coptis teeta wall.)、三角叶黄连(coptis dletoidea c.y.cheng et hsiao)的干燥根茎。短萼黄连(coptis chinensis var.brevisepala w.t.wang et hsiao)为黄连的一个变种。黄连主要产地除湖北、四川、重庆、安徽、云南外,还有湖南澧县、江西鄱阳、福建建瓯、广西柳州、浙江余杭等地。
3.针对黄连进行的研究主要集中在化学成分、药理作用、质量标准、临床及日常应用方面,在分子生物学方面针对黄连群体遗传多样性的研究较少。近年来,由于人为的大量野生黄连资源采挖,生态环境恶化,导致野生雅连、云连濒临灭绝,野生黄连极度匮乏,因此开发一套分子标记来保护黄连种质遗传多样性迫在眉睫。
4.简单重复序列(simple sequence repeat,ssr)是由1~6个核苷酸组成的简单重复序列,广泛分布于真核生物的整个基因组。尽管ssr分布于整个基因组的不同位置,但其两端序列多是保守的单拷贝序列,根据这两端的序列设计一对特异引物,通过pcr技术将核心微卫星dna序列扩增出来,利用电泳分析技术就可以得到其长度的多态性。ssr标记由于共显性好、能很好的区分纯合基因和杂合基因、多态性高、重复性好、稳定性好等优点,已经被广泛应用于分子辅助育种、遗传多样性分析、种质资源鉴定等研究中。
5.为了开展分子生物学ssr标记辅助鉴定黄连植物种质资源,促进黄连良种选育,加快种质资源的开发利用,保护黄连种质资源多样性,亟需开发了黄连的ssr引物,为黄连种质资源评估、培育优良品种、构建核心种质库等研究提供科学依据。
技术实现要素:
6.本发明在黄连全长基因组的基础上,基于获得的大量ssr信息,通过pcr检测对选取的部分ssr进行验证和多态性分析,从而获得具有通用型的多态性引物。本发明旨在提供一种新的用于黄连遗传多样性分析的ssr引物组及其应用,同时为黄连核心种质库筛选、亲缘关系研究、优良品种选育奠定基础。
7.本发明首先提供了一种基于黄连ssr标记的核心引物组,其包括以下22组引物对:cc3、cc6、cc18、cc27、cc29、cc38、cc43、cc49、cc53、cc57、cc90、cc98、cc103、cc106、cc113、cc117、cc129、cc134、ccssr144、cc162、cc169、cc179,22对引物序列如下所示:
8.(1)扩增ssr分子标记的cc3引物:
9.seq id no:1:cc3-f:5'-tattgtgggtgaagttatgg-3'
10.seq id no:2:cc3-r:5'-gtgttattttgtcgtttagtga-3'
11.(2)扩增ssr分子标记的cc6引物:
12.seq id no:3:cc6-f:5'-gataaaggggaccaagac-3'
13.seq id no:4:cc6-r:5'-gtagcgaatgggcaata-3'
14.(3)扩增ssr分子标记的cc18引物:
15.seq id no:5:cc18-f:5'-ccgttcacccactacaa-3'
16.seq id no:6:cc18-r:5'-aaagcaaacacctccaa-3'
17.(4)扩增ssr分子标记的cc27引物:
18.seq id no:7:cc27-f:5'-ctaaacaagatttcgttactcc-3'
19.seq id no:8:cc27-r:5'-aaggctattctcaaagcacta-3'
20.(5)扩增ssr分子标记的cc29引物:
21.seq id no:9:cc29-f:5'-ggagactcactgccaaca-3'
22.seq id no:10:cc29-r:5'-cgagaaatgaccaaggaa-3'
23.(6)扩增ssr分子标记的cc38引物:
24.seq id no:11:cc38-f:5'-gtaaccaaaccccttct-3'
25.seq id no:12:cc38-r:5'-ctcgtccactaaaatcca-3'
26.(7)扩增ssr分子标记的cc43引物:
27.seq id no:13:cc43-f:5'-attacgagaaaggtggag-3'
28.seq id no:14:cc43-r:5'-gatgtgatgggaggaga-3'
29.(8)扩增ssr分子标记的cc49引物:
30.seq id no:15:cc49-f:5'-tgaaatgttcggctctt-3'
31.seq id no:16:cc49-r:5'-gccaacggtggtctaat-3'
32.(9)扩增ssr分子标记的cc53引物:
33.seq id no:17:cc53-f:5'-tcgtttccgtcaagtgc-3'
34.seq id no:18:cc53-r:5'-tcaagatgccaacctcc-3'
35.(10)扩增ssr分子标记的cc57引物:
36.seq id no:19:cc57-f:5'-cggaagaataggcaatg-3'
37.seq id no:20:cc57-r:5'-tgtcactcgccagaaat-3'
38.(11)扩增ssr分子标记的cc90引物:
39.seq id no:21:ssr11-f:5'-attggagataccgtgaa-3'
40.seq id no:22:ssr11-r:5'-gaaataggaggaatagtgat-3'
41.(12)扩增ssr分子标记的cc98引物:
42.seq id no:23:cc98-f:5'-cggaaccctaacaagat-3'
43.seq id no:24:cc98-r:5'-cgatgccaaatgtatga-3'
44.(13)扩增ssr分子标记的cc103引物:
45.seq id no:25:cc103-f:5'-tgcgtcacagtttcagt-3'
46.seq id no:26:cc103-r:5'-cgtaagatagcagcatagag-3'
47.(14)扩增ssr分子标记的cc106引物:
48.seq id no:27:cc106-f:5'-ggggattgaggatggaa-3'
49.seq id no:28:cc106-r:5'-cccttgtgggaacttta-3'
50.(15)扩增ssr分子标记的cc113引物:
51.seq id no:29:cc113-f:5'-tttctgttttctccgctat-3'
52.seq id no:30:cc113-r:5'-aaatgtccttgggttca-3'
53.(16)扩增ssr分子标记的cc117引物:
54.seq id no:31:cc117-f:5'-aaatgtaggagcagagc-3'
55.seq id no:32:cc117-r:5'-gaaagggagttagaagaa-3'
56.(17)扩增ssr分子标记的cc129引物:
57.seq id no:33:cc129-f:5'-gccacattatttattacc-3'
58.seq id no:34:cc129-r:5'-tagtttacgaggctttc-3'
59.(18)扩增ssr分子标记的cc134引物:
60.seq id no:35:cc134-f:5'-gagggtgaagccgttat-3'
61.seq id no:36:cc134-r:5'-tctgccaagggtgtatc-3'
62.(19)扩增ssr分子标记的cc144引物:
63.seq id no:37:cc144-f:5'-tcgcattccagtaacca-3'
64.seq id no:38:cc144-r:5'-atccctgaaaccataagt-3'
65.(20)扩增ssr分子标记的cc162引物:
66.seq id no:39:cc162-f:5'-ccctgtggtgagatttg-3'
67.seq id no:40:cc162-r:5'-tttacgctcttgtccct-3'
68.(21)扩增ssr分子标记的cc169引物:
69.seq id no:41:cc169-f:5'-tcttccctcctccacaa-3'
70.seq id no:42:cc169-r:5'-tccagcgagcctcttat-3'
71.(22)扩增ssr分子标记的cc179引物:
72.seq id no:43:cc179-f:5'-agtgatgtatcggttgtc-3'
73.seq id no:44:cc179-r:5'-aaataagtaagcgtcctc-3'。
74.又一方面,本发明提供了上述的引物组在黄连群体遗传多样性分析及种质资源鉴定中的应用。
75.一种黄连群体遗传多样性分析及种质资源鉴定的方法,包括以下步骤:
76.(1)提取待测黄连样品dna;
77.(2)在所述引物组的每对引物的正向引物加上通用m13接头序列,得到m13接头正向引物;
78.(3)以步骤(1)提取的dna为模板,以所述引物组的每对引物的反向引物、m13接头正向引物进行pcr扩增,得到荧光pcr扩增产物;
79.(4)将得到的荧光pcr扩增产物进行毛细管荧光电泳检测,使用genemarkerv2.2.0软件读取毛细管电泳数据,统计条带检测结果;
80.(5)利用统计条带检测结果进行黄连群体遗传多样性分析和种质遗传鉴定。
81.其中,步骤(5)的群体遗传多样性分析和种质遗传鉴定的具体方法如下:
82.a.根据所述步骤(4)中条带检测结果,记录每对引物对应的每个黄连样本的扩增片段大小;
83.b.根据综合整理得到的扩增片段大小,利用genalex6.5软件计算各引物对的以下遗传多样性参数,如等位基因数量(na)、有效等位基因数量(ne)、观察杂合度(ho)、预期杂合
度(he)、香农信息指数(i)和不同引物等位基因频率等,在用genalex6.5软件计算不同引物等位基因后,用pic_cale软件计算多态信息含量(pic);
84.c.根据所述步骤a中综合整理得到的扩增片段大小,按照扩增片段从大到小编号和读取,有扩增条带出现记为“1”,无条带出现记为“0”,建立原始矩阵,导入r语言的ape程辑包绘制n-j树。
85.其中,步骤(3)中的pcr扩增体系如下:2μl基因组dna、5μl的2
×
taq pcr master mix、0.05μl浓度为10pmol/μl的m13接头正向引物、0.24μl浓度为10pmol/μl的反向引物、0.15μl m13荧光修饰基团、2.56μlddh2o。
86.其中,所述pcr扩增的反应程序为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,共35个循环;最后72℃末端延伸10min。
87.所述黄连样品为黄连幼嫩叶片。
88.与现有技术相比,本发明的技术方案具备如下有益效果:
89.现有技术没有针对黄连多种遗传资源开发的ssr引物组,本发明应用基因组技术及ssr分子标记技术,利用黄连基因组设计ssr引物,遗传多样性分析的采样种质基源种类多,包括黄连、云南黄连、短萼黄连;采样范围广,包含安徽、云南、湖北、重庆、四川等多个省份;采样种质包括野生种质和栽培种质,经验证,本发明设计的引物组准确度高、特异性、稳定性强,为进行黄连种质资源遗传多样性保护、亲缘关系研究、核心种质库筛选奠定了基础。
附图说明
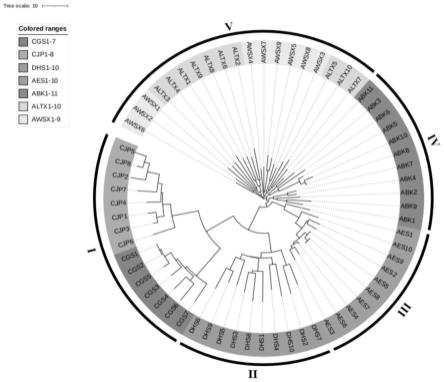
90.图1为黄连遗传多样性的n-j树聚类图。
91.图2为以引物cc57扩增部分黄连材料得到的毛细管荧光电泳检测峰图,图2中sample1表示样本aes1的扩增图谱,sample2表示样本aes2的扩增图谱,sample3表示样本awsx1的扩增图谱,sample4表示样本altx1的扩增图谱,sample5表示样本dhs5的扩增图谱。
具体实施方式
92.下面结合实施例对本发明的ssr引物组及其具体应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
93.实施例1
94.利用已有黄连全基因组序列,使用misa软件(http://pgrc.ipk-gatersleben.de/misa/)进行ssr位点扫描筛选,获得大量ssr位点;利用primer 5.0软件对所述位点进行引物设计。
95.在本发明中,所述筛选的标准为:单核苷酸至少重复10次,二核苷酸至少重复6次,三、四、五和六核苷酸至少重复5次才被识别为ssr位点。本发明利用primer5.0软件对这些位点进行引物设计,参数设定为:引物长度18-27bp;退火温度为55-65℃;pcr产物长度范围在100bp至300bp之间;gc含量在40%至60%之间,最后成功设计出180对ssr引物。利用8个样本研究引物的扩增效率及多态性,筛选的标准为:扩增效率高于80%,且等位基因≥3个。最终从180对引物中筛选出22对能稳定扩增出清晰且多态性条带的引物,引物序列如表1所示,委托生工生物工程(上海)股份有限公司合成。
96.表1黄连22对ssr引物信息
[0097][0098][0099]
实施例2
[0100]
基于实施例1合成的ssr引物组可应用于黄连群体遗传多样性分析及种质资源鉴定,其分析方法包括如下步骤:
[0101]
a、提取待测黄连样品基因组dna;
[0102]
以65份黄连样本验证开发的ssr标记有效性。黄连样本信息见表2。样品为黄连幼叶,每份样本只选取1个单株采集样品。
[0103]
表2黄连样本信息
[0104]
黄连种质省份野生或栽培样品标号样品份数短萼黄连安徽野生dhs1-1010云南黄连云南野生cgs1-77云南黄连云南野生cjp1-88黄连湖北野生aes1-1010黄连湖北栽培abk1-1111黄连重庆栽培altx1-1010黄连四川栽培awsx1-99
[0105]
选取上述65份材料的健康嫩叶,采用改良的ctab法提取其dna,并用nanodrop核酸测定仪和1%的琼脂糖凝胶电泳检测供试材料dna浓度与纯度,将合格dna样品置于-20℃条件下保存备用。
[0106]
b、将序列表1所示每个引物的正向引物加上通用m13接头序列“tgtaaaacgacggccagt”,得到m13接头正向引物;
[0107]
c、以步骤a提取的待测样品基因组dna为模板,以反向引物、m13接头正向引物进行pcr扩增,得到荧光pcr扩增产物:所述pcr扩增体系如下:2μl基因组dna、5μl的2
×
taq pcr master mix、0.05μl浓度为10pmol/μl的正向引物、0.24μl浓度为10pmol/μl的反向引物、0.15μl m13荧光修饰基团(rox或hex或fam或tamra)、2.56μlddh2o。pcr扩增的反应程序为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,共35个循环;最后72℃末端延伸10min。
[0108]
d、将步骤c得到的荧光pcr扩增产物使用dna测序仪abi3730xl进行毛细管荧光电泳检测,利用genemarker v2.2.0读取样本片段大小及等位基因数目,统计条带检测结果。
[0109]
e、综合整理得到的扩增片段大小,利用genalex6.5软件计算各引物对的以下遗传多样性参数,如等位基因数量(na)、有效等位基因数量(ne)、观察杂合度(ho)、预期杂合度(he)、香农信息指数(i)和不同引物等位基因频率等,在用genalex6.5软件计算不同引物等位基因后,用pic_cale软件计算多态信息含量(pic);根据综合整理得到的扩增片段大小,按照扩增片段从大到小编号和读取,有扩增条带出现记为“1”,无条带出现记为“0”,建立原始矩阵,导入r语言的ape程辑包绘制n-j树,对65份黄连样本个体进行聚类分析。
[0110]
图2是以引物cc57对部分黄连材料进行扩增得到的毛细管荧光电泳检测结果。
[0111]
22对ssr引物对65份黄连材料的扩增结果见表3。
[0112]
表3 22对ssr多态性引物对黄连材料扩增信息统计
[0113][0114][0115]
从表3可知,22对引物共扩增出259条多态性谱带,每对引物平均等位基因数为11.77个,有效等位基因数的范围为1.346-3.373。shannon信息多样性指数、期望杂合度和多态信息含量指数均是反映引物多态性的指标,其值越大说明多态性越高,三个指标的平均值分别为0.854、0.470和0.764,表明黄连材料间遗传多样性十分丰富,以及本发明开发的ssr引物组能应用于黄连遗传多样性分析及种质系谱分析。从各个引物来看,引物cc3、cc38、cc53、cc98具有较高的shannon信息多样性指数、期望杂合度和多态信息含量指数,说
明其扩增效果较好、遗传多样性值较高、有较高的鉴定效率。
[0116]
为进一步验证该引物组在黄连遗传多样性中的应用,对所有居群样本扩增片段大小建立原始矩阵,导入r语言的ape程辑包绘制n-j树,对65份黄连样本个体进行聚类分析,结果见图1。n-j树结果显示,不同遗传距离可将所有黄连样本分为五大类:i、ii、iii、iv、v。第一大类(i)包括15份样本,又分为两支,分别涵盖所有来自云南的野生云南黄连;第二大类(ii)包括10份样本,涵盖所有来自安徽的野生短萼黄连;第三大类(iii)包括10份样本,涵盖所有来自湖北的野生黄连;第四大类(iv)包括11份样本,又分为两支,涵盖所有来自湖北的栽培黄连;第五大类(v)包括19份样本,又分为三支,涵盖所有来自重庆和四川的栽培黄连。
[0117]
从图1的聚类分析结果来看,所有的野生云南黄连样本(cgs1-7、cjp1-8)及野生短萼黄连样本(dhs1-10),与野生黄连样本(aes1-10)及栽培黄连样本相比遗传距离有较显著的差异;野生黄连样本(aes1-10)与所有栽培黄连样本相比遗传距离大;所有栽培黄连样本间遗传距离较小,所有栽培黄连样本中,除来自湖北的栽培黄连(abk1-11)聚为一支,来自重庆(altx1-10)和四川(awsx1-9)的栽培黄连较为混杂,遗传差异较小,这说明由于近年来频繁的引种驯化,栽培黄连种质较为混杂,无明显地理距离上的遗传分化。
[0118]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1