一种美迪紫檀素的生物合成方法
his的表达强度,在dw-04的基础上又增加了i
′2h5、2-his的拷贝数和p450酶的氧化还原伙伴cpr,成功构建了菌株dw-06。接下来,以dw-06为底盘,转入含有hi4
′
omt的外源模块7,以验证以甘草素为底物,经过2-his、hi4
′
omt、hid关键酶催化表达后合成芒柄花黄素,继而合成美迪紫檀素。
7.一种美迪紫檀素的生物合成方法,其特征在于,包括以下步骤:
8.(1)构建酵母菌株dw-01(见表1),异甘草素在该酵母菌株中异源表达的查尔酮异构酶作用下可获得化合物1—甘草素,结构式如下:
[0009][0010]
(2)构建酵母菌株dw-04(见表1),甘草素在该酵母菌株中异源表达的2-羟基异黄酮合成酶和2-羟基异黄酮脱水酶作用下可获得化合物2—黄豆苷元,结构式如下:
[0011][0012]
(3)构建酵母菌株dw-07(见表1),黄豆苷元在该酵母菌株中异源表达的异黄酮-4
′‑
o-甲基转移酶作用下获得化合物3—芒柄花黄素,结构式如下:
[0013][0014]
(4)构建酵母菌株dw-02、dw-03和dw-06(见表1),芒柄花黄素在中这些酵母菌株中异源表达的异黄酮-2
′‑
羟化酶、异黄酮还原酶、雌激素还原酶和pterocarpansynthase作用下获得化合物美迪紫檀素,其结构式如下:
[0015][0016]
本发明提供的美迪紫檀素合成相关酿酒酵母菌株构建方法如下表1所示:
[0017]
表1美迪紫檀素合成相关酿酒酵母菌株构建
[0018][0019][0020]
注:表中所述基因依次为:chs(chalcone synthase)查尔酮合成酶;chi(chalcone isomerase)查尔酮异构酶;chr(chalcone reductase)查尔酮还原酶;i2'h5(isoflavone 2'-hydroxylase)异黄酮-2
′‑
羟化酶;ifr4(isoflavone reductase)异黄酮还原酶;gepts(glycyrrhiza echinata pterocarpan synthase)紫檀碱合成酶;vr(vestitone reductase)雌激素还原酶;2-his(2-hydroxyisoflavanone)2-羟基异黄酮合成酶;hid(2-hydroxyisoflavanone dehydratase)2-羟基异黄酮脱水酶;c4h(cinnamate 4-hydroxylase)肉桂酸羟化酶;4cl(4-coumarate coa ligase)4-香豆酰辅酶a连接酶;gmcpr(soybean cytochrome p450 reductase)细胞色素p450环化酶;hi4
′
omt(isoflavone 4
′‑
o-methyltransferase)异黄酮-4
′‑
o-甲基转移酶。
[0021]
作为优选方案,以上所述的一种美迪紫檀素的生物合成方法,包括以下步骤:
[0022]
(1)异甘草素在查尔酮异构酶的催化下异构成甘草素
[0023][0024]
300μl酶反应体系为:缓冲液hepes(1m/l)15μl,底物异甘草素(10mg/ml)7.7μl,chi(49.81mg/ml)30μl,超纯水补至300μl。混匀后于水浴锅中反应过夜,用乙酸乙酯萃取,合并萃取液后离心浓缩至干,后加甲醇复溶,经0.22μm微孔滤膜滤过,得甘草素;
[0025]
(2)甘草素在2-羟基异黄酮合成酶(2-his)、2-羟基异黄酮脱水酶(hid)的催化下生成黄豆苷元
[0026][0027]
1ml酶反应体系为:酶反应液(0.2m k2hpo4,1.25mm gsh,50%蔗糖,1mm nadph)400μl,底物甘草素(10mg/ml)2.5μl,nadh(70mm/l)15μl,mgcl2(1m/l)5μl,2-his粗酶液430μl和hid粗酶液50μl,超纯水补至300μl。混匀后于水浴锅中反应过夜,用乙酸乙酯萃取,合并萃取液后离心浓缩至干,后加甲醇复溶,经0.22μm微孔滤膜滤过,得黄豆苷元;
[0028]
(3)黄豆苷元在异黄酮-4
′‑
o-甲基转移酶(hi4
′
omt)的催化下生成芒柄花黄素
[0029][0030]
300μl酶反应体系为:tris-hcl(ph 7.5,1m/l)60μl,β-巯基乙醇(55mm/l)76μl,edta(0.5m/l)3μl,nadph(10mm/l)30μl,底物黄豆苷元(10mg/ml)1.2μl,s-腺苷甲硫氨酸(sam)(10mm/l)14μl,hi4
′
omt 30μl,超纯水补至300μl。混匀后于水浴锅中反应过夜,用乙酸乙酯萃取,合并萃取液后离心浓缩至干,后加甲醇复溶,经0.22μm微孔滤膜滤过,得芒柄花黄素;
[0031]
(4)芒柄花黄素在异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)催化下生成美迪紫檀素
[0032][0033]
1ml酶反应体系为:k3po4(1m/l)100μl,蔗糖(2m/l)192.5μl,gsh(1m/l)0.5μl,nadph(10mm/l)200μl,nadh(10mm/l)200μl,mgcl2(1m/l)5μl,底物芒柄花黄素(10mg/ml)1.2μl,粗酶液250μl,超纯水补至300μl。混匀后于水浴锅中反应过夜。芒柄花黄素能在异黄酮-2
′‑
羟化酶(i2′
h5)和异黄酮还原酶(ifr4)生成中间产物vestitone,继而中间产物vestitone在雌激素还原酶(vr)及pterocarpan synthase(pts)的催化下生成美迪紫檀素,
用乙酸乙酯萃取三次,合并萃取液后离心浓缩至干,后加甲醇复溶,经0.22μm微孔滤膜滤过,得到美迪紫檀素。
[0034]
作为优选方案,以上所述的一种美迪紫檀素的生物合成方法,包括以下步骤:
[0035]
(1)异甘草素在查尔酮异构酶的催化下异构成甘草素
[0036][0037]
300μl酶反应体系为:缓冲液hepes(1m/l)15μl,底物异甘草素(10mg/ml)7.7μl,chi(49.81mg/ml)30μl,超纯水补至300μl。混匀后于水浴锅中反应过夜,用3倍量乙酸乙酯萃取3次,合并萃取液后离心浓缩至干,后加200μl甲醇复溶,经0.22μm微孔滤膜滤过,得甘草素;
[0038]
(2)甘草素在2-羟基异黄酮合成酶(2-his)、2-羟基异黄酮脱水酶(hid)的催化下生成黄豆苷元
[0039][0040]
1ml酶反应体系为:酶反应液(0.2m k2hpo4,1.25mm gsh,50%蔗糖,1mm nadph)400μl,底物甘草素(10mg/ml)2.5μl,nadh(70mm/l)15μl,mgcl2(1m/l)5μl,2-his粗酶液430μl和hid粗酶液50μl,超纯水补至300μl。混匀后于30℃水浴锅中反应过夜,用300μl乙酸乙酯萃取三次,合并萃取液后离心浓缩至干,后加200μl甲醇复溶,经0.22μm微孔滤膜滤过,得黄豆苷元;
[0041]
(3)黄豆苷元在异黄酮-4
′‑
o-甲基转移酶(hi4
′
omt)的催化下生成芒柄花黄素
[0042][0043]
300μl酶反应体系为:tris-hcl(ph 7.5,1m/l)60μl,β-巯基乙醇(55mm/l)76μl,edta(0.5m/l)3μl,nadph(10mm/l)30μl,底物黄豆苷元(10mg/ml)1.2μl,s-腺苷甲硫氨酸(sam)(10mm/l)14μl,hi4
′
omt30μl,超纯水补至300μl。混匀后于30℃水浴锅中反应过夜,用300μl乙酸乙酯萃取三次,合并萃取液后离心浓缩至干,后加200μl甲醇复溶,经0.22μm微孔滤膜滤过,得芒柄花黄素;
[0044]
(4)芒柄花黄素在异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)催化下生成美迪紫檀素
[0045]
[0046]
1ml酶反应体系为:k3po4(1m/l)100μl,蔗糖(2m/l)192.5μl,gsh(1m/l)0.5μl,nadph(10mm/l)200μl,nadh(10mm/l)200μl,mgcl2(1m/l)5μl,底物芒柄花黄素(10mg/ml)1.2μl,粗酶液250μl,超纯水补至300μl。混匀后于30℃水浴锅中反应过夜。芒柄花黄素能在异黄酮-2
′‑
羟化酶(i2′
h5)和异黄酮还原酶(ifr4)生成中间产物vestitone,继而中间产物vestitone在雌激素还原酶(vr)及pterocarpan synthase(pts)的催化下生成美迪紫檀素,用300μl乙酸乙酯萃取三次,合并萃取液后离心浓缩至干,后加200μl甲醇复溶,经0.22μm微孔滤膜滤过,得到美迪紫檀素。
[0047]
有益效果:
[0048]
本发明通过大量实验筛选出12个关键酶基因——肉桂酸-4-羟化酶(c4h)、香豆酰辅酶a连接酶(4cl)、查尔酮合成酶(chs)、查尔酮还原酶(chr)、查尔酮异构酶(chi)、2-羟基异黄酮合成酶(2-his)、2-羟基异黄酮脱水酶(hid)、异黄酮-4
′‑
o-甲基转移酶(hi4
′
omt)、异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)、紫檀碱合成酶(pts)作为美迪紫檀素的表达元件,构建酿酒酵母细胞工厂异源合成美迪紫檀素。本发明合成方法经济高效、绿色环保,合成得到的美迪紫檀素纯度高。
附图说明
[0049]
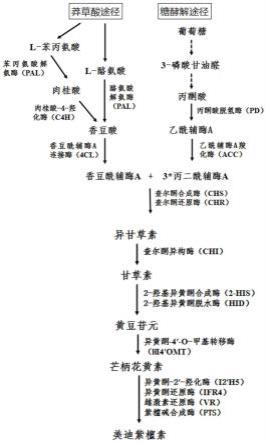
图1美迪紫檀素生物合成途径;
[0050]
图2为实施例1异甘草素转化为甘草素的hplc图。
[0051]
图3为实施例2甘草素转化为黄豆苷元的hplc图。
[0052]
图4为实施例2甘草素转化为黄豆苷元的质谱图。
[0053]
图5为实施例3黄豆苷元转化为芒柄花黄素的hplc图。
[0054]
图6为实施例3黄豆苷元转化为芒柄花黄素的质谱图。
[0055]
图7为实施例4芒柄花黄素转化为中间产物vestitone再转化为美迪紫檀素的hplc图。
[0056]
图8为实施例4中间产物vestitone的质谱图。
[0057]
图9为实施例4芒柄花黄素的质谱图。
具体实施方式
[0058]
本发明通过基因模块构建,并将其导入酵母细胞中进行异源表达,发现菌株dw-01可生成甘草素,菌株dw-o5可生成黄豆苷元,菌株dw-07可生成芒柄花黄素,菌株dw-03可生成美迪紫檀素。下面结合具体实施对本发明作进一步阐述,但这些实施不应解释为限制本发明。
[0059]
实施例1菌株dw-01中查尔酮异构酶(chi)的酶活性鉴定
[0060]
分析查尔酮异构酶(chi)对底物异甘草素的作用
[0061]
查尔酮异构酶(chi)催化底物异甘草素的酶反应如下:
[0062]
ms确定其分子量,结果见图6。
[0077]
实施例4菌株dw-02、dw-03、dw-06中异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)的酶活性鉴定
[0078]
分析异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)对底物芒柄花黄素的作用。
[0079]
异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)催化底物芒柄花黄素的酶反应如下:
[0080][0081]
芒柄花黄素能在异黄酮-2
′‑
羟化酶(i2′
h5)和异黄酮还原酶(ifr4)生成中间产物vestitone,继而在雌激素还原酶(vr)及pterocarpan synthase(pts)的催化下生成美迪紫檀素,可以通过超高效液相色谱法检测产物美迪紫檀素来鉴定异黄酮-2
′‑
羟化酶(i2′
h5)、异黄酮还原酶(ifr4)、雌激素还原酶(vr)及pterocarpan synthase(pts)的酶活性。
[0082]
测试方法如下:1ml酶反应体系为:k3po4(1m/l)100μl,蔗糖(2m/l)192.5μl,gsh(1m/l)0.5μl,nadph(10mm/l)200μl,nadh(10mm/l)200μl,mgcl2(1m/l)5μl,底物芒柄花黄素(10mg/ml)1.2μl,粗酶液250μl,超纯水补至300μl。混匀后于30℃水浴锅中反应过夜。芒柄花黄素能在异黄酮-2
′‑
羟化酶(i2′
h5)和异黄酮还原酶(ifr4)生成中间产物vestitone,质谱图如图8,继而中间产物vestitone在雌激素还原酶(vr)及pterocarpan synthase(pts)的催化下生成美迪紫檀素,用300μl乙酸乙酯萃取三次,合并萃取液后离心浓缩至干,后加200μl甲醇复溶,经0.22μm微孔滤膜滤过,得到美迪紫檀素。取续滤液进uplc如图7,并将产物通过lc-ms确定其分子量,结果见图9。
[0083]
实施例5酿酒酵母菌株产美迪紫檀素在产业中的应用
[0084]
1.食品、药品、保健品领域应用
[0085]
(1)食品领域应用
[0086]
利用酿酒酵母细胞工厂发酵得到的产物美迪紫檀素,由于其具有抗氧化性、稳定性和生物活性,可以应用于食品生产。
[0087]
(2)药品、保健品领域应用
[0088]
美迪紫檀素具有抗癌活性、抗氧化性,可用于药品及保健品生产。
[0089]
2.抗氧化剂应用
[0090]
美迪紫檀素由于其具有抗氧化性、稳定性,可作为抗氧化剂应用于食品、保健品、化妆品、日用品、化工等行业。
[0091]
3.生物制剂
[0092]
由酿酒酵母异源生物合成的美迪紫檀素,可作为生物制剂应用于生物化学成分标品、食品添加剂、保健品胶囊、粉剂、片剂或液体产品原料等。
[0093]
以上所述仅是本发明的优选实施方式,不应被视为是对本发明范围的限制。对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,可根据本发明的技术方案及其较佳实施例的描述,做出各种可能的等同改变或润饰,这些改变和润饰也应视为本
发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1