固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法与流程
本发明属于污水处理技术领域,具体涉及一种固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法。
背景技术:
水体富营养化是指氮、磷等植物营养物质含量过多而引起的水质污染现象。会导致水生生物多样性破坏,进而造成水生生态系统丧失自我维持、自我调节能力与系统平衡稳定性,并最终导致水生生态系统的破坏和环境问题的加剧。
研究显示,目前我国的水体污染中,氮已逐渐上升为主要污染物,主要是由于大量的含氮废水未经处理或处理不完全就排入水体造成的。而氮作为表征地表水水质状况的主要污染物指标之一,是影响水生态系统健康和稳定的重要因素。因此,富营养化水体中氮素的去除是当前废水处理领域中急需解决的难题之一,脱氮技术的研究和应用引起了人们的广泛关注。而人工湿地因其具有处理效率高、投资低、运行维持费用低等优点,被广泛用于处理各种污水,特别是暴雨径流、农业面源废水等,在污染控制方面发挥了重要作用。
人工湿地中氮的去除途径主要包括植物吸收、氨氮挥发、基质吸附和微生物硝化-反硝化等。研究表明,微生物硝化-反硝化是人工湿地脱氮的主要途径。主要原因是湿地系统大部分区域溶解氧不足,植物通过输氧,根系周围微环境依次呈现出好氧-缺氧-厌氧状态,有利于硝化-反硝化作用的进行。湿地系统内硝态氮必须通过反硝化作用才能彻底的从系统中去除。而对于低碳氮比的富营养化水体,人工湿地内反硝化作用因为缺乏可利用有机碳、硝酸盐或存在过量的氧气而受到抑制,其中可利用碳源的缺乏往往是脱氮过程中的限制性步骤。能为反硝化细菌所利用的碳源主要可分为3类:废水中所含的有机碳源、内源碳、外加碳源等。内源碳主要是指基质内由植物枯叶或其他有机物分解生成的,并不能完全被反硝化细菌所利用,而影响系统的反硝化能力。
针对人工湿地内部普遍存在的反硝化细菌可利用有机碳源不足的状态,越来越多的研究者开始关注外加碳源对湿地脱氮效率的影响。garcia-montiel等研究发现,在人工湿地中添加简单的有机物(如葡萄糖)能够提高反硝化速率。虽然低分子碳水化合物,如葡萄糖、果糖、乙酸等作为碳源,可以提高系统的脱氮效果,但也存在出水有机物超标的风险。因此,随着对该领域研究的不断深入,更多地选择以天然有机物(如碎树枝、植物残体等富含木质纤维素的植物生物质固体碳源)作为外加碳源,但它们存在前期剧烈溶出、分解,n、p释放量大的现象,cod也较高,对初期出水水质可能造成次生污染。
对于低碳氮比水体,采用人工湿地技术除氮的过程中,可利用碳源的缺乏是脱氮过程中的关键性的限制因素。虽然许多研究者都采用外加碳源特别是植物生物质固体碳源的方式来解决,但在实际应用中都存在出水水质恶化的风险,以及在选择投加外源碳的种类、投加方式、投加量的多少、投加外源碳后氮元素的动力学模型以及对脱氮效果的影响等方面缺乏系统的研究工作。此外,在人工湿地的长期运行时,基质中的反硝菌的数量、活性等也难以得到有效保障,进而也会严重影响脱氮效率。
技术实现要素:
本发明要解决的技术问题是克服现有技术的不足,提供一种能够为低碳氮比污水的反硝化过程提供稳定充足的碳源、脱氮效果好、处理后水质大幅提高的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法。
为了解决上述技术问题,本发明采用以下技术方案:
一种固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法,所述方法采用固定化反硝化细菌的固体碳源小球处理低碳氮比污水,所述低碳氮比污水的碳氮比为1~9∶1,处理温度控制在10℃~40℃,处理ph值控制在6.5~8;
所述固定化反硝化细菌的固体碳源小球的制备方法包括以下步骤:
(1)谷壳预处理:将谷壳先进行水洗和烘干处理,然后打碎至1mm~2mm,置于碱溶液中加热处理,再经水洗并浸泡后,采用酸溶液调节ph值至中性,烘干至恒重,得到预处理后的谷壳;
(2)将聚乙烯醇和海藻酸钠加入水中,调节ph值至中性,加热搅拌直至混合均匀,将所得混合液在室温下放置,以冷却和消除溶解过程中生成的气泡,然后对混合液进行灭菌处理,再将步骤(1)预处理后的谷壳加入灭菌后的混合液中搅拌均匀,得到聚乙烯醇-海藻酸钠-谷壳混合液;其中,聚乙烯醇∶海藻酸钠∶预处理后的谷壳∶水的质量比为3~6∶0.5~2∶1~4∶100;
(3)将含有反硝化细菌的菌悬液加入到步骤(2)的聚乙烯醇-海藻酸钠-谷壳混合液中搅拌均匀,然后将混合后的液体经注射装置挤压到cacl2溶液中,经交联反应后,得到固定化反硝化细菌的固体碳源小球。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述固定化反硝化细菌的固体碳源小球投加于人工湿地装置中,通过人工湿地装置处理低碳氮比污水。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述低碳氮比污水的碳氮比为3~5∶1,所述处理温度控制在30℃,所述处理ph值控制在7~8。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述低碳氮比污水中硝酸盐浓度为50mg/l~150mg/l。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述步骤(2)中,所述聚乙烯醇∶海藻酸钠∶预处理后的谷壳∶水的质量比为5~6∶0.5~2∶1~4∶100。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述步骤(2)中,所述聚乙烯醇∶海藻酸钠∶预处理后的谷壳∶水的质量比为6∶1∶3∶100。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述步骤(3)中,所述反硝化细菌为荧光假单胞菌。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述步骤(3)中,所述含有反硝化细菌的菌悬液由以下方法制备得到:将培养好的反硝化细菌的菌种培养液以4500r/min~6000r/min离心15min~25min,取离心沉淀悬浊液用磷酸缓冲溶液清洗,然后用生理盐水清洗,离心后得到沉淀物菌体,取适量沉淀物菌体加蒸馏水,得到含有反硝化细菌的菌悬液。
上述的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法中,优选的,所述步骤(1)的谷壳预处理中:打碎后的谷壳与碱溶液的质量比为1∶30~50,所述碱溶液为naoh溶液,所述naoh溶液的质量分数为1%~3%,所述加热的温度为90℃,加热的时间为1h~1.5h,所述酸溶液为盐酸,所述盐酸的浓度为0.1mol/l~0.5mol/l。
与现有技术相比,本发明的优点在于:
1、本申请基于富营养化水体的低碳高氮问题,以低碳氮比的富营养化水体为研究对象,以包埋剂包埋反硝化菌和经处理后的谷壳而形成的新型固定化小球强化去除富营养化水体中氮素,并采用水平潜流人工湿地技术进行处理,可以解决影响人工湿地去除富营养化水体中氮素的关键性问题。因此,本申请对于低碳氮比的富营养化水体中氮素的去除具有重要实用意义,同时也是对人工湿地处理工艺的优化和创新,提高了人工湿地处理工艺的安全性和稳定性;固定化小球既可以为反硝化脱氮提供持续性的碳源供给,又可以保障反硝化菌的数量和活性,从而能有效的保证除氮效率;同时也实现了废物资源化利用,保护水环境。
2、本发明提供的固定化反硝化细菌的固体碳源小球是由海藻酸钠、聚乙烯醇、谷壳和水制成的混合液与反硝化细菌的菌悬液在cacl2溶液中通过交联反应制成。该固定化反硝化细菌的固体碳源小球通过外加碳源和反硝化细菌的协同作用,不仅可以在低碳氮比的污水反硝化处理过程中提供稳定的碳源,使得脱氮效率得到极大的提升,还由于小球稳定性良好,不会在污水处理过程中生成额外的沉淀物造成二次污染,使得处理过的污水水质更好,也进一步地降低了污水处理的成本。本发明的制备方法简单、成本低廉,相比投加甲醇等碳源更适合大规模应用在低碳氮比污水处理领域。
附图说明:
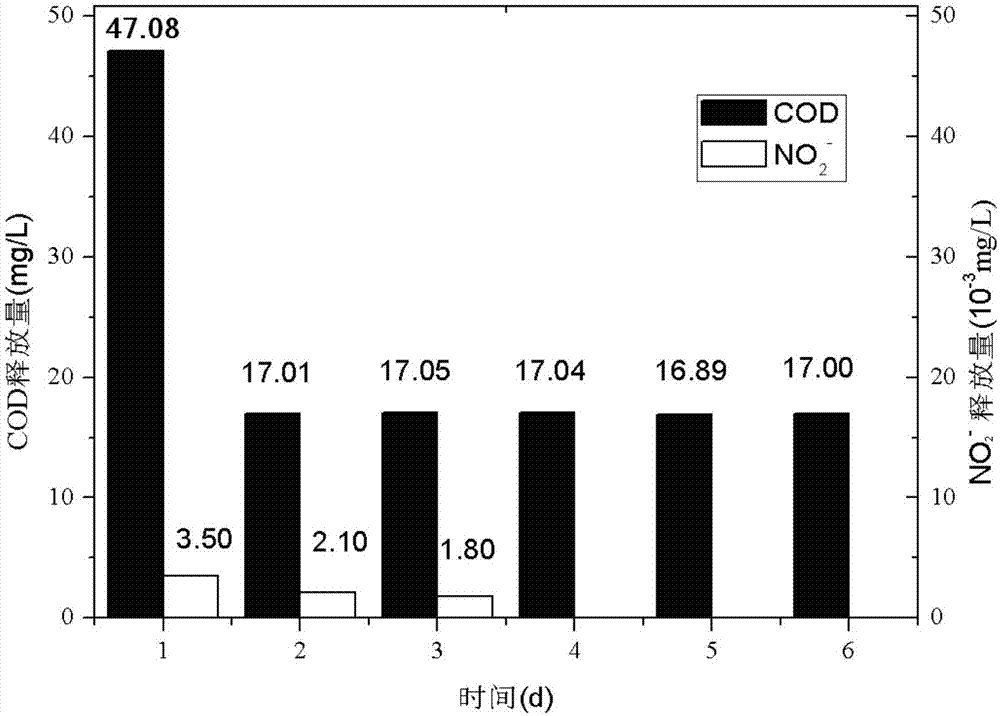
图1为本发明实施例1的正交实验中第14组的碳源和no2--n的释放量图。
图2为本发明实施例1的对比实验1中固定化反硝化细菌的固体碳源小球在不同no3--n浓度下的no3--n去除率。
图3为本发明实施例1的对比实验1中未经固定化的反硝化细菌菌悬液+固体碳源小球的组合在不同no3--n浓度下的no3--n去除率。
图4为本发明实施例1的对比实验1中固定化反硝化细菌的固体碳源小球在不同温度下的no3--n去除率。
图5为本发明实施例1的对比实验1中未经固定化的反硝化细菌菌悬液+固体碳源小球的组合在不同温度下的no3--n去除率。
图6为本发明实施例1的对比实验1中固定化反硝化细菌的固体碳源小球在不同ph下的no3--n去除率。
图7为本发明实施例1的对比实验1中未经固定化的反硝化细菌菌悬液+固体碳源小球的组合在不同ph下的no3--n去除率。
图8为本发明实施例1的对比实验2中固定化反硝化细菌的固体碳源小球在不同碳氮比下的no3--n去除率。
图9为本发明实施例1的对比实验2中未加谷壳的固定化反硝化细菌小球在不同碳氮比下的no3--n去除率。
图10为本发明实施例1的对比实验2中固定化反硝化细菌的固体碳源小球在不同温度下的no3--n去除率。
图11为本发明实施例1的对比实验2中未加谷壳的固定化反硝化细菌小球在不同温度下的no3--n去除率。
图12为本发明实施例1的对比实验2中固定化反硝化细菌的固体碳源小球在不同ph下的no3--n去除率。
图13为本发明实施例1的对比实验2中未加谷壳的固定化反硝化细菌小球在不同ph下的no3--n去除率。
图14为本发明实施例1的人工湿地实验中cw1和cw2中固定化反硝化菌的固体碳源对nh4+-n去除率。
图15为本发明实施例1的人工湿地实验中nh4+-n的进水浓度以及cw1和cw2的nh4+-n出水浓度随时间的变化图。
图16为本发明实施例1的人工湿地实验中人工湿地净化工艺流程图。
具体实施方式
以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。
以下实施例中所采用的材料和仪器均为市售。
以下各实施例和对比例中,采用的实验设备、药剂和测定方法等如下:
1、实验设备及仪器
实验设备有:微生物恒温培养箱、显数恒温摇床、离心机等。
实验仪器有:ph计、cod测定仪及分光光度计等。
2、实验材料与药剂
本实验中需要测定的项目涉及ph、cod、no2--n、no3--n的测定,根据标准的测定方法,研究中需要使用到的药剂主要有:
分析纯化学药剂:(nh4)2fe(so4)2、k2cr2o7、ag2so4、hgcl、kno3、苯酚、对氨基苯磺酰胺等。
3、分析项目及方法
ph测定:玻璃电极法
cod测定:重铬酸盐法
no2--n测定:n-(1-萘基)-乙二胺光度法
no3--n测定:酚二磺酸光度法
相应的分析步骤均按国家标准分析方法执行。
4、原水水质
本实验的研究对象为低碳氮比污水,根据实验需要配制不同碳氮比的污水,碳源采用葡萄糖,氮源用硝酸钾,再加上部分微量元素磷酸二氢钾、无水氯化钙和无水硫酸镁。
实施例1:
一种本发明的固定化反硝化细菌的固体碳源小球处理低碳氮比污水的方法,研究过程和技术方案如下:
1、制备固定化反硝化细菌的固体碳源小球
(1)谷壳的预处理:
(1.1)谷壳水洗处理:将谷壳用蒸馏水冲洗,去除表面附着的灰尘,然后在108℃下烘干两小时。
(1.2)谷壳碱处理:将烘干的谷壳机械打碎至1mm左右,以固液质量比为1∶30,将打碎的谷壳投加入质量分数为1%的naoh溶液中,加热至90℃持续1小时。
(1.3)谷壳ph调节:将碱处理后的谷壳碎片用蒸馏水冲洗,然后用蒸馏水浸泡,用0.1mol/l的稀盐酸调节ph至中性,最后在108℃下烘干至恒重。烘干至恒重后的谷壳碎片,表面呈深黄色,松散较脆。
(2)固体碳源小球的制备条件探索
为获得制备固体碳源小球的最佳配方,以下先通过正交实验确定不同配方下固体碳源小球的碳源释放效果:
在制备固体碳源小球的过程中,包括聚乙烯醇(pva)浓度a、海藻酸钠浓度b、预处理后的谷壳质量c、温度d、ph值e对碳源释放效果此处进行影响因素水平正交实验。五因素四水平共16组实验。
表1单因素值
固体碳源小球的具体制备过程如下,相关参数如表1所示:
首先分别将16组实验中pva、海藻酸钠按照对应数值加入100g蒸馏水中,调节ph值到中性后加热至沸腾状态并连续搅拌直至该混合液变得均匀。然后将其在室温下放置24h,以便冷却和消除溶解过程中生成的气泡。将上述混合液进行分装、灭菌、冷却后,将相应含量的谷壳加入混合液中反复搅拌均匀后,得到聚乙烯醇-海藻酸钠-谷壳混合液。
用对应规格的注射器将所得聚乙烯醇-海藻酸钠-谷壳混合液挤压到cacl2溶液(质量分数为4%)中,交联反应2h,形成直径约为5mm的小球,即为固体碳源小球。该固体碳源小球呈5mm透明球体,球体混有谷壳碎片,具有弹性不易破碎。将这些固体碳源小球用无菌水清洗后,在4℃下放置24h。
固体碳源小球碳源释放量的测定:将制备好的16组固体碳源小球分别放入500ml的锥形瓶中,调节到表1对应的ph值,在恒温水浴锅内调节到对应温度,加入500ml蒸馏水,分别在1h、3h、5h、24h、48h、72h、96h取样测定水中的cod、亚硝酸盐和硝酸盐的含量,每取一次样换一次蒸馏水。
表2固体碳源小球碳源释放实验结果表
通过以上表2实验结果显示,经过碱处理后的谷壳在固体碳源小球内能够稳定的释放碳源,各组实验中亚硝酸氮的释放量极低,硝酸氮的释放量基本为0,通过正交实验得出,固体碳源小球中碳源释放量最高的实验组为第14组,即当聚乙烯醇为6g,海藻酸钠为1g,谷壳为3g,温度为15℃,ph值为8时,如图1所示,得到最大的碳源稳定释放时平均速率0.71mg/(l*h)(由常规计算得到)。由此可见,固体碳源小球能够稳定向溶液中释放碳源,且引入的亚硝酸氮和硝酸氮对实验的影响基本忽略不计。
(3)固定化反硝化细菌的固体碳源小球的制备
在以上的碳源释放实验中,探索了聚乙烯醇、海藻酸钠、预处理后的谷壳和水可用于制备固体碳源小球的比例范围以及最佳配比,以下结合该最佳配比来制备固定化反硝化细菌的固体碳源小球。以上的步骤(1)谷壳的预处理和步骤(2)中制备聚乙烯醇-海藻酸钠-谷壳混合液的过程均包括在固定化反硝化细菌的固体碳源小球的制备过程中。
实验试剂:谷壳、海藻酸钠、聚乙烯醇、磷酸缓冲液
反硝化细菌种类:荧光假单胞菌,购买自中国工业微生物菌种保藏管理中心,保藏号为21093。
(3.1)菌悬液的制备:首先选取荧光假单胞菌作为反硝化细菌,将培养好的荧光假单胞菌的菌种培养液用离心机以4500r/min离心15min,取离心沉淀悬浊液用磷酸缓冲溶液清洗,然后用生理盐水清洗3遍,离心后得到沉淀物菌体。取适量菌体加蒸馏水配制成菌悬液,例如,可取约1/3沉淀物菌体加入50ml蒸馏水中。
(3.2)将菌悬液(可取20ml)加入到上述步骤(2)固体碳源小球碳源释放量实验中碳源释放最佳实验组的聚乙烯醇-海藻酸钠-谷壳混合液中反复搅拌均匀后,用对应规格的注射器将其挤压到质量分数为4%的cacl2溶液中(cacl2溶液无体积要求,将混合溶液一次次间歇挤进cacl2溶液中即可),交联反应2h,形成直径约为5mm的小球,即为固定化反硝化细菌的固体碳源小球。该固定化反硝化细菌的固体碳源小球呈5mm透明球体,淡黄色,球体混有谷壳碎片,具有弹性不易破碎。
2、将上述制备的固定化反硝化细菌的固体碳源小球用于处理低碳氮比污水,并研究处理过程的最佳条件
对比实验1微生物固定化对脱氮效果的影响
本对比实验中,将实施例1中配比最佳的固定化反硝化细菌的固体碳源小球与未经固定化的反硝化细菌菌悬液+固体碳源小球的组合分别在不同的no3--n浓度、不同的温度以及不同的ph值的条件下进行对比。旨在通过三种条件下两对比组分的脱氮效果差异来考察固定化反硝化细菌的固体碳源小球与未经固定化的反硝化细菌菌悬液+固体碳源小球的组合在脱氮效果上的优劣程度。
1、硝酸盐浓度实验
实验试剂:硝酸钾、葡萄糖
分别配制no3--n浓度(即硝酸盐浓度)为50mg/l、100mg/l、150mg/l的溶液,通过加入葡萄糖控制碳氮比为3,温度控制为30℃,ph值调节至7.5,然后分为以下6组实验:
a:no3--n50mg/l+固定化反硝化细菌的固体碳源小球
b:no3--n50mg/l+固体碳源小球+菌悬液(投加量与被固定的量相同)
c:no3--n100mg/l+固定化反硝化细菌的固体碳源小球
d:no3--n100mg/l+固体碳源小球+菌悬液(投加量与被固定的量相同)
e:no3--n150mg/l+固定化反硝化细菌的固体碳源小球
f:no3--n150mg/l+固体碳源小球+菌悬液(投加量与被固定的量相同)
表3硝酸盐浓度对脱氮效果的影响实验结果
通过表3、图2和图3可知,在不同硝酸盐浓度的溶液中,72h后,固定化反硝化细菌的固体碳源小球对no3--n的去除率均高于未固定化反硝化细菌的固体碳源小球,在硝酸盐浓度为50mg/l和150mg/l的溶液中,固定化反硝化细菌的固体碳源小球与未固定化反硝化细菌的固体碳源小球对于no3--n的去除率分别是89.78%和80.02%、85.94%和76.22%,高出了接近10个百分点,而当no3--n浓度在100mg/l时,固定化反硝化细菌的固体碳源小球与未固定化反硝化细菌的固体碳源小球对于no3--n的去除率分别96.59%和92.95%。
综上所述,在相同的时间内,no3--n浓度为100mg/l的溶液,反硝化细菌对硝酸盐的去除率最高;在不同浓度的no3--n溶液中固定化的反硝化细菌的固体碳源小球对no3--n的去除率都优于未固定化反硝化细菌的固体碳源小球。因此,被固定化的反硝化细菌,在对no3--n的去除能力上有明显的提高。
2、温度实验
实验试剂:硝酸钾、葡萄糖
把溶液温度分别控制在10℃、20℃、30℃、40℃,no3--n的浓度为100mg/l,通过加入葡萄糖控制碳氮比为3,ph值调节至7.5,然后分为以下8组实验:
a:10℃+固定化反硝化细菌的固体碳源小球
b:10℃+固体碳源小球+菌悬液(投加量与被固定的量相同)
c:20℃+固定化反硝化细菌的固体碳源小球
d:20℃+固体碳源小球+菌悬液(投加量与被固定的量相同)
e:30℃+固定化反硝化细菌的固体碳源小球
f:30℃+固体碳源小球+菌悬液(投加量与被固定的量相同)
g:40℃+固定化反硝化细菌的固体碳源小球
h:40℃+固体碳源小球+菌悬液(投加量与被固定的量相同)
表4温度对脱氮效果的影响实验结果
通过表4、图4和图5可知,在不同温度下,no3--n浓度为100mg/l,其他条件与前面实验组完全相同,比较固定化反硝化细菌的固体碳源小球与未固定化反硝化细菌的固体碳源小球对no3--n去除率。温度在20℃和30℃时,去除率高于其他两组,其中30℃最高达到96.59%,因为反硝化细菌的最适生长温度为30℃左右,其活性最大,对no3--n去除效果最佳,在低温10℃时去除率为91.89%,在高温40℃时去除率为67.77%,说明反硝化细菌在非适宜温度下,其活性受到不同程度的影响,最终no3--n的去除率四个温度差别都在二十个百分点以内,说明固定化反硝化细菌的no3--n去除率受温度影响作用较大,在最适生长温度30℃能较快达到很高的去除率。
综上所述,在对低碳氮比污水的处理中,温度对反硝化细菌的影响较大,反硝化细菌在适宜的温度下对no3--n的去除率都能够达到较高水平,而固定化的反硝化细菌对no3--n的去除上优于未被固定化的反硝化细菌,说明固定化反硝化细菌的固体碳源小球,在不同温度下对低碳氮比污水都有较好的处理效果。
3、ph值实验
实验试剂:硝酸钾、葡萄糖
把溶液ph值分别控制在6.5、7、7.5、8,no3--n的浓度为100mg/l,通过加入葡萄糖控制碳氮比为3,温度控制为30℃,然后分为以下8组实验:
a:ph6.5+固定化反硝化细菌的固体碳源小球
b:ph6.5+固体碳源小球+菌悬液(投加量与被固定的量相同)
c:ph7+固定化反硝化细菌的固体碳源小球
d:ph7+固体碳源小球+菌悬液(投加量与被固定的量相同)
e:ph7.5+固定化反硝化细菌的固体碳源小球
f:ph7.5+固体碳源小球+菌悬液(投加量与被固定的量相同)
g:ph8+固定化反硝化细菌的固体碳源小球
h:ph8+固体碳源小球+菌悬液(投加量与被固定的量相同)
表5ph值对脱氮效果的影响实验结果
通过表5和图6、7可见,在不同ph下,no3--n浓度为100mg/l,其他条件与前面实验组完全相同,除了ph为6.5的实验组去除率为90%,其他三组的去除率基本在96%,因为反硝化细菌的最适生长ph在7~8,其中ph为7.5和8时去除率最高,都为96.5%以上。固定化反硝化细菌的no3--n去除率都高于未固定化反硝化细菌,高出约5个百分点。
综上所述,反硝化细菌在弱碱性的溶液中,对no3--n的去除效果较好,固定化的反硝化细菌对no3--n的去除优于未被固定化的反硝化细菌。因此,固定化反硝化细菌的固体碳源小球在弱碱性条件,对低碳氮比污水有着较好的处理效果且优于未固定化反硝化细菌的固体碳源小球。
通过上述三个对比试验可知,在不同的no3--n浓度、不同的温度、不同的ph值的条件下,固定化反硝化细菌的固体碳源小球对no3--n的去除率均优于未经固定化的反硝化细菌菌悬液+固体碳源小球的组合。
对比实验2外加碳源对脱氮效果的影响
本实施例中,将实施例1中配比最佳的固定化反硝化细菌的固体碳源小球与未加谷壳的固定化反硝化细菌小球分别在不同的碳氮比、不同的温度以及不同的ph值的条件下进行对比实验。旨在通过三种条件下两对比组分的脱氮效果差异来考察固定化反硝化细菌的固体碳源小球与未加谷壳的固定化反硝化细菌小球在脱氮效果上的优劣程度。
1、碳氮比实验
实验试剂:硝酸钾、葡萄糖
将溶液中的碳氮比分别配成1∶1、3∶1、5∶1、7∶1、9∶1,温度控制为30℃,ph值调节至7.5,然后分为以下6组实验:
a:c∶n为1+固定化反硝化细菌的固体碳源小球
b:c∶n为1+固定化反硝化细菌小球(未加谷壳)
c:c∶n为3+固定化反硝化细菌的固体碳源小球
d:c∶n为3+固定化反硝化细菌小球(未加谷壳)
e:c∶n为5+固定化反硝化细菌的固体碳源小球
f:c∶n为5+固定化反硝化细菌小球(未加谷壳)
g:c∶n为7+固定化反硝化细菌的固体碳源小球
h:c∶n为7+固定化反硝化细菌小球(未加谷壳)
i:c∶n为9+固定化反硝化细菌的固体碳源小球
j:c∶n为9+固定化反硝化细菌小球(未加谷壳)
表6碳氮比对脱氮效果的影响实验结果
通过表6、图8和图9可知,在反硝化过程中c∶n≤5时,碳作为反硝化作用的限制性因素,当c∶n>5时,no3--n的去除率基本大于90%。外加碳源的固定化反硝化细菌在配制污水碳氮比分别为1、3、5、7、9,其他条件与之前完全相同的情况下,对no3--n的去除率基本相同,都在90%以上,由于有外加碳源的存在,碳不再是反硝化作用的限制因素,no3--n的去除率也不随碳源的增加而有较大变化。当未加碳源时,只有c∶n为7和9的实验组对no3--n仍然保持很高去除率,去除率为96%左右,其他三个实验组的去除率分别为47.06、57.89%和74.91%。在处理低碳氮比的污水时,常存在碳源不足的问题,外加碳源能提供充足的碳源,提高污水中的碳氮比,对no3--n的去除率有很大的提升,对于c∶n为3的实验组,未加碳源的实验组no3--n去除率从57.89%提高96.59%。
综上可知,外加碳源对反硝化细菌处理低碳氮比污水的影响较大,碳氮比较低时,碳源不足会导致no3--n的去除率降低,谷壳的加入能提高固定化反硝化细菌的固体碳源小球处理低碳氮比污水的能力。
2、温度实验
实验试剂:硝酸钾、葡萄糖
把溶液温度分别控制在10℃、20℃、30℃、40℃,no3-n的浓度为100mg/l,通过加入葡萄糖控制碳氮比为3,ph值调节至7.5,然后分为以下8组实验:
a:10℃+固定化反硝化细菌的固体碳源小球
b:10℃+固定化反硝化细菌小球(未加谷壳)
c:20℃+固定化反硝化细菌的固体碳源小球
d:20℃+固定化反硝化细菌小球(未加谷壳)
e:30℃+固定化反硝化细菌的固体碳源小球
f:30℃+固定化反硝化细菌小球(未加谷壳)
g:40℃+固定化反硝化细菌的固体碳源小球
h:40℃+固定化反硝化细菌小球(未加谷壳)
表7温度对脱氮效果的影响实验结果
通过表7、图10和图11可知,以c∶n为3,在不同温度下其他条件完全相同的实验组,进行外加碳源与未加碳源对no3--n的去除率的影响进行分析。从结果可以看出外加碳源与未加碳源的固定化反硝化细菌对no3--n去除率的最适宜温度是30℃,外加碳源的固定化反硝化细菌对no3--n的去除率在90%到96%之间(40℃除外),而未加碳源的固定化反硝化细菌对no3--n的去除率仅在53%到58%。
综上说明,在低碳氮比的污水中,温度不作为限制性因素影响反硝化作用,碳源依旧是影响反硝化作用的主要限制性因素,外加碳源的固定化反硝化细菌优于未加碳源的固定化反硝化细菌。
3、ph值实验
实验试剂:硝酸钾、葡萄糖
把溶液ph值分别控制在6.5、7、7.5、8,no3--n的浓度为100mg/l,通过加入葡萄糖控制碳氮比为3,温度控制为30℃,然后分为以下8组实验:
a:ph6.5+固定化反硝化细菌的固体碳源小球
b:ph6.5+固定化反硝化细菌小球(未加谷壳)
c:ph7+固定化反硝化细菌的固体碳源小球
d:ph7+固定化反硝化细菌小球(未加谷壳)
e:ph7.5+固定化反硝化细菌的固体碳源小球
f:ph7.5+固定化反硝化细菌小球(未加谷壳)
g:ph8+固定化反硝化细菌的固体碳源小球
h:ph8+固定化反硝化细菌小球(未加谷壳)
表8ph值对脱氮效果的影响实验结果
通过表8、图12和图13可知,以c∶n为3,在不同ph下其他条件完全相同的实验组,对外加碳源与未加碳源对no3--n的去除率的影响进行分析。从结果可以看出,ph在7到8之间外加固定化反硝化细菌对no3--n的去除率在90%到97%之间,保持较高的去除率,而未加碳源的固定化反硝化细菌小球的去除率仅在53%到59%。
由此说明,ph的变化对未加碳源的固定化反硝化细菌的反硝化作用影响不大,ph不作为反硝化作用的限制性因素,固定化反硝化细菌的固体碳源小球对no3--n的去除率明显高于未加入谷壳的固定化反硝化细菌的小球。
综上所述,本发明的固体碳源小球在当聚乙烯醇∶海藻酸钠∶谷壳为6∶1∶3,温度为15℃,ph值为8时,得到最大的碳源释放速率为0.71mg/(l*h);在此基础上,加入反硝化细菌制备成固定化反硝化细菌的固体碳源小球时,在适宜温度为30℃,ph值为7.5时,对低碳氮比污水中no3--n的去除率达到96.59%。
通过上述对比试验可知,在不同碳氮比、不同温度以及不同ph值的条件下,固定化反硝化细菌的固体碳源小球对no3--n的去除率均高于未加入谷壳的固定化反硝化细菌的小球。
3、本实验考察加入本发明的固定化反硝化细菌的固体碳源小球与不加入固定化反硝化细菌的固体碳源小球对人工湿地脱氮效果的影响。
将上述实验得到的最佳处理条件用于人工湿地处理低碳氮比污水的过程中。
3.1人工湿地装置参数及植物种植
本实施例采用了两套完全一样的水平潜流人工湿地装置,分别称为cw1和cw2。人工湿地装置长为105cm,宽为75cm,高为70cm,底部坡度约2%;处理区底部5cm高填充粒径10~20mm卵石(承托层),上部填充粒径3~8mm碎石,填料层的平均孔隙率约为38%,有效容积为200l。沿装置长度方向在35cm、70cm处设置取样口,取样深度距装置底部50cm。人工湿地净化工艺流程图如图16示意所示,低位水箱储存着模拟污水,通过泵送至高位水箱,维持稳定的高位水箱液面高度,由高位水箱底部出水管将污水送至配水槽,然后经三角堰均匀向人工湿地装置配水,污水经人工湿地装置处理后,经底部穿孔管收集而排出。
处理区植物分为两种,前2/3段种植芦苇,后1/3段种香蒲,植物种植密度为36株/m2。
3.2人工湿地装置运行方式
本实施例处理污水为人工配制模拟低碳氮比污水(碳氮比为3~5∶1),主要成份包括葡萄糖、硫酸铵、磷酸二氢钾和微量元素等。处理温度为室温(20至40度),ph值为中性。
本实验在两套相同的装置内同时开展,cw1内不投加固定化反硝化细菌的固体碳源小球,而在cw2的卵石层顶部投加本发明的固定化反硝化细菌的固体碳源小球,分别栽种相同的植物,待植物生长成熟后正式开展本实验。本实验分六个阶段连续运行,分别为阶段ⅰ-ⅵ。各阶段的运行方式及控制指标以及nh4+-n从各阶段平均去除率如表9所示。
表9人工湿地运行方式及水质组成及结果
从表9、图14和图15可见,加入固定化反硝化细菌的固体碳源小球(含外加碳源)人工湿地比未加入的人工湿地对nh4+-n的去除效果要好,最高去除率分别为96.75和85.53(其中某一天的值),平均去除率分别为85.23和61.38(整个周期的平均值)。在未加入固定化反硝化细菌的固定碳源小球的人工湿地中,如图15所示,随着碳氮比的增加(碳氮比即cod和氨氮的比值,cod可反映碳),nh4+-n的去除率是上升的,因为在低碳氮比中,碳源作为反硝化作用的主要限制因素,而在加入固定化反硝化细菌的固体碳源小球(即外加碳源)的人工湿地中,随着碳氮比增加,nh4+-n去除率没有明显上升,这是由于碳源充足时,碳源不再作为限制反硝化作用的主要因素,由于进水负荷增加,反硝化细菌分解硝酸氮能力达到饱和,去除率有所下降。分别比较表中ⅰ和ⅱ、ⅲ和ⅳ、ⅴ和ⅵ阶段,1、3、5阶段的流量为67l/d,2、4、6阶段的流量为134l/d,明显看出htr(水力停留时间)长的阶段对nh4+-n去除率要好于htr短的,而且加入固定化反硝化细菌的外加碳源的人工湿地其去除率降低幅度小于未加入固定化反硝化细菌的外加碳源的人工湿地,原因在于htr太短导致nh4+-n未能完全被分解就被排出人工湿地;由于未加入固定化反硝化细菌的外加碳源的人工湿地其反硝化细菌是富集在基质与植物根部,由于htr太短,水流冲刷速度太快,反硝化细菌易被水流带走,导致生物量减少,而固定的反硝化细菌则不易被冲刷,对nh4+-n去除率相对稳定。因此,采用加入固定化反硝化细菌的外加碳源的人工湿地对nh4+-n的去除率较高且稳定。
综上所述,加入了固定化反硝化细菌的固体碳源促进了反硝化作用的完全进行,使得人工湿地对nh4+-n的去除率明显高于未加入固定化反硝化细菌的固体碳源的人工湿地,且去除率更稳定。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!