一种利用光合微藻制备富氢水的方法及装置与流程
本发明属于新能源及生物制氢技术领域,具体涉及一种利用光合微藻制备富氢水的方法及装置。
背景技术:
氢分子是自然界最小、最简单的分子。穿透性极强,容易穿透皮肤和黏膜而进入细胞、细胞核和线粒体,极易被人体吸收、利用。氢气具有抗氧化作用,可高效清除恶性自由基,维持细胞内外体液的内环境平衡,保持有效的免疫力和自我修复能力[ohsawai,ishikawam,takahashik,etal.hydrogenactsasatherapeuticantioxidantbyselectivelyreducingcytotoxicoxygenradicals.[j].naturemedicine,2007,13(6):688];而且可以改善病症,改善过敏体质,起到良好的减肥效果[余光宇.美丽肌肤的“氢”春[g].郑州:世界中医养生美容学术大会,2015];同时还可降低血黏度和血压,缓解糖尿病[kajiyamas,hasegawag,asanom,etal.supplementationofhydrogen-richwaterimproveslipidandglucosemetabolisminpatientswithtype2diabetesorimpairedglucosetolerance[j].nutrres,2008,28:137-143;nakaoa,toyoday,sharmap,evansm,guthrien.effectivenessofhydrogenrichwateronantioxidantstatusofsubjectswithpotentialmetabolicsyndrome-anopenlabelpilotstudy[j].jclinbiochemnutr,2010,46:140-149;songg,lim,sangh,etal.hydrogen-richwaterdecreasesserumldl-cholesterollevelsandimproveshdlfunctioninpatientswithpotentialmetabolicsyndrome[j].jlipidres,2013,54:1884-1893]。同时氢气能减轻辐射引起的小肠、肝脏、生殖器细胞的损伤,并且对脏器具有明显的保护作用。
由于氢气具有易燃、易爆性,所以对氢气制备、保存、使用条件有一定的局限性。目前比较理想的方法是通过一定压强(0.4-0.6mpa),将高纯度工业氢气溶解在水或生理盐水中4小时以上,制成富氢饱和液[6],可口服应用,但这样造成了氢气的大量浪费且具有极大的安全隐患。并且富氢水在保存过程中,氢气浓度会随着放置时间的延长而逐渐降低,并且氢气浓度变化与储存容器和保存温度无明显相关关系[秦秀军,安全,张伟,等.富氢水制备及保存方法的初步研究[j].癌变·畸变·突变,2013,25(6):457-460]。
技术实现要素:
为了克服上述现有技术中的缺陷,本发明提供一种制备富氢水的装置及利用其制备富氢水的方法。
本发明所提供的制备富氢水的装置,包括微藻光合产氢系统,排水收气系统和富氢水收集系统,所述微藻光合产氢系统、排水收气系统和富氢水收集系统通过无菌导管顺序连接;
所述微藻光合产氢系统包括一个微藻培养瓶,
所述微藻培养瓶内放置有由光合微藻细胞悬浮液及缺硫tap培养液组成的微藻培养体系;
所述微藻光合产氢系统还可进一步包括一组led灯,一个磁力搅拌器、太阳能板和蓄电池;
所述太阳能板用于将太阳能转化为电能储存于蓄电池中;
所述蓄电池用于对led灯及磁力搅拌器供电,以支持微藻光合产氢;
所述微藻培养瓶的瓶口采用带有无菌导管的橡皮塞密闭;
所述排水收气系统为一个装满灭菌生理盐水的无菌瓶;
所述富氢水收集系统为真空无菌袋;
所述微藻光合产氢系统通过橡皮塞上带有的无菌导管与所述装满灭菌生理盐水的无菌瓶的一端连接,所述装满灭菌生理盐水的无菌瓶的另一端与真空无菌袋连接;
所述连接微藻光合产氢系统、排水收气系统和富氢水收集系统的无菌导管上均带有可控阀门。
本发明还提供一种利用光合微藻制备富氢水的方法。
所述利用光合微藻制备富氢水的方法包括:
1)首先按照上述制备富氢水的装置的各个部件的连接关系,构建所述制备富氢水的装置,然后向所述微藻光合产氢系统的微藻培养瓶中加入由光合微藻细胞悬浮液及缺硫tap培养液组成的微藻培养体系,
2)用带有无菌导管的橡皮塞封住培养瓶的瓶口,将所述无菌导管连接至装满灭菌生理盐水的无菌瓶(即排水收气系统)的一端,并将所述装满灭菌生理盐水的无菌玻璃瓶的另一端与真空无菌袋(即富氢水收集系统)连接;
3)开启装置进行连续光照培养;
4)光照培养的同时通过排水法实时将产生的氢气通入无菌生理盐水中,利用微藻产生的氢气本身的压力将其溶解于生理盐水中,排出的生理盐水即为富氢水,同时收集高纯度氢气气体。
上述方法中,所述培养瓶具体可为schott培养瓶;
所述光合微藻具体可为莱茵衣藻(chlamydomonasreinhardtii);
所述光合微藻细胞悬浮液通过包括下述步骤的方法制备得到:
a)挑取平板培养两周内的光合微藻细胞转入tap培养液中,摇床培养,得到预培养的光合微藻细胞;
b)收集预培养的细胞,接种至tap培养液中,培养24-36h;
c)将步骤b)所得细胞用缺硫tap培养液悬浮,得到光合微藻细胞悬浮液;
上述方法中,tap培养液的组成为(g/l):nh4cl0.4;mgso4·7h2o0.1;cac12·2h2o0.05;k2hpo40.108;kh2po40.056;trisbase2.423;hutner’straceelement1ml,冰乙酸1ml;
缺硫tap培养液的组成为(g/l):将tap培养液中的硫化物以等摩尔换成相应的氯化物;
固体tap培养基为:在tap培养液中加1.5%的琼脂粉;
hutner’straceelement(g/l):
步骤a)中,所述摇床培养的条件为:25℃,60rpm,100μes-1m-2摇床培养24-36h;
步骤b)中,所述预培养的光合微藻细胞在tap培养液中的起始浓度可为(1-5)×105cells/ml。
步骤1)所得体系中,光合微藻细胞的起始叶绿素浓度为25μg/ml;
步骤3)中,所述连续光照培养的光照强度为:100μes-1m-2,温度为25℃;
所述连续光照培养的时间大于30小时,具体可为30-120小时。
本发明通过光合微藻排水法制备富氢水不需要另外购买工业氢气及产氢设备,自身以光能为能源,整个生产过程清洁无污染;光合微藻排水法获得的富氢水,由于其产生过程为持续利用微藻产生的氢气压力将水排出,水分子均匀包裹氢分子,使氢气和水达到稳定结合,具有较高的含氢量且在储存过程中氢含量较为稳定;光合微藻排水法,整个过程是无菌密闭环境,因此获得的富氢水非常清洁,在lb培养基上培养24小时,仍无菌落生长;从产氢效率看,虽然光合微藻获得富氢水需经过24小时以上,但在之后的120小时内仍具有持续的生产能力,并且在48-72小时达到线性速度,2l的微藻培养液至120小时可以获得10l以上的富氢水;光合微藻在产生10l富氢水的同时还产生了10l氢气,这一方法可同时得到用于治疗的高纯度氢气。
本发明利用微藻将太阳光转化为氢气,并通过排水法实时将氢气通入无菌生理盐水中,利用微藻产生氢气本身的压力将其溶解于生理盐水中,排出的生理盐水即为富氢水,同时收集纯度极高的氢气气体。此方法相比较传统富氢水制备方法具有清洁高效安全的特点。
附图说明
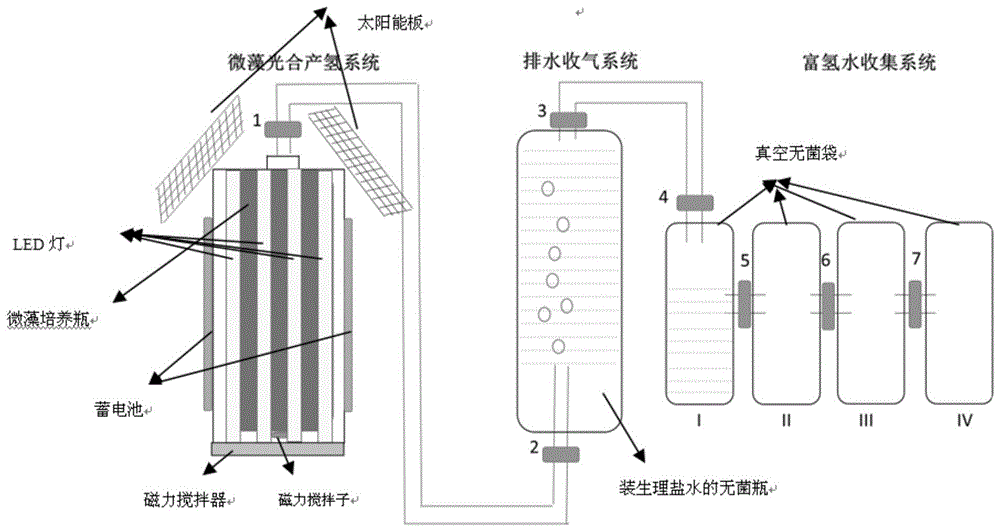
图1为本发明的制备富氢水的装置的示意图。
图2为本发明实施例中检测到的真空袋中收集的富氢水的体积随时间变化图。
图3为本发明实施例中采用三种方法制得的富氢水含氢量检测结果图。
图4为本发明实施例中采用三种方法制得的富氢水的含菌量检测结果图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
下述实施例中所采用的培养瓶为2l的scott玻璃瓶;
装满无菌生理盐水的容器为钢化玻璃瓶,容量为2l;真空无菌袋、导管及阀门为pvc材质。
图1为本发明的制备富氢水的装置的示意图。
本装置包括微藻光合产氢系统,排水收气系统和富氢水收集系统。微藻光合产氢系统由一个2l微藻培养瓶、一组led灯(共8根),一个磁力搅拌器、两块太阳能板和两块蓄电池组成;排水收气系统是一个装满灭菌生理盐水的无菌玻璃瓶;富氢水收集系统由四个串联的真空无菌袋组成。三个系统之间用无菌导管相连,并且导管上均带有可控阀门。
本装置工作原理及操作非常简单,太阳能板将太阳能转化为电能储存于蓄电池中,蓄电池对led灯及磁力搅拌器供电,支持微藻持续产生氢气,装置启动12小时后打开阀门1和阀门2,氢气进入排水收气系统,看到气泡产生后打开阀门3和阀门4,无菌生理盐水进入富氢水收集系统,当无菌真空袋i收集满后,打开阀门5,让富氢水流入无菌真空袋ii,当无菌真空袋收集满后,有两种操作可以选择:一是关闭阀门4和阀门5,将装满富氢水的无菌真空袋ii密闭收集,同时将无菌真空袋iii与无菌真空袋i用导管相连;二是打开阀门6,让富氢水流入无菌真空袋iii,等真空袋iii装满富氢水后,打开阀门7,让富氢水继续流入无菌真空袋vi。当排水收气系统中的生理盐水全部排出后,密闭收集无菌瓶和无菌袋,此时无菌瓶中充满氢气,无菌袋中装满了无菌富氢水。更换新的排水收气系统和富氢水收集系统,继续收集氢气和富氢水。一瓶2l微藻培养液(其中,光合微藻细胞的起始叶绿素浓度为25μg/ml)可以在五天(120小时)内生产约13l富氢水和13l的氢气。
实施例、
1.材料与方法
1.1材料
1.1.1植物材料:莱茵衣藻(chlamydomonasreinhardtii),藻种cc124为杜克大学藻种库莱茵衣藻(chlamycenter)的产品。
1.1.2培养基
1.tap培养液(g/l):nh4cl0.4;mgso4·7h2o0.1;cac12·2h2o0.05;k2hpo40.108;kh2po40.056;trisbase2.423;hutner’straceelement1ml,冰乙酸1ml(为北京化学试剂公司的产品)。
2.缺硫tap培养液(g/l):将tap培养液中的硫化物以等摩尔换成相应的氯化物(为北京化学试剂公司的产品)。
3.固体tap培养基:在tap培养液中加1.5%的琼脂粉。
4.hutner’straceelement(g/l):(为sigma公司的产品)
1.1.3其他试剂
无菌生理盐水:0.9%的nacl溶解液,高温高压灭菌后装入2l无菌玻璃瓶中,所述无菌玻璃瓶连接有两根带阀门的导管,一根连接橡皮塞,另一根连接另一500ml真空无菌袋。
1.2方法
1.2.1材料培养:
1.挑取平板培养两周内的(莱茵衣藻)细胞转入装有30mltap培养液的100ml三角瓶中,25℃,60rpm,100μes-1m-2摇床培养24-36h。
2.收集预培养的细胞,接种至2000mltap培养液中,起始浓度1-5×105cells/ml;培养24-36h。
1.2.2缺硫处理诱导产氢反应
1.25℃,2500rpm离心4min收集细胞,每1000ml细胞用500ml左右的缺硫培养基洗细胞一次,用30ml左右的缺硫tap培养液悬浮细胞,测叶绿素浓度。
2.取20μl悬浮细胞,加入980μl缺硫培养液,再加入4ml丙酮,混匀,5000rpm,5分钟;
3.取离心后的上清,测定663nm和645nm处的吸光值,根据下面的公式计算总叶绿素含量:
chl(a+b)=8.02×od663+20.21×od645
其中,chl(a+b)表示培养体系叶绿素a和叶绿素b的总量,od663表示663nm波长处的吸光值;od645表示645nm波长处的吸光值;
4.计算最终叶绿素浓度达到25μg/ml所需的步骤1中的细胞原液(即细胞悬浮液)体积,将所需体积的细胞悬浮液加入新鲜的缺硫培养基中;
5.采用schott培养瓶做放氢瓶,培养体系为2000ml,计算最终叶绿素浓度达到25μg/ml所需的4步骤中的细胞原液体积,加入所需体积的细胞悬浮液,用缺硫tap培养液补足到2000ml。
6.用带有无菌导管的橡皮塞封住培养瓶的瓶口。
7.打开装置中微藻产氢体系的led照明灯,将光强设定为100μes-1m-2,装置所处环境温度设定为25-30℃。
8.500ml真空无菌袋装满富氢水后,用气相色谱测定富氢水中含氢量。
1.2.3压强法制备富氢水
采用增加压强的方法制备富氢水。通过预先抽真空的方法将500ml生理盐水(0.9%nacl无菌水)中的空气分压降低,最后通入一定压强的氢气,保持10小时后,获得富含氢气的水溶液。用气相色谱测定富氢水的含氢量。
1.2.4氢棒制备富氢水
氢棒(购自北京云医国际科技有限公司)装入500ml生理盐水(0.9%nacl无菌水)中,浸泡10小时后,利用气相色谱测定富氢水的含氢量。
1.2.5检测不同保存时间对三种方法得到的富氢水中氢气浓度的影响
将通过微藻光合产氢制备好的富氢水封存于真空袋中,另外两种方法制备的富氢水装入500ml无菌玻璃瓶中,拧紧瓶口。三份富氢水分别于4℃、室温放置不同时间(0、6、12、24和48h)后,测定各组水溶液中的氢气浓度,研究水溶液中氢气浓度与放置温度及时间的关系。
1.2.6检测三种方法得到的富氢水中的含菌量
将三种方法制备的富氢水分别于4℃和室温放置24小时,在无菌操作台上,各取2ml滴于提前铺好lb培养基的培养皿上,用菌涂棒涂布均匀,每种处理涂布3-5皿。37℃培养24小时,分别计数各培养皿菌落数。
2.结果
2.1光合微藻制备富氢水体积检测
不同时间点检测真空袋中收集的富氢水的体积,结果如图2所示,产氢速度在24小时较慢,但在30小时即可以收集到500ml富氢水,之后产氢速度快速增加,至120小时可以收集富氢水100l。
2.2三种方法得到的富氢水含氢量检测
光合微藻利用排水法得到的富氢水装满500ml真空袋后,以及另外两种方法制备的富氢水马上利用液相色谱检测三种方法得到的富氢水含氢量情况,结果如图3所示,三种方法得到的富氢水含氢量不同,排水法获得的富氢水含氢量最高,可达1.6ppm以上,产氢棒方法获得的富氢水氢气含量最低,为1.34ppm。
2.3不同保存温度及时间对三种方法得到的富氢水中氢气浓度的影响
光合微藻排水法收集于密闭袋中的富氢水在4℃和室温情况下的含氢量均较为稳定,48小时后,含氢量仍能保持在1.1ppm以上,仍然具有应用价值。压强法及制氢棒法收集于玻璃瓶中的富氢水均不能在放置48小时后保持有效含氢浓度,失去应用价值。
表1不同制备方法、温度和时间对富氢水含氢量的影响(单位:ppm)
2.4不同制备方法的含菌量检测
如图4所示,光合微藻排水法制备的富氢水最为清洁,涂布lb平板24小时没有菌落生长,其余两种方法得到的富氢水均有一定的含菌量,尤其是制氢棒法获得的富氢水,含菌情况最为严重。
本发明通过光合微藻排水法制备富氢水不需要另外购买工业氢气及产氢设备,自身以光能为能源,整个生产过程清洁无污染;光合微藻排水法获得的富氢水,由于其产生过程为持续利用微藻产生的氢气压力将水排出,水分子均匀包裹氢分子,使氢气和水达到稳定结合,具有较高的含氢量且在储存过程中氢含量较为稳定;光合微藻排水法,整个过程是无菌密闭环境,因此获得的富氢水非常清洁,在lb培养基上培养24小时,仍无菌落生长;从产氢效率看,虽然光合微藻获得富氢水需经过24小时以上,但在之后的120小时内仍具有持续的生产能力,并且在48-72小时达到线性速度,2l的微藻培养液至120小时可以获得10l以上的富氢水;光合微藻在产生10l富氢水的同时还产生了10l氢气,这一方法可同时得到用于治疗的高纯度氢气。
- 还没有人留言评论。精彩留言会获得点赞!