磁核包覆型亚铁氰化钛钾吸附剂的制备方法及产品与应用与流程
本发明涉及无机材料领域,特别涉及一种磁核包覆型亚铁氰化钛钾吸附剂的工业化制备方法及其产品与应用。
背景技术:
核电作为一种重要的清洁能源,正在逐渐成为我国能源结构中的重要组成部分。日本福岛核事故中,放射性废液的快速高效去除成为事故后处理的关键问题。以福岛事故为警示,在我国建立核电站事故应急机制、开展放射性废液应急处理技术研究,是非常重要和紧迫的。
以福岛的处理工艺为例,放射性废液由于与损坏的反应堆燃料元件和其它被污染的组件接触,污染程度各不相同,总量达110000吨,放射性污染水平达到1Ci/L的量级,其中134/137Cs是主要的辐射来源(Hijikata et.al.,2014;Tsukada et.Al.,2014)。
日本福岛事故中所用放射性废液处理系统可分为四个部分(Gay et.al.,2012):1)采用油水分离工艺以去除废水中的油类物质,以保障后续工艺的正常运行,分离装置来自日本东芝公司;2)采用美国Kurion公司提供的无机吸附剂去除Cs;3)采用法国Avera公司提供的化学共沉淀工艺进一步去除Cs和Sr;4)采用反渗透装置和蒸发浓缩工艺进行除盐精处理,装置来自采用日立公司、Avera公司和东芝公司。在该工艺中通过Kurion的吸附和Avera的共沉淀两步工艺,134Cs和137Cs的去污因子为105~106(Fournel et.al.,2012),其中采用了菱沸石为除铯吸附剂(Rhodes et.al.,2012),在化学共沉淀工艺中采用了亚铁氰化物(Denton et.al.,2012),Cs+最终以Cs2NiFe(CN)6的形式沉淀下来。该处理系统该系统的主要优势在于:无机吸附剂对痕量放射性核素离子的选择性强,可适用于高含盐量的海水冷却水;无机吸附剂大幅地降低了废液的放射性,有效地保障了后续膜工艺的运行和辐射防护;此外无机吸附剂相比于树脂,放射性废物产生量小,后处理更简单安全。但该工艺中使用的菱沸石吸附剂吸附速率不够快,仍然难以满足事故条件下大量放射性废液快速处理的要求。
过渡金属离子稳定的亚铁氰化物是一类高效沉淀和固定Cs离子的无机材料(Ambashta et.al.,2003;Mimura et.al.,1997;Vrtoch et.al.,2011;Zhang et.al.,2009),对Cs+的选择性系数可达1500000(Pickett et.al.,2002),并且在很宽的pH值范围内都能保持对Cs+高效吸附。例如,亚铁氰化铜钾在pH为1.1的情况下对铯仍能保持21.7mg/g的吸附容量(Sangvanich et.al.,2010)。但是亚铁氰化物颗粒粒径小,容易形成胶体,无法直接应用于常见的填充床操作中,也难以进行固液相分离。而利用加热、陈化等方法将其制备成粒径较大的材料,又使得材料内部传质阻力大,吸附速率小,最终导致吸附容量低。于是有研究者用溶胶凝胶法将亚铁氰化物负载于多孔载体之上,形成复合吸附剂(Chang et.al.,2008;Hu et.al.,2012;Liu et.al.,2009)。复合亚铁氰化钴钾对铯的吸附容量能达到46.6mg/g(Lehto et.al.,1987)。以TiCl4为原料,采用常用于制备高效液相色谱填料的方法,将二氧化钛溶胶加入到尿素和六亚甲基四胺溶液中,混合后加入含表面活性剂的煤油中,制备水合二氧化钛凝胶颗粒;然后将得到的二氧化钛颗粒浸泡于亚铁氰化钾和盐酸混合溶液中,可以制备出亚铁氰化钛钾球形颗粒(徐世平et.al.,1997)。这种方法解决了亚铁氰化物难以球形化的问题,但合成的材料比表面积较小,且材料中仍然残留大量的有机物,在处理放射性废液之后进行的煅烧固化阶段容易发生爆炸。
本课题组在亚铁氰化物的固载化成型方面做了大量工作,例如:第一种是采用硅溶胶原位固定技术制备了亚铁氰化钴钾与多孔SiO2的杂化材料,对Cs+的吸附容量可达0.335meq Cs/g-adsorbent(中国专利CN200710064453.0);第二种是以成型的硅胶小球与钛酸四丁酯反应形成表面包覆TiO2的复合载体,再将该载体浸泡于亚铁氰化钾的盐酸溶液中,获得球形亚铁氰化钛钾/小球硅胶杂化材料(中国专利200710122085.0);第三种是采用磁核包覆技术,在以水化学方法制备的亚微米级Fe3O4表面包覆保护层SiO2,之后在其上通过溶胶凝胶技术或沉积沉淀技术负载不同的金属离子M过渡层(M=Ti、Zr、Zn、Fe、Cu、Co、Ni等),最后将磁性载体浸渍于亚铁氰化钾的盐酸溶液中,获得微米级磁性亚铁氰化物吸附剂(中国专利ZL 2012 1 0347269.8)。该吸附剂具有高效吸附Cs离子的能力之外,还可以通过外加磁场实现固液相的分离。
在上述众多亚铁氰化物的固载化方法中,采用磁核包覆技术制得的磁性亚铁氰化物吸附剂由于其可以通过外加磁场实现固液相分离的特性而特别令人感兴趣。然而,迄今为止所制备的磁性亚铁氰化物吸附剂均是采用人工合成的具有高表面活性的Fe3O4室内米粒子作为核心,因而所得到的吸附剂通常具有几微米的颗粒尺寸。例如,在中国专利CN102836693中,所得到的磁性亚铁氰化物吸附剂粒径为0.2至5微米。这样颗粒尺寸大小的吸附剂在工业应用中的范围有限,难以推广。
工业磁粉具有成本低、获得容易的特点。从工业角度出发,将其作为核心以上述磁核包覆技术来制备磁性亚铁氰化物吸附剂是令人感兴趣的。另外工业磁粉的自沉降性能好,比较适合于工业应用。然而,这种工业磁粉具有粒径较大、表面致密、比表面积小、表面活性羟基官能团少的特点,因而对其进行表面生长和/或表面包覆在技术上存在一定的难度;按照现有技术的方法还无法制备以工业磁粉为核心的磁性亚铁氰化物吸附剂。
技术实现要素:
本发明在前期磁性吸附剂研制以及中试放大制备的基础上,提供一种工业规模化制备磁核包覆型亚铁氰化钛钾的方法及其产品,所得吸附剂可用于去除放射性废液中Cs离子,或者其他液体环境中的稳定Cs同位素。
本发明一种工业规模化制备磁核包覆型亚铁氰化钛钾吸附剂的制备方法中所用到的生产线,主要设备包括:反应釜、离心机、自动进样系统、真空烘箱、电热蒸箱、鼓风烘房等。离心机设置在反应釜下方,反应釜设置有自动进样系统,自动进样系统可以采用蠕动泵。自动进样系统也称作自动流加系统。
本发明一种工业规模化制备磁核包覆型亚铁氰化钛钾吸附剂的制备方法,该方法包括以下步骤:
选择采用工业磁粉或自制磁粉为载体;
(1)第一次包硅:首先在1号反应釜中依次加入无水乙醇和正硅酸乙酯(TEOS),开启搅拌桨20min使TEOS溶解均匀,在连续搅拌下从固体加料口加入磁粉,开启油浴加热系统使温度达到30℃,并继续搅拌2h;接着通过自动流加系统加入浓氨水,并通过pH自动连锁控制,使反应体系在pH不低于11.5的条件下反应1h;之后通过自动流加系统加入纯水,在搅拌下反应5~10h。反应结束后打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,固体物料用清水冲洗,直到离心机出水pH降低至9。所获得固体物料记为FeSi1。
(2)第二次包硅:预先配制1mol/L的硫酸溶液和浓度为5~20%的硅酸钠溶液备用。在2号反应釜中加入纯水,在搅拌条件下加入步骤(1)所获的固体物料FeSi1,开启油浴加热系统使温度达到90℃,采用自动流加系统两路同时分别滴加硅酸钠溶液和硫酸溶液,用自动pH控制使整个滴加过程中体系pH=9.5,直到全部硅酸钠溶液滴加完毕,停止滴加硫酸溶液,使体系在搅拌条件下反应5~10h。反应结束后打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,固体物料用清水冲洗,直到离心机出水pH降低至7~8。将固体物料放入鼓风烘房烘至彻底干燥,所获得固体物料记为FeSi2。
(3)吸附包钛过程:在干燥无水的3号反应釜中加入乙醇或异丙醇,再继续加入钛酸四丁酯,开启搅拌器使溶解均匀。将干燥的固体物料FeSi2加入到反应器中,搅拌1h后,停止搅拌静置3h。之后打开反应釜底的出料口阀门,物料进入反应釜下面的离心机进行固液分离,排出的液体用干燥的桶收集。获得的固体材料放置在真空烘箱内,在50℃下抽真空,脱除溶剂乙醇或异丙醇。获得的固体物料记为FeSiTi1。
(4)气相水解包钛过程:将步骤(3)获得的固体物料FeSiTi1均分放入电热蒸箱内的多个托盘中,开启蒸箱,在高温和一定的压力下使水蒸气与钛酸四丁酯发生水解反应2~4h,在材料表面生成TiO2包覆层。采用该方法可以抑制易在溶液相(例如水相)反应中出现的钛源均相水解现象,提高TiO2的负载量和保护层的结构稳定性。反应后的物料放入鼓风烘箱内在120℃下彻底烘干。获得的固体物料记为FeSiTi2。
(5)吸附剂包覆过程:在4号反应釜中加入纯水,在搅拌的条件下采用自动流加系统加入浓盐酸,使盐酸的浓度为0.5~1.0mol/L;继续加入亚铁氰化钾,搅拌均匀后使其浓度达到15wt%~40wt%。在反应釜内加入固体物料FeSiTi2,并在30℃下浸泡进行24h,期间每隔3~4h搅拌30min。待反应结束后,打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,溶液收集在一个洁净的储液桶中。所获得的固体物料用清水冲洗,直到离心机出水为浅绿色或无色。将固体物料放入鼓风烘房烘至彻底干燥,所获得固体物料即为目标的磁核包覆型亚铁氰化钛钾吸附剂。
进一步,所述步骤(1)~(5)中,磁粉采用Fe3O4或其他任何铁基磁性材料,颗粒度≤80目(即180微米)。可采用工业级Fe3O4磁粉,颗粒度优选80~120目(120微米-180微米)。在本发明的上下文中,“工业级磁粉”是指,直接由矿石研磨、筛分得到的具有磁性的粉末状颗粒,其通常具有120微米或更大(即具有120目或更低目数)的颗粒尺寸。这种工业磁粉具有表面致密、比表面积小、表面活性羟基官能团少的特点,因而对其进行表面生长和/或表面包覆在技术上存在一定的难度。本发明的发明人惊讶地发现,采用两步包硅法可以在工业磁粉表面,例如颗粒具有80-120目颗粒尺寸的工业Fe3O4磁粉表面,形成包覆完整的SiO2保护层,从而保护Fe3O4在酸性溶液中不易溶出。
进一步,所述步骤(1)中,有机溶剂可以是乙醇、丙醇或异丙醇等;硅源可以是正硅酸甲酯或正硅酸乙酯。
进一步,所述步骤(1)中,有机硅源的量与磁铁粉质量相关,Si:Fe3O4=5wt%~10wt%;有机硅源与醇的体积比例为1:5~1:10,加入的纯水与醇的体积比为1:5~1:10;
进一步,所述步骤(1)中,加入的碱液可以是浓氨水、NaOH溶液、Na2CO3溶液等。碱液的加入总量及滴加速度受反应体系pH控制,保证整个反应过程中pH不低于11.5。
进一步,所述步骤(1)中,反应温度为20~50℃,反应时间为5~10h。所述步骤(1)中,滤出废液用精馏装置进行水/醇分离,获得95%的回收醇重复应用。
进一步,所述步骤(2)中,初始纯水和磁粉的加入量满足固液相质量比为1∶1~1∶5,硅酸钠的量与磁粉质量相关,为Si:Fe3O4=5wt%~10wt%,硅酸钠溶液的浓度配制为5~20wt%,采用稀酸溶液调节pH=9~10之间,稀酸溶液采用浓度为0.2~1mol/L稀硫酸或稀盐酸,反应时间为5~10h。
进一步,所述步骤(2)中,配制硫酸溶液的浓度为1mol/L;硫酸的加入量受反应体系pH控制,保证整个反应过程中pH=9.5。步骤(2)中也可以采用盐酸溶液。
进一步,所述步骤(2)中,反应温度为80~90℃,反应时间为5~10h。
进一步,所述步骤(2)中所获得中间体FeSi2需要彻底烘干。
进一步,所述步骤(3)中,将包覆了二氧化硅层的工业磁粉在无水状态下在钛源中进行浸渍。在本发明的上下文中,“钛源”是指为吸附剂提供元素Ti的物质,其包括,但不限于钛酸四烷基酯和四氯化钛,优选选自由钛酸四甲基酯、钛酸四乙基酯、钛酸四丙基酯、钛酸四丁基酯或其组合组成的组,更优选选自钛酸四丁基酯。在本发明的一个实施方式中,将钛酸四丁酯作为钛源在无水状态下进行浸渍。
进一步,所述步骤(3)中,采用钛酸四丁酯为钛源,Ti:Fe3O4=5wt%~10wt%;采用溶剂为无水乙醇、无水异丙醇或者无水丙醇;二者体积比为1∶2~1∶4。
进一步,所述步骤(3)中,所获固体产物需要在低温真空下去除大量的有机溶剂,温度为40~50℃。
进一步,所述步骤(4)中,气相水解温度为100℃~120℃,压力为0.05~0.08MPa;水解后的材料在常压120℃的鼓风烘箱内干燥。
进一步,为提高TiO2的负载量,重复所述步骤(3)和(4)2~3次,使得吸附剂表面Ti的含量达到Ti/磁粉大于5wt%。
进一步,所述步骤(5)中,Fe3O4与纯水质量比为1∶3~1∶5,反应液中盐酸的浓度为0.5~1.0mol/L;亚铁氰化钾浓度为15wt%~40wt%。根据本发明的一个优选实施例,使用亚铁氰化钾作为亚铁氰化物以提供吸附活性组分。然而,本领域技术人员可以理解,工业上容易得到的其他亚铁氰化物,诸如亚铁氰化钠,由于其与亚铁氰化钾相似的化学性质,同样也适用于本发明。
本发明的发明人惊讶地发现,在本发明的步骤(5)中,表面反应可以在较少量无机酸的存在下以较高的固-液相质量比来实施,而未对反应效果产生不利影响。与中国专利CN102836693A中公开的磁核包覆型亚铁氰化物吸附剂的制备过程相比,本发明的方法使得随后的后处理步骤更加容易,减少了废水排放,有利于环境。
进一步,所述步骤(5)中,所述后处理的具体步骤为:反应后所得的沉淀物经离心机分离后,用清水清洗,直至离心机出口液体为浅绿色或无色,沉淀物经120℃干燥,获得目标磁核包覆型亚铁氰化钛钾吸附剂。
由上述制备方法制备所得的磁核包覆型亚铁氰化钛钾吸附剂,也在本发明的保护范围之内。该磁核包覆型亚铁氰化钛钾吸附剂的内核为磁粉颗粒(优选小于120目,即大于120微米),在所述磁粉颗粒外表面由里向外分别设置有二氧化硅覆膜层和亚铁氰化钛钾覆膜层。这种大粒径磁粉颗粒作为核心的磁核包覆型亚铁氰化钛钾吸附剂是新颖的。
本发明的发明人还惊讶地发现,根据本发明的磁核包覆型亚铁氰化钛钾吸附剂具有结构稳定、吸附性能高的特点。这种吸附剂由于可以吸附放射性同位素Cs离子,也可以吸附稳定性同位素Cs离子,因此具有广阔的应用前景。例如,可以通过吸附作用用于实现分离和/或去除和/或提取放射性同位素Cs离子,也可以用于分离和/或去除和/或提取稳定性同位素Cs离子的应用。因此,根据本发明的磁核包覆型亚铁氰化钛钾吸附剂在吸附(包括去除或分离或提取)放射性同位素Cs离子和吸附(包括去除或分离或提取)稳定同位素Cs离子的应用,也在本发明的保护范围之内。
上述磁核包覆型亚铁氰化钛钾除铯吸附剂在去除放射性同位素Cs离子和去除稳定同位素Cs离子的应用方法,采用序批式动态吸附反应器模式进行废液处理。所述反应器设计为两路并联,每一路分为两级。
本发明在80~120目的工业Fe3O4磁粉表面首先采用两步反应法包覆完整的SiO2保护层,使Fe3O4在酸性溶液中不易溶出;接着采用钛酸四丁酯/醇溶液浸渍和气相水解的方法,在高温高压水蒸气作用下制备过渡包覆层TiO2,克服了在溶液相容易发生的Ti4+均相水解作用,提高了TiO2的负载量和结合强度;最后采用溶液相表面反应的方法将亚铁氰化钾与TiO2层反应,使生成的活性亚铁氰化钛钾吸附剂组分牢固地生长在磁核表面,制成具有磁性的除铯吸附剂。
附图说明
图1是规模化制备磁核包覆型亚铁氰化钛钾吸附剂的生产线结构示意图;
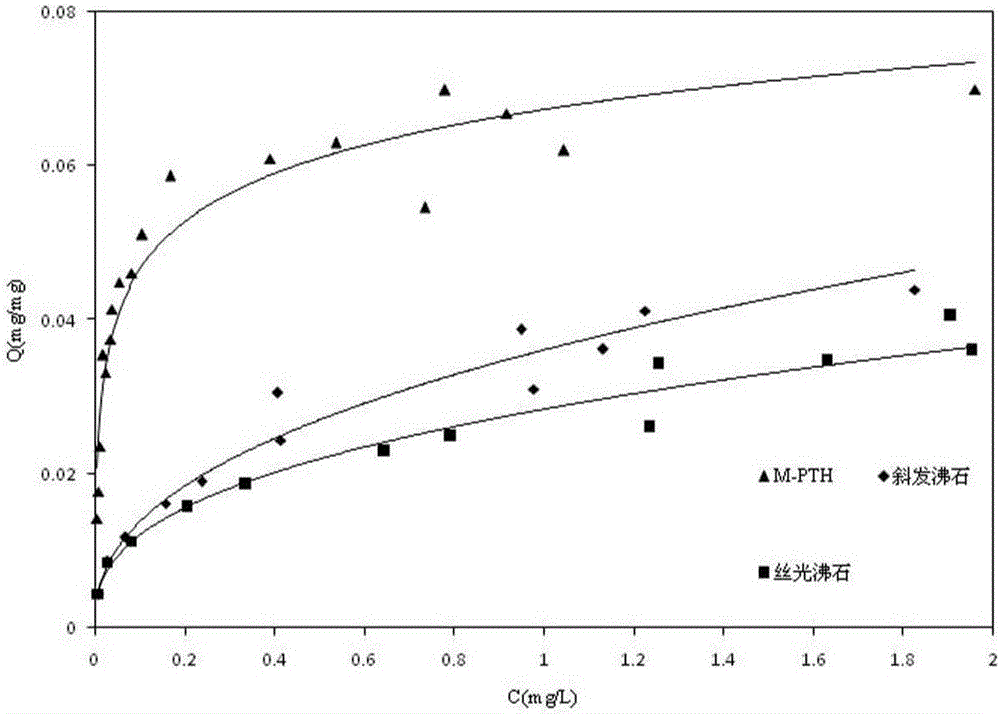
图2是实施例1所获得磁核包覆型亚铁氰化钛钾吸附剂对Cs+的吸附等温线;
图3是酸度对实施例1所获得M-PTH(磁核包覆型亚铁氰化钛钾吸附剂的英文缩写)的zeta电位及其除铯性能的影响;
图4是溶液中阳离子(0.01mol/L)对实施例1所获得M-PTH吸附Cs+性能的影响;
图5是实施例1所获得M-PTH材料在不同投加量下的Cs+吸附动力学曲线;
图6是序批式反应器工作原理示意图;
图7是两路两级序批式动态吸附反应器结构示意图;
图8是实施例1所获得M-PTH在两路两级序批式反应器中各处理批次的去污因子变化;
图9是实施例2所获得亚铁氰化钛钾吸附剂红外光谱;
图10是实施例2所获得M-PTH在两级序批式反应器中各处理批次去污因子变化。
具体实施方式
下面结合具体实施方式对本发明作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法,所述原材料及检测所用标准化学试剂如无特别说明均能从公开商业途径获得。
在以下的实施例中,吸附剂分别进行了静态吸附和序批式吸附反应器性能试验测定,吸附前后Cs+离子的浓度采用等离子体质谱(ICP-MS)来测定,吸附剂性能采用分配系数Kd和去污系数DF来表示。
静态吸附测定中,一定量的吸附剂加入到50mL的离心管中,置于恒温摇床上摇动48h~72h,测定吸附前后的Cs+离子浓度,吸附剂性能采用分配系数Kd和去污系数DF来表示。吸附分配系数Kd(mL/g)如下式(1)所示,其中C0和Ct分别为被吸附离子的初始浓度以及达到吸附平衡后浓度,F为被处理溶液体积(mL)与吸附剂质量(mg)之比。去污系数如下式(2)所示,为被吸附离子的进水浓度与达到吸附平衡后的出水浓度的比值。一般吸附分配系数说明了吸附材料本身的特性,Kd值在105以上的说明吸附剂的性能良好;去污系数的大小不仅与材料本身的吸附特性相关,也与吸附剂的用量相关,该值越大说明污染物去除得越干净。
Kd=(Co-Ct)×F×1000/Ct (1)
动态吸附性能采用序批式反应器进行,其工作过程如图6所示分为四个阶段,分别为进水、吸附、沉淀、出水。假设处理量为1t/h,进水浓度为1.5mg/L,去污因子大于1000,进水、吸附、沉淀、出水阶段各2.5min,则一个处理循环需要10min,每小时能处理6个循环,则单个反应器的有效体积需要167L。反应器设计为两路并联,每一路分为两级,如图7所示,当反应器中吸附剂耗尽时需要进行更换。采用去污系数DF来表示两级的Cs+去污效果。
实施例1:公斤级吸附剂的实验室制备
在实验室玻璃反应釜中进行了公斤级磁核包覆型亚铁氰化钛钾吸附剂的制备,步骤如下:
选择采用工业磁粉或自制磁粉为载体;
(1)在反应釜中依次加入8L无水乙醇和1L正硅酸乙酯(TEOS),连续搅拌20min使TEOS溶解均匀,之后加入4kg粒度为100目左右的磁铁粉,水浴加热使温度一直保持在30℃下继续搅拌2h;接着缓慢滴加浓氨水约2L,通过碱催化诱发TEOS水解形成SiO2,随着反应的进行会出现pH的降低。过程中用pH计在线测定,通过滴加氨水控制反应在pH始终不低于11.5的条件下反应2h,直到观察pH不出现降低现象为止。之后滴加纯水2L,在搅拌下反应5~10h。反应结束后从反应釜底出料,采用磁场进行固液分离,并将固体物料用清水冲洗,直到出水pH降低至9。所获得固体物料记为FeSi1。
(2)预先配制2L浓度1mol/L的硫酸溶液和4L浓度为5wt%的硅酸钠溶液备用。在反应釜中加入纯水8L,在搅拌条件下加入固体物料FeSi1,开启水浴加热系统使温度达到90℃;采用双股并流方法同时滴加硅酸钠溶液和硫酸溶液,用pH计在线测定,控制整个滴加过程中体系pH=9.5,直到全部硅酸钠溶液滴加完毕,停止滴加硫酸溶液,使体系在搅拌条件下反应5~10h。反应结束后从反应釜底出料,采用磁场进行固液分离,并将固体物料用清水冲洗,直到出水pH降低至7~8。将固体物料放入鼓风烘箱内120℃下彻底干燥,所获得固体物料记为FeSi2。
(3)在干燥无水的大烧杯内加入1.5L异丙醇和1L钛酸四丁酯,用台式搅拌器搅拌使溶解均匀。将干燥固体物料FeSi2加入大烧杯中,搅拌1h后,停止搅拌静置3h。之后用干燥的抽滤装置进行固液分离,滤出液体收集于干燥瓶中密封,量体积约为0.8L。固体材料放置在真空烘箱内,在50℃下抽真空,脱除异丙醇。获得的固体物料记为FeSiTi1。
(4)将固体物料FeSiTi1放入高压锅,在高温蒸汽作用下进行气相水解2~4h,在材料表面生成TiO2包覆层。反应后的物料放入鼓风烘箱内在120℃下彻底烘干。获得的固体物料记为FeSiTi2。
(5)重复以上(3)和(4)步骤2次,以提高材料表面TiO2的包覆量,第2次和第3次吸附混合溶液体积约为2L。
(6)在反应釜中加入5L纯水和10L浓度为1mol/L的盐酸,在搅拌下加入亚铁氰化钾5kg,搅拌使溶解均匀。在反应釜内加入固体物料FeSiTi2,并在30℃下浸泡进行48h,期间每隔3~4h搅拌30min。反应结束后用抽滤装置进行固液分离,滤液收集于洁净的试剂瓶中。所获固体物料用清水冲洗直到出水为浅绿色或无色,之后放入鼓风烘箱内于120℃干燥彻底,样品记为M-PTH。
图2为样品M-PTH对Cs+离子的吸附等温线,结果表明:M-PTH对Cs+的吸附比斜发沸石和丝光沸石更有利,当溶液中Cs+的平衡浓度从0.006mg/L增大到1.959mg/L时,M-PTH对Cs+的平衡吸附容量从0.014mg/mg增大到了0.070mg/mg;而在同样的范围内,两种沸石材料对Cs+的平衡吸附容量只从0.004mg/mg增大到0.044mg/mg。
图3为三种材料对Cs+的去除率以及M-PTH的zeta电位在不同pH下的变化情况,MPTH在很宽的pH值范围内(pH=1~11)都能保持对Cs+有90%以上的去除率,尤其是在偏酸性的pH值范围内(pH=1~5),M-PTH的去除率要明显高于两种沸石材料。而在pH值高于11之后,三种材料对Cs+的去除效率都明显降低。M-PTH的zeta电位图表明在测量的pH值范围内(pH=2~10)吸附剂表面带负电,从而促进了Cs+在吸附剂表面双电层内的扩散以及与H+的交换;在强碱性(pH>11)溶液中M-PTH材料可能会发生分解,从而导致其对Cs+的吸附效果下降。
图4为待处理放射性废液中共存的非放阳离子(0.01mol/L)对实施例1所获M-PTH吸附Cs+性能的影响,从中可见相同价态的阳离子对最大吸附容量的影响基本相同;一价离子与二价离子对吸附容量的影响也基本相同,均降为0.058mg/mg左右;相比于一价离子和二价离子,三价离子对吸附容量的影响稍大,降至0.035mg/mg左右。
图5是实施例1所获M-PTH材料在不同投加量下的Cs+吸附动力学曲线,从中可见相同吸附剂投加量下M-PTH对Cs+的吸附速率明显大于沸石,这也意味着在吸附去除Cs+的过程中,M-PTH能适应较小的固液相接触时间和较大的水处理量。
图8是采用两路两级序批式反应器测定的M-PTH动态除铯性能,从结果中可见在初始阶段,第一级的去污因子大于1000,随着处理批次的增加,第一级的去污因子逐渐减小,意味着一级出水浓度逐渐增大,此时第二级反应器发挥的作用越来越明显,因此,第二级的去污因子随着处理批次的增加而增大;两级反应器的总体去污因子在处理70批原水之后仍能保持大于1000。在满足去污因子大于1000的条件下,处理70L原水产生的富集Cs+的废弃吸附剂仅40g(约10mL),处理量与废物产生量的体积比为7000。
实施例2:磁核包覆型亚铁氰化钛钾吸附剂的工业化制备
在生产线上进行磁核包覆型亚铁氰化钛钾吸附剂的放大制备。
选择采用工业磁粉或自制磁粉为载体;
(1)第一次包硅:首先在1号反应釜中依次加入无水乙醇和正硅酸乙酯(TEOS),二者体积比为8:1,开启搅拌桨20min使TEOS溶解均匀,在连续搅拌下从固体加料口加入磁铁粉,开启油浴加热系统使温度达到30℃,并继续搅拌2h;接着通过自动流加系统加入浓度为1mol/L的NaOH溶液,并通过pH自动连锁控制,使反应体系在pH不低于11.5的条件下反应1h;之后通过自动流加系统加入纯水,水/乙醇体积比为1∶8,在搅拌下反应5~10h。反应结束后打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,固体物料用清水冲洗,直到离心机出水pH降低至9。所获得固体物料记为FeSi1;滤出废液用精馏装置进行水/乙醇分离,获得95%的回收乙醇可以重复应用。
(2)第二次包硅:预先配制1mol/L的硫酸溶液和浓度为5wt%的硅酸钠溶液备用。在2号反应釜中加入纯水,在搅拌条件下加入步骤(1)所获的固体物料FeSi1,使固液相质量比为1∶2。开启油浴加热系统使温度达到90℃,采用自动流加系统两路同时分别滴加硅酸钠溶液和硫酸溶液,用自动pH控制使整个滴加过程中体系pH=9.5,直到全部硅酸钠溶液滴加完毕,停止滴加硫酸溶液,使体系在搅拌条件下反应5~10h。反应结束后打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,固体物料用清水冲洗,直到离心机出水pH降低至7~8,滤出碱性废液用桶收集。将固体物料放入鼓风烘房烘至彻底干燥,所获得固体物料记为FeSi2。
(3)吸附包钛过程:在严格干燥无水的3号反应釜中加入乙醇和钛酸四丁酯,二者体积比为1.5:1,开启搅拌器使溶解均匀。将干燥的固体物料FeSi2加入到反应器中,搅拌1h后,停止搅拌静置3h。之后打开反应釜底的出料口阀门,物料进入反应釜下面的离心机进行固液分离,排出的液体用干燥的桶收集。获得的固体材料放置在真空烘箱内,在50℃下抽真空,脱除溶剂乙醇。获得的固体物料记为FeSiTi1。
(4)气相水解包钛过程:将步骤(3)获得的固体物料FeSiTi1均分放入电热蒸箱内的多个托盘中,开启蒸箱,在高温和一定的压力下使水蒸气与钛酸四丁酯发生水解反应2~4h,在材料表面生成TiO2包覆层。反应后的物料放入鼓风烘箱内在120℃下彻底烘干。获得的固体物料记为FeSiTi2。
(5)重复以上(3)和(4)步骤2次,以提高材料表面TiO2的包覆量。
(6)吸附剂包覆过程:在4号反应釜中加入纯水,在搅拌的条件下采用自动流加系统加入浓盐酸,使盐酸的浓度为0.5~1.0mol/L;继续加入亚铁氰化钾,搅拌均匀后使其浓度达到30wt%。在反应釜内加入固体物料FeSiTi2,并在30℃下浸泡进行24~48h,期间每隔3~4h搅拌30min。待反应结束后,打开反应釜底的出料阀门,物料进入反应釜下面的离心机进行固液分离,溶液收集在一个洁净的储液桶中。所获得的固体物料用清水冲洗,直到离心机出水为浅绿色或无色。将固体物料放入鼓风烘房烘至彻底干燥,所获得固体物料即为目标的磁核包覆型亚铁氰化钛钾吸附剂。
所获得吸附剂经X射线荧光分析可知,Si的包覆量为6.4wt%,Ti的包覆量为6.2wt%,经傅里叶变换红外光谱检测(参见图9),材料表面形成了良好的亚铁氰化物活性结构。
图10为采用两路两级序批式反应器测定吸附剂对Cs+的去除性能。每个批次处理原水20升,处理量为100L/h。从结果中可见,随着处理批次的增加,第一级的去污因子逐渐减小,第二级的去污因子逐渐增大,两级反应器的总体去污因子逐渐降低,在处理约30个批次原水之后降为1000,处理约70个批次原水之后降为100。在满足去污因子大于1000的条件下,按处理30个批次计算,处理600L原水产生的富集Cs+的废弃吸附剂为800g(一级反应器中吸附剂投加量,约200mL),处理量与废物产生量的体积比为3000。在满足去污因子大于100的条件下,相应体积比为7000。
上面通过具体实施例的方式对本发明的各个方面进行了解释,但是本领域技术人员可以理解:本发明并不仅限于上面所描述的具体实施方式,本领域技术人员对本文所公开的各种具体技术手段、原料、工艺步骤等所做的等效替换和以及各种技术手段、原料、工艺步骤等的组合都在本发明的范围之内。
为了进一步举例说明本发明的某些方面,本发明还具体地提供了如下的一些非限制性实施方式:
1.一种用于制备磁核包覆型亚铁氰化物吸附剂的方法,其特征在于,所述方法包括以下步骤:
(1)在磁粉的存在下,使有机硅源的醇溶液在不低于11.5的pH下进行液相水解,从而在所述磁粉表面包覆SiO2,由此得到中间体FeSi1;
(2)在所述FeSi1的存在下,使硅酸盐进行液相水解,从而在所述FeSi1表面进一步包覆SiO2,如此得到中间体FeSi2;
(3)在无水条件下,通过吸附的方法在FeSi2表面负载钛源,从而得到表面负载有钛源的中间体FeSiTi1;
(4)在高温高压条件下,使所述FeSiTi1中的钛源与水蒸气反应进行气相水解,从而得到表面包覆有TiO2层的中间体FeSiTi2;
(5)通过将中间体FeSiTi2与酸性亚铁氰化物溶液接触使亚铁氰化物包覆所述FeSiTi2,再经后处理得到所述磁核包覆型亚铁氰化物吸附剂。
2.如实施方式1所述的制备方法,其特征在于,所述磁粉具有小于120目(大于120微米)的颗粒尺寸,优选具有在80-120目(120微米-180微米)范围内的颗粒尺寸。
3.如实施方式1所述的制备方法,其特征在于,在所述步骤(1)中,引入碱,优选地,所述碱选自由氨、NaOH、Na2CO3及其组合组成的组。
4.如实施方式1所述的制备方法,其特征在于,在所述步骤(1)中,所述有机硅源选自由硅烷甲酯、硅烷乙酯及其组合组成的组。
5.如实施方式1所述的制备方法,其特征在于,在所述步骤(1)中,相对于所述磁粉的重量,所述有机硅源的用量在5wt%至10wt%的范围内。
6.如实施方式1所述的制备方法,其特征在于,在所述步骤(1)中,所述有机硅源与所述醇的体积比在1:5至1:10的范围内。
7.如实施方式1所述的制备方法,其特征在于,在所述步骤(1)中,所述醇选自由乙醇、异丙醇、丙醇及其组合组成的组。
8.如实施方式1所述的制备方法,其特征在于,在所述步骤(2)中,引入无机酸,优选地,所述无机酸选自由盐酸、硫酸或其组合组成的组。
9.如实施方式1所述的制备方法,其特征在于,在所述步骤(2)中,所述硅酸盐选自由碱金属硅酸盐、碱土金属硅酸盐或其组合组成的组,优选是硅酸钠。
10.如实施方式8所述的制备方法,其特征在于,在所述步骤(2)中,所述硅酸盐和所述无机酸同时滴加。
11.如实施方式1所述的制备方法,其特征在于,在所述步骤(3)中,所述钛源包括钛酸四烷基酯和四氯化钛,优选选自由钛酸四甲基酯、钛酸四乙基酯、钛酸四丙基酯、钛酸四丁基酯或其组合组成的组,更优选是钛酸四丁基酯。
12.如实施方式1所述的制备方法,其特征在于,在所述步骤(3)中,相对于所述磁粉的重量,所述钛源的用量在5wt%至10wt%的范围内。
13.如实施方式1所述的制备方法,其特征在于,所述步骤(3)包括将所述FeSi2浸渍在钛源的醇溶液中。
14.如实施方式13所述的制备方法,其特征在于,在所述步骤(3)中,所述钛源与所述醇的体积比在1:2至1∶4的范围内。
15.如实施方式14所述的制备方法,其特征在于,在所述步骤(3)中,所述醇选自由乙醇、异丙醇、丙醇及其组合组成的组。
16.如实施方式1所述的制备方法,其特征在于,在所述步骤(4)中,气相水解在100℃~120℃的温度和0.05~0.08MPa的压力下实施。
17.如实施方式1所述的制备方法,其特征在于,在所述步骤(5)中,使亚铁氰化物包覆所述FeSiTi2包括,在无机酸的存在下,将中间体FeSiTi2浸泡在酸性亚铁氰化物溶液中一定时间,亚铁氰化物与TiO2层进行表面反应生成钛离子稳定的亚铁氰化物。
18.如实施方式17所述的制备方法,其特征在于,在步骤(5)中,所述无机酸的浓度介于0.5~1.0mol/L之间。
19.如实施方式17所述的制备方法,其特征在于,在步骤(5)中,亚铁氰化物水溶液的浓度介于15wt%至40wt%之间。
20.如实施方式17所述的制备方法,其特征在于,在步骤(5)中,所述磁粉与纯水的质量比介于1:3至1:5之间。
21.如实施方式17所述的制备方法,其特征在于,在步骤(5)中,所述无机酸选自由盐酸、硫酸或其组合组成的组。
22.如实施方式1或17所述的制备方法,其特征在于,在步骤(5)中,所述亚铁氰化物选自由亚铁氰化钠、亚铁氰化钾、或其组合组成的组,优选亚铁氰化钾。
23.如实施方式2所述的制备方法,其特征在于,所述磁粉是80-120目范围内的工业级Fe3O4磁粉。
24.实施方式1至23中任意一项所述的方法得到的磁核包覆型钛离子稳定的亚铁氰化物吸附剂。
25.一种磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其包含:
作为内核的颗粒尺寸小于120目(大于120微米)的磁粉颗粒;
包覆所述磁粉颗粒的二氧化硅层;以及
包覆所述二氧化硅层的钛离子稳定的亚铁氰化物层。
26.如实施方式25所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其特征在于,所述磁粉颗粒具有80-120目(120微米-180微米)的颗粒尺寸。
27.如实施方式26所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其特征在于,所述磁粉是80-120目范围内的工业级Fe3O4磁粉。
28.如实施方式25所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其特征在于,所述二氧化硅层的致密度使得所述磁粉在酸性溶液中不会溶出。
29.如实施方式25-28中任意一项所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其特征在于,相对于所述磁粉的重量,Ti的含量大于5wt%。
30.如实施方式25-28中任意一项所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂,其特征在于,所述亚铁氰化物选自由亚铁氰化钠、亚铁氰化钾、或其组合组成的组,优选亚铁氰化钾。
31.如实施方式24或者实施方式25-30中任意一项所述的磁核包覆型钛离子稳定的亚铁氰化物吸附剂用于吸附放射性同位素Cs离子和/或吸附稳定性同位素Cs离子的用途。
32.如实施方式31所述的用途,用于去除或分离或提取放射性同位素Cs离子和/或去除或分离稳定性同位素Cs离子。
33.如实施方式31或32所述的用途,其特征在于,所述放射性同位素Cs离子和/或稳定性同位素Cs离子存在于pH在1-11的范围内的水性体系中。
34.如实施方式31或32所述的用途,其特征在于,所述放射性同位素Cs离子和/或稳定性同位素Cs离子存在于pH在1-5的范围内的水性体系中。
35.一种生产磁核包覆型钛离子稳定的亚铁氰化物吸附剂的生产装置,其特征在于,所述生产装置包括反应釜、离心机、真空烘箱、电热蒸箱和鼓风烘房。
36.如实施方式35所述的生产装置,其特征在于,所述离心机设置在所述反应釜下方。
37.如实施方式35或36所述的生产装置,其特征在于,所述反应釜设置有在线pH控制系统和自动进样系统,这两个系统之间设定有一定的连锁控制关系。
- 还没有人留言评论。精彩留言会获得点赞!