一种双支路实现间隔微液滴融合功能的微通道的制作方法
皮升至纳升体积范围的微液滴因具有无交叉污染等优势,它在血液检测、蛋白质结晶、细胞分析、聚合酶链反应(PCR)、疾病诊断、颗粒合成等生化领域呈现出巨大的应用潜力。
背景技术:
微流控芯片技术(Microfluidics)又被称为芯片实验室(Lab-on-a-chip),能在一个几平方厘米的微小芯片上集成传统的生物和化学实验室的基本功能,包括样品分离、制备、化学反应、检测等操作。液滴微流控技术是微流控芯片技术的一个重要分支。微液滴因具有通量高,无交叉污染等优势,其在喷墨打印、微混合、DNA分析、材料合成、蛋白质结晶等领域呈现出巨大的应用潜力。一些基于微液滴的生化反应,如微纳颗粒合成,过程中需要将两种不同的液滴融合在一起,以便获得较好的混合反应效果。由此,液滴的可控融合已成为一项重要的液滴微流控技术,对于在液滴内实现多步反应十分重要。
技术实现要素:
一种双支路实现间隔微液滴融合功能的微通道,本发明是基于上游分叉下游又汇合的双支路微通道流动阻力差异原理,设计了实现间隔微液滴相融合的微通道。
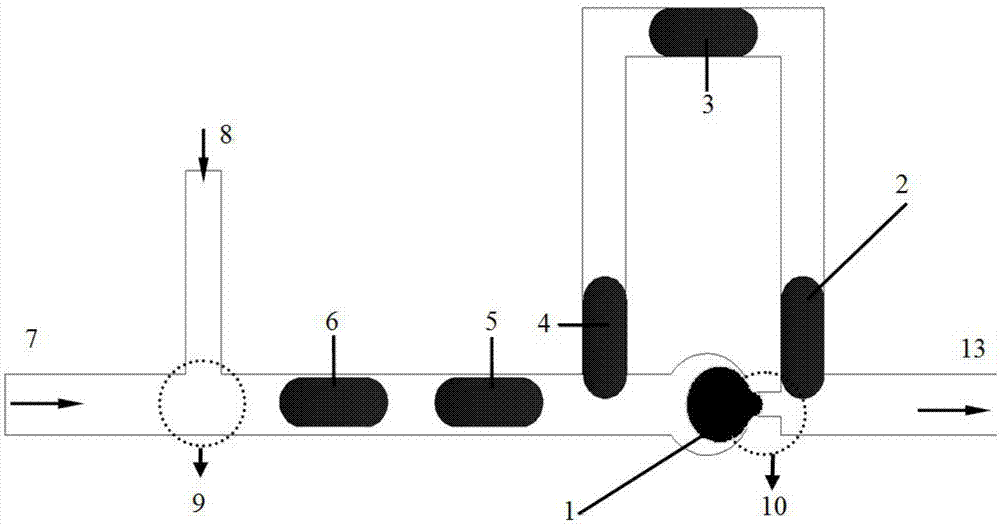
一种双支路实现间隔微液滴融合功能的微通道,该微通道包含两个功能单元,一是微液滴生成单元9,该微液滴生成单元9为用以生成微液滴的T型通道;另一是实现微液滴融合单元10,该微液滴融合单元10由上游分叉下游又汇合的两支路通道构成。微液滴生成单元9同水相入口8和油相入口7相连接。微液滴融合单元10是由第一支路11和第二支路12构成的上游分叉下游又汇合的双支路结构组成,第一支路11和第二支路12两连接组成口字形结构,第一支路11为底部的水平结构,第一支路11的端部设有球形端口,第二支路12为倒U形结构。
工作时,离散相(水相)通过注射泵与水相入口8相连,连续相(油相)通过注射泵与油相入口7相连,出口13通过PE管连接至液池。在连续相施加给离散相的剪切力和压力共同作用下,在液滴生成单元9处生成大小均一的微液滴,这为液滴后续融合做“前期准备”。此后,第一支路11与第二支路12内的液滴发生不同融合行为。
第一液滴1在第一支路11内运动,第一支路11的流阻R11小于第二支路12的流阻R12;运动的液滴增加了该支路的流阻R11,且增加至超过第二支路12的流阻R12;第二液滴2则选择第二支路12运动。由于第一液滴1沿第一支路11球形端口的“缩颈”结构使得第一路径11的流阻R11变大,以至第三液滴3和第四液滴4继续运动至第二支路12。此时第二支路12中第二液滴2、第三液滴3、第四液滴4大大增加了R12,以至第五液滴5运动至第一支路11和第二支路12的上游交汇处时,第一液滴1被连续相“挤压”至第一支路11和第二支路12的下游交汇处同第二液滴2发生融合。为了使液滴在第二支路12的运动速度快于第一支路11,并将第二支路12的宽度减小,以达到第一支路液滴1和第二支路液滴2在下游交汇处融合的目的。发生第一次融合后,第一液滴1完全离开第一支路支路11,由后续的第五液滴5“补充”至第一支路11。第五液滴5和第三液滴3进行第二次融合,第六液滴6和第四液滴4进行第三次融合。此后,如此重复进行,第二支路12同第一支路11的液滴发生三次融合即第一次为相邻液滴融合,第二次和第三次为间隔一个液滴融合。因此,该发明的微通道不仅可实现相邻液滴融合而且还可以实现间隔液滴融合的功能,这将为微液滴发生复杂的生化反应提供非常便利的条件。
微通道通过软光刻工艺加工而成,所采用材料为聚二甲基硅氧烷(PDMS)。
本发明在不增加额外驱动或者控制装置的基础上,利用简单两支路交汇结构不仅可实现相邻液滴融合而且还可以实现间隔液滴融合的功能,同已有的实现液滴融合功能的微通道相比,该发明结构简单且可灵活实现液滴的可控融合功能,这将为微液滴发生复杂的可控的生化反应提供保障。
附图说明
图1实现微液滴融合的双支路微通道结构示意图
图2双支路局部结构放大示意图
图3实现微液滴融合的双支路微通道实际工作示意图
具体实施方式
结合附图3对本发明的微通道工作过程和效果进行进一步详细说明和验证。
微通道实际工作主要包含水相入口、油相入口、液滴生成单元、融合单元和出口。工作时注射泵分别通过PE管同水相入口和油相入口相连接。出口通过PE管连接至废液池。为了证明该发明可以实现间隔液滴融合的功能,图3给出了实验效果图,图(a)和图(b)分别为两液滴融合前后实验实际效果图。由图3可知,该发明可以达到预期的融合效果。
- 还没有人留言评论。精彩留言会获得点赞!