从含硒的工业气体中除去硒的组合物及其方法与流程
本发明整体涉及用于从工业气体中处理和除去硒的硫化亚铁悬浮液。
背景技术:
来自燃煤锅炉的污染物排放是重要的环境问题。这些污染物可以以气体形式(例如,烟囱排放物)、液体形式(例如,处理或未处理的废水污水排出物)或固体形式(例如,煤炭燃烧副产物)进入环境。
硒向环境的释放,特别是作为包含在废水污水排出物中的污染物的释放是特别关注的。
尽管硒是人和动物的营养中的必需元素,但是如果以高水平摄入,则硒可能变得有毒。因此,燃煤锅炉、采矿活动和工业来源的废水污水排放中硒的浓度和总量受到严格的政府法规控制。
硒通常以“亚硒酸根”离子和“硒酸根”离子的形式存在于水介质,如废水污水中。出于本公开的目的,当提及亚硒酸根离子时,术语“SeO32-”、“Se4+”或“四价硒”可互换使用,而当提及硒酸根离子时,术语“SeO42-”、“Se6+”或“六价硒”可互换使用。
可以通过将干燥吸附剂注入工业气流中并随后在颗粒物质控制装置(如静电除尘器或织物过滤器)中收集该吸附剂来从工业气体中捕获和除去某些污染物(例如,汞)。这些系统统称为“干式洗涤器”系统。在已知的干燥吸附剂中,已经最积极地研究并在商业上最广泛地使用了基于活性碳和钙的吸附剂。
目前,在燃煤和燃油工厂中,用于汞排放控制的干式洗涤器系统中最常用的吸附剂是将粉末状活性炭(PAC)注入到烟气流中。
已在干式洗涤器系统中用于汞除去的其它吸附剂的实例包括Biermann等人的美国专利申请公开第2003/0103882号和Lovell等人的美国专利第6,719,828中公开的那些,其公开了层状吸附剂,如具有夹在粘土层之间的金属硫化物的粘土的制备。通过注入干燥吸附剂用于汞捕获的其它专利是基于通过使化合物在基底上或之中形成薄层来制备吸附剂。这些类型的吸附剂使用了基底,其包含溶胶-凝胶衍生物,如Edmiston的美国专利第7,790,830号;Edmiston的美国专利第8,119,759号;和Edmiston的美国专利第8,217,131号中所公开的;介孔载体上的自组装单层,如Pate的美国专利第8,088,283号;Shankle的美国专利第8,412,664号;和Krogue等人的美国专利第8,197,687号中所公开的;层状硅酸盐,如Lovell等人的美国专利第7,288,499号中所公开的,或各种其它基底。除此之外,Yang等人的美国专利第7,575,629号和Yang等人的美国专利第7,704,920号中公开了,任何在金属盐与硫化物盐接触而在基底表面上形成水不溶性金属硫化物时可以释放金属离子的金属盐可以用于生产用于汞除去的有效的干燥吸附剂。
生产和使用复杂且昂贵的上述干燥吸附剂对于从工业气体中除去某些污染物(pollutant)或致污物(contaminant)可能是有效的,然而这些干燥吸附剂在从工业气体中除去硒中未显示出有效。
用于降低毒性气体污染物或其它致污物向环境排放的另一类洗涤器系统通常称为“湿式洗涤器”。在湿式洗涤器系统中,通过(1)用洗涤器液体喷洒含有污染物或致污物的工业气体,(2)通过将工业气体分散或推动通过洗涤器液体,或(3)通过任何其它方式将污染物或致污物从工业气体传输到洗涤器液体中,来将含有污染物或致污物的工业气体与洗涤液或浆液(洗涤器液体)接触以产生气-液界面以将污染物或致污物从工业气体传输到洗涤器液体中。
在这些湿式洗涤器系统中使用的洗涤器液体的组成根据工业气体中目标除去的污染物或致污物而改变。例如,在用于除去酸(例如,HCl、HSO3)或二氧化硫(SO2)的湿式烟气脱硫装置中,主要使用含有石灰石(CaCO3)、钙或镁的氧化物或氢氧化物或其它混合物的浆液液体。
尽管可以设计和运行特定湿式洗涤器系统来除去一种或多种目标污染物,但是其还可能同时以不同有效性程度从工业气体中除去其它污染物或致污物。这些污染物或致污物之一是硒。
由于湿式洗涤器系统中的环境是动态的,因此从工业气体中除去任何污染物或致污物是复杂的。从工业气体中成功除去污染物或致污物必须考虑进入湿式洗涤器系统之前工业气体中存在于污染物或致污物之间的各种平衡条件。
一旦含有污染物或致污物的工业气体进入湿式洗涤器系统,则从工业气体中成功除去这些污染物或致污物是基于同时控制工业气体中的污染物或致污物与存在(或产生)于整个湿式洗涤器系统,并且特别是湿式洗涤器液体本身中的固相、液相和气相之间相互作用导致的物理和化学反应。
一旦从工业气体中除去硒并且现在硒处于湿式洗涤器液体中,则从湿式洗涤器液体中除去硒是更复杂的,因为从湿式洗涤器液体中除去硒所需的物理、化学和氧化还原条件可能不同(或完全相反)于处理或除去包含在湿式洗涤器液体中的其它目标污染物或致污物所需的那些条件。
从洗涤器液体中处理或除去硒特有的一个复杂因素在于湿式洗涤器液体中的硒物质主要是硒酸根离子或者硒酸根络合物,将其从洗涤器液体中除去是更困难且昂贵的。
通常,一旦洗涤器液体不再对于它们的预期目的有效或有用,则处理洗涤器液体以降低包含在洗涤器液体内的任何污染物或致污物的浓度或总质量负荷,并将处理的湿式洗涤器液体从洗涤器液体废水处理系统排放到环境中。
从变得溶于湿式洗涤器系统中的湿式洗涤器液体的水相的工业气流除去污染物或致污物的一种机制依赖于污染物或致污物的“离子”或“氧化”相的吸收(absorption)。例如,工业气相中的金属阳离子(“M”)可以溶于湿式洗涤器液体中,并且如果带相反电荷的阴离子(“X”)也存在于湿式洗涤器液体中,则形成“MX”络合物或MX沉淀。在这些情况下,吸收是通过由大量的主体(液)相吸收(吸纳)存在于工业气流中的原子、分子或离子的现象。
另一种除去机制是“吸附(adsorption)”,其是其中来自气体、液体或溶解的固体的原子、离子或分子附着(结合)到另一固体表面的物理现象。通过吸附结合的确切性质取决于所涉及的物质,但是吸附过程通常分类为物理吸附(弱范德华力的特性)、化学吸附(共价键的特性)或一些其它类型的静电引力。换言之,吸收是通过溶解到另一相(通常为液体)中来从一个相中除去本来存在于该相中的物质的过程,其与吸附相反,吸附是原子、离子或分子从主体液体或气体中积累到固体表面上。
已经应用了各种处理技术,包括反浸透、离子交换、凝固、吸附和生物处理来从水介质(例如,废水、洗涤器液体)除去硒。在它们之中,已经广泛研究了使用Fe-、Mn-或Al-(氧化物)氢氧化物的吸附,因为水性硒物质在这些矿物表面上的吸附在确定硒的移动性和生物利用度中起重要作用。尽管这些处理方法可能能够将Se2-和Se4+两者降低至5μg/L以下,但是它们不适合于处理或除去燃煤发电厂或还含有高浓度硫酸根离子(SO4(2-))的其它工业活动来源的废水中的Se6+,因为硫酸根离子的理化性质类似于Se(+6),因而硫酸根离子的竞争吸附显著降低了从这些类型废水中除去Se(+6)的效率。
通过(1)主要基于在吸附剂上吸附的干式洗涤器系统中的吸附剂,和(2)在排放到环境之前,处理或除去含硒的湿式洗涤器液体废水,本发明克服了从工业气体中除去硒的缺点。
技术实现要素:
根据随着对它们的说明的进行将变得显而易见的本发明的各个特征、特性和实施方式,本发明提供了从工业气体除去硒的方法,该方法包括(comprise of)以下步骤:
将含硒的工业气体与:
硫化亚铁颗粒的液体悬浮液,或
已经涂覆在基底上或浸透到基底中的硫化亚铁颗粒的液体悬浮液接触;以及
使包含在工业气体中的硒与硫化亚铁颗粒的液体悬浮液,或已经涂覆在基底上或浸透到基底中的硫化亚铁颗粒的液体悬浮液反应,并且通过以下至少一种方法除去:
i)将硒吸附到硫化亚铁悬浮液中的硫化亚铁的表面上或已经涂覆在基底上或浸透到基底中的硫化亚铁颗粒的液体悬浮液上;
ii)将硒吸附到(氢氧化铁)氧化铁或绿锈(green rust,铜绿)上;和
iii)通过与硫化亚铁颗粒的硫化物部分反应形成作为沉淀物的一硒化铁(FeSe)的吸收。
本发明还提供了对使用湿式气体洗涤器系统从工业气体中除去硒的方法的改进,其中湿式气体洗涤器系统含有洗涤器液体并配置为用洗涤器液体接收和洗涤工业气体,该改进包括提供作为洗涤器液体的硫化亚铁颗粒的液体悬浮液。
本发明还提供了在湿式洗涤器系统中使用的湿式洗涤器液体组合物以从工业气体中除去硒,其包括硫化亚铁颗粒的液体悬浮液。
本发明还提供了在干式洗涤器系统中使用的吸附剂组合物以从工业气体中除去硒,其包括已涂覆或浸透到基底中的硫化亚铁颗粒的液体悬浮液。
附图说明
将参考附图描述本发明,附图仅作为非限制性实例提供,其中:
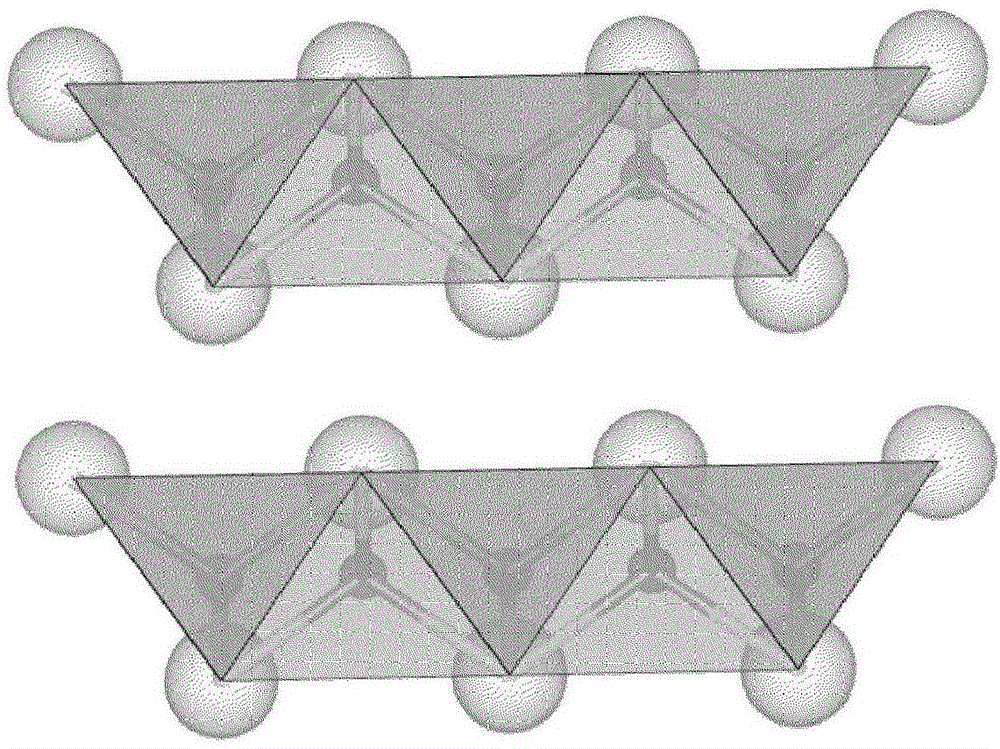
图1a和1b分别表示FeSm(四方硫铁矿)的“单个晶胞”或“片层”。
图2是在25℃下与FeSm平衡的溶解的Fe2+的总活度,与FeSm平衡的溶解的Fe(II)的总活度的图表,其中粗线为在25℃下与FeSm平衡的溶解的Fe2+的总活度,以及细线为pH依赖和非pH依赖反应的Fe2-活度得到的10-3和10-5M的总溶解S2-浓度,Σ[S2-]。来源:“The solubility of FeS”.David Rickard.Geochimica et Cosmochimica Acta 70(2006)5779-5789.
图3是根据本发明的一个实施方式使用湿式洗涤器系统从工业气体中除去硒的方法的图解。
图4是根据本发明的一个实施方式在干式洗涤器系统内从工业气体中除去硒的方法的图解。
图5是根据本发明的一个实施方式在干式洗涤器系统内从工业气体中除去硒的方法,其中将工业气体通过干式洗涤器吸附剂的图解。
具体实施方式
本发明提供一种硫化亚铁悬浮液、一种用于生产硫化亚铁悬浮液的方法和用于使用硫化亚铁悬浮液从工业气体中处理和除去硒的方法。
本发明的硫化亚铁悬浮液是微溶的胶态悬浮液,其可以用于增强湿式洗涤器系统的硒除去能力,并且如果用作吸附剂涂覆在基底上或浸透到基底中时,用于增强干式洗涤器系统的硒除去能力。
通过复杂化学反应、沉淀、共沉淀和表面吸附的组合,本发明的硫化亚铁悬浮液可以有效地从工业气体中除去硒,同时防止或最小化硒酸根离子的形成。
可以通过将亚铁离子源(例如,FeCl2)、硫离子源(例如,NaHS)和碱性源(例如,NaOH)结合在一起来产生本发明的碱性硫化亚铁悬浮液。根据本发明不同的实施方式,在洗涤烟气期间,可以控制/调节亚铁离子源、硫离子源和碱性源的摩尔比,从而控制/调节不溶性硫化亚铁(FeS)的浓度。
碱性硫化亚铁悬浮液可以用于任何类型的湿式气体洗涤器系统中的湿式洗涤器液体,其包括但不限于文丘里洗涤器(venturi scrubber)、喷淋洗涤器(spray scrubber)、旋流喷雾室(cyclone spray chamber)、锐孔口洗涤器(orifice scrubber)、冲击洗涤器(impingement scrubber)、填充床洗涤器(packed bed scrubber)和喷射鼓泡反应器(JBR)。
在本发明的过程中,本发明人发现含有微溶的硫化亚铁的液体悬浮液(或者含有涂覆在基底上或浸透到基底中的微溶的硫化亚铁的液体悬浮液)通过吸收和吸附机理有效并且经济地除去硒,同时延迟或防止低价态的硒氧化为硒酸根(Se6+)。
尽管亚铁离子源(例如,FeCl2)、硫离子源(例如,NaHS)和碱性源(例如,NaOH)的各种摩尔比的组合,但是所得含有FeS颗粒的碱性液体悬浮液提供了从工业气流除去硒的经济且有效的试剂。
硫化亚铁(有时称为四方硫铁矿、无序四方硫铁矿和无定形硫化亚铁)根据以下反应解离:
取决于其中形成硫化亚铁的环境,溶度积常数(Ksp)将在1×10-3至1×10-5之间。由于这比FeSe的溶度积(Ksp=3×10-19)高很多数量级,因此在可以在工业气体或湿式洗涤器系统的洗涤器液体中存在(或形成)的硒离子(Se2-)的存在下,FeSe的形成是有优势且快速的。通过提供处于微溶的硫化亚铁固体颗粒的形式的亚铁离子(Fe2+),仅化学计量的量的硫化物将进入沉淀任何Se2-所必需的洗涤器液体中。当与现有技术相比时,本发明的优势是减轻了“过量”或“不足”计量的沉淀Se2-+所必需的二价铁的要求量的可能性。
本发明还使得能够调节亚铁离子源、硫离子源和碱性源的摩尔比来产生用于实时、连续地从工业气体中除去硒的硫化亚铁悬浮液。调节悬浮液中不溶性FeS的浓度的能力、通过调节原料的化学计量、pH或两者的组合来产生具有指定浓度的亚铁离子(或硫离子)的硫化亚铁悬浮液的能力两者皆提供了目前尚不可能或预见的产生从工业气体除去硒的硫化亚铁颗粒的悬浮液的独特灵活性。
在本发明的过程中,本发明人出乎意料地发现含有微溶的硫化亚铁(FeS)的液体悬浮液可以通过吸收和吸附机理有效且经济地除去Se2-、Se2+和Se4+离子,同时最小化或限制硒酸根(Se6+)离子的形成。
尽管亚铁离子源(例如,FeCl2)、硫离子源(例如,NaHS)和碱性源(例如,NaOH)的各种摩尔比的组合,但是所得含有FeS颗粒的碱性液体悬浮液提供了适合于从工业气流除去硒的经济且有效的湿式洗涤器液体添加剂,或者在涂覆在基底上或浸透到基底中时,用作吸附剂以增强在干式洗涤器系统中从工业气体除去硒的能力。
硫化亚铁(有时称为四方硫铁矿、无序四方硫铁矿和无定形硫化亚铁)通过以下反应解离:
图1a和1b表示FeSm(四方硫铁矿)的“单个晶胞”或“片层”。在这些图中,注意到每个铁离子是“四向”配位至每个硫离子的。
取决于含有硒的环境,硒可以作为硒离子(Se2-)存在。据信用于将Se2-结合至FeSm(四方硫铁矿)的机制涉及Se2-吸附至FeSm表面(3),作为FeSe沉淀(4),或两者的组合:
在本文中,吸附意在涵盖导致在FeSm-液体界面的Se2-积累(例如,低表面覆盖度下的表面络合)和高表面覆盖度下的表面沉淀的所有过程。
在其它环境条件中,硒可以作为亚硒酸根离子(Se4+)存在。研究已证明通过中间体(如Se0),FeS将Se4+还原为较不可溶的物质,如Se2-,随后以类似于FeSe或FeSex的结构形成固相。(XPS Analysis of Sorption of Selenium(IV)and Selenium(VI)to Mackinawite(FeS).Dong Suk Han,Bill Batchelor,and Ahmed Abdel-Wahab,Environmental Progress&Sustainable Energy.2013(Vol.32,No.1),p.84-93)。
其它研究表明取决于pH,亚硒酸根的吸收和吸附机制是不同的。(Sorption of selenium(IV)and selenium(VI)to mackinawite(FeS):Effect of contact time,extent of removal,sorption envelopes.Dong Suk Han,Bill Batchelor,and Ahmed Abdel-Wahab.Journal of Hazardous Materials 2011(186)451–457.还参见Selenite Reduction by Mackinawite,Magnetite and Siderite:XAS Characterization of Nanosized Redox Products.Andreas C.Scheinots and Laurent Charlet.Environmnetal Science and Technology 2008(42)1984-1989)。由于当pH从6.6降低至4.4时,四方硫铁矿的溶解度增加了约四个(4)数量级(参见图2),因此在这两个不同的pH值(FeSe在pH 4.4;Se0在pH 6.3)下的四方硫铁矿的存在下,最终的氧化还原反应产物表明最终反应产物显著受四方硫铁矿的溶解度影响。因此,基于非均质表面反应假设的可能的反应途径使得这些研究人员得到以下结论:
pH 4.4下的反应:
6≡Fe2++HSeO3-+FeS+6H+→6≡Fe3++FeSe+HS-+3H2O (5)
pH 6.3下的反应:
4≡Fe2++HSeO3-+5H+→4≡Fe3++Se(s)+3H2O (6)
在较高的pH下(例如,pH=7至8),Se4+的除去更好地由BET等温线(除去速率开始很快,随后相对较缓)更好地描述,可以推断在这些较高的pH下发生了一些多层吸附。
硒还可以作为硒酸根离子(Se6+)存在,特别是在洗涤器液体中。尽管上述研究表明与初始Se6+浓度无关,在第一小时期间可以从溶液中除去大于百分之十(10%)的Se6+,但此后Se6+的额外除去快速减缓。与Se4+相比,Se6+吸纳的较低程度和较慢速率可以是由于Se6+对FeS表面较低的亲合度。在pH>7时,这可能发生,因为FeS表面带负电荷,并且与将大部分作为具有一个负电荷的阴离子存在的Se4+相比,Se6+将作为带有两个负电荷的阴离子存在。
在燃煤锅炉的大多数洗涤器液体中普遍存在的竞争性离子,如硫酸根(SO42-)的效果对通过FeS的Se4+的除去具有可忽略的影响,然而,出人意料地存在一些较高水平的硫酸根导致Se6+除去增加的迹象。Se6+除去的增强可以是由另一种中间固相产物,如绿锈(GR)的缔合所造成的。
绿锈(GR)是混合的Fe2+/Fe3+(氧化物)氢氧化物,具有以下通式:
[Fe2+(1-x)Fe3+x(OH)2][x/n An-:mH2O] (7)
其中“An-”是位于水中间层的阴离子(例如,SO42-、CO32-、Cl-)以提供电子电荷平衡。
由于Se4+比Se6+更易于还原,因此Fe和Se物质的标准状态氧化还原电势表明Fe2+应能够将Se6+还原成Se0或Se2-。总反应可以写成:
Se6+O42-+8Fe2++9H+→8Fe3++HSe-+4H2O (8)
然而,以上方程仅描述了根据pH的水相中的反应,并且更重要地,没有解释任何固体表面反应或动力学(需要时间)。尽管Fe2+主要作为“水合离子”[Fe(H2O)6]存在于酸性溶液中,但它在pH>4.0下在Fe3+存在下将作为绿锈沉淀,或者在pH>8.0下不存在Fe3+的情况下作为Fe(OH)2沉淀。
因此,理论上可以通过水相中的均相反应,通过吸附和还原在GR表面上或者通过共沉淀和还原在GR中间层中的非均相反应,或者通过这些机制的任意组合在pH 4.0下发生Se6+还原。
在酸性溶液(pH=3.5)中用四方硫铁矿(FeSm)处理的硒酸根(Se6+)(其中水性Fe2+主要作为水合离子[Fe(H2O)6]存在并且没有任何GR沉淀)表明在160小时的反应内,Se6+未还原,并且Se6+保持为未络合的SeO42-。然而相反地,水合Se6+在pH>5.0下制备的样品中是“不稳定的”。在这些条件下,“混合价态的”GR最初沉淀,并且在pH 7.0下随时间转化为“Fe3+-氧化物”(四氧化三铁(magnetite)和碱式氧化铁(lepidocrocite)),并且在pH 9.5下仅转化为四氧化三铁。当存在于绿锈中的Fe2+完全氧化成Fe3+时,形成四氧化三铁和碱式氧化铁。GR及其氧化产物的存在强烈影响水相和固相Se物质形成,并因此影响潜在的去除效率。当硒浓度低于对Se固体已知的饱和极限时,则可以将沉淀排除出用于Se除去的主要机制。因此可以在GR的中间层内、外表面上或两者中发生硒酸根(Se6+)转化。中间层取代的Se6+向Se0的还原促进了消耗GR的四氧化三铁形成,并且还原的Se0原子在GR颗粒表面上形成簇。GR的快速沉淀动力学和灵活晶体结构可能使其能够在多种地球化学条件下形成。举例来说,具有硫酸根的中间层的GR可以促进硒酸根(Se6+)还原并且总结为以下反应:
(“Abiotic Selenium Redox Transformations in the Presence of Fe(II,III)Oxides”.S.C.B.Myneni,T.K.Tokunaga,G.E.Brown Jr.Science 1997(278),1106-1109)。
图3是根据本发明的一个实施方式用于从工业气体中除去硒的方法的图解。如图3中所示,将亚铁离子源(例如,FeCl2)34、硫离子源(例如,NaHS)35和碱性源(例如,NaOH)36结合在一起以产生硫化亚铁颗粒的碱性液体悬浮液。硫化亚铁颗粒的碱性液体悬浮液在湿式气体洗涤器系统31中用作湿式洗涤器液体添加剂,将含硒的工业气流32通过湿式气体洗涤器系统31以产生不含硒的工业气流33。
图3所示的方法使得在处理期间控制/调节亚铁离子源、硫离子源和碱性源的摩尔比,使得实时控制/调节湿式洗涤器液体添加剂中的微溶的硫化亚铁(FeS)的浓度。在替代选择中,可以在装置外制备微溶的硫化亚铁悬浮液,将其传输至湿式洗涤器系统位置所在地,然后注入到湿式洗涤器液体中。
图4是根据本发明的另一个实施方式用于从工业气体中除去硒的方法的图解。如图4中所示,将亚铁离子源(例如,FeCl2)44、硫离子源(例如,NaHS)45和碱性源(例如,NaOH)46结合在一起以产生硫化亚铁颗粒的碱性液体悬浮液。然后,将硫化亚铁颗粒的碱性液体悬浮液涂覆在基底42上或浸透到基底42中。然后,将涂覆或浸透的基底41注入含硒的工业气体43中以产生不含硒的工业气流44。
图5是根据本发明的另一个实施方式用于从工业气体中除去硒的方法的图解。如图5中所示,将亚铁离子源(例如,FeCl2)54、硫离子源(例如,NaHS)55和碱性源(例如,NaOH)56结合在一起以产生硫化亚铁颗粒的碱性液体悬浮液。然后,将硫化亚铁颗粒的碱性液体悬浮液涂覆在基底52上或浸透到基底52中。然后,将涂覆或浸透的基底51置于盒或容器57中,将含硒的工业气体53通过其中以产生不含硒的工业气流58。
尽管已参考上述说明中的具体方式、材料和实施方式描述了本发明,但是本领域技术人员可以容易地确定本发明的基本特征,并且可以在不背离如上所述和所附权利要求中所说明的本发明的精神和范围的情况下做出多种改变和修改以适合于多种用途和特性。
- 还没有人留言评论。精彩留言会获得点赞!