(R)‑1‑(1‑苯乙基)硫脲单侧修饰的Fe‑Anderson型杂多酸催化剂、制备方法及其应用与流程
本发明涉及催化技术领域,尤其是不对称选择催化领域,具体来说是一种(R)-1-(1-苯乙基)硫脲单侧修饰的Fe-Anderson型杂多酸催化剂、制备方法及其应用。
背景技术:
手性催化剂是催化合成手性物质的关键。有机小分子催化具有催化条件温和、催化效率高、对环境友好等优点,并且有机小分子催化剂可以应用到很多金属催化剂不能够涉猎的催化领域,因此引起了广泛的关注,成为近十年来不对称合成研究的热点领域。它是通过和反应底物以不稳定的共价键可逆地形成活性中间体或通过若相互作用,如氧键、范德华力或离子对等活化反应底物。虽然具有众多的优点,但也存在着催化剂的用量较高、且不能回收再利用等缺点,因此,寻找一种绿色、高效、可回收利用的催化剂值得化学工作者的进一步研究。
多金属氧酸盐作为酸催化剂,在众多反应中表现出良好的催化性能,是一种新型的高效的多功能催化剂,即有酸催化性能,又具有氧化还原催化性能,且稳定性很好,既可作均相反应,也可作非均相反应,甚至可作相转移催化剂,对环境无污染,对设备腐蚀作用小,是一类很有前景的绿色、环保催化剂,广泛应用在催化化学、分析化学、药物化学、电化学、食品化学、光化学和石油化学等领域,具有广阔的应用前景。
从1826年Berzelius报道的第一个多酸化合物开始,迄今为止已有近200年的历史,随着合成技术的不断发展和科研工作者的不懈努力,层出不穷的多酸化合物被报道,研究比较多的主要包括Keggin结构(1:12A系列)、Sliverton结构(1:12B系列)、Anderson结构(1:6系列)、Dawson结构(2:18系列)、Waugh结构(1:9系列)等。设计与合成具有高活性、高选择性、高稳定性、可循环利用的多酸催化剂是多酸化学家一直不懈追求的目标,自1927年,以多酸为催化剂催化丙烯水合制取异丙醇反应在日本实现工业化以后,越来越多的科研工作者投入到多酸催化领域的研究工作中Mizuno、Hill、李灿、奚祖威、高爽、胡长文、吴传德、罗三中、刘术侠、薛岗林、郭伊荇、王晓红等在该领域均有出色工作。自从手性多金属氧酸盐被成功合成以后,人们便开始了手性多酸在不对称催化领域的探索。手性多金属氧酸盐集多酸与手性材料的各种优异性能于一身。其独特的可溶性类矿物金属-氧化物结构,为手性的非生命起源学说及无机固体中手性传递的探索提供了理想的模型;其高的负电性,可调的酸碱性、氧化还原活性及纳米尺寸,更为多功能非线性光学、纳米材料、立体选择性催化以及医药等新材料的设计、合成带来了新的希望。
尽管,部分非对称修饰的Anderson型多金属氧酸盐已经可以合成,但由于其较难分离和产率较低,对于非对称修饰的Anderson型多金属氧酸盐的报道还是较少,尤其是水溶性的非对称修饰的Anderson型多金属氧酸盐。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了一种以常见的非贵金属Fe为中心的(R)-1-(1-苯乙基)硫脲单侧修饰的Anderson型杂多酸催化剂、制备方法及其应用,本发明能够较高产率的得到单侧修饰的Fe-Anderson型杂多酸催化剂,该催化剂可以解决现有价格昂贵、手性有机小分子催化剂活性较低、用量高且不易回收利用等问题,可用于苄胺类化合物的自身氧化偶联反应。
本发明中,从有机小分子催化剂的设计思路出发,创新性地提出利用“酸-碱”协同催化策略,以具有潜在催化活性的手性有机小分子作为前躯体,通过有机修饰等方法,巧妙地使有机小分子与高Bronsted酸性的缺位多阴离子结合,构筑手性多酸材料的思路,并在实现这一思路的同时,有机修饰的多酸不但保留了多酸原有的结构,而且拓展了多酸的研究领域,使其在催化、药物和功能材料方面具有潜在应用价值。以期望实现高的催化活性和高的对映选择性催化的同时,还可以解决昂贵催化剂以及回收重复利用等问题。
本发明的技术方案具体介绍如下。
本发明提供一种(R)-1-(1-苯乙基)硫脲单侧修饰的Fe-Anderson型杂多酸催化剂的制备方法,具体步骤如下:
1)以钼酸铵为起始原料,与硫酸铁在pH=2~5之间反应生成Fe-Anderson型杂多酸母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O;
2)Fe-Anderson型杂多酸母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O与三羟甲基氨基甲烷回流条件下反应后,再和四丁基溴化铵TBAB在室温条件下反应得到氨基单侧修饰的Fe-Anderson型多金属氧酸盐;
3)以(R)-(+)-1-苯基乙胺为原料合成(R)-1-(1-苯乙基)异硫氰酸酯;
4)将步骤2)得到的氨基单侧修饰的Fe-Anderson型多金属氧酸盐与步骤3)得到的(R)-1-(1-苯乙基)异硫氰酸酯反应得到(R)-1-(1-苯乙基)硫脲单侧修饰的Fe-Anderson型杂多酸催化剂。
本发明中,步骤1)中,硫酸铁和钼酸铵的摩尔比为1:1~1:2,反应温度为80℃~100℃,反应时间为30min~1h。
本发明中,步骤1)中,用盐酸或者其他酸调节pH。
本发明中,步骤2)中,Fe-Anderson型杂多酸母体(NH4)3(H2O)6[FeMo6O18(OH)6]·2H2O与三羟甲基氨基甲烷的摩尔比为1:2~1:5;Fe-Anderson型杂多酸母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O与四丁基溴化铵TBAB的摩尔比为1:3~1:5。
本发明中,步骤4)中,采用非质子极性溶剂为溶剂;氨基单侧修饰的Fe-Anderson型多金属氧酸盐和(R)-1-(1-苯乙基)异硫氰酸酯的摩尔比为1:3~1:5,反应温度为45~55℃,反应时间为2~3天。
本发明提供一种上述的制备方法得到的(R)-1-(1-苯乙基)硫脲单侧修饰的Fe-Anderson型杂多酸催化剂。
本发明还提供一种上述(R)-1-(1-苯乙基)硫脲单侧修饰的Fe-Anderson型杂多酸催化剂在苄胺类化合物自身氧化偶联反应生成亚胺反应中的应用。自身氧化偶联反应时,以苄胺类化合物为原料,在氧气作用下,在60℃~100℃的温度、以乙腈为溶剂的条件下,加入(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂反应,得到亚胺。
优选的,(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂的投加量为苄胺类化合物的0.5mol%~5mol%。
和现有技术相比,本发明的有益效果在于:本发明在具有高对称性的杂多酸母体单侧引入有机小分子,使有机部分与无机的多阴离子有机地结合为一个整体,从而产生协同作用获得更多新颖的性质。该催化剂具有反应条件温和、环境友好、高效、高对应选择性和可回收利用等优点,且以常见的非贵金属Fe为中心,更具有推广利用的价值,可适用于工业化生产。
附图说明
图1是本发明的合成路线图。
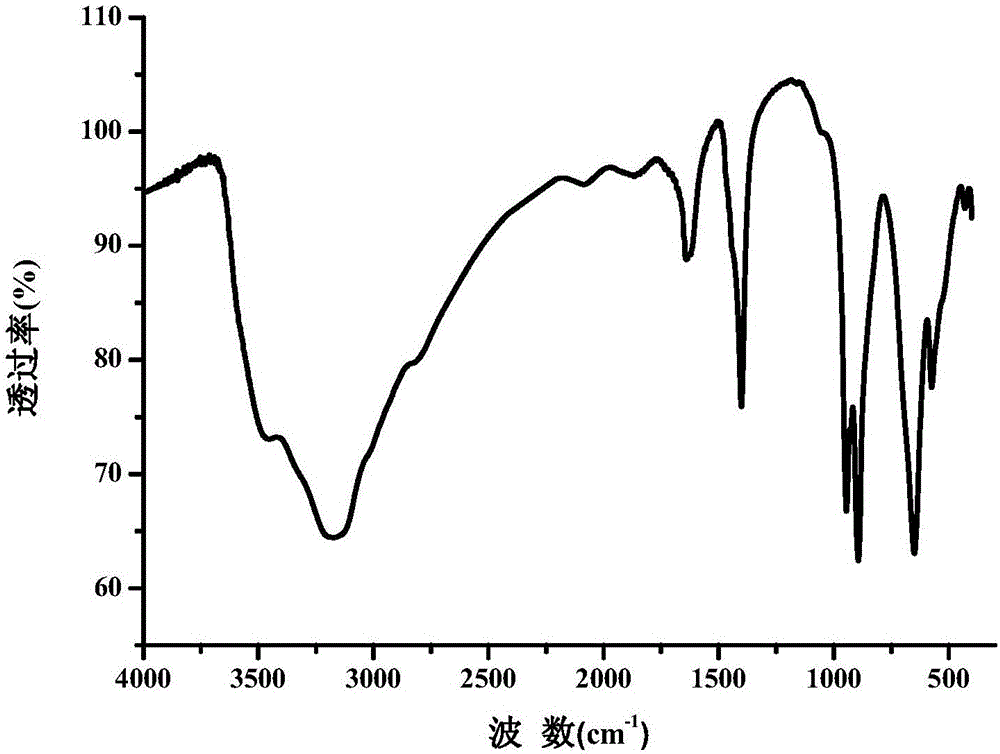
图2是母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O的红外谱图。
图3是(R)-1-(1-苯乙基)异硫氰酸酯的核磁谱图。
图4是单侧氨基修饰的Fe-Anderson型多金属氧酸盐的红外谱图。
图5是(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂的核磁谱图。
具体实施方式
以下采用实施例来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题,并达成技术效果的实现过程能充分理解并据以实施。
图1是本发明的合成路线图。
实施例1
Fe-Anderson型杂多酸母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O的制备
取15.9g(12.9mmol)钼酸铵加到250ml去离子水中,充分搅拌得到透明液体,之后滴加浓盐酸,将体系的PH调到2~4。加热至沸腾,缓慢加入3.2g(9.3mmol)硫酸铁固体,搅1h,有少量固体产生,停止搅拌,趁热抽滤,得到棕红色液体,放置于室温下,静置48h,重结晶一次,得到白色固体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O,收率为80.3%。
母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O的红外谱图如图2所示。
实施例2
(R)-1-(1-苯乙基)异硫氰酸酯的制备
在干燥的反应容器中加入(R)-(+)-1-苯基乙胺(0.606g,5mmol),用20mL醇溶解,随后分别缓慢加入加CS2(0.1142g,15mmol)和三乙胺(0.506mg,5mmol),在室温搅拌反应1h后,随后在0℃条件下加入二碳酸二叔丁酯(Boc2O)(1.091mg,5mmol)和4-二甲氨基吡啶(DMAP)(18mg,0.15mmol),在室温搅拌反应2h后(在搅拌的过程有气体产生,应注意放气减压),可获得0.7451g(R)-1-(1-苯乙基)异硫氰酸酯。收率为91.3%。
(R)-1-(1-苯乙基)异硫氰酸酯的核磁谱图数据如图3所示。
1H NMR(501MHz,CDCl3)δ7.27(dt,J=12.3,7.7Hz,5H),4.82(q,J=6.7Hz,1H),1.58(d,J=6.8Hz,3H).
实施例3
单侧氨基修饰的Fe-Anderson型多金属氧酸盐的制备
取1.5g(1mmol)母体(NH4)3(H2O)6[FeMo6O18(OH)6]·25H2O用10ml去离子水中溶解,搅拌得到浅黄色溶液后,缓慢加入0.2g(1.9mmol)三羟甲基氨基甲烷,加热回流,反应进行24h后,在室温条件下将0.9g(3.0mmol)TBAB加入反应体系中,立即得到大量微黄色沉淀即粗产物,抽滤得到浅黄色液体,放置得到结晶,即Fe-Anderson型多酸[TBA]3{[NH2C(CH2O)3]FeMo6O18(OH)3}。
单侧氨基修饰的Fe-Anderson型多金属氧酸盐的红外谱图如图4所示。
实施例4
(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂的制备
将有机单侧氨基修饰[TBA]3{[NH2C(CH2O)3]FeMo6O18(OH)3}5.1g(0.3mmol)用5mL的DMF在50℃条件下溶解后,加入(R)-1-(1-苯乙基)异硫氰酸酯0.20g(1.4mmol),维持50℃搅拌条件下,反应48h,乙醚氛围中得到浅黄色晶体,即获得(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂。
(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型杂多酸催化剂的核磁谱图数据如图5所示。
1H NMR(501MHz,DMSO)δ7.90(s,2H),7.22(d,J=52.0Hz,5H),2.99(d,J=136.8Hz,23H),1.52(s,24H),1.23(d,J=43.5Hz,24H),0.89(s,36H).
应用实施例
(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型多酸催化苄胺类化合物的自身氧化偶联反应
在干净的反应管中加入0.086g(0.05mmol)(R)-1-(1-苯乙基)硫脲修饰的Fe-Anderson型多酸催化剂和0.53g(5mmol)苄胺类化合物,再加入6ml乙腈作为溶剂,最后在反应管上加一个氧气球,反应24h,取4ml乙醇加入反应体系,离心使催化剂沉降,再加入2ml乙醇再次分离催化剂,过滤,得到催化剂,真空干燥。反应体系经萃取后,柱层析分离得到亚胺化合物,得到产品0.93g,收率为97%。为了考察反应底物的普适性,我们拓展了一系列的底物,分别选取了吸电子和供电子取代基的一级胺,催化的产物及收率结果见表1。
以苄胺的自身氧化偶联做模板反应,回收得到的催化剂直接用于下一个反应(苄胺的自身氧化偶联反应)。催化剂回收利用所得到的结果见表2。
表1Fe-Anderson型多酸催化苄胺的自身氧化偶联反应实验结果。
表2催化剂回收利用的实验结果
所有上述的首要实施这一知识产权,并没有设定限制其他形式的实施这种新产品和/或新方法。本领域技术人员将利用这一重要信息,上述内容修改,以实现类似的执行情况。但是,所有修改或改造基于本发明新产品属于保留的权利。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!