一种微流控芯片及其制备方法和应用与流程
本发明涉及一种芯片及其制备方法和应用,尤其是涉及一种微流控芯片及其制备方法和应用。
背景技术:
微流控,是一种精确控制和操控微尺度流体,尤其特指亚微米结构的技术。通过在微尺度下流体的控制,在20世纪80年代,微流控技术开始兴起,并在DNA芯片,芯片实验室,微进样技术,微热力学技术等方向得到了发展。微流控分析芯片最初在美国被称为"芯片实验室"(lab-on-a-chip),在欧洲被称为"微整合分析芯片"(micrototal analytical systems),它是微流控技术(Microfluidics)实现的主要平台,可以把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程。有着体积轻巧、使用样品及试剂量少,且反应速度快、可大量平行处理及可即用即弃等优点的微流控芯片,在生物、化学、医学等领域有着的巨大潜力,并已逐渐发展成为一个生物、化学、医学、流体、电子、材料、机械等多学科交叉的崭新研究领域(Whitesides,G.M.,Nature2006,442,368-373)。
MIT Technology Review杂志发布的2015年度十大突破技术,液体活检荣登榜单,这预示着液体活检技术强大的发展前景和潜力。液态活检这一概念最早在1974年由Sorrells等提出(Sorrells R.B.,J.Ark.Med.Soc.1974;71(1):59-62.)。液体活检目前主要的检测对象包括四个:循环肿瘤细胞(CTC)、肿瘤外泌体(exosome)、循环肿瘤DNA(ctDNA)和肿瘤相关蛋白标志物等;它们来源于肿瘤组织,存在于血液,可以提示肿瘤发展进程及抗药性等信息,指导个体化精准治疗。与现有肿瘤检测方法相比,液态活检无侵入性、可频繁多次检测及快速反应能力均体现出显着的优势(胡琨,等.临床药物治疗杂志.2016,14(4):1-7.)。
无论是检测CTC、ctDNA还是exosome,首要的工作都必须分离获取他们。强生公司的Cell Search循环肿瘤细胞检测系统,是全球第一个也是唯一经过美国食品药品监督管理局(FDA)和中国国家食品药品监督管理总局(CFDA)批准,用于恶性肿瘤疾病管理的检测CTC的商业化产品。该系统分离CTC主要是基于免疫磁珠分离法。其缺点是:分离效率不高、得到的是死细胞、无法对CTC进行分子生物学分析。循环肿瘤DNA(ctDNA)和肿瘤相关蛋白标志物目前主要是依赖化学试剂分离法,面临着分离的纯度和浓度不高的问题。外泌体的分离方法多为离心法、化学试剂沉降法和免疫磁珠法,同样存在着多种问题,如步骤繁琐、耗时耗力、外泌体遭到破坏外、分离效率等。目前,无论是商品化的技术还是大量科技文献多报道的方法,都还只是针对这四个检测对象中的其中一个检测对象进行分离。肿瘤是一种复杂的疾病,如何提高肿瘤检测的准确性是医学临床所面对的一大难题。对于液体活检技术而言,必须改变传统的依赖检测单一对象的做法,针对多靶标的联合检测是液体活检技术在肿瘤检测领域的未来发展方向。
技术实现要素:
为了得到针对多靶标的联合检测样品,本发明人研究出了一种微流控芯片。该微流控芯片包括封装层和基底层,还包括设置在封装层和基底层之间的多孔膜层和支持层;封装层与多孔膜层相接,基底层与支持层相接;封装层上设置有封装层入口、封装层微流控通道和封装层出口,使得液体能够从封装层入口流入封装层微流控通道并从封装层出口流出;多孔膜层上设置有通孔,使得液体能够从封装层入口和/或封装层微流控通道流入该通孔;支持层上设置有支持层入口、支持层微流控通道和支持层出口,使得液体能够从上述通孔流入支持层入口,并经支持层微流控通道从支持层出口流出。其中,通孔的数量为M个,M为整数,M≥1。
进一步地,多孔膜层和支持层的数量均为N层,N为整数,N≥1;多孔膜层和支持层从上到下交替排列。
进一步地,N≥2;从上到下多孔膜层上的通孔的孔径依次缩小。
进一步地,N≥2;从上到下,支持层上的支持层入口的长度依次增大,多孔膜层上的通孔的个数依次增多,多孔膜层的大小依次增大。
进一步地,封装层的材质是聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)、环氧树脂、玻璃、硅片或者塑料。
进一步地,多孔膜层的材质是氮化硅(SiN)、碳化硅(SiC)、二氧化硅(SiO2)或高分子聚合物。
进一步地,多孔膜层的通孔的孔径大小是10nm~20μm。
进一步地,多孔膜层的厚度是10nm~10μm。
进一步地,支持层的材质是聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)、环氧树脂、玻璃、硅片或者塑料。
进一步地,基底层的材质是聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)、环氧树脂、玻璃、硅片或者塑料。且基底层上无孔洞。
本发明还公开了一种如上所述的微流控芯片的制备方法。该方法采用氧等离子体键合法、高温热压法、化学黏合剂粘合法中的一种或者多种将微流控芯片的各相邻层之间进行密封。
本发明涉及上述微流控芯片在食品卫生、环境监测、药物开发、生物化学、微化工、战场生物侦测领域的应用。
本发明还涉及一种含有上述微流控芯片的临床诊断试剂盒、设备或者器材。
本发明所提供的微流控芯片及其制备方法与现有技术相比,具有操作简单、省时省力、综合成本较低等优点,尤其是一次操作,能同步分离不同大小物质的特点,可大大提高后续分析的效率。因此,在临床诊断、食品卫生、环境监测、药物开发、生物化学、微化工、战场生物侦测等领域有很好的应用前景。
附图说明
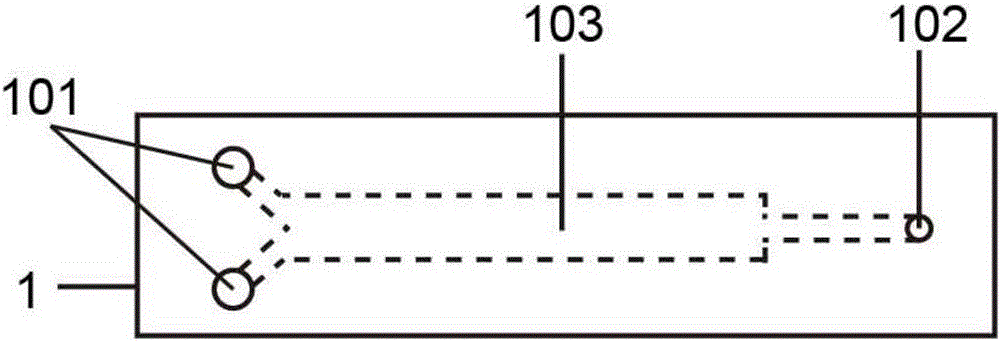
图1是本发明的一个具体实施方式中的封装层的俯视透视图。
图2是图1中的封装层的纵向剖面图。
图3是本发明的一个具体实施方式中的基底层的俯视透视图。
图4是图3中的基底层的纵向剖面图。
图5是本发明的一个具体实施方式中的微流控芯片的俯视透视图。
图6是图5中的微流控芯片的纵向剖面图。
图7是本发明的一个具体实施方式中的多孔膜层的俯视透视图。
图8是图7中的多孔膜层的纵向剖面图。
图9是本发明的一个具体实施方式中的支持层的俯视透视图。
图10是图9中的支持层的纵向剖面图。
具体实施方式
下面结合附图对本发明做进一步地说明。
如图1和2所示,封装层1的结构中含有封装层入口101、封装层出口102和封装层微流控通道103,且三者相互连通,液体能够从封装层入口101进入,流经封装层微流控通道103,从封装层出口102出去。
如图3和4所示,基底层2为板状结构,其上无孔洞。
如图5和6所示,此微流控芯片含有三层多孔膜层和三层支持层。为便于区分,从上到下将三层多孔膜层分别命名为第一多孔膜层3、第二多孔膜层5和第三多孔膜层7;从上到下将三层支持层分别命名为第一支持层4、第二支持层6和第三支持层8。
图6显示,从上到下依次为封装层1、第一多孔膜层3、第一支持层4、第二多孔膜层5、第二支持层6、第三多孔膜层7、第三支持层8和基底层2。
以第一多孔膜层3为例,介绍多孔膜层的结构。如图7和8所示,第一多孔膜层3的厚度为H,第一多孔膜层3上有多个通孔301,通孔301的孔径为S。H的取值范围是10nm~10μm。通孔的孔径的取值范围是10nm~20μm。通孔的数量为M个。在图7中,M=20。在实际应用中,通孔的数量不限于20个,可以是大于等于1的任意整数个。通孔能够使得上下两层的空间连通。
以第一支持层4为例,介绍支持层的结构。如图9和10所示,第一支持层4包含支持层入口401、支持层出口402和支持层微流控通道403,且三者相互连通,液体能够从支持层入口401进入,流经支持层微流控通道403,从支持层出口402出去。
如图6所示,封装层1的封装层入口101与封装层微流控通道103和封装层出口102相连通。
封装层入口101经第一多孔膜层3的通孔301与第一支持层4的支持层入口401、第一支持层4的支持层微流控通道403以及第一支持层4的支持层出口402相连通。
第一支持层4的支持层入口401经第二多孔膜层5的通孔501与第二支持层6的支持层入口601、第二支持层6的支持层微流控通道603以第二支持层6的支持层出口602相连通。
第二支持层6的支持层入口601经第三多孔膜层7的通孔701与第三支持层8的支持层入口801、第三支持层8的支持层微流控通道803以第三支持层8的支持层出口802相连通。
第一多孔膜层3覆盖第一支持层4的支持层入口401,但不覆盖第一支持层4的支持层出口402。封装层1也不覆盖第一支持层4的支持层出口402。因此,多余的液体可以从该出口流出。
第二多孔膜层5覆盖第二支持层6的支持层入口601,但不覆盖第二支持层6的支持层出口602。第一支持层4也不覆盖第二支持层6的支持层出口602。因此,多余的液体可以从该出口流出。
第三多孔膜层7覆盖第三支持层8的支持层入口801,但不覆盖第三支持层8的支持层出口802。第二支持层6也不覆盖第三支持层8的支持层出口802。因此,多余的液体可以从该出口流出。
第一多孔膜层3的通孔301的孔径大于其下次的第二多孔膜层5的通孔501的孔径。
第二多孔膜层5的通孔501的孔径又大于其下次的第三多孔膜层7的通孔701的孔径。
封装层1与第一多孔膜层3之间通过物理或化学方法密封。
第一多孔膜层3与第一支持层4之间通过物理或化学方法密封。
第一支持层4与第二多孔膜层5之间通过物理或化学方法密封。
第二多孔膜层5与第二支持层6之间通过物理或化学方法密封。
第二支持层6与第三多孔膜层7之间通过物理或化学方法密封。
第三多孔膜层7与第三支持层8之间通过物理或化学方法密封。
第三支持层8与基底层2之间通过物理或化学方法密封。
这里的物理或化学方法密封包括氧等离子体键合法、高温热压法、化学黏合剂粘合法中的一种或者多种。
工作时,液体从封装层入口101加入,进入封装层微流控通道103,经过第一多孔膜层3的通孔301的筛选,大于该通孔301孔径的物质被保留在第一多孔膜层3上,小于该通孔301孔径的物质通过该通孔301进入第一支持层4的支持层入口401,过多的液体从封装层出口102排出。
进入第一支持层4的支持层入口401的物质流经第一支持层4的支持层微流控通道403以及经过第二多孔膜层5的通孔501孔径的筛选,大于该通孔501孔径的物质被保留在第二多孔膜层5上,小于该通孔501孔径的物质通过该通孔501进入第二支持层6的支持层入口601,过多的液体从第一支持层4的支持层出口402排出。
进入第二支持层6的支持层入口601的物质流经第二支持层6的支持层微流控通道603以及经过第三多孔膜层7的通孔701孔径的筛选,大于该通孔701孔径的物质被保留在第三多孔膜层7上,小于该通孔701孔径的物质通过该通孔701进入第三支持层8的支持层入口801,过多的液体从第二支持层6的支持层出口602排出。
进入第三支持层8的支持层入口801的物质进入第三支持层8的支持层微流控通道803,以及保留在基底层2与第三支持层8围合的空间内,多余的液体从第三支持层8的支持层出口802排出。从而实现了一次操作,同步分离不同大小物质的功能。这也使得该微流控芯片可以在临床诊断、食品卫生、环境监测、药物开发、生物化学、微化工、战场生物侦测等领域有很好的应用前景。
以上是微流控芯片含有三层多孔膜层和三层支持层的情况。事实上,微流控芯片可以是含有N层多孔膜层和N层支持层,且N≥1,N为自然数。其结构和制备方法类似于上述含有三层多孔膜层和三层支持层的微流控芯片,这里不再赘述。
以上详细描述了本发明的一个具体实施方式,仅为了说明本发明的技术构思及特点,其目的在于让本领域技术人员能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!