用于亲和色谱基质的消毒方法与流程
本发明涉及亲和色谱领域,更具体地涉及一种消毒亲和色谱基质的方法。
背景技术:
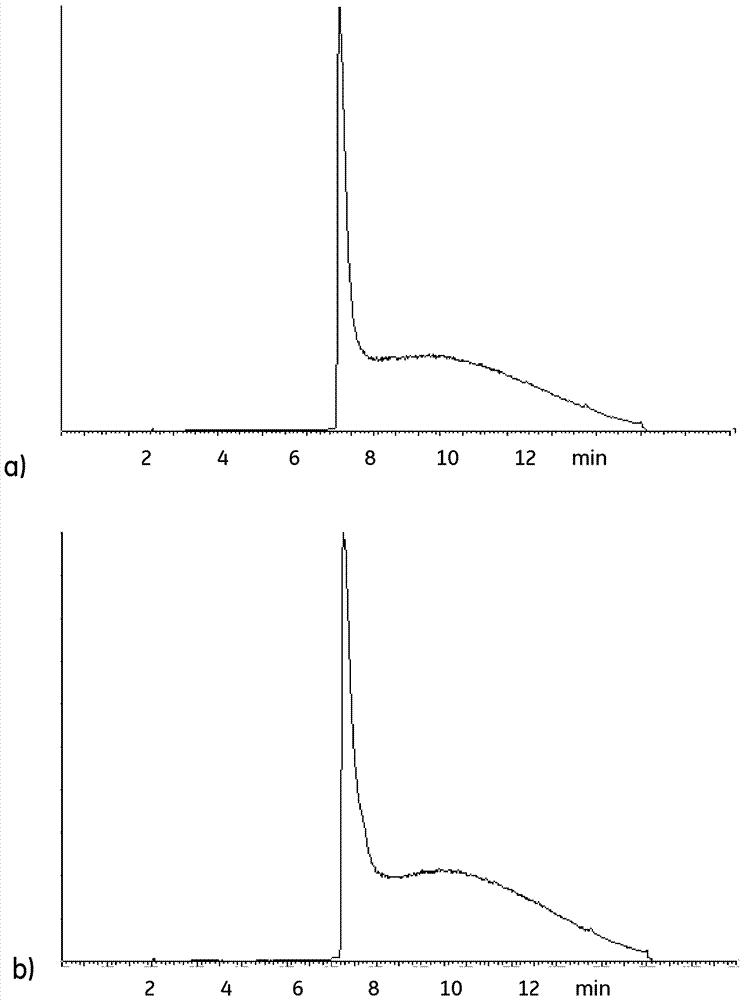
:免疫球蛋白和免疫球蛋白片段代表在全球制造或开发中的最流行的生物制药产品。这种特定治疗市场的高商业需求以及由此带来的价值,已经导致重点放在制药公司上,使它们各自制造过程的生产力最大化,同时控制相关成本和保持产品质量。亲和色谱,一般在含有葡萄球菌蛋白a或其变体的基质上,通常被用作完整免疫球蛋白分子纯化的关键步骤之一。蛋白a对免疫球蛋白fc链的高度选择性结合提供了具有杂质和污染物的极高清除率的通用步骤。类似地,含有消化链球菌蛋白l或其变体的基质可用于纯化如fabs或抗体的其它片段,如scfv、bites、结构域抗体等,它们包含κ轻链。任何生物过程的色谱应用都需要对杂质和污染物的确定去除进行全面的关注。这些杂质或污染物例如可以是在色谱过程中吸附到固定相或基质的没有被洗脱的分子,例如非期望的生物分子或微生物,包括例如蛋白质、碳水化合物、脂质、细菌和病毒。从基质中去除这些杂质/污染物通常在第一次洗脱所需的产品后进行,以便在后续使用之前使基质再生。这样的去除通常涉及一种被称为原位清洗(cip)的过程,并且通常涉及碱性溶液。此外,需要对基质进行定期的消毒,以使柱子中出现的任何微生物或芽孢失活。这通常作为一种原位消毒(sip)过程进行,涉及氢氧化钠或酸性溶液,例如含有抑菌剂如苄醇的磷酸/醋酸混合物。然而,在使用具有蛋白质类配体的基质的情况下,很难找到有效杀死微生物和芽孢而不损害配体的条件。因此,本领域中仍然需要不损害配体的有效的sip方法。技术实现要素:本发明的一方面是提供一种用于具有蛋白质类配体的亲和色谱介质的消毒和/或清洗方法,该方法基本不会损害配体的功能。这通过权利要求1所定义的方法来实现。一个优点在于可以实现细菌和芽孢的高度失活。另一优点在于与产品相关的杂质如紧密结合的非洗脱抗体或与过程相关的杂质如宿主细胞蛋白可以被除去。本发明的第二个方面是提供氧化剂溶液用于亲和色谱介质的消毒和/或清洗的用途。这通过在权利要求中定义的用途来实现。本发明更多合适的实施方案在从属权利要求中进行了描述。定义术语“抗体”和“免疫球蛋白”在此可互换使用,并且理解为也包括抗体片段、含有抗体或抗体片段的融合蛋白以及含有抗体或抗体片段的缀合物。术语“κ轻链结合多肽”和“κ轻链结合蛋白”在此分别指能够结合到抗体的κ轻链的多肽或蛋白,包括例如蛋白l以及保持所述结合特性的其任何变体、片段或融合蛋白。术语“耐氧化”在此指这样的物质,用0.1m过氧乙酸水溶液在22+/-2℃孵育24小时后,其功能保留至少80%,例如至少90%。该功能例如可以为对于靶物质例如免疫球蛋白、igg、单克隆抗体或抗体片段的结合能力。术语“亲和色谱基质”在此指具有能够结合靶物质的配体的分离基质,其中平衡解离常数kd小于约10-5m,例如在10-14到10-6m之间。在此,kd被定义为kd=[l]*[t]/[lt],其中[l]为游离配体的浓度,[t]为游离靶物质的浓度,以及[lt]为配体-靶物质复合物的浓度。大多数这样的配体都是蛋白质,例如可以包括细菌的免疫球蛋白结合蛋白质及其变体、抗体、链霉亲和素、凝集素等。所述靶物质例如可以为蛋白质,诸如免疫球蛋白。附图说明图1显示了重组蛋白l在0.1m过氧乙酸中孵育1h前(a)和后(b)的色谱图(紫外检测)。x轴表示时间,y轴表示紫外吸光度(280nm)。图2显示了针对κ链的单链骆驼抗体(kappaselect配体)在0.1m过氧乙酸中孵育1h前(a)和后(b)的色谱图(紫外检测)。x轴表示时间,y轴表示紫外吸光度(280nm)。图3显示了重组蛋白l在0.1m过氧乙酸中孵育1h前(a)和后(b)的色谱图(ms检测)。x轴表示时间,y轴表示ms响应。图4显示了针对κ链的单链骆驼抗体(kappaselect配体)在0.1m过氧乙酸中孵育1h前(a)和后(b)的色谱图(ms检测)。x轴表示时间,y轴表示ms响应。图5显示了刚性琼脂糖基础基质的压力-流量曲线,a)未经处理的基质以及b)用30mm过氧乙酸溶液孵育后的相同基质样品。具体实施方式在一方面,本发明公开了一种用于亲和色谱基质清洗或消毒的方法。该方法包含以下步骤:a)提供一种具有偶联到载体的耐氧化蛋白质类配体的亲和色谱基质。所述蛋白质类配体可以适当地包括一个或多个来源于细菌蛋白的免疫球蛋白结合域或基本上由其组成。细菌免疫球蛋白结合蛋白在本领域是公知的(参阅例如evsidorin,tfsoloveva:biochemistrymoscow76(3),295-308,2011),并且特别可以以革兰氏阳性细菌的免疫球蛋白结合蛋白为例,例如葡萄球菌蛋白a(spa,seqidno:17)、消化链球菌蛋白l(seqidno:18)和链球菌蛋白g(seqidno:19)。这些蛋白质具有共同的单链结构,其特征为在分子中存在三个不同区域:n-末端区域,包含负责蛋白质穿过细胞质膜易位然后分离的信号肽;功能区域,包括决定蛋白质功能活性的数个结构域;以及c-末端区域,表示为负责在细胞壁中锚定蛋白质的分选信号。功能区域按照单一原则构建:它们包含一种或几种类型的多肽重复。同一类型的高度同源重复可以被串联组织起来。重复的次数可以改变并决定分子量和功能活性的蛋白质异质性。用作亲和配体的这些蛋白质的重组变体通常缺乏c-末端区域,因为出于此目的是不需要的。它们也可以有不同的n-末端区域和在结构域内选择的点突变,以例如提高蛋白质的碱稳定性。b)使所述基质与含有至少一种由分子式i定义的氧化剂的消毒溶液接触,r–o–o–h(i)其中,r为氢或酰基r’-c(o)-,r’为氢或甲基、乙基或丙基。这类氧化剂包括过氧化氢h2o2、过氧甲酸hco3h、过氧乙酸ch3co3h、过氧丙酸ch3ch2co3h和过氧丁酸ch3ch2ch2co3h。消毒溶液的ph例如可以为2-12,例如2-4或2-3,其对消毒效果是有益的,且至少一种氧化剂的浓度例如可以为0.01-1.0mol/l,例如0.02-0.2mol/l、0.05-0.5mol/l或0.03-0.1mol/l。所述溶液可以含有根据分子式i的单一氧化剂或多种氧化剂的混合物,例如过氧化氢与过氧甲酸或过氧乙酸的混合物。在混合物的情况下,由分子式i定义的氧化剂的总浓度可以适当地为0.01-1mol/l,例如0.02-0.2mol/l、0.05-0.5mol/l或0.03-0.1mol/l。该溶液还可以含有羧酸,例如甲酸、乙酸、丙酸或丁酸。如果溶液含有过酸,所述羧酸可以适当地为相应的羧酸,即具有与过酸r’c(o)ooh相同的酰基r’-c(o)-的羧酸r’-c(o)-oh。接触可能包括用消毒溶液孵育基质例如1min-24h,例如5min-24h或10min-24h或基本上由其组成。所述孵育可以适当地在由基质填充的柱子中,或者在含有来自拆卸柱子的基质的单独的容器中进行,并且孵育温度例如可以为室温或15-30℃。该柱子可以为可重复使用的不锈钢柱子,但也可以是单次使用的柱子,例如由热塑性和弹性体成分制备的柱子。在后一种情况下,热塑性和弹性体材料可以适当地选择以使得它们不会因为氧化剂溶液而显著降解。在15-30℃范围之外的温度也是可能的,特别是如果进行一些实验工作来寻找合适的浓度和孵育时间。作为一级的似值,可以假设可以应用通常的arrhenius温度依赖性,使得对于温度增加10℃,孵育时间可减少2-3倍。在恒定温度下,适宜浓度和孵育时间之间的关系可以假定为近似线性的。在某些实施方案中,免疫球蛋白结合域可以来源于细菌蛋白,所述细菌蛋白选自葡萄球菌蛋白a、消化链球菌蛋白l和链球菌蛋白g,例如选自葡萄球菌蛋白a和消化链球菌蛋白l。免疫球蛋白结合域例如可以与葡萄球菌蛋白a的结构域e、d、a、b或c,与蛋白z(蛋白a的结构域b的变体)或与消化链球菌蛋白l的结构域1、2、3、4或5具有至少80%,例如至少90或95%的同源性。在本文中,免疫球蛋白包含的结构域可由选自seqidno:1-11的氨基酸序列定义,或与该氨基酸序列具有至少80%,例如至少90%或95%的序列同源性。seqidno:1-蛋白a的结构域eaqqnafyqvlnmpnlnadqrngfiqslkddpsqsanvlgeaqklndsqapkseqidno:2–蛋白a的结构域dadaqqnkfnkdqqsafyeilnmpnlneeqrngfiqslkddpsqstnvlgeakklnesqapkseqidno:3–蛋白a的结构域aadnnfnkeqqnafyeilnmpnlneeqrngfiqslkddpsqsanllaeakklnesqapkseqidno:4–蛋白a的结构域badnkfnkeqqnafyeilhlpnlneeqrngfiqslkddpsqsanllaeakklndaqapkseqidno:5–蛋白a的结构域cadnkfnkeqqnafyeilhlpnlteeqrngfiqslkddpsvskeilaeakklndaqapkseqidno:6–蛋白zvdnkfnkeqqnafyeilhlpnlneeqrnafiqslkddpsqsanllaeakklndaqapkseqidno:7–蛋白l的结构域1seeevtikanlifangstqtaefkgtfekatseayayadtlkkdngeytvdvadkgytlnikfagkektpeeseqidno:8–蛋白l的结构域2pkeevtikanliyadgktqtaefkgtfeeataeayryadalkkdngeytvdvadkgytlnikfagkektpeeseqidno:9–蛋白l的结构域3pkeevtikanliyadgktqtaefkgtfeeataeayryadllakengkytvdvadkgytlnikfagkektpeeseqidno:10–蛋白l的结构域4pkeevtikanliyadgktqtaefkgtfaeataeayryadllakengkytadledggytinirfagkkvdekpeeseqidno:11–蛋白l的结构域5ekeqvtikeniyfedgtvqtatfkgtfaeataeayryadllskehgkytadledggytinirfag在一些实施方案中,免疫球蛋白结合域可以来源于seqidno:1-11的天然结构域的已知变体,例如在以下一个或多个中描述的结构域:wo03080655a1、wo2008039141a1、ep1992692a1、ep2157099a1、ep2202310a2、ep2412809a1、ep2557157a1、ep2157099和wo2013109302a2,其所有通过引用以其全文并入本文。所述免疫球蛋白结合域可例如由选自seqidno:12-16的氨基酸序列定义,或与该氨基酸序列具有至少90%,例如至少95%或98%的序列同源性。seqidno:12–蛋白z变体(wo03080655a1)vdnkfnkeqqnafyeilhlpnlteeqrnafiqslkddpsqsanllaeakklndaqapkseqidno:13–蛋白z变体(wo03080655a1)vdakfdkeqqnafyeilhlpnlteeqrnafiqslkddpsqsanllaeakklndaqapkseqidno:14–结构域c变体(wo2008039141a1)adnkfnkeqqnafyeilhlpnlteeqrnafiqslkddpsvskeilaeakklndaqapkseqidno:15–结构域c变体(ep2557157a1)adnkfnkeqqnafyeilhlpnlteeqrnafiqelkddpsvskeilaeakklndaqapkseqidno:16–结构域c变体(wo3013109302a2)fnkeqqnafyeilhlpnlteeqrngfiqslkddpsvskeilaeakklndaqapkseqidno:17–蛋白aaqqnafyqvlnmpnlnadqrngfiqslkddpsqsanvlgeaqklndsqapkadaqqnkfnkdqqsafyeilnmpnlneeqrngfiqslkddpsqstnvlgeakklnesqapkadnnfnkeqqnafyeilnmpnlneeqrngfiqslkddpsqsanllaeakklnesqapkadnkfnkeqqnafyeilhlpnlneeqrngfiqslkddpsqsanllaeakklndaqapkadnkfnkeqqnafyeilhlpnlteeqrngfiqslkddpsvskeilaeakklndaqapkseqidno:18–蛋白l(us5965390)avenkeetpetpetdseeevtikanlifangstqtaefkgtfekatseayayadtlkkdngeytvdvadkgytlnikfagkektpeepkeevtikanliyadgktqtaefkgtfeeataeayryadalkkdngeytvdvadkgytlnikfagkektpeepkeevtikanliyadgktqtaefkgtfeeataeayryadllakengkytvdvadkgytlnikfagkektpeepkeevtikanliyadgktqtaefkgtfaeataeayryadllakengkytadledggytinirfagkkvdekpeeseqidno:19–蛋白gaqhdeavdansrgsvdaseltpavttyklvingktlkgettteavdaataekvfkqyandngvdgewtyddatktftvtekpevidaseltpavttyklvingktlkgetttkavdaetaekafkqyandngvdgvwtyddatktftvtemvtevplesta在该方法的某些实施方案中,所述配体包括来源于细菌蛋白的免疫球蛋白结合域的同源或异源多聚体或基本上由其组成。这就是说,配体包括上面所讨论的多个结构域。配体中的结构域可以是全部相同的(同源多聚体),或者它们中一个或多个可以与其它不同(异源多聚体)。除了结构域之外,配体可以包括结构域之间的接头结构、n-末端的前导或信号序列以及c-末端的尾序列。在一些实施方案中,所述配体包括葡萄球菌蛋白a或葡萄球菌蛋白a的碱稳定的免疫球蛋白结合变体。如上所述,蛋白a按次序包括五个结构域e、d、a、b、c。可以商购获得的含有葡萄球菌蛋白a配体的基质的例子包括mabselecttm和mabselectxtra(gehealthcare)、proseptm-a和prosepultraplus(merck-millipore)、absolutetm(novasep)、captivatmprimabtm(repligen)以及proteinadiamond(bestchrom)。蛋白a的碱稳定变体通常为修饰的结构域c或蛋白质z单元的同源或异源多聚体,如在例如wo03080655a1、wo2008039141a1、ep1992692a1、ep2157099a1、ep2202310a2、ep2412809a1、ep2557157a1、ep2157099和wo2013109302a2中所讨论的。可以商购获得的含有葡萄球菌蛋白a的碱稳定的免疫球蛋白结合变体的基质的实例包括mabselectsure和mabselectsurelx(gehealthcare)、eshmunotma(merck-millipore)、toyopearltmaf-rproteina(tosohbioscience)、amspheretmproteina(jsrlifesciencesinc.)以及kancapatm(kanekacorp.)。在该方法的某些实施方案中,所述配体包含消化链球菌蛋白l或消化链球菌蛋白l的碱稳定的免疫球蛋白结合变体。可以商购获得的具有蛋白l配体的基质的实例是captotml(gehealthcare)。蛋白l的碱稳定的变体在共同待审的申请pctep2015/079387和pctep2015/079389中讨论,这两者通过引用以其全文并入本文。所述配体还可以包括这样的氨基酸序列,其由选自seqidno:17-19的氨基酸序列定义,或与该氨基酸序列具有至少90%,例如至少95%或98%的序列同源性。与上面讨论的源于细菌蛋白的配体相比,发现源自抗体的配体对本发明的方法中使用的消毒溶液不稳定。对于来源于单链骆驼抗体的配体,特别是这种情况,如在例如wo0144301a1中描述。具有这种配体的基质的例子包括kappaselecttm、lambdafabselecttm、viiiselecttm和viiselecttm(均来自gehealthcare)。在一些实施方案中,该方法包括,在步骤b)之前,使所述基质与含有免疫球蛋白的溶液接触以吸附所述免疫球蛋白并随后使所述基质与洗脱溶液接触以解吸所述免疫球蛋白的步骤a’)。在步骤b)应用前,步骤a’)可以例如重复至少10次,例如至少25次,但是步骤b)也可以在步骤a’)的每个实例后应用。步骤a’)还可以包括原位清洗步骤,例如使用10-500或10-100mmol/l的碱,例如naoh作为清洗溶液。在某些实施方案中,步骤b)中活的细菌、滋养型细菌和/或芽孢的含量减少至少3log10、例如至少5log10或至少6log10。在一些实施方案中,在步骤b)之后所述基质的免疫球蛋白-或igg-结合能力为在步骤b)之前的免疫球蛋白-或igg-结合能力的至少95%、例如至少97%。基质的载体(也被称为基础基质)可以为任何适当的公知的类型,特别为耐氧化载体,例如,在22+/-2℃下用0.03m或0.1m过氧乙酸溶液24小时孵育之后压力-流量性能没有改变20%以上的载体。传统的亲和分离基质通常为有机性质的,并基于聚合物,其将亲水性表面暴露在使用的水性介质中,即暴露羟基(-oh)、羧基(-cooh)、酰胺基(-conh2,可能是n取代的形式)、氨基(-nh2,可能以取代的形式)、寡-或聚乙烯氧基基团在它们外表面上,并且如果存在,也暴露在内表面上。固体载体可以适当地为多孔的。孔隙度可以以kav或kd值(对于特定尺寸的探针分子是可用的孔体积分数)表示,该值通过反相尺寸排阻色谱法测定,例如,根据gelfiltrationprinciplesandmethods,pharmacialkbbiotechnology1991,第6-13页中所描述的方法。根据定义,kd和kav值二者总是在0-1范围内。kav值可以有利地为0.6-0.95,例如0.7-0.90或0.6-0.8,如用分子量为110kda的葡聚糖作为探针分子来测量的。这样的优点在于,该载体具有大分数的孔,能够容纳蛋白质类配体和结合到配体的免疫球蛋白,并能提供免疫球蛋白进入和离开结合位点的大量运输。蛋白质类配体可以共价偶联到载体,例如通过传统的偶联技术利用例如配体中存在的巯基、氨基和/或羧基基团将它们连接到载体上。双环氧化合物、表氯醇、cnbr、n-羟基琥珀酰亚胺(nhs)等都是公知的偶联剂。在载体和配体之间,可以引入一种称为间隔区的分子,其提高配体的可用性并促进配体与载体的化学偶联。在一些实施方案中,基质包括5-20,例如5-15mg/ml、5-11mg/ml或8-11mg/ml的与载体偶联的配体。偶联配体的量可以由偶联过程中使用的配体的浓度、使用的偶联条件和/或由使用的载体的孔隙结构来控制。一般来说,基质的绝对结合能力随偶联配体的量增加而增加,至少达到空隙被偶联配体明显阻塞的点。每毫克偶联配体的相对结合能力将在高偶联水平上降低,导致在上述给定范围内的最佳的成本-效益。在一些实施方案中,蛋白质类配体通过多点连接与载体偶联。这可以通过使用配体中的多个活性基团与载体中的活性基团反应的偶联条件来实现。通常地,多点连接可能涉及序列中氨基酸残基的多个固有的活性基团,例如在赖氨酸上的胺,与载体上的活性基团,例如环氧化合物、氰酸酯(例如来自cnbr活化)、琥珀酰亚胺酯(例如,来自nhs活化)等的反应。但是,也可能在配体的不同位置上故意引入活性基团以影响偶联特性。为了通过赖氨酸来提供多点偶联,偶联反应在其中显著部分的赖氨酸伯胺处于非质子化的亲核状态的ph下,例如在高于8.0的ph,例如高于10的ph下适当地进行。在某些实施方案中,配体通过硫醚键偶联到载体上。进行这种偶联的方法是本领域所公知的并且本领域技术人员使用标准技术和设备是容易进行的。硫醚键是柔性且稳定的,并普遍适用于亲和色谱。特别地当硫醚键在配体上通过末端或接近末端的半胱氨酸残基时,偶联配体的移动性增强,这提供了改善的结合能力和结合动力学。在一些实施方案中配体通过在如上所述的蛋白上提供的c-末端半胱氨酸进行偶联。这允许半胱氨酸巯基与载体上的亲电子基团,如环氧化物基团、卤代醇基团等高效偶联,导致硫醚桥偶联。在某些实施方案中,载体包括多羟基的聚合物,如多糖。多糖的例子包括例如葡聚糖、淀粉、纤维素、支链淀粉、琼脂、琼脂糖等。多糖是天然亲水性的并具有低程度的非特异性相互作用,它们提供了高含量的活性(可活化)羟基,而且它们对生物处理中使用的碱性清洗溶液通常是稳定的。在某些实施方案中,载体包括琼脂或琼脂糖。本发明所使用的载体可以容易地根据标准方法制备,例如反相悬浮胶凝(shjertén:biochimbiophysacta79(2),393-398(1964))。或者,基础基质为可商购产品,例如以sepharose™ff(geheathcare)的名字销售的交联的琼脂糖珠。在对消毒方法特别有利的一个实施方案中,载体为刚性交联琼脂糖。这种琼脂糖载体是高度交联的,例如根据us6602990、us7396467或us8309709中描述的方法,其通过引用以其全文并入本文。呈球形珠的形式并在2.6厘米的内径柱中填充至20厘米的床高度的刚性交联琼脂糖载体,给出了3巴背压下的水流速度v(cm/h)至少为0.14xd2,其中d为珠的体积加权的中值直径(d50,v)(以微米为单位)。刚性交联琼脂糖对在本发明的方法中使用的氧化剂来说是非常稳定的。在某些实施方案中,载体,例如多糖或琼脂糖载体,是交联的,例如以羟基烷基醚交联。产生这样交联的交联剂例如可以为表卤代醇例如表氯醇、双环氧化合物例如丁二醇二缩水甘油醚、烯丙基化试剂例如烯丙基卤化物或烯丙基缩水甘油醚。交联有利于载体的刚度并提高化学稳定性。羟烷基醚交联是碱性稳定的并且不会引起显著的非特异性吸附。或者,固体载体基于合成的聚合物,例如聚乙烯醇、聚羟基烷基丙烯酸酯、聚羟基烷基甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酰胺等。在疏水性聚合物的情况下,例如基于二乙烯基和单乙烯基取代苯的基质,基质表面通常是亲水性的以将如上定义的亲水基团暴露在周围的水性液体中。这种聚合物容易根据标准方法生产,参阅例如“styrenebasedpolymersupportsdevelopedbysuspensionpolymerization”(rarshady:chimicael'industria70(9),70-75(1988))。或者,使用可商购的产品,例如source™(geheathcare)。在另一种选择中,根据本发明的固体载体包括无机性质的载体,例如二氧化硅、玻璃、氧化锆等。在又一实施方案中,固体载体为另一种形式,例如表面、芯片、毛细管或过滤器(例如膜或深度过滤器基质)。至于根据本发明的基质的形状,在一个实施方案中,基质是多孔膜的形式。在另一可选的实施方案中,基质为珠状或颗粒形式,其可以适当地是多孔的。珠状或颗粒形式的基质可以被用作填充床或以悬浮形式。悬浮形式包括被称为膨胀床和纯悬浮物的那些,其中颗粒或珠是自由移动的。本发明的第二个方面公开了含有由分子式i定义的氧化剂的溶液用于具有偶联到载体的蛋白质类配体的亲和色谱基质的消毒的用途,r–o–o–h(i)其中,r为氢或酰基r’-c(o)-,r’为氢或甲基、乙基或丙基。如上所述,所述蛋白质类配体包括来源于细菌蛋白的一个或多个免疫球蛋白结合域或基本上由其组成。该用途可以包括如上所述的任意实施方案中的方法。此外,本发明公开了一种用于色谱基质消毒的方法,包括以下步骤:a)提供一种具有偶联到刚性交联琼脂糖载体的耐氧化配体的色谱基质,b)使所述基质与含有由分子式i定义的氧化剂的消毒溶液接触,r–o–o–h(i)其中,r为氢或酰基r’-c(o)-,r’为氢或甲基、乙基或丙基。所述配体可以为如上所述的耐氧化蛋白质类配体,但它们也可以为例如阳离子交换配体(例如含有磺丙基、磺乙基或羧甲基的配体)、阴离子交换配体(例如含有三甲基铵或二乙基氨基乙基)、疏水配体(例如含有丁基、己基、辛基或苯基)或多模式基团(例如含有与疏水基团组合的阳离子或阴离子交换基团)。配体可以均匀分布在基质上,或它们可以专门或主要地位于基质的一个区域中,例如珠形基质的核心或外壳。如上所述,在所述消毒溶液中所述氧化剂的浓度可以为例如0.01-1mol/l以及ph值可以为例如2-12,例如2-4或2-3。在步骤b)中的基质可以用所述消毒溶液孵育1min-24h,例如5min-24h或15min-3h,并且,基质可以是例如球形珠的形式,其具有10-200微米的中值直径(d50,v),例如30-100微米。实施例(均在室温为22+/-2℃进行)实施例1(captol消毒研究)本研究的目的是评估添加至captol50%浆液的八种消毒剂及作为参照的pbs对细菌芽孢和细菌的杀菌与杀芽孢作用。该作用以0和15分钟以及1小时、4小时和24小时的接触时间进行测试。该测试在captol50%和消毒剂的浆液中进行。将浓度约为107cfu/ml的微生物加入至悬浮液,通过中和消毒剂,在给定的时间间隔后对减少作用进行评估。中和剂的效力及其恢复接种的微生物的能力通过验证与攻击测试平行的方法来证实。对微生物枯草芽孢杆菌(芽孢)和绿脓假单胞菌(pseudomonasaeruginosa)(滋养型细菌)的log10减少,评估结果。107cfu/ml的微生物被加入到含消毒剂的10mlcaptol50%浆液中。混合样品并将0.1ml重复样品加入到50ml的中和剂中(0.075m的磷酸盐缓冲剂,含有0.3%的卵磷脂、3.0%的吐温80、0.5%的硫代硫酸钠以及0.1%的l-组氨酸)。总溶液通过过滤对应于10倍连续稀释的部分进行分析。使用100ml0.9%的nacl将滤纸冲洗三次。作为阳性对照,各微生物被加入至50ml的中和剂中,对于消毒剂攻击测试加入同样的量。总溶液通过过滤对应于10倍连续稀释的部分进行分析。使用100ml0.9%的nacl将滤纸冲洗三次。滤纸在30-35℃在tsa(trypticasesoyagar)上孵育2-5天。在1-3天后进行初步读数。微生物的减少以与阳性对照相比,存活微生物的log10计算。结果表明,在试验的消毒剂中,只有0.1m的过氧乙酸和含有3%过氧化氢的0.6%的甲酸能有效地杀死枯草芽孢杆菌芽孢。表1。在接触时间为0和15分钟以及1、4和24小时后,当加至含各种消毒剂的captol50%的浆液中时,枯草芽孢杆菌的活菌计数结果(log10减少)。结果为来自浆液的重复样品的平均值。表2。在接触时间为0和15分钟以及1、4和24小时后,当加入至含各种消毒剂的captol50%浆液中时,绿脓假单胞菌的活菌计数结果(log10减少)。结果为来自浆液的重复样品的平均值。实施例2(配体孵育,biacore测试)本研究的目的是研究不同色谱介质配体的结合动力学,作为用0.1m过氧乙酸(paa)消毒前后的保留结合能力的度量。在biacoretm仪器上通过表面等离子体共振测量动力学。测试的配体是seqidno:13的单体(z1)和四聚物(z4)、重组蛋白a(rpra)、重组蛋白l(rprl)和针对iggκ链的单链骆驼抗体(kappaselect配体)。z1、z4和rpra用固定在biacore芯片上的单克隆抗体进行测试,而rprl和kappaselect配体用固定的fab抗体片段测试。1.1ml10mg/mlz1、z4和rpra被还原,烷基化和缓冲液交换到10mmnacl,并在质谱仪(ms)上进行分析,以验证还原和烷基化。2.1mlrprl和kappaselect配体被稀释到10mg/ml。3.抽取对照样品(0h)100µl和缓冲液交换至50mm的碳酸氢铵。4.加入10%1mpaa并且开始孵育。5.在1小时、2小时、4小时、8小时、16小时和24小时后抽取样品100µl和缓冲液交换至50mm的碳酸氢铵以阻止氧化反应。6.在所有的样品中,浓度通过测量276nm的紫外吸光度测定。7.然后在lc-ms和biacore上分析这些样品。在0.1mpaa中从0h孵育到16h的z1配体,在sip前后有类似的亲和力。孵育24小时后的配体的解离速率没有变化,但结合速率发生变化,这也导致亲和力的变化。在0.1mpaa中从0h孵育到24h的z4配体,在sip前后有类似的亲和力。在0.1mpaa中从0h孵育到24h的rpra配体,随sip处理增加,导致亲和力的一些损失。配体在结合速率和解离速率上都发生了变化,并导致亲和力的变化。在0.1mpaa中从0h孵育到24h的rprl配体,在sip前后有类似的亲和力。sip前后的lc色谱图(图1a和b)显示没有降解的迹象。kappaselect配体在0.1mpaa中1小时后已经严重降解,因此不可能对它进行任何动力学研究。在sip前后的lc色谱图(图2a和b)也显示了基本上完全的降解。实施例3(基质孵育)这些实验的目的是测试不同亲和色谱介质的原位消毒(sip)相容性。这使用tecan机器人,在predictorrobocolumn600µl中填充的六种不同的色谱介质上用0.1m过氧乙酸的sip后,通过计算10%突破动态结合能力(dbc)来进行。初始dbc在没有经过sip的六个相应的参考柱上测量。介质为:captol(重组蛋白l)、kappaselect(针对iggκ链的单链骆驼抗体)、mabselect(重组蛋白a)、mabselectsure(具有置换的天冬酰胺的蛋白z变体的多聚体)、mabselectsurelx(具有置换的天冬酰胺的蛋白z变体的多聚体)和mabselectxtra(重组蛋白a)。所有这些介质中的载体都是刚性交联琼脂糖。方法1.清洗/去除储存溶液:10个柱体积(cv)(6x1000µl)的20mm磷酸盐、150mmnaclph为7.42.加入20cv(12x1000µl)sip溶液(0.1m过氧乙酸)3.用柱塞、封口膜以及铝箔将微型柱的底部和顶部密封4.室温下在sip溶液里进行24小时的孵育5.sip孵育24小时后,清洗:10cv(6x1000µl)的20mm磷酸盐、150mmnaclph为7.46.上样:在不同浓度下12*600µlfab/mab,保留时间6分钟7.在紫外可读板上收集未结合样品并测定280nm(以及300nm)的紫外吸光度对于未经过sip的柱的dbc,进行第1、6和7点。表3。sip前后的动态结合能力(在0.1m过氧乙酸中进行24小时的孵育)基质dbc对照,无sip(g/l)sip后的dbc(g/l)δdbc(g/l)captol3029-1kappaselect200-20mabselect5251-1mabselectsure50511mabselectsurelx63630mabselectxtra59601实施例4(基质孵育captol)每孔中有6微升的captol的predictortm(geheathcare)96-孔过滤板进行以下步骤:predictor存储溶液的去除(20%乙醇)清洗:3x200µl20mm磷酸盐、150mmnaclph为7.4清洗3x200µlmilliq加入600µlsip溶液和20mm磷酸盐、150mmnaclph为7.4(对照)(板中48份溶液以及重复)用封口膜将板的底端和顶端封闭在sip溶液中进行4或24小时的孵育,以450rpm振荡液体通过离心分离除去(500xg,1min)。fab的静态结合能力(sbc)通过以下确定:1.sip溶液的除去2.清洗:1x600µlmilliq,1x600µlpbs3.平衡:3x200µl20mm磷酸盐、150mmnaclph为7.44.上样:200µl浓度为2.5mg/ml的fab,1100rpm孵育10min和90min5.在紫外可读板上收集未结合样品并测定280nm(以及254nm)的紫外吸光度液体通过离心分离除去(500xg,1min)。从流通部分的紫外吸光度中减去pbs缓冲液在280nm的紫外吸光度(路径检查)(a280-blank280)。流通部分的浓度使用标准曲线计算(a280-blank280)/1.2796sbc的计算:v样品=200µlv介质=6µlvr=6+0.6*v介质=9.6vr:保留体积,即过滤器的体积(6µl)和在树脂中的液体体积(0.6*6)表4。在sip溶液中孵育4或24h后,与对照20mm磷酸盐、150mmnaclph7.4(pbs)相比,captol对fab的剩余静态容量。对于使用fab样品孵育10和90min,确定sbc值。实施例5(基质孵育与ms分析)200mg湿基质用水洗涤并用0.1m过氧乙酸孵育24h。所述基质通过过滤去除,孵育溶液在watersaquityh-class和watersxevoq-tofmslc-ms系统上使用rplcc18rpc柱进行分析。在孵育溶液中蛋白片段的存在指示通过过氧乙酸的配体降解。对具有不同蛋白质类亲和配体的七种基质进行测试(全部来自gehealthcare):kappaselect(针对iggκ链的单链骆驼抗体)lambdafabselect(针对iggλ链的单链骆驼抗体)factorviiselect(针对因子vii的单链骆驼抗体)factorviiiselect(针对因子viii的单链骆驼抗体)captol(重组蛋白l)mabselectxtra(重组蛋白a)mabselectsure(具有置换的天冬酰胺的蛋白z变体的多聚体)。表50.1m过氧乙酸孵育溶液的lc-ms分析结果基质结果kappaselect配体降解lambdafabselect配体降解factorviiselect配体降解factorviiiselect配体降解captol无降解,无配体泄露mabselectxtra无降解,完整配体少量泄露mabselectsure无降解,完整配体少量泄露实施例6(基础基质的稳定性)为了观察氧化剂处理是否具有琼脂糖基础基质的任何负面性质,在未处理的基质样品以及已使用氧化剂孵育的样品上进行刚性琼脂糖基础基质的压力-流量试验。基础基质所使用的基础基质为中值直径为88微米(体积加权,d50v)的刚性交联琼脂糖珠,其根据us6602990方法制备,并根据gelfiltrationprinciplesandmethods,pharmacialkbbiotechnology1991,pp6-13中所描述的方法,具有对于分子量为110kda的葡聚糖,对应于0.70的反相凝胶过滤色谱kd值的孔径。孵育基础基质在30mm水性过氧乙酸中在室温下孵育24h,然后用蒸馏水洗涤。柱子填充300ml沉降的凝胶用蒸馏水浆化以得到620ml体积的浆液并将其填充在内径为35mm的finelinetm35/600柱(gehealthcare,瑞典)中。填充压力为0.10±0.02巴,且床高度为300±10mm。压力-流量测试将蒸馏水通过柱子泵入,逐步增加背压至高达7.5巴。每一次增压步骤后,泵速保持恒定5min并测量体积流动速率和背压。线性流速(以体积流动速率除以柱子内截面面积来计算)相对于背压作图,并从曲线中计算最大流速,而在最大流速时获得最大压力作为背压。结果图5显示了a)未孵育基质和b)孵育后的基质的流速对背压的曲线。孵育前的最大流速为1.30×103cm/h,以及孵育后为1.18×103cm/h,而孵育前后相应的最大压力分别为5.31和5.44巴。差异在该方法的试验误差限度内,表明过氧乙酸孵育不会影响基质的压力-流量特性。这进一步通过在coultercounter中测定珠的中值直径证实,显示了孵育前的d50v中值直径为88.3微米以及孵育后的中值直径为88.5微米(无统计学显著差异)。珠的孔径也没有受到影响,如对于分子量为110kda的葡聚糖的kd值在孵育前为0.696以及在孵育后为0.692所显示的。实施例7(清洗,mabselectsure)mabselectsure基质的等分试样被单克隆抗体(mab)进料污染,然后用不同的清洗溶液孵育。清洗后,基质在sds-dtt缓冲液中煮沸以释放任何蛋白,上清液在amershamwb系统(gehealthcare,瑞典)中在电泳凝胶上运行,以确定残余污染物蛋白的量。污染每个孔含有20微升mabselectsure的96-孔过滤板(predictormabselectsure,gehealthcare,瑞典)用每个孔3×200微升pbs缓冲液平衡,然后每孔装载200微升mab进料(含4g/lmab的cho细胞上清液)并孵育30min。使用200微升pbs清洗后,孔用2×200微升50mmph值为3.5的醋酸缓冲液洗脱。平衡-装载-清洗洗脱循环重复进行共五个循环,然后孔被平衡并加入蒸馏水。在每一步骤(上样、洗涤、洗脱、清洗)后用真空过滤或离心除去液体。清洗孔使用3×200微升蒸馏水清洗,然后用300微升cip溶液1孵育15min。cip1溶液去除后,它们用2×300微升pbs和2×300微升水清洗。然后它们用300微升cip溶液2孵育15min并进行如上清洗。cip1和cip2溶液列于表6中。表6。cip溶液和在mabselectsure中残留污染物蛋白的量cip溶液1cip溶液2残留污染物(扫描强度)pbs(对照)pbs(对照)32400pbs100mmnaoh381030mm过氧乙酸pbs458030mm过氧乙酸100mmnaoh595100mm过氧乙酸pbs2030100mm过氧乙酸100mmnaoh347100mmdtt/tris100mmnaoh1150分析通过加入50微升标记缓冲溶液+5微升cy5并孵育30min,使用amershamwbcy5标记试剂盒对孔中的基质用cy5荧光染料预标记。然后加入50微升sds-dtt缓冲液,与基质煮沸5min。上清液装载至amershamwb凝胶卡上,并和预先标记的单克隆抗体和mabselectsure配体参照加上一组分子量标准一起运行。扫描凝胶卡并将扫描信号整合以给出对应于从基质中重新获得的残留污染物的量的数值。结果表明,30mm过氧乙酸与100nmnaoh几乎一样有效,而100mm过氧乙酸是更有效的。通过氧化剂与碱的连续组合获得了特别好的结果。实施例8(清洗,captol)该实施例按实施例7进行,不同之处在于20微升predictorcaptol板,在孔中使用蛋白l-功能化的captol基质,并且污染物为结构域抗体(dab)进料,其由来自热处理的大肠杆菌培养物的上清液组成,其中周质表达dab。表6。cip溶液和在captol中残留污染物蛋白的量cip溶液1cip溶液2残留污染物(扫描强度)pbs(对照)pbs(对照)42700pbs15mmnaoh692030mm过氧乙酸pbs1360030mm过氧乙酸15mmnaoh1660100mm过氧乙酸pbs4150100mm过氧乙酸15mmnaoh1960100mmdtt/tris15mmnaoh7250此处同样,过氧乙酸具有明显的清洗效果,并且该效果通过与15mm碱的连续组合进一步增强。本书面描述使用实例来公开本发明,包括最佳模式,并且还使本领域技术人员能够实践本发明,包括制备和使用任何装置或系统并且执行任何并入的方法。本发明的专利保护范围由权利要求限定,并且可包括本领域技术人员所想到的其它实例。如果其它实例具有与权利要求的字面语言并无不同的结构要素,或如果其它实例包括与权利要求的字面语言并无实质不同的等效结构要素,则这样的其它实例预期在权利要求的保护范围内。本文中提到的所有专利和专利申请通过引用以其全文并入本文,如同它们被单独并入一样。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种动态高压固相反应制备锂离子筛的方法
- 一种复合磁性纳米粒子Fe<sub>3</sub>O<sub>4</sub>/MPS/PAA/NTA-Ni<sup>2+</sup>及其制备方法和其在分离纯化组氨酸标 ...的制作方法
- 一种l-丝氨酸的核酸适配体及其用图
- 亲水性胆碱磷酸基质的有机聚合物液相整体色谱柱的制备与应用
- 亲水性胆碱磷酸基质的有机聚合物液相整体色谱柱的制备与应用
- 一种以硅胶为基质的凝集素高效亲和色谱材料的制备方法
- 一种功能化复合金属氧化物材料及其制备方法和应用
- 用于亲和色谱法和用于延长治疗剂的半衰期的化合物的制作方法
- 新抗体纯化方法和由该方法得到的抗体、以及使用了阳离子交换基团的新抗体纯化法和 ...的制作方法
- 清洗基于a蛋白的亲和色谱柱的方法